
- •5.Термодинамические процессы. Виды процессов, изохорные, изобарные, адиабатные. Равновесные и неравновесные процессы.
- •68. Осмотическое давление растворов и уравнение Вант Гоффа.
- •5. Классификация дисперсных систем по размеру частиц, виду дисперсной фазы и дисперсионной среды.
- •105. Использование эмульсий в пищевой и парфюмерной промышленности.
5.Термодинамические процессы. Виды процессов, изохорные, изобарные, адиабатные. Равновесные и неравновесные процессы.
Термодинамическая система – группа тел, взаимодействующих между собой и окружающей средой путем обмена веществом и энергией. Совокупность всех физических и химических свойств системы характеризует её термодинамическое состояние. Все величины, характеризующие какое-либо свойство системы, называют параметрами состояния (температура, давление, концентрация, объем и т.д.). Переход системы из одного состояния в другое, сопровождающийся изменением хотя бы одного параметра состояния, называется термодинамическим процессом.
Изобарный процесс – процесс, протекающий при постоянном давлении.
Изохорный процесс – процесс, протекающий при постоянном объеме.
Изотермический процесс – процесс, протекающий при постоянной температуре.
Адиабатный процесс – процесс, протекающий при отсутствии теплообмена системы с окружающей средой.
Необратимый процесс – процесс, протекающий только в одном направлении.
Обратимый процесс – процесс, одновременно протекающий в двух противоположных направлениях.
Любая материальная система обладает внутренней энергией, которая является суммой кинетической и потенциальной энергии взаимодействия всех частиц системы. Внутренняя энергия – свойство системы, зависящее только от ее параметров состояния (температуры) и не зависящее от того, в каком процессе система пришла к данному состоянию, поэтому внутренняя энергия является термодинамической функцией состояния и определенному состоянию системы соответствует строго определенное значение внутренней энергии.
Формы перехода энергии от системы к окружающей среде и обратно могут быть разбиты на две группы. В первую группу входит форма перехода энергии путем хаотических столкновений молекул соприкасающихся тел, т.е. путём теплопроводности или излучения. Мерой передаваемой таким способом энергии является теплота. Теплота есть форма передачи энергии путём неупорядоченного движения частиц системы.
Во вторую группу включаются различные формы перехода энергии, общей чертой которых является перемещение очень большого числа частиц под действием каких-либо сил, например, расширение газа, находящегося под давлением и др. Общей мерой передаваемой такими способами энергии является работа – форма передачи энергии путём упорядоченного движения частиц.
Теплота и работа характеризуют качественно и количественно две различные формы передачи энергии от одной системы к другой. Теплота и работа не могут содержаться в теле. Теплота и работа возникают только тогда, когда возникает процесс, и характеризуют только процесс, поэтому они являются термодинамическими функциями процесса.
47 Выразить константу КР равновесия 2SO2 (г) + O2 (г) 2SOЗ (г) через равновесные парциальные давления реагирующих веществ.
Константа равновесия реакции
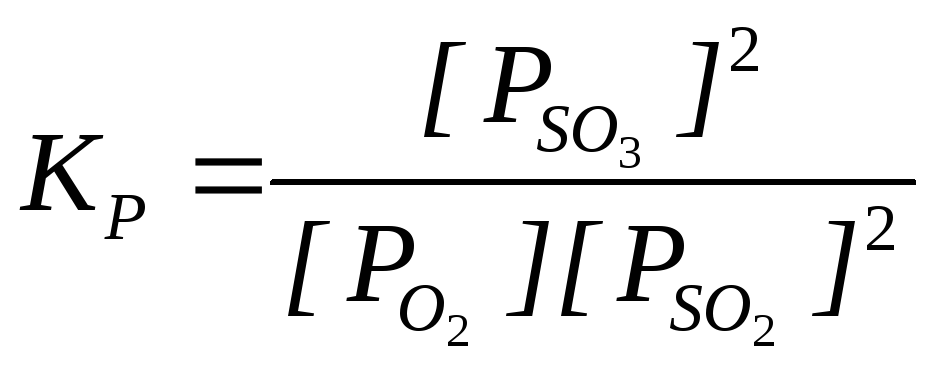
где: [P] – равновесные парциальные давления веществ, Па
68. Осмотическое давление растворов и уравнение Вант Гоффа.
Осмотическое давление, диффузное давление, термодинамический параметр, характеризующий стремление раствора к понижениюконцентрации при соприкосновении с чистым растворителем вследствие встречной диффузии молекул растворённого вещества и растворителя.
Если раствор отделен от чистого растворителя полупроницаемой мембраной, то возможна лишь односторонняя диффузия — осмотическое всасывание растворителя через мембрану в раствор. В этом случае осмотическое давление становится доступной для прямого измерения величиной, равной избыточному давлению, приложенному со стороны раствора при осмотическом равновесии ).
Осмотическое давлениеобусловлено понижением химического потенциала растворителя в присутствии растворённого вещества. Тенденция системы выравниватьхимические потенциалы во всех частях своего объёма и перейти в состояние с более низким уровнем свободной энергии вызывает осмотическое (диффузионный) перенос вещества. Осмотическое давление в идеальных и предельно разбавленных растворах не зависит от природырастворителя и растворённых веществ; при постоянной температуре оно определяется только числом «кинетических элементов» — ионов,молекул, ассоциатов или коллоидных частиц — в единице объёма раствора. Первые измерения осмотического давления произвёл В. Пфеффер (1877), исследуя водные растворы тростникового сахара. Его данные позволили Я. X. Вант-Гоффу установить (1887) зависимость осмотическогодавления от концентрации растворённого вещества, совпадающую по форме с Бойля — Мариотта законом для идеальных газов.
Оказалось, что осмотическое давление (p) численно равно давлению, которое оказало бы растворённое вещество, если бы оно при данной температуренаходилось в состоянии идеального газа и занимало объём, равный объёму раствора. Для весьма разбавленных растворов недиссоциирующихвеществ найденная закономерность с достаточной точностью описывается уравнением: pV = nRT, где n — число молей растворённого вещества в объёме раствора V; R — универсальная газовая постоянная; Т — абсолютная температура. В случае диссоциации вещества в растворе на ионы в правую часть уравнения вводится множитель i > 1, коэффициент Вант-Гоффа; при ассоциации растворённого вещества i < 1.
Осмотическоедавление реального раствора (p') всегда выше, чем идеального (p''), причём отношение p'/ p'' = g, называемое осмотическим коэффициентом, увеличивается с ростом концентрации. Растворы с одинаковым осмотическим давлением называется изотоническими или изоосмотическими. Так, различные кровезаменители и физиологические растворы изотоничны относительно внутренних жидкостей организма. Если один раствор в сравнении с другим имеет более высокое осмотическое давление, его называют гипертоническим, а имеющий более низкое осмотическое давление— гипотоническим.
Осмотическое давление измеряют
с помощью специальных приборов —
осмометров. Различают статические и
динамические методы измерения. Первый
метод основан на определении избыточного
гидростатического давления по
высоте столба жидкости Н
в трубке осмометров после установления
осмотического равновесия
при равенстве внешних давлений pA и
рБ в
камерах А и Б. Второй метод сводится к
измерению скоростей v всасывания и
выдавливания растворителя из
осмотической ячейки при различных
значениях избыточного давления Dp
= pA —
рБ с
последующей интерполяцией полученных
данных к n = 0 при Dp = p. Многие
осмометры позволяют использовать оба
метода. Одна из главных трудностей в
измерении осмотического давления —
правильный подбор полупроницаемых
мембран. Обычно применяют плёнки
из целлофана,
природных и синтетических полимеров,
пористые керамические и стеклянные
перегородки. Учение о методах и технике
измерения осмотического давленияназываются осмометрией.
Основное приложение осмометрии —
определение молекулярной
массы (М) полимеров.
Значения М вычисляют из соотношения ![]() ,
где с — концентрация полимера по
массе; А — коэффициент, зависящий от
строения макромолекулы.
,
где с — концентрация полимера по
массе; А — коэффициент, зависящий от
строения макромолекулы.
Осмотическое давление может достигать значительных величин. Например, 4%-ный раствор сахара при комнатной температуре имеет осмотическое давление около 0,3 Мн/м2, а 53%-ный — около 10 Мн/м2; осмотическое давление морской воды около 0,27 Мн/м2.
Осмотическое давление в
клетках
животных, растений, микроорганизмов и
в биологических жидкостях
зависит от концентрации веществ,
растворённых в их жидких средах. Солевой
состав биологических жидкостей и клеток,
характерный для организмов
каждого вида, поддерживается
избирательной проницаемостью биологических
мембран для разных солей и
активным транспортом ионов.
Относительное постоянство
осмотического давления обеспечивается
водно-солевым обменом, т. е. всасыванием,
распределением, потреблением и
выделением воды и солей(см.
Выделение, Выделительная система,
Осморегуляция). У т. н. гиперосмотических
организмов
внутреннее осмотическое давление больше
внешнего, у гипоосмотических — меньше
внешнего; у изоосмотических
(пойкилоосмотических) внутреннее
осмотическое давление
равно внешнему. В первом случае ноны
активно поглощаются организмом и
задерживаются в нём, а вода поступает
через биологич. мембраны пассивно,
в соответствии с осмотическим градиентом.
Гиперосмотическая регуляция свойственна
пресноводным организмам,
мор. хрящевым рыбам (акулы, скаты) и всем
растениям. У организмов с
гипоосмотической регуляцией имеются
приспособления для активного
выделения солей.
У костистых рыб преобладающие в
океанических водах ионы Na+ и
Cl— выделяются
через жабры, у морских пресмыкающихся
(змеи и черепахи) и у птиц — через особые
солевые железы, расположенные в области
головы. Ионы Mg2+, ![]() ,
, ![]() у
этих организмов выделяются
через почки. Осмотическоедавление у
гипер- и гипоосмотических организмов может
создаваться как за счёт ионов,
преобладающих во внешней среде, так и
продуктов обмена. Например, у акуловых
рыб и скатов осмотическое давление на
60% создаётся за счёт мочевины и
триметиламмония; в плазме
кровимлекопитающих — главным образом
за счёт ионов Na+ и
Cl—;
в личинках насекомых — за счёт
разнообразных низкомолекулярных метаболитов.
У морских одноклеточных, иглокожих,
головоногих моллюсков, миксин и др.
изоосмотических организмов,
у которых осмотическое давлениеопределяется
осмотическим давлением внешней
среды и равно ему, механизмы осморегуляции
отсутствуют (исключая клеточные).
у
этих организмов выделяются
через почки. Осмотическоедавление у
гипер- и гипоосмотических организмов может
создаваться как за счёт ионов,
преобладающих во внешней среде, так и
продуктов обмена. Например, у акуловых
рыб и скатов осмотическое давление на
60% создаётся за счёт мочевины и
триметиламмония; в плазме
кровимлекопитающих — главным образом
за счёт ионов Na+ и
Cl—;
в личинках насекомых — за счёт
разнообразных низкомолекулярных метаболитов.
У морских одноклеточных, иглокожих,
головоногих моллюсков, миксин и др.
изоосмотических организмов,
у которых осмотическое давлениеопределяется
осмотическим давлением внешней
среды и равно ему, механизмы осморегуляции
отсутствуют (исключая клеточные).
Диапазон средних величин осмотического давления в клетках организмов, не способных поддерживать осмотический гомеостаз, довольно широк и зависит от вида и возраста организма, типа клеток и осмотического давления окружающей среды. В оптимальных условиях осмотическое давлениеклеточного сока наземных органов болотных растений колеблется от 2 до 16 ат, у степных — от 8 до 40 ат. В разных клетках растения осмотическоедавление может резко различаться (так, у мангровых осмотическое давление клеточного сока около 60 ат, а осмотическое давление в сосудахксилемы не превышает 1—2 ат). У гомоосмотических организмов, т. е. способных поддерживать относительное постоянство осмотическогодавления, средней величины и диапазон колебаний осмотического давления различны (дождевой червь — 3,6—4,8 ат, пресноводные рыбы — 6,0—6,6, океанические костистые рыбы — 7,8—8,5, акуловые — 22,3—23,2, млекопитающие — 6,6—8,0 ат). У млекопитающих осмотическое давлениебольшинства биологических жидкостей равно осмотическому давлению крови (исключение составляют жидкости, выделяемые некоторымижелезами, — слюна, пот, моча и др.). Осмотическое давление, создаваемое в клетках животных высокомолекулярными соединениями (белки,полисахариды и др.), незначительно, но играет важную роль в обмене веществ (см. Онкотическое давление).

Принципиальная схема осмометра: А — камера для раствора; Б — камера для растворителя; М — мембрана. Уровни жидкости в трубках при осмотическом равновесии: а и б — в условиях равенства внешних давлений в камерах А и Б, когда rА = rБ, при этом Н — столб жидкости, уравновешивающий осмотическое давление; б — в условиях неравенства внешних давлений, когда rА — rБ = p.
5. Для вещества, указанного ниже при соответствующем номере задачи, вычислить стандартную энтальпию образования при 298 К (fН°298), зная его стандартную энтальпию сгорания (CН°), а так же вычислить стандартную энтальпию образования при 398 К, используя полученную величину fН°298 и изобарные теплоёмкости СР (смотри CН° в таблице 4.3 и СР в таблицах 4.3 и 4.4 приложения 4). Продуктами сгорания для указанных веществ являются CO2 (г), H2O (ж) и N2 (г) в случае азотсодержащих соединений.
5. метан СН4 (г)
Реакция: CH4 + 2O2 = CO2 + 2H2O
![]() кДж.моль
-393.51 -285.83
кДж.моль
-393.51 -285.83
Cp , Дж/моль*К 35.7 29.4 37.13 75.35
Тепловой эффект реакции равен теплоте сгорания метана:
![]()
откуда теплота образования метана равна
![]() =
2*(-285,83)+(-393,51) – (-890,3) =
=
2*(-285,83)+(-393,51) – (-890,3) =
––74,87 кДж = -74870 Дж
Тепловой эффект реакции при любой температуре Т находя по уравнению Кирхгофа
![]()
После интегрирования уравнения в пределах от 298K до Т получаем
![]()
=74870+(2*75,35+37,13-2*29,4-35,7)*(398-298) = 84203 Дж
105. Стандартная энергия Гиббса реакции СО (г) + Н2О (г) = СО2 (г) + Н2 (г) равна –25.5 кДж/моль при 373 К. Вычислить константу равновесия этой реакции, а так же обратной реакции СО2 (г) + Н2 (г) = СО (г) + Н2О (г).
Константу равновесия прямой реакции находим из уравнения
![]()
откуда
![]()
![]() 3,7*103
3,7*103
Константы прямой и обратной реакций связаны соотношением
![]()
Следовательноно,
![]() 2,7*10-4
2,7*10-4
Коллоидная химия
