
Многовариантные задачи
52. Вычислить стандартные изменения изобарного потенциала химической реакции при 25°С по стандартным значениям энтальпий образования и абсолютных энтропии, воспользовавшись таблицами стандартных величин. Все реакции проводятся между чистыми твердыми, жидкими и газообразными веществами (не в растворе).
|
Номер задачи |
Реакции |
|
1 |
ZnО (т) + СО (г) =Zn (т) + С02 (г)
|
|
2 |
ZnS (т) + Н2 (г) = Zn (т) + H2S (г)
|
|
3 |
2С02 (г) = 2СО (г) + 02 (г)
|
|
4 |
СО (г) + НгО (ж) = С02 (г) + Н2 (г)
|
|
5 |
2HI (г) = Н2 (г) + I2 (г)
|
|
6 |
СО (г) + 2Н2 (г) = СН3ОН (ж)
|
|
7 |
NH3 (г) + НСl (г) =NH,Cl (т)
|
|
8 |
Н2 (г) + С02 (г) =СО (г) + Н20 (ж)
|
|
9 |
С02 (г) + 4Н2 (г)=СН4 (г) + 2Н20 (ж)
|
|
10 |
2Н20 (ж) =2Н2 (г) + 02 (г)
|
|
11 |
SO2 (г) + С!2 (г) =S02CI2 (г)
|
|
12 |
СО (г) + С12 (г) =СОС12 (г)
|
|
13 |
4HCI (г) + 02 (г) =2Н20 (ж) + 2С12 (г)
|
|
14 |
СНзСООН (г) + 2Н2 (г) = 2СН3ОН (г)
|
|
15 |
СО (г) + ЗН2 (г) = СH4 (г) + Н20 (г)
|
|
16 |
Н2 (г) + НСОН (г) = СНзОН (г)
|
|
17 |
4NH3 (г) + 502 (г) = 6Н20 (г) + 4NO (г)
|
|
18 |
Са(ОН)2 (т) =СаО (т) + Н20 (ж)
|
|
19 |
РСl5 (г) = PCl3 (г) + Сl2(г)
|
|
20 |
С2Н4 (г) + 302 (г) =2С03 (г) + 2Н20 (ж)
|
|
21 |
СаСОз (т) =СаО (т) + С02 (г)
|
|
22 |
H2S (г) + COS (г) =Н20 (г) + CS2 (г)
|
|
23 |
H2S (г) + С02 (г) =Н20 (г) + COS (г)
|
|
24 |
СбН6 (г) + ЗН2 (г) =С6Н12 (ж) |
|
25 |
С2Н5ОН (ж) = С2НЧ (г) + Н20 (ж)
|
|
26 |
СН4 (г) + 2H2S (г) = CS2 (ж) + 4Н2 (г)
|
|
27 |
2AgN03 (т) = 2Ag (т) + 2N02 (г) + 02 (г)
|
|
28 |
4С0 (г) + 2S02 (г) =S2 (г) + 4С02 (г)
|
|
29 |
2NaHC03 (т) = Na2C03 (т) + Н20 (г) + С02 (г)
|
|
30 |
MgC03 (т) = MgO (т) + С02 (г)
|
Ответ:1)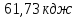 ;2)
;2)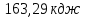 ;3)
;3)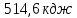 ;
4)
;
4)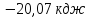 ;5)
;5)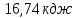 ;6)
;6)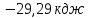 ;7)
;7)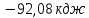 ;
8)
;
8)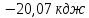 ;9)
;9)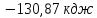 ;10)
;10)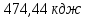 ;
11)
;
11)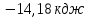 ;12)
;12)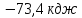 ;13)
;13)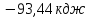 ;14)
;14)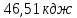 ;15)
;15)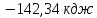 ;16)
;16) ;17)
;17)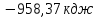 ;18)
;18)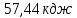 ;19)
;19)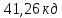 ;
20)
;
20)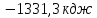 ;21)
;21)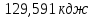 ;22)
;22)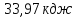 ;23)
;23)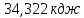 ;24)
;24)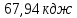 ;25)
;25)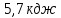 ;26)
;26) ;27)
;27)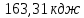 ;28)
;28)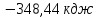 ;29)
;29)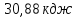 ;30)
;30)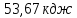
\
Варианты для решения задач
Вариант 1.
Глава1:1,5,9,16,20,21,25,29,35,40,44,48,49,53,57,64,65,72,73,77,
84,85.89,96,97,104,105,112,113,117,121,125,130,134,136(1,5,9,13,
17,21,25,29).
Глава 2: 4,8,12,13,17,24,28,29.36.37.44,48,51,52(4,8,13,17,21,25,28,30).
Вариант 2.
Глава1:2,6,10,15,19,22,26,30,34,39,43,47,50,54,58,63,66,71,74,78,
83,86,90,95,
98,103,106,111,114,118,122,126,131,135,136(2,6,10,14,18,22,26,30)
Глава2:3,7,11,14,18,23,27,30,35,38,43,47,51,52(3,7,12,16,20,24,27,30).
Вариант 3.
Глава1:3,7,11,14,18,23,27,31,33,38,42,46,51,55,59,62,67,70,75,79,
82,87,91,94,
99,102,107,110,115,119,123,127,132,135,136(3,7,11,15,19,23,27,30)
Глава2:2,6,10,15,19,22,26,31,34,39,42,46,50,52(2,6,11,15,19,23,26,30).
Вариант 4.
Глава1:4,8,12,13,17,24,28,32,36,37,41,45,52,56,60,61,68,69,76,80,
81,88,92,93,
100,101,108,109,116,120,124,128,129,133,136(4,8,12,16,20,24,28,
29).
Глава2:1,5,9,16,20,21,25,32,33,40,41,45,49,52(1,5,9,10,14,18,22,25,30).
Список литературы
-
Ахметов, Б.В. Задачи и упражнения по физической и коллоидной химии/ Б.В. Ахметов. – Ленинград: Химия, 1988. – 240с.
-
Кудряшов, И.В. Сборник примеров и задач по физической химии: Учеб. пособие для хим.-технол. спец. вузов./ И.В Кудряшов, Г.С. Каретников – 6-е изд., перераб. и доп.– Москва: Высшая школа, 1991. – 527с.
-
Лабовиц, Л., Дж. Аренс. Задачи по физической химии с решениями: Перевод с английского канд. хим. наук В.П. Вендилло; под ред. проф. Ю.В. Филиппов. – Москва: Мир, 1972. – 443с.
-
Семиохин, И.А. Сборник задач по химической кинетике./ И. А. Семиохин. – Москва, 2005. – 89с.
-
Картушинская, А. И., Лельчук, Ч.А., Стромберг, А.Г. Сборник задач по химической термодинамике/ Под редакцией А. Г. Стромберга. Учебное пособие для химико-технологических вузов – Москва: Высшая школа, 1973. – 224 с.
-
Слышенков, В. С., Бурдь, Г.А., Минюк, Г.Е. Агрегатные состояния вещества. Химическая термодинамика : пособие.- Гродно : ГрГУ, 2008.-137 с.
-
Лямина, Г. В., Лапова, Т. В., Курзина, И. А., Вайтулевич, Е. А., Еремина, А. Н. Химическая термодинамика : Учебное пособие. Томск : Изд. Томск. архит.-строит. ун-та, 2006.- 51 с.
-
БГУ
