Тесты по разделу «Полимеры»
1.Карбоцепным является полимер:
1) (-СF2-)n-тефлон
2) (-CH2O-)n-полифоральдегид
3) (-MeO-)n-оксиды металлов
4) (-ЅιO2-)n-двуокись кремния
5) (-S-)n-сера
2.Гетероцепным полимером является:
1) (-СН2-)n-полиэтилен
2) (-СН2-СClH-)n-поливинилхлорид
3) (СН2-С(СН3)2-)-полиизобутилен
4) (-СН2-СН-F-)n–поливинилфторид
5) (-СН2-СН2О-)n-полиэтиленоксид
3.Полимерами не являются:
1) Вещества, получаемые методами поликонденсации
2) Вещества, получаемые методами полимеризации
3) Вещества, получаемые методами полимераналогичных превращений
4) Продукты взаимодействия щелочей с минеральными кислотами
5) Вещества, получаемые реакциями полиприсоединения
4 Наиболее устойчивым полимером является:
1)Тефлон ( Фторпласт-4)
2)Белок
3)Полиэтилен
4)Каучук
5)Крахмал
5. При нагревании термопласты:
1)Только разлагаются
2)Переходят в вязкотекучее состояние практически без разложения
3)Испаряются
4)Кристаллизуются
5)Обугливаются
6.Природным полимером является:
1)Желатин
2)Органическое стекло
3)Лавсан
4)Полиэтилен
5)Фторопласт-4
7.Органические ВМС содержат в своем составе:
1)Только углерод
2)Углерод, водород, кремний и водород
4)Углерод, водород, азот, кислород и серу
5)Кремний, фосфор, серу
8.При реакции поликонденсации не образуются:
1) Поликарбонаты
2) Полипептиды
3) Полиэфиры
4) Водород
5) Полиамиды
9. К сетчатым полимерам не относятся:
1) Лавсан
2) Тефлон
3) Резина
4) Клетчатка
5) Нейлон
10. Поликонденсационные ВМС могут быть получены реакциями взаимодействия:
1) Этилена и изобутилена
2) Стирола и соляной кислоты
3) Этилендиамина и уксусной кислоты
4) Гексаметилендиамина и адипиновой кислоты
5) Адипиновой кислоты и метанола
11. Степень полимеризации это:
1) Отношение среднего молекулярного веса полимера к молекулярному весу мономера
2) Отношение молекулярного веса полимера к молекулярному весу мономера
3) Молекулярный вес полимера
4) Молекулярный вес мономера
5) Количество молей полимера
12. При полимеризации метилметакрилата - СН2=С(СН3)СООСН3 образуется:
1) Полиметилметакрилат
2) Метанол
3) Полиакрилонитрил
4) Каучук
5) Лавсан
13. При обработке полистирола серной кислотой образуется:
1) Бензолсульфокислота
2) Сульфированный полистирол
3) Стирол
4) Бензол
5) Винилбензол
14. При гидролизе капрона образуются:
1) Капроновая кислота
2) Капролактам
3) Полиамид
4) Валериановая кислота
5) Азотная кислота
15. Пенополиуретаны это:
1) Пенополиэтилен
2) Вспененные полиуретаны
3) Пенополистирол
4) Поронит
5) Плексиглас
16. Силиконы это:
1) Силикаты
2) Диалкилдихлорсиланы
3) Полисилоксаны
4) Диарилдихлорсиланы
5) Алкиларилдихлорсиланы
17. Натуральный каучук это:
1) Транс-полиизопрен
2) Цис-полиизопрен
3) Полибутадиен
4) Гуттаперча
5) Наирит
18. При нитровании клетчатки не образуется:
1) Вода
2) Пироксилин
3) Динитроклетчатка
4) Целлофан
5) Мононитроклетчатка
19. Лавсан (терилен) образуется при взаимодействии:
1) Диметилтерефталата с этиленгликолем
2) Этиленгликоля с фталиевой кислтой
3) Окиси этилена с диметилтерефталатом
4) Адипиновой кислоты с этиленглиголем
5) Фталевого ангидрида с глицерином
20. При нагревании термореактивных ВМС не образуются:
1) Низкомолекулярные продукты
2) Углистые вещества
3) Продукты уплотнения
4) Термопластичные ВМС
5) Продукты полимераналогичных превращений
21. При реакции поликонденсации формальдегида с фенолом не образуется:
1) Резол
2) Резит
3) Резина
4) Фенолформальдегидные смолы
5) Вода
22. При гидролизе поливинилацетата обрауется:
1) Виниловый спирт
2) Поливиниловый спирт
3) Окись этилена
4) Уксусный альдегид
5) Уксусный ангидрид
23. При полном сгорании полиэтилена образуются:
1) СО2 и Н2О
2) Н2О2
3) Н2и О2
4) Сажа
5) Олигомеры
24. Реакция радикальной полимеризации осуществляется под действием:
1) Инициаторов радикальной полимеризации
2) Оснований Льюиса
3) Кислот Льюиса
4) Минеральных кислот
5) Металлорганических соединений
25. Полиамиды получаются при взаимодействии:
1) Двухосновных кислот и гликолей
2) Диаминов с альдегидами
3) Аминокислот с минеральными кислотами
4) Диаминов с двухосновными кислотами
5) Диаминов с азотистой кислотой
Тесты к разделу «Физикохимический анализ»
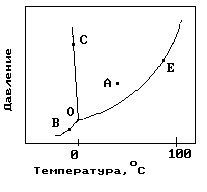
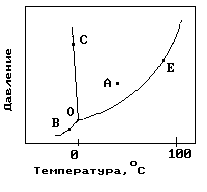
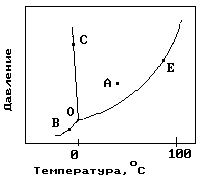
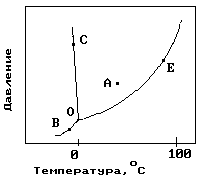
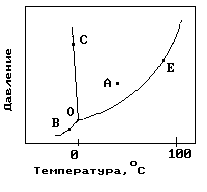
1.На рисунке показана фазовая диаграмма воды. Укажите на диаграмме точки, характеризующие равновесие жидкой и паровой фаз.
|
|
1) A 2) В иС 3) Е 4) С 5) О и Е |
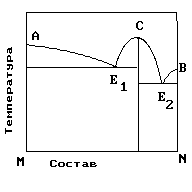
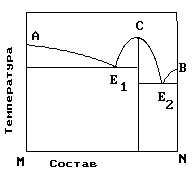
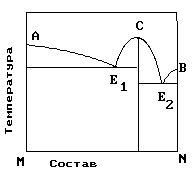
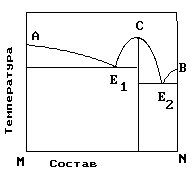
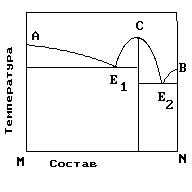
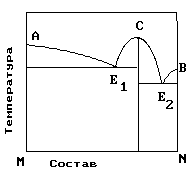
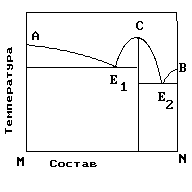
2.На рис. приведена диаграмма состояния системы компонентов M и N. Укажите на диаграмме точки, отвечающие равновесию жидкого сплава и кристаллов химического соединения MN.
|
|
1) только c 2) b и d 3) aиb 4) e и a 5) cиd |
3. На рис. приведена диаграмма состояния системы А-В. Укажите на диаграмме область однородного расплава.

1) IV 2) I 3)II 4)V 5)III
4. На рисунке приведена диаграмма состояния системы компонентов M и N. Укажите на диаграмме точку, отвечающую температуре плавления химического соединения MN.
|
|
1) E2 2) B 3) C 4) E1 5) A |
5. . На рисунке представлена диаграмма состояния компонентов M и N. Укажите на диаграмме точку эвтектики интерметаллического соединения и компанента-M
|
|
1) E2 2) B 3) C 4) E1 5) A |
6. На рис. приведена диаграмма состояния системы А-В. Укажите область кристаллов А и эвтектики.

1) IV 2) I 3)II 4)V 5)III
7.На рис. приведена диаграмма состояния системы А-В. Укажите область кристаллов В и эвтектики.

1) IV 2) I 3)II 4) V 5)III
8. На рис. приведена диаграмма состояния системы А-В. Укажите область равновесия кристаллов В и расплава
 1)
IV 2) I 3)II 4)
V 5)
III
1)
IV 2) I 3)II 4)
V 5)
III
9. На рис. приведена диаграмма состояния системы А-В. Укажите область кристаллов А и расплава.
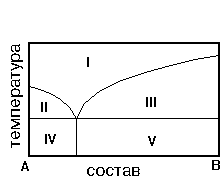
1) IV 2) I 3) II 4) V 5) III
10. На рисунке представлена диаграмма состояния компонентов M и N. Укажите на диаграмме точку эвтектики интерметаллического соединения и компанента-N
|
|
1) E2 2) B 3) C 4) E1 5) A |
11. На рисунке показана фазовая диаграмма воды. Укажите на диаграмме кривую кипения воды.
|
|
1) A 2) В иС 3) Е 4) С 5) О и Е |
12. На рисунке показана фазовая диаграмма воды. Укажите на диаграмме тройную точку воды.
|
|
1) A 2) В иС 3) Е 4) С 5) О |
13. На рисунке показана фазовая диаграмма воды. Укажите на диаграмме кривую плавления льда.
|
|
1) A 2) В иС 3) Е 4)О-С 5) О |
14. На рисунке показана фазовая диаграмма воды. Укажите на диаграмме кривую сублимации льда (переход льда в пар, минуя жидкое состояние).
|
|
1) A 2) В иС 3) Е 4)О-В 5) О |
15. На рисунке представлена диаграмма состояния компонентов M и N. Укажите на диаграмме точку плавления копонента –М.
|
|
1) E2 2) B 3) C 4) E1 5) A |
16. На рисунке представлена диаграмма состояния компонентов M и N. Укажите на диаграмме точку плавления копонента –N
|
|
1) E2 2) B 3) C 4) E1 5) A |
17. На рис. приведена диаграмма состояния системы А-В. Такого типа диаграммы отвечают:
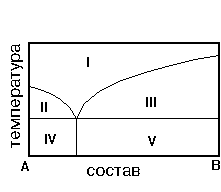 1) Тугоплавким сплавам
1) Тугоплавким сплавам
2) Легкоплавким сплавам
3) Сплавам с неограниченной растворимостью металлов в жидком и твердом виде
4) Сплавам металлов, образующих интерметаллические соединения
5) Всем сплавам
18. Для сплава, диаграмма которого приведена на рисунке, характерно:

1) Образование интерметаллического соединения
2) Неограниченная растворимость компонентов в твердом и жидком состояниях
3) Механическая смесь
4) Ограниченная растворимость компонентов в твердом и жидком состояниях
5) Одинаковая химическая природа металлов
19. На рисунке представлена диаграмма состояния компонентов M и N. Укажите на диаграмме кривую, характеризующую равновесие «расплав-кристаллы химиического соединения»
|
|
1) E2 2) B 3)Е1-С-Е2 4) E1 5) A |
20. На рисунке представлена диаграмма состояния компонентов M и N. Укажите на диаграмме кривую, характеризующую равновесие «расплав-кристаллы компонента А»
|
|
1) E2 2) B 3)Е1-С-Е2 4) E1 5) A-Е1 |
21. На рисунке представлена диаграмма состояния компонентов M и N. Укажите на диаграмме кривую, характеризующую равновесие «расплав-кристаллы компонента В»
|
|
1) E2 2) B –Е2 3)Е1-С-Е2 4) E1 5) A-Е1 |
22. На рисунке показана фазовая диаграмма воды. Укажите на диаграмме точку жидкой фазы.
|
|
1) A 2) В иС 3) Е 4) С 5) О и Е |
23. При нейтрализации соляной кислоты (НСL)
раствором едкого натра РН –среды:
1) Становится равной 0
2) Становится равной 7
3) Становится меньше 7
4) Становится больше 8
5) Становится меньше 0
24. При взаимодействии: N2 + 3 H2 = 2NH3 аналитическим сигналом будет:
1) Уменьшении давления реакционной смеси
2) Скорость химической реакции
3) Положение равновесия
4) Концентрация катализатора
5) Теплота образования аммиака
25. При реакции разложения перекиси водорода аналитическим сигналом является:
2Н2О2 =Н2О + О2
1) Концентрация катализатора
2) Объем раствора
3) Молекулярный вес перекиси водорода
4) Парциальное давление образующегося кислорода
5) Теплоемкость воды
26. Все аналитические методы основаны на получении и измерении аналитического сигнала, т.е. любого проявления химических или физических свойств вещества. Аналитическим сигналом в кислотно-основном титровании является:
1) Окраска индикатора
2) Показатель преломления
3) Масса
4) Pадиоактивность
5) Цвет раствора.
Тесты к разделу “ Металлы “
1. С водой при комнатной температуре взаимодействует:
1) Золото
2) Платина
3) Калий
4) Медь
5) Свинец
2. С соляной кислотой ( НСl ) реагирует с выделением водорода:
1) Серебро
2) Платина
3) Золото
4) железо
5) Медь
3. Старательским способом добывают:
1) Калий
2) Натрий
3) Золото
4) Магний
5) Кальций
4. Металл не реагирует с азотной кислотoй ( HNO3 )
1) Золото
2) Железо
3) Натрий
4) Цинк
5) Литий
5. Металл из руды получают карботермией ( восстановление углеродом )
1) Железо
2) Литий
2) Калий
3) Натрий
4) Франций
5) Цезий
6. Золото устойчиво на воздухе ввиду того, что:
1) Имеет большой стандартный электродный потенциал
2) Находится в первой группе элементов таблицы Д.И.Менделеева
3) На нем отсутствует оксидная пленка
4) Образует амальгаму
5) В природе встречается в самородном виде
7. Оксид хрома (VI ) проявляет:
1) Амфотерные свойства
2) Кислотные свойства
3) Основные свойства
4) Восстановительные свойства
5) Безразличный оксид
8. При взаимодействии медного купороса (CuSO4 ) c цинком образуется:
1) Медь и сульфат цинка
2) Серная кислота
3) Гидроксид меди и сульфат цинка
4) Сульфит меди (II)
5) Оксид цинка и сульфид меди
9. При взаимодействии железа с водой в присутствии кислорода образуется:
1)
Бурая ржавчина ( Fe2O3 n H2O)
n H2O)
2) Карбонат железа
3) Карбид железа
4) Нитрид железа
5) Озонид железа
10. Наиболее активный металл : K , Au , Pt , Fe , Pb
1) Pb
2) K
3) Au
4) Fe
5) Pt
11. Разбавленная серная кислота не реагирует с:
1) Медью
2) Кальцием
3) Железом
4) Магнием
5) Хромом
12. Алюминий устойчив на воздухе ввиду того , что:
1) Имеет отрицательный стандартный электродный потенциал
2) Покрыт с поверхности устойчивой оксидной пленкой
3) Пассивируется в концентрированной азотной кислоте
4) Реагирует с водными растворами щелочей
5) Пластичен
13. Алюминий получают в промышленности:
1) Электролизом глинозема в расплаве криолита
2) Карботермией
3) Электролизом водных растворов
4) Пирометаллургическим способом
5) Восстановлением водородом
14. Медь реагирует с концентрированной азотной кислотой с образованием:
1) Нитрата меди ( II ) , воды и двуокиси азота
2) Нитрата меди ( I) , воды и двуокиси азота
3) Нитрата меди ( II) и воды
4) Нитрата меди (II ) и двуокиси азота
5) Нитрата меди ( II ) , воды и оксида азота (1)
15. Желез реагирует с азотнокислым серебром с образованием:
1) Серебра и нитрата железа (II)
2) Оксида серебра и нитрита железа
3) Серебра и нитрида железа
4) Нитрида серебра и оксида железа (II)
5) Серебра и оксида железа (II)
16. При взаимодействии железа с кислородом:
1) Железо восстанавливается с образованием оксида
2) Железо окисляется с образованием оксида
3) Кислород окисляется при образовании оксида железа
4) Железо не реагирует с кислородом
5) Железо проявляет амфотерные свойства
17. Бериллий в отличии от элементов второй группы элементов
таблицы Д.И. Менделеева проявляет:
1) Амфотерные свойства
2) Основные свойства
3) Кислотные свойства
4) Окислительные свойства
5) Окислительно-восстановительную двойственность
18. При взаимодействии перманганата калия (марганцовка) с перекисью
водорода в присутствии серной кслоты образуются:
1) Сульфат марганца, сульфат калия, вода и кислород
2) Сульфид марганца, сульфат калия, вода и кислород
3) Сульфат марганца, сульфат калия и вода
4) Сульфат калия, вода и кислород
5) Сульфат марганца, вода и кислород
19. При взаимодействии бромистоводородной кислоы (НВr) с
двуокисью марганца образуются:
1) Бром, вода, бромид марганца
2) Бром, вода, бромат марганца
3) Бром и бромид марганца
4) Бромистый водород, вода и бромид марганца
5) Бром и бромат марганца
20. CrO3 проявляет:
1) Окислительно-восстановительную двойственность
2) Окислительые и кислотные свойства
3) Восстановительные свойства
4) Основные свойства
5) Амфотерные свойства
21. Металлы реагируют с неокисляющими кислотами с выделением
водорода если:
1) Стандартный потенциал меньше «0»
2) Стандартный потенциал больше «0»
3) В ряду напряжений металлов стоит после водорода
4) Стандартный потенциал имеет положительное значение
5) Электроотрицательность больше «1»
22. Активность металлов Pt, Au, Na, Fe, Pb, уменьшается в порядке:
1) Na, Fe, Pb, Au, Pt
2) Au, Na, Fe, Pb, Pt
3) Pt, Au, Na, Fe, Pb
4) Pt, Au, Na, Pb, Fe
5) Na, Fe, Pt, Au, Pb
23. Металл может быть получен электролизом водных растворов солей
этого металла:
1) Натрий
2) Калий
3) Медь
4) Кальций
5) Литий
24. Латунь это сплав:
1) Меди и цинка
2) Меди и олова
3) Лантана и цинка
4) Меди и золота
5) Меди и серебра
25. Реакция : Me + nHCl = MeCln + H2 xaрактерна для :
1) Li
2) Cu
3) Ag
4) Pt
5) Au
Тесты по разделу «Металлы и электрохимический ряд напряжений металлов» .
Координационное число в кристаллической решетке металлов может быть равным
6 и 8
8 и 10
8 и 12
6 и 10
В узлах кристаллической решетки металлов находятся
нейтральные атомы металла
положительно заряженные ионы металла
3) отрицательно заряженные ионы металла
отрицательно и положительно заряженные ионы металла.
Наибольшей электропроводностью среди металлов обладают
Fe, Co , Ni
Zn, Cu, Fe
Al, Cr, Mn
Au, Ag, Cu
В химических реакциях металлы выступают в роли
окислителей
восстановителей
окислителей и восстановителей
акцепторов электронов
Электродные потенциалы не зависят от
природы металла
концентрации соли
атомной массы металла
температуры
Промышленная очистка титана от примесей осуществляется
иодидным способым
2) электролитическим путем
3) отгонкой летучих соединений
4) зонным методом.
Промышленная очистка меди от примесей осуществляется
иодидным способом
электролитическим путем
отгонкой летучих соединений
зонным методом
Получение хрома алюмотермическим методом выражается реакцией
to
1) CrCl3 + А1 → А1С13 +Cr
(раствор) (раствор)
to
2) 2 Cr2О3 + А1 → 3Cr + CrО3 + Al2O3
to
3) Cr2О3 + 2А1 → 2Cr + Al2O3
to
4) 4 CrCl3 + 2 А12O3→ 4Cr+ 4 А1С13 + 3O2
(раствор)
Электролизом растворов нельзя получить
Na и Mg
2) Pb и Zn
3) Cu и Ag
4) Fe и Ni
При электрохимическом рафинировании меди, содержащей марганец, цинк, золото и серебро в анодный шлам перейдут
1) ZnиAg
2) MnиAu
3) Au и Ag
Zn и Mn
При электрохимическом рафинировании меди, содержащей марганец, цинк, железо и серебро в раствор перейдут
Mn u Zn
Mn u Ag
Mn, Ag u Fe
4) Mn, Zn u Fe
Стандартные электродные потенциалы соответствуют концентрации иона Men+, равной
0,001 моль/л
0,01 моль/л
0,1 моль/л
1 моль/л
Флотационный метод обогащения руды основан на
различии плотности минералов
различной смачиваемости минералов
различии в магнитных свойствах минералов
различии химических свойств минералов
Не взаимодействуют с разбавленной соляной кислотой
Zn u Mg
Fe u Be
Cu u Ag
Mn u Al
Возможным является процесс, описываемый уравнением
1) Zn + CuSO4 → ZnSO4 + Cu
2) Ag + Zn(NO3)2 → 2 AgNO3 + Zn
3) Pb + FeSO4 → PbSO4 + Fe
4) Sn + NiCl2 → SnCl2 + Ni
Реакция меди с концентрированной азотной кислотой описывается уравнением
1) Cu + 2 HNO3 → Cu(NO3)2 + H2↑
2) 4Cu + 10 HNO3 → 4Cu(NO3)2 + N2O↑ + 5H2O
3) 3Cu + 8 HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
4) Cu + 4 HNO3 → Cu(NO3)2 + 2 NO2↑ + 2H2O
Реакция меди с разбавленной азотной кислотой описывается уравнением
1) Cu + 2 HNO3 → Cu(NO3)2 + H2↑
2) 4Cu + 10 HNO3 → 4Cu(NO3)2 + N2O↑ + 5H2O
3) 3Cu + 8 HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
4) Cu + 4 HNO3 → Cu(NO3)2 + 2 NO2↑ + 2H2O
Реакция магния с разбавленной азотной кислотой выражается уравнением
1) 4Mg + 10 HNO3 → 4Mg(NO3)2 + N2O↑ + 5H2O
2) Mg + 2 HNO3 → Mg(NO3)2 + H2↑
3) Mg + 4 HNO3 → Mg(NO3)2 + 2 NO2↑ + 2H2O
4) Mg + HNO3 → MgO + HNO2
Концентрированная серная кислота не взаимодействует со следующими металлами
Cu u Ag
Ag u Pt
Zn u Mg
Sn u Al
Амфотерными свойствами обладают металлы
Fe u Ni
Be u Al
Na u Mg
Co u K
Не взаимодействуют с водой
Mg u K
Mn u Na
Ca u Ba
4) Zn u Sn
Относятся к легким конструкционным следующие металлы
Mg u Al
2) Co u Ni
3) Ti u Pt
4) Cu u Zn
Из четырех металлов Li,Na,K,Rbнаименьший потенциал ионизации имеет
Li
Na
K
4) Rb
Из четырех металлов Mg,Ca,Sr,Baнаименьшую электроотрицательность имеет
Mg
Ca
Sr
Ba
Разбавленная серная кислота не взаимодействует со следующими металлами
Сu u Hg
2) Al u Fe
3) Zn u Cr
4) Mg u Pb
Тесты по разделу «Строение атома и периодическая система Д.И.Менделеева».
1.Ядерную планетарную модель атома предложил
1) Бор
2) Зоммерфельд
3) Резерфорд
4) Планк
5) Томсон
2.Принцип неопределенности Гейзенберга описывается уравнением
1)

2)
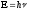
3)
 q
q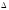 V
V h/m
h/m
4)
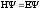
5) E = mc2
3.Уравнение Де-Бройля имеет вид
1)
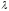 =h/mv
=h/mv
2)

3)
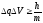
4)
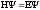
5) E = mc2
4. Уравнение Шредингера имеет вид
1)
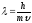
2)
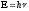
3)
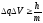
4)
H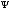 =E
=E
5) E = mc2
5. Изотопами являются
1) 40Ca и 42Ca
20 20
2) 40Ar и 40K
18 19
3) 40Ca и 40K
20 19
4) 136Xe и 138Ba
54 56
5) 23Na и 39K
11 19
6. Ядро атома состоит из
1) протонов и электронов
2) протонов и нейтронов
3) нейтронов и электронов
4) протонов
5) протонов, нейтронов и электронов
7. Энергию и размер орбитали характеризует
1) главное квантовое число n
2) орбитальное квантовое число l
3) магнитное квантовое число ml
4) спиновое квантовое число ms
5) количество находящихся на ней электронов

8. Форму атомной орбитали определяет
1) главное квантовое число n
2) орбитальное квантовое число l
3) магнитное квантовое число ml
4) спиновое квантовое число ms
5) порядковый номер атома в таблице Менделеева
9. Магнитное квантовое число ml характеризует
1) энергию орбитали
2) размер орбитали
3) форму орбитали
4) собственный механический момент движения электрона
5) ориентацию орбитали в пространстве
10. Все возможные значения магнитного квантового числа для d-орбиталей
1) 1,2,3
2) –1,0,1
3) –2,-1,0,1,2,3
4) –3,-2,-1,0,1,2,3
5) 1,2,3,4
11. Все возможные значения магнитного квантового числа для p-орбиталей
1) 1,2,3
2) –1,0,1
3) –2,-1,0,1,2
4) –3,-2,-1,0,1,2,3
5) 1,2,3,4
12. Какие орбитали имеют форму гантели
1) s-орбитали
2) p-орбитали
3) d-орбитали
4) f-орбитали
5) гибридные орбитали
13. В атоме не может быть …… электронов с одинаковым набором четырех квантовых чисел
1) двух
2) трех
3) пяти
4) семи
5) четырех
14. Какое электронное состояние возможно
1) 2s3
2) 3p7
3) 4d11
4) 3f 5
5) 5d 6
15.
Строение внешней электронной оболочки
в устойчивом состоянии имеет






2 p
2 s
1) кислород
2) кремний
3) азот
4) алюминий
5) фтор
16. В невозбужденном состоянии число электронов на четвертом энергетическом уровне равно пяти у
1) технеция
2) брома
3) германия
4) мышьяка
5) ванадия
17. Способность атомов притягивать к себе электронную плотность
1) потенциал ионизации
2) электроотрицательность
3) сродство атома к электрону
4) электростатическое притяжение
5) электрохимический потенциал
18. Энергия, выделяющаяся при присоединении электрона к свободному атому
1) потенциал ионизации
2) электроотрицательность
3) сродство атома к электрону
4) электростатическое притяжение
5) энергия Гиббса
19. Величина I в процессе
A(атом)
+ I
A+
+ 1 e
1) потенциал ионизации
2) электроотрицательность
3) сродство атома к электрону
4) внутренняя энергия
5) стандартный электродный потенциал
20. Количество протонов, нейтронов и электронов в атоме 52Cr
1) 52,24,52 24
2) 24,52,24
3) 24,24,28
4) 28,24,24
5) 24,28,24
21. В атоме 127J …. нейтронов
53
1) 53
2) 127
3) 180
4) 74
5) 85
22. Электроотрицательность элементов в таблице Д.И. Менделеева в периодах слева направо …., а в группах сверху вниз ….
1) уменьшается, уменьшается
2) увеличивается, уменьшается
3) увеличивается, увеличивается
4) уменьшается, увеличивается
5) увеличивается, не изменяется
23. В атоме 51V …. протонов
23
1) 23
2) 51
3) 74
4) 28
5) 25
24. Возможные валентности серы с точки зрения строения атома
1) 3, 5
2) 2, 4, 6
3) 1, 3, 5
4) 5, 7
5) 1, 3
25. Возможные валентности хлора с точки зрения строения атома
1) 1,7
2) 1,5,7
3) 1,3,5,7
4) 1,2,7
5) 1,2,4,7