
Лекция 17
.docЛекция 17
-
Реакционная способность в реакциях элиминирования
1. Влияние строения субстрата
1) На активность в целом

Возможны четыре вида влияния:
(а) стабилизация-дестабилизация образующейся двойной связи α- и β-заместителями (группами);
(б) стабилизация-дестабилизация отрицательного заряда аниона, т. е. изменение кислотности β-протона (в основном это влияние β-заместителей);
(в) стабилизация-дестабилизация положительного заряда (карбокатиона); это влияние в основном характерно для α-заместителей (α-групп);
(г) стерические эффекты (заслонение); это характерно и для α- и для β-групп.
Влияния (а) и (г) характерны для всех трех механизмов Е1, Е1сВ, Е2, причем эффект (г) наиболее выражен для механизма Е2.
Эффект (б) не характерен для механизма Е1.
Эффект (в) не характерен для механизма Е1сВ.
Арильная группа и двойная связь в качестве заместителей повышают скорость при любом механизме, стабилизируя двойную связь (эффект (а)), независимо от положения этих заместителей при α- либо β-углероде.
Акцепторная группа в β-положении, включая фенил, увеличивает кислотность субстрата, делокализуя отрицательный заряд, но в α-положении не оказывает влияния, если только нет эффекта (а).
Ведение в β-положение таких акцепторных заместителей, как Br, Cl, CN, Ts, NO2, SR, существенно увеличивает скорость реакций Е2. Влияние таких групп в α-положении на скорость процесса (в сторону увеличения) не столь существенно, поскольку отрицательный заряд локализован в основном на β-углероде [Марч; Днепровский, с. 348].
Донорные заместители ускоряют Е2-реакцию в случае «центрального» переходного состояния с большой двоесвязанностью. В случае сильно карбанионного переходного состояния с малой двоесвязанностью основное значение имеет замедляющий эффект +F-эффект алкильных групп [Днепровский, с. 348].
2) На спектр механизмов
α-Alk- и α-Ar-группы увеличивают скорость реакций Е1, стабилизируя карбокатионный центр в переходном состоянии.
β-Alk-заместители так же сдвигают спектр механизмов в сторону Е1, понижая кислотность β-протона.
β-Ar-заместители сдвигают спектр в сторону Е1сВ за счет стабилизации карбанионного центра. Аналогичным образом действуют все акцепторные заместители в β-положении.
3) На тип реакции (элиминирование или замещение E/S)
а) В условиях второго порядка, т. е. в присутствии основания В, α-разветвление способствует элиминированию по следующим причинам:
– из-за статистического фактора (больше β-водородов для атаки основания);
– из-за стерических препятствий для атаки α-углерода основанием (нуклеофилом).

б) В условиях первого порядка, когда B = solv, α-разветвление незначительно увеличивает долю элиминирования по отношению к замещению E1/SN1, но продукт SN1-реакции преобладает:


в) В условиях второго порядка β-разветвление также увеличивает отношение E2/SN2 за счет падения скорости SN2-процесса. Акцепторная группа в β-положении не только увеличивает скорость Е2 и сдвигает механизм в сторону Е1сВ, но также увеличивает отношение E/S.
г) В условиях первого порядка β-разветвление также благоприятствует E vs. S, т. е. элиминированию по сравнению с замещением по стерическим причинам.
Пальм несколько иначе трактует влияние заместителей у образующейся двойной связи на соотношение Е1/SN1. В переходном состоянии второй стадии реакции Е1 группировка

обладает –R-характером, поэтому все заместители +R-типа, и в α- и в β-положении, будут ускорять Е1-процесс [Пальм, с. 299].
2. Влияние атакующего основания
1) На спектр механизмов

Чем сильнее добавленное основание, тем больше скорость процесса.
Типичные основания для реакций Е2:
H2O, NR3, ˉOH, ˉOAc, ˉOR, ˉOAr, NH2ˉ, CO32-, LiAlH4, Iˉ, CNˉ.
Для препаративных целей пригодны только:
ˉOH/H2O, ˉOR/ROH, NH2ˉ/NH3 (т. е. основание в растворителе, являющемся сопряженной кислотой основания).
2) На тип реакции (элиминирование/замещение E/S)
а) При высокой концентрации сильного основания в неионизирующихся растворителях (основание десольватировано) более предпочтительны бимолекулярные механизмы, причем Е2 преобладает над SN2.
б) При низкой концентрации основания (или в его отсутствии) в ионизирующихся растворителях преобладают мономолекулярные механизмы, при этом SN1 превалирует над E1.
в) Использование сильных нуклеофилов, но слабых оснований (например, Iˉ) благоприятствует замещению.
г) Чем меньше основание ассоциировано в ионные пары, т. е. чем оно «свободнее», тем больше замещение S преобладает над элиминированием E.
3. Влияние уходящей группы
1) На реакционную способность
E2 проводили со следующими уходящими группами: R3N+, R3P+, R2S+, HOR+, SO2R, OSO2R, OC(O)R, OOH, OOR, NO2, F, Cl, Br, I, CN (но не с Н2О+):
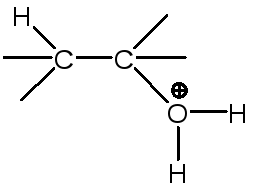
Механизм Е2 для таких реакций почти никогда не реализуется.
E1 проводили со следующими уходящими группами: R3N+, R2S+, H2O+, HOR+, OSO2R, OC(O)R, Cl, Br, I, N2+.
Однако для препаративных целей используют только следующие уходящие группы:
в реакциях Е1 – Н2О+;
в реакциях Е2 – Cl, Br, I и R3N+.
Чем выше стабильность уходящей группы, т. е. чем больше ее нуклеофугность, тем выше скорость процесса.

2) На спектр механизмов
Более хорошие уходящие группы (более сильные нуклеофуги) сдвигают механизм в сторону Е1, так как облегчают ионизацию с образованием карбокатиона.
Плохие и положительно заряженные уходящие группы сдвигают механизм в сторону Е1сВ, так как сильные электроноакцепторные –I (–F)-эффекты увеличивают кислотность β-водорода.
3) На тип реакции (E/S)
В реакциях первого порядка уходящая группа не может влиять на конкуренцию E vs. S, так как она отщепляется до того, как возникает возможность того или иного пути. Это не так, если в реакции участвует ионная пара.
В реакциях второго порядка соотношение E/S слегка возрастает в ряду:
I > Br > Cl
Группа OTs способствует замещению (S), а заряженная уходящая группа – элиминированию (Е).
4. Влияние среды
-
Влияние растворителя на спектр механизмов
Существует общая закономерность:
|
Более полярное окружение повышает скорость любой реакции, идущей через ионные интермедиаты. |
Поэтому при наличии нейтральных уходящих групп повышение полярности растворителя и увеличение ионной силы раствора будет способствовать реакциям Е1 или Е1сВ.
2) Влияние среды на скорость реакции
В случае мономолекулярных механизмов и образования ионных интермедиатов увеличение полярности среды (растворителя) повышает скорость процесса, как только что было отмечено.
В случае бимолекулярных процессов (Е2) заряды делокализованы в переходном состоянии (ПС) в большей степени, чем в исходном (для реакций анион–молекула), а в случае заряженной уходящей группы – даже уменьшены (для реакций анион–катион):

Это приводит к тому, что для реакции Е2 с ростом полярности растворителя скорость процесса падает.
3) Влияние растворителя на тип реакции (E/S)
С увеличением полярности растворителя увеличивается доля SN2-реакции за счет падения доли Е2-реакции (растет SN2/ Е2). Частичное объяснение заключается в том, что в переходном состоянии элиминирования заряды более делокализованы, чем в переходном состоянии замещения.

Поэтому реакции элиминирования целесообразнее проводить в спиртовых щелочах, а реакции замещения – в водных:


4) Влияние температуры
Независимо от порядка реакции при увеличении температуры возрастает доля элиминирования по сравнению с замещением, а при высоких температурах элиминирование преобладает над замещением. Это связано с тем, что энергия активации элиминирования, как правило, больше энергии активации замещения (при элиминировании происходит больше изменений в химических связях).
-
Пиролитическое элиминирование
Происходит при нагревании субстрата без какого-либо реагента, часто – в газовой фазе, тогда как элиминирование в растворе требует присутствия в одной из стадий основания (которым может быть сам растворитель).
-
Механизмы
1) Механизм Еi

В этом случае возможно исключительно син(цис)-элиминирование.
2) Свободно-радикальный механизм
Инициирование:
![]()
Развитие (рост) цепи:

Обрыв цепи (диспропорционирование):
![]()
-
Ориентация
-
Применимо правило Бредта:
|
Если в системе (молекуле, субстрате) имеется двойная связь, то предпочтительнее будет образовываться сопряженная система, если к этому нет значительных стерических препятствий. |

2) Во многих случаях ориентация носит статистический характер и определяется числом атомов водорода в β-положениях. В данном случае выполняется правило Гофмана.


3) Стерические эффекты как в основном, так и в переходном состоянии синхронного перициклического элиминирования играют значительную роль.
