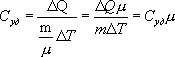Лекции физика
.docxЯвление резонанса используется для усиления колебаний, например, электромагнитных. Однако при конструировании различных машин и сооружений необходимо учитывать даже самую небольшую периодическую силу с тем, чтобы предотвратить нежелательные последствия резонанса.
Стоячие волны
Когда две одинаковые волны с равными амплитудами и периодами распространяются навстречу друг другу, то при их наложении возникают стоячие волны. Стоячие волны могут быть получены при отражении от препятствий. Допустим, излучатель посылает волну к препятствию (падающая волна). Отраженная от него волна наложится на падающую волну. Уравнение стоячей волны можно получить сложением уравнения падающей волны

![]()
и
уравнения отраженной волны
![]()
Отраженная
волна движется в направлении,
противоположном падающей волне, поэтому
расстояние х берем со знаком минус.
Смещение точки, которая участвует
одновременно в двух колебаниях, равно
алгебраической сумме
![]() .
После несложных преобразований, получаем
.
После несложных преобразований, получаем
|
|
(8.15) |
Это уравнение стоячей волны определяет смещение любой точки волны.
|
Величина
|
(8.16) |
не
зависит от времени и определяет амплитуду
любой точки с координатой х. Каждая
точка совершает гармоническое колебание
с периодом Т. Амплитуда Аст
для каждой точки вполне определена. Но
при переходе от одной точки волны к
другой она изменяется в зависимости от
расстояния х. Если придавать х значения,
равные
![]() и
т.д., то при подстановке в уравнение
(8.16) получим
и
т.д., то при подстановке в уравнение
(8.16) получим
![]() .
Следовательно, указанные точки волны
остаются в покое, т.к. амплитуды их
колебаний равны нулю. Эти точки называются
узлами стоячей волны. Точки, в которых
колебания происходят с максимальной
амплитудой, называются пучностями.
Расстояние между соседними узлами (или
пучностями) называются длиной стоячей
волны и равно
.
Следовательно, указанные точки волны
остаются в покое, т.к. амплитуды их
колебаний равны нулю. Эти точки называются
узлами стоячей волны. Точки, в которых
колебания происходят с максимальной
амплитудой, называются пучностями.
Расстояние между соседними узлами (или
пучностями) называются длиной стоячей
волны и равно
![]()
где λ - длина бегущей волны.
В стоячей волне все точки среды, в которой они распространяются, расположенные между двумя соседними узлами, колеблются в одной фазе. Точки среды, лежащие по разные стороны от узла, колеблются в противофазе -фазы их отличаются на π. т.е. при переходе через узел фаза колебаний скачкообразно меняется на π. В отличие от бегущих волн в стоячей волне отсутствует перенос энергии вследствие того, что образующие эту волну прямая и обратная волны переносят энергию в равных количествах и в прямом и в противоположном направлениях. В том случае, когда волна отражается от среды более плотной, чем та среда, где распространяется волна, в месте отражения возникает узел, фаза изменяется на противоположную. При этом говорят, что происходит потеря половины волны. Когда волна отражается от среды менее плотной в месте отражения, появляется кучность, и потери половины волны нет.
Термодинамическое
состояние тела (например, газа)
характеризуется его массой
![]() ,
молярной массой μ, давлением
,
молярной массой μ, давлением
![]() ,
объемом
,
объемом
![]() ,
температурой
,
температурой
![]() (а
возможно, и другими величинами, например,
определяющими его химический состав).
Все эти величины называются
термодинамическими параметрами тела.
Однако, как будет видно из дальнейшего,
такие параметры, как
(а
возможно, и другими величинами, например,
определяющими его химический состав).
Все эти величины называются
термодинамическими параметрами тела.
Однако, как будет видно из дальнейшего,
такие параметры, как
![]() ,имеют
смысл только тогда, когда тело находится,
хотя бы приближенно, в так называемом
состоянии термодинамического равновесия
(т.д.р.). Так называется состояние, в
котором все термодинамические параметры
остаются со временем постоянными (к
этому следует добавить еще условие
отсутствия стационарных потоков). Если,
например, быстро подогревать газ, как
это показано на рис. 9.1, температура
непосредственно подогреваемой части
сосуда А окажется выше температуры
части В. Не будут равны и давления в
частях А и В. В этом случае не имеет
смысла понятие температуры
,имеют
смысл только тогда, когда тело находится,
хотя бы приближенно, в так называемом
состоянии термодинамического равновесия
(т.д.р.). Так называется состояние, в
котором все термодинамические параметры
остаются со временем постоянными (к
этому следует добавить еще условие
отсутствия стационарных потоков). Если,
например, быстро подогревать газ, как
это показано на рис. 9.1, температура
непосредственно подогреваемой части
сосуда А окажется выше температуры
части В. Не будут равны и давления в
частях А и В. В этом случае не имеет
смысла понятие температуры
![]() или
давления
или
давления
![]() всего
газа. Другой пример – впустим в газ
пучок быстрых молекул. Ясно, что не имеет
смысла говорить о температуре газа до
тех пор, пока быстрые молекулы, вследствие
ряда столкновений с другими, не приобретут
скоростей порядка средней скорости
остальных молекул, иначе говоря, пока
система не придет в состояние т.д.р.
всего
газа. Другой пример – впустим в газ
пучок быстрых молекул. Ясно, что не имеет
смысла говорить о температуре газа до
тех пор, пока быстрые молекулы, вследствие
ряда столкновений с другими, не приобретут
скоростей порядка средней скорости
остальных молекул, иначе говоря, пока
система не придет в состояние т.д.р.
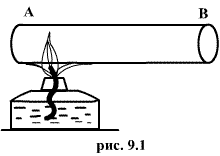
В состоянии т.д.р. для каждого вещества термодинамические параметры связаны между собой так называемым уравнением состояния:
|
|
(9.1) |
Таким уравнением состояния для идеального газа является уравнение Менделеева – Клапейрона:
|
|
(9.2) |
Здесь R=8,31 Дж/(мольК) – универсальная газовая постоянная, μ - молярная масса. Для углерода (С) величина μ составляет 12г, для водорода (H2) – 2г, для кислорода (О2) – 32г, для воды (Н2О) – 18г и т.д.
В моле любого вещества содержится одно и то же количество молекул N0, называемое числом Авогадро:
|
|
(9.3) |
Это объясняется тем, что значение моля любого вещества выбрано пропорциональным массе молекулы этого вещества. Масса молекулы может быть получена делением массы моля на число Авогадро:
|
|
(9.4) |
Отношение универсальной газовой постоянной R к числу Авогадро (т.е. универсальная газовая постоянная, приходящаяся на одну молекулу) называется постоянной Больцмана:
|
|
(9.5) |
В формулу (9.2) входят еще давление, объем, температура и масса газа. Давление Р в системе СИ измеряется в ньютонах на квадратный метр или паскалях (Н/м2=Па), объем V – в кубических метрах (м2), масса m – в килограммах (кг), температура T – в кельвинах (К). Абсолютная температура Т отсчитывается от абсолютного нуля (-273,15°С), т.е. Т=t+273,15, где t – температура по Цельсию.
Если количество вещества равно 1 молю, то (9.2) превращается в
|
|
(9.6) |
Идеальным газом называется газ, настолько разреженный, что он подчиняется уравнению (9.2) или(9.6). Смысл этого определения состоит, очевидно, в том, что для подчинения уравнению (9.6) газ должен быть достаточно разреженным. Если газ, напротив, сжат до достаточно больших плотностей (так называемый реальный газ), то вместо (9.6) имеем
|
|
(9.7) |
Это – уравнение состояния реального газа или уравнение Ван-дер-Ваальса. Здесь a и b – постоянные.
Внутр Энергия Ид газа
Под внутренней энергией (U) понимается вся энергия системы (тела) за исключением механической энергии системы как целого. Что именно входит во внутреннюю энергию системы? Сюда входит кинетическая энергия поступательного движения ее молекул, потенциальная энергия их взаимодействия между собой, энергия возбуждения колебаний и вращений молекул. Здесь перечислены лишь те виды энергии системы, которые могут меняться в рассматриваемых нами термодинамических процессах. Например, энергию возбуждения атомных ядер нужно будет включить, если будут рассматриваться температуры, при которых такое возбуждение может произойти.
Поскольку состояние термодинамической системы (например, газа) определяется величинами m, μ, V, T (давление P само определяется этими же величинами), то от них должна зависеть и внутренняя энергия U. Опустим пока постоянные для данного тела m и μ (ниже примем их во внимание), запишем U=U(V,T). Зависимость внутренней энергии от объема V связана с тем, что при изменении объема меняется расстояние между молекулами и, следовательно, потенциальная энергия их взаимодействия. Эта зависимость существенна только для реального газа. Для идеального газа внутренняя энергия должна зависеть только от температуры, т.е. U=U(T), так как температура определяет среднюю кинетическую энергию молекул.
![]() ,
,
Работа газа
Рассмотрим газ, находящийся в цилиндре с поршнем, позволяющем менять объем газа (рис 9.2). Отметим, что слово «газ» здесь совершенно условно. Это может быть жидкость, кристалл и вообще любое тело. Цилиндр контактирует с нагревателем или холодильником, который может сообщать газу тепло или отбирать его.
Пусть на поршень оказывается внешнее давление, величина которого может быть любой.

Все процессы, которые будем рассматривать ниже, будут квазистатическими, т.е. медленными настолько, чтобы можно было считать, что в каждый момент газ находится в состоянии т.д.р. Если очень быстро сжать газ, то давление его у поршня окажется на какой-то момент больше, чем в стальном объеме, и тогда нельзя будет говорить о давлении газа вообще. Такой процесс не является квазистатическим. Приближенно квазистатическими являются и процессы, достаточно быстрые с технической точки зрения, например процессы, происходящих в цилиндрах двигателя автомашины во время работы мотора (оказывается, для приближенной квазистатичности требуется, чтобы скорость поршня была мала по сравнению со скоростью звука в газе).
Работа
над газом выполняется внешними силами
при его сжатии. Работа самого газа
выполняется при его расширении. Пусть
газ расширяется так, что поршень на
рис.9.2 поднимается на величину dx. Тогда
газ выполнит работу
![]() (S
– площадь поршня). Получим
(S
– площадь поршня). Получим
|
|
(9.8) |
Эта величина называется элементарной работой газа. Работа при расширении газа от объема V1 до V2 будет равна
|
|
(9.9) |
Если по одной оси отложить объем газа, по другой – его давление (плоскость P – V), то работа (9.9) будет изображаться площадью под кривой P(V) (рис.9.3).
Процесс расширения от объема V1 до объема V2 может происходить различным образом: например, можно при этом изолировать газ от нагревателя или, наоборот, нагревать газ и т.д. Иначе говоря, при перемещении из точки 1 в точку 2 в газе могут происходить различные процессы, даже если зафиксировано начальное и конечное состояния. В каждом процессе работа будет иметь свое значение, так как площадь под кривой процесса будет различной (кривые I, II, и III на рис.9.3). Таким образом, выполняемая газом работа зависит от процесса, который с ним происходит. Обычно (хотя это и не совсем точное выражение) говорят, что «работа газа есть функция процесса».
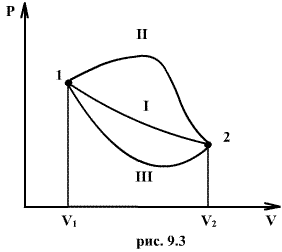
Заметим, что работа положительна, если она выполняется газом, и отрицательна, если внешние силы выполняют ее над газом.
Тепло ёмкость
В термодинамике для характеристики тепловых свойств тел используется понятие теплоемкости.
Теплоемкость - количество теплоты необходимое для нагревания тела на один Кельвин
|
|
(9.11) |
Удельной теплоемкостью называется величина, числено равная теплоте, которую надо сообщить единице массы тела для повышения его температуры на один Кельвин:
|
|
(9.12) |
Отсюда можно определить количество теплоты, необходимое для нагревания вещества, массы m
|
|
(9.13) |
Молярная теплоемкость - количество тепла необходимое для нагревания одного моля вещества на один Кельвин
|
|
(9.14) |
Воспользовавшись I законом термодинамики выражение (9.11) можно переписать в виде
|
|
(9.15) |
откуда следует, что теплоемкость есть функция процесса, т.е. теплоемкость системы зависит от того каким образом система переходит из одного состояния в другое. Вообще говоря, таких процессов может быть сколько угодно, фактически же используются чаще всего теплоемкость при р=const(Cp) и при V=const(CV).