
стекольная шихта
.docx|
ЮРГПУ (НПИ) Кафедра ТКС и ВВ
|
Расчет стекольной шихты |
№ 1 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Цель работы: получить практические навыки в расчете стекольной шихты. Приборы и материалы: сырьевые материалы, фарфоровая ступка и пестик, аллундовый (шамотный) тигель, весы, силитовая электрическая печь, средства индивидуальной защиты. Краткая теория Стекольной шихтой называется однородная смесь предварительно подготовленных и отвешенных по заданному рецепту сырьевых материалов. Сырьевые материалы для производства стекла делятся на две группы: главные и вспомогательные. Главные материалы - это материалы, посредством которых в стекломассу вводятся оксиды: кислотные (стеклообразователи), щелочные и щелочноземельные (модификаторы). Стеклообразователи- оксиды, способные самостоятельно образовывать стекло. Это SiO2 , B2O3, P2O5 и др. Модификаторы- оксиды, не способные самостоятельно образовывать стекла. Они входят в структуру стекла, разрывая и упрощая сетку стекла и определяя его свойства. Вспомогательные материалы - это добавки, улучшающие свойства стекла или облегчающие варку: осветлители, обесцвечиватели, красители, глушители, окислители, восстановители и ускорители варки. Главные материалы вводятся следующими сырьевыми компонентами. Кремнезем SiO2 . Для большинства стеклоизделий основным сырьевым компонентом является кварцевый песок, содержание которого в шихте составляет 60…70% и выше. Для производства стеклоизделий используются кварцевые пески с содержанием SiO2 не менее 96%. Борный ангидрид В2О3 . Исходным материалом для введения В2О3 в шихту является борная кислота Н3ВО3 и бура Nа2B4O7∙10H2O, чаще- кальцинированная безводная бура Nа2B4O7 . При расчете шихты необходимо учитывать летучесть буры и борной кислоты. Температура плавления буры – 747°С. Глинозем Аl2О3 вводят в состав стекла с помощью технического оксида алюминия, гидроксида алюминия Аl2О3∙3Н2О, полевых шпатов, пегматитов, каолинов и др., а также отходов горнообогатительных фабрик — полевошпатового и нефелинового концентратов. Полевые шпаты бывают калиевые (ортоклазы, микроклины K2О∙Al2О3∙6SiО2), натриевые (альбиты Na2О∙Al2О3∙6SiО2), кальциевые (анортиты CaO∙Al2O3∙ 6SiО2). Каолины Al2O3∙2SiO2∙2H2O (A12O3 39,5 %; SiO2 46,5 %; H2O 14 %) применяют для стекловарения после обогащения (Fe2O3 0,4—1,0%) Фосфорный ангидрид Р2О5 вводят в состав стекла в виде солей фосфорной кислоты, преимущественно солей кальция, натрия (суперфосфат, костяная мука и пр.). Применяют также фосфаты аммония, апатитовый концентрат и др. Диоксид циркония ZrО2 вводят в состав стекла в виде циркона или диоксида циркония. Циркон ZrSiО4 — природный минерал, который добывают из россыпей горных пород. Цирконовый концентрат содержит, %: ZrО2 - 64,5; SiО2 - 31,5; TiО2 - 2; Fe2О3 - 0,5. Из циркона получают диоксид циркония. Диоксид титана TiО2 вводят в стекло через искусственный продукт TiО2, получаемый из титансодержащих минералов (сфена, титаномагнетита, ильменита), а также из титанистых шлаков. Оксид цинка ZnO вводят в стекло посредством цинковых белил, в которых содержится не менее 96 % оксида цинка. Оксид свинца РbО2 вводят в стекло посредством свинцового глета (желтый оксид свинца) и свинцового сурика (красный оксид свинца). При варке стекла сурик разлагается (2Рb3О4→6РbО+ О2) на РbО (97,7:%) и О2 (2,3 %). Выделяющийся при этом кислород помогает осветлению стекломассы. Оксид натрия Na2О в состав стекла вводят через кальцинированную соду и сульфат натрия. Сода Na2CО3 бывает кристаллической Na2CO3∙10H2O и безводной Na2CО3. В стекловарении применяют главным образом безводную соду, которая содержит 58,5 % Na2О и 41,5 % СО2. Кроме того, соду подразделяют на искусственную, природную, легкую, тяжелую. Природная сода применяется редко, потому что она содержит до 15—20% загрязняющих примесей: сульфата натрия, хлористого натрия и др. Оксид калия К2О вводят в состав стекла при помощи поташа (К2CO3), содовопоташной смеси и селитры KNО3. Поташ К2СО3 состоит из 68,2 % К2О и 31,8 % СО2. Поташ должен содержать не менее 98 % К2СО3, имеет вид белого порошка, растворимого в воде, легко поглощающего влагу из воздуха. Различают поташ кристаллический К2СО3∙2Н2О и кальцинированный К2СО3. В стеклоделии применяют преимущественно кальцинированный поташ. Оксид лития Li2О вводят в стекло посредством искусственного углекислого лития Li2СОз и природных минералов лепидолита LiF∙KF∙Al2О3∙3SiО2, сподумена Li2О∙Al2О3∙4SiО2 и др. В лепидолите содержится 6 %, в сподумене —8 % Li2О. Углекислый литий должен содержать: Li2CО3 не менее 65 %, сульфатов в пересчете на SO4 не более 1,5 %, хлоридов не более 1 % и R2O3 не более 0,5 %. Оксид кальция СаО вводят в состав стекла посредством карбоната кальция (известняк, мел, мрамор). Известняк — осадочная горная порода белого цвета или окрашенная соединениями железа в разные оттенки: зеленоватый, желтый, бурый, красноватый и др. Известняки, используемые в стекловарении, должны содержать не менее 53 % оксида кальция и не более 0,2 % оксида железа (для сортовой посуды не более 0,03%). Мел — мягкая осадочная порода белого цвета, иногда слегка окрашенная примесями. Содержание основного вещества должно быть не менее 98%. Мрамор — горная порода, отличается высоким содержанием СаСО3 до 99 - 99,5 %, постоянством состава и небольшим количеством оксида железа до 0,015 %. Оксид магния MgO вводят в состав стекла преимущественно посредством доломита и может быть введен магнезитом или доломитизированным известняком. Доломит CaCО3∙MgCО3 — природный двойной карбонат кальция и магния, горная порода, в которой кроме основного вещества содержатся примеси (SiО2, A12О3, Fe2О3). В зависимости от вида и концентрации примесей доломит окрашен в желтый, бурый, серый цвет. Допускаемое содержание оксидов железа, %, не более: для оконного стекла 0,3, технического 0,1, сортового 0,05. Оксид бария ВаО вводится в стекло посредством разных солей бария (сернокислый, углекислый, азотнокислый). Сернокислый барий BaSО4 встречается в природе в виде минерала барита (тяжелый шпат). Применение ограничено вследствие трудностей разложения без восстановителей. При повышении концентрации в шихте (более 5 %) добавляют восстановитель (4—7 %). В стекло переходит 65,6 % ВаО. Углекислый барий ВаСО3 встречается в природе в виде минерала витерита. В стеклоделии применяется также искусственный ВаСО3. В стекло переходит 77,7 % ВаО. Азотнокислый барий Ba(NО3)2, применяемый при производстве оптических стекол (баритовые кроны), содержит 58,6 % ВаО. Вспомогательные материалы: Глушители — вещества, при введении которых стекло приобретает способность рассеивать свет (становится непрозрачным). Глушители которые делятся на три группы по способу глушения: ─ кристаллические — с выделением кристаллической фазы; ─ ликвационные —дисперсионные; ─ газовые — за счет газовой фазы. Наиболее интенсивными являются глушители, образующие кристаллическую фазу. Важнейшим глушителем с кристаллизацией при обжиге является диоксид титана TiO2 (с показателем преломления анатаза и рутила соответственно n=2,52 и 2,76). При обжиге необходима кристаллизация TiO2 в виде анатаза, обладающего равномерной мелкокристаллической структурой. В случае же кристаллизации рутила выделяются крупные, неравномерно расположенные кристаллы желтоватого цвета, обладающие повышенной окрашивающей способностью. В шихту TiO2 как глушитель вводят в количестве 16–20 %, причем пригодным для варки белых эмалей является технический продукт с содержанием TiO2 не менее 98 %. TiO2 снижает вязкость эмали, повышает кислотостойкость и блеск. Наилучшее глушение эмали TiO2 наблюдается в присутствии В2О3, Al2O3 и Р2О5. Помимо TiO2, к дисперсионным глушителям относятся SnO2, ZrO2, CeO2, MoO3, соединения мышьяка, ZnS, Sb2O3. ZrO2 встречается в природе в виде минералов — бадделеита ZrO2 и циркона ZrO2SiO2, применяется в качестве кристаллизующегося глушителя, главным образом, в фосфатсодержащих эмалях. ZrO2 (n=2,4), помимо глушения, улучшает химическую и термическую стойкость, тугоплавкость и блеск покрытий. Обычно ZrO2 сочетают с Al2O3, SiO2, Al2O3SiO2. Его введение повышает температуру плавления и щелочестойкость эмали. Классическим дисперсионным глушителем является SnO2 (коэффициент преломления n=2,06). Это глушитель, который почти не растворяется в расплавленной эмали. Те же незначительные его количества, которые растворяются, частично снова выделяются, улучшая химическую стойкость и прочность эмали. SnO2 придает эмали слабый оттенок цвета слоновой кости и используется, прежде всего, для просветления керамических красок в производстве ювелирных изделий. СеО2 как дисперсионный глушитель применяется редко, только в специальных эмалях ввиду склонности к переходу в Се2О3, при этом окраска из желтовато-белой переходит в желтовато-коричневую. К дисперсионным глушителям на основе сурьмы относятся антимонат натрия NaSbO3, придающий кремовато-белый цвет покрытию. К глушителям, глушащим за счет выделения газовой фазы, относятся многочисленные фтористые соединения. Их глушащее действие проявляется как в виде интенсификаторов кристаллизации, так и за счет образования газовой фазы. CaF2 — плавиковый шпат, применяемый в качестве флюса, является слабым глушителем. Представляет собой мелкозернистый материал с незначительными количествами примесей силикатов, известкового шпата, оксидов железа. Глушащее действие CaF2 базируется на взаимодействии с Na2O при выделении кристаллов фторида натрия. Ввиду опасности угара фторидов их нельзя вводить в сильно измельченном виде. Общим для всех фторидов является то, что они обладают слабым глушащим действием и самостоятельно, как правило, не применяются. В общем случае они увеличивают ТКЛР, улучшают блеск, снижают температуру начала размягчения. Из-за отрицательного влияния фтора на состояние окружающей среды в эмалировочной промышленности существует тенденция к исключению или значительному уменьшению применения фтористых компонентов или соединений, либо к установке специальных аппаратов, улавливающих фтор. К вспомогательным материалам относятся также активаторы сцепления эмали с металлом — оксидные и сульфидные соединения. К оксидным активаторам сцепления относятся оксиды кобальта, никеля, меди, молибдена, ванадия. Из оксидов кобальта наиболее применимы СоО — серого цвета и Со2О3 — черного цвета, из оксидов никеля: NiO — зеленого цвета и Ni2O3 — черного цвета. Наиболее эффективен оксид кобальта в количестве до 1 %. Оксиды никеля действуют слабее и их вводят в 3–4 раза больше, но чаще всего используют совместно оксиды кобальта (0,3–0,5 %) и никеля (0,5–2 %). МоО3, а также молибдаты аммония, кальция и бария применяют в сочетании с Sb2O3 в качестве активаторов сцепления при безгрунтовом белом эмалировании (1–2 % МоО3, 1–4 % Sb2O3). V2O5 применяется как адгезионное средство при эмалировании хромоникелевых сталей. К сульфидным активаторам адгезии относятся As2S3 и As2S5, их применяют в сочетании с другими адгезионными средствами. Окислители вводят в шихту эмали для окисления органических примесей в расплаве и создания окислительных условий, способствующих получению окраски или ее нейтрализации, например, для перевода иона Fe2+ в ион Fe3+. В качестве окислителей используют натриевую и калиевую селитры (NaNO3 и KNO3), пиролюзит MnO2, в отдельных случаях используют и нитрат бария Ba(NO3)2. Нитраты, помимо окислительной роли, выполняют еще и роль плавней. Красители стекла представляют собой соединения переходных и редкоземельных тяжелых металлов. С помощью красителей стеклу можно придать любую окраску. На окрашивание стекла влияет тип красителя, его концентрация, режим марки и окислительно-восстановительные условия. Один и тот же краситель в зависимости от условий варки и концентрации может сообщать стеклу разный цвет. На интенсивность и оттенок окрашивания стекла влияет также его состав. Ход работы: Расчет сырьевых компонентов шихты: Расчет шихты ведут исходя из суммарного количества компонента, вносимого всеми сырьевыми материалами. Кроме того, большинство сырьевых материало содержат летучие вещества, удаляющиеся в процессе стекловарения (вода, газообразные составляющие). Поэтому такие сырьевые материалы должны быть в избытке. При расчете шихты следует учитывать поправку на улетучивание некоторых компонентов (сода). Таблица 1 – Химический состав сырьевых материалов.
Результаты исследования: Вариант № 6. Содержание оксидов, % (по массе):
Приводим состав стекла и каждого сырьевого компонента к 100 %:
Составляем систему уравнений: 99,05х1 + 0,22х5 + 1,42х6 + 1,03х7 + 0,53х8 + 0,23х9 = 29,41 0,12 х1 + 54,45х6 = 1,96 15,0х2 + 0,43х3 + 58,5х4 + 0,52х5 = 3,73 0,12 х2 + 66,30х5 = 6,96 35,12 х2 = 4,51 56,03 х3 = 10,0 97,7 х9 = 33,33 77,20 х7 = 4,9 98,42 х8 = 5,2 => Х1 = 0,2708 Х2 = 0,1284 Х3 = 0,1785 Х4 = 0,0286 Х5 = 0,1047 Х6 = 0,0354 Х7 = 0,0635 Х8 = 0,0528 Х9 = 0,3411 Решая систему уравнений и умножая полученные данные на 100, а также учитывая улетучивание соды в количестве 3,2% имеем следующий состав шихты на 100 массовых частей стекломассы, масс.ч: Песка = 27,08, Буры = 12,84, Борной кислоты = 17,85, Соды = 2,86, Поташа = 10,48, Известняка = 3,54, Углекислого бария = 6,35, Оксида цинка = 5,28, Сурика свинцового = 34,11. ИТОГО = 120,38.
Таблица 1. Теоретический состав стекла и шихты.
Вывод: В ходе выполнения работы были получены практические навыки в расчете стекольной шихты.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
С Работу выполнил Студент ХТФ 4-10 Бушнова Ольга |
Работу проверил доцент к.т.н. Рябова А. В.
|
Дата |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

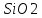 – 30,0
%
– 30,0
%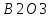 – 14,8
%
– 14,8
%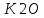 – 7,1
%
– 7,1
% – 3,8
%
– 3,8
%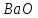 – 5,0
%
– 5,0
%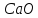 – 2,0
%
– 2,0
% – 34,0
%
– 34,0
%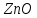 – 5,3
%
– 5,3
%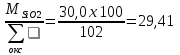
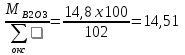
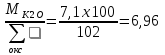
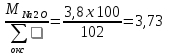
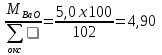
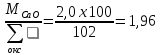
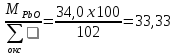
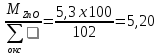
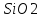 – х1
песка;
– х1
песка;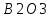 – х2
буры и х3
борной кислоты;
– х2
буры и х3
борной кислоты; –х5
поташа;
–х5
поташа;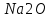 – х4
соды кальцинированной;
– х4
соды кальцинированной;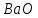 – х7
углекислого бария;
– х7
углекислого бария;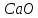 – х6
известняка;
– х6
известняка;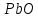 – х9
сурика свинцового;
– х9
сурика свинцового;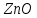 – х8
оксида свинца.
– х8
оксида свинца.