Федеральное агентство железнодорожного транспорта
Омский государственный университет путей и сообщений
Кафедра «теплоэнергетика»
Техническая термодинамика
Курсовая работа по дисциплине «теоретические основы теплотехники»
Вариант - 15
Студент группы 37ж
_______ Руденко В.С.
Руководитель: доцент кафедры
«теплоэнергетика»
_______ В. Н. Кузнецов
Омск 2009
УДК 621.1: 536.7.075
Реферат
Курсовая работа содержит 67 страницы, 14 страниц графического материала, 16 таблиц
Энтальпия, энтропия, котельная установка, турбина, регенерация, степень сжатия, количество теплоты
В данной работе рассматриваются газы, газовые циклы, циклы паротурбинных установок, циклы трансформаторов тепла.
Целью работы является изучение процессов, нахождение недостающих параметров, определение КПД
Содержание
Введение …………………………………………………………………..…………5
Газовые процессы
1.1 Задание 1………………………………………………………………………....6
Определение недостающих начальных параметров……………….………7
Определение конечных параметров………………………………………....8
Определение тепла, работы и изменения параметров: внутренней энергии, энтальпии и энтропии…………………………………………......................9
Задача 2……………………………………………………………………….13
Определение недостающих начальных параметров………………………15
Определение конечных параметров………………………………………...16
Определение работы и изменение параметров: внутренней энергии, энтальпии и энтропии………………………………………………………..17
Газовые циклы
Задача 1…………………………………………………………………….....23
Определение параметров газа в переходных точках цикла……………...24
Определение тепла q, работы l и изменение параметров: внутренней энергии Δu, энтальпии Δh, энтропии Δs, в каждом процессе…………….28
Определение полезной работы, подведенного и отведенного тепла в цикле, q1 и q2 соответственно, и его КПД ηt (двумя способами)……………….....30
Задача 2…………………………………………………………………….....33
Определение параметров газа в переходных точках цикла………………34
Определение терла q, работы l и изменение параметров: внутренней энергии Δu, энтальпии Δh, энтропии Δs, в каждом процессе…………….37
Определение полезной работы, подведенного и отведенного тепла в цикле, q1 и q2 соответственно, и его КПД ηt (двумя способами)……………….....39
Циклы паросиловых установок
Задача 1…………………………………………………………………….....44
Расчет термического КПД при давлении промперегрева pП = 20 бар…..45
Расчет термического КПД при давлении промперегрева pП = 10 бар…..45
Расчет термического КПД при давлении промперегрева pП=5 бар.........46
Расчет термического КПД при давлении промперегрева pП = 2 бар……46
Расчет термического КПД при давлении промперегрева pП = 1 бар……46
Расчет термического КПД без промперегрева……………………….……47
Построение зависимости ηt = f(pП) и сравнение с термическим КПД без промперегрева………………………………………………………………..49
Задача 2 …………………………………………………………………........50
Расчет энтальпии h01, h02, h2……………………………………………........51
Расчет α1 и α2…………………………………………………………….........51
Расчет термического КПД регенеративного цикла………………………..51
Расчет термического КПД обычного цикла Ренкина ……………………..52
Циклы трансформаторов тепла
Задача 1…………………………………………………………………….....58
Расчет удельной холодопроизводительности в цикле…………………….59
Расчет затраченной работе в цикле……………………………………....60
Расчет холодильного коэффициента в цикле………………………….....61
Задача 2……………………………………………………………………..63
Заключение………………………………………………………………………...66
Библиографический список……………………………………………………....67
Ведение
В настоящее время во всех сферах человеческой деятельности используется тепло. Ученые давно изучили основные закономерности переноса и использования теплоты. Но как научиться правильно использовать тепло? Как получить новые и эффективные источники тепла? Именно эти вопросы помогает решить термодинамика. Термодинамика представляет собой науку о закономерностях превращения энергии. Основным содержанием технической термодинамики является изучение процессов взаимного преобразования тепловой и механической энергии.
При изучении термодинамики особое внимание следует уделить усвоению термодинамического метода исследования, который имеет следующие особенности. Во-первых, термодинамика строится по дедуктивному принципу, т. е. от общего к частному. Её основной особенностью являются два закона (начала), установленных опытным путём. Первый из них представляет специфическую форму закона сохранения и превращения энергии и имеет, поэтому всеобщий характер, второй – устанавливает качественную направленность процессов, осуществляемых в физических системах. С помощью математического аппарата термодинамики получают соотношения, позволяющие решать конкретные задачи (например, рассчитывать термодинамические процессы). Во-вторых, термодинамика имеет дело только с макроскопическими величинами. Процессы здесь рассматриваются как непрерывная последовательность состояний равновесия.
Термодинамика рассматривает равновесные процессы и равновесные состояния, так как только равновесные состояния могут быть описаны количественно с помощью уравнений состояния. Лишь равновесные процессы изменения состояния термодинамической системы можно изображать графически.
Цель выполнения работы – закрепление и углубление полученных знаний, ознакомление с необходимой справочной литературой, государственными и отраслевыми стандартами, получение навыков самостоятельного решения инженерных задач и технически грамотного изложения пояснительной записки.
Расчеты в курсовой работе иллюстрированы графиками и рисунками, рассмотрены газовые процессы, циклы, паросиловые установки, а также циклы трансформаторного тепла.
1 Газовые процессы
Задача 1
Газ с начальной температурой Т1 = 300 К и давлением р1 = 0.1 МПа
политропно сжимается в компрессоре до давления р2. Определить недостающие начальные параметры v1, u1, h1, s1, конечные параметры T2, v2, u2, h2, s2, тепло
q1-2, работу l1-2, изменение параметров в процессе ∆u1-2, ∆h1-2, ∆s1-2. Построить процесс в диаграммах p, v и T, s (в масштабе).
Данные к задачи указаны в таблице 1.1
Таблица 1.1
|
№ варианта |
Данные к задаче
| ||
|
газ |
р2, бар |
n | |
|
15 |
СО2 |
0.6 |
1.10 |
Дано:
"СИ"
газ СО
сжимается
политропно

Т1 = 300 К
р1 = 0.1 МПа =105 Па
р2
= 0.6 МПа
 .
.
n = 1.10
Найти:
v1, u1, h1, s1,
T2, v2, u2, h2, s2,
q1-2, l1-2, ∆u1-2,
∆h1-2, ∆s1-2.
Решение:
Для расчетов неизвестных параметров необходимо рассчитать газовую
постоянную. Газовая постоянная является индивидуальной для каждого газа,
то есть зависит от молекулярной массы газа и рассчитывается по формуле:
 (1.1)
(1.1)
где см – это кажущаяся молекулярная масса, она зависит от пропорции компонентов, из которых состоит смесь газа.
В данном случае имеется газ СО2, и для него газовая постоянная будет равна:

Так же понадобится для расчетов изобарная (ср) и изохорная (сv) теплоемкости. Так как данный газ СО2 – трехатомный, следовательно изобарная теплоемкость равна:

а изохорная теплоемкость равна:

Объем при нормальных условиях будет равен:

1.1.1 Определим недостающие начальные параметры
1.1.1.1 Определим начальный объем v1
Из уравнения Клапейрона: pv = RT, (1.1)
Для данного случая начальный объем будет равен:
 (1.2)
(1.2)
где R – газовая постоянная, кДж/кгК;
Т1 – начальная температура, К;
р1
– начальное давление, Па.
1.1.1.2 Определим начальную внутреннюю энергию u1
Величина внутренней энергии газа зависит как от скорости движения молекул и атомов, так и от расстояния между ними. Скорость движения микрочастиц вещества зависит от температуры тела, а силы взаимодействия между ними – от удельного объема. Поэтому внутреннюю энергию можно представить в виде:
 (1.3)
(1.3)
где сv– изохорная теплоемкость газа, кДж/кгК;

1.1.1.3 Определим энтальпию h1 в начале процесса
Энтальпия газа так же, как и внутренняя энергия, зависит только от температуры. Следовательно, энтальпия h1 в начале процесса рассчитывается по формуле:
 ,
(1.4)
,
(1.4)
где ср – изобарная теплоемкость газа, кДж/кгК;

1.1.1.4 Определим энтропию s1 в начале процесса
В уравнении первого закона термодинамики dq = du + pdv только du является полным дифференциалом внутренней энергии u. Введением множителя 1/Т можно привести это уравнение к уравнению в полных дифференциалах:
 (1.5)
(1.5)
где ds – полный дифференциал параметра s, то есть энтропии.
Для идеальных газов pv = RT, du = cvdT, поэтому
 .
(1.6)
.
(1.6)
После интегрирования (1.1.6) получаем расчетную формулу для определения энтропии:
 (1.7)
(1.7)
где v– начальный объем, м3/кг.
Согласно формуле (1.1.7) энтропию s1 в данном случае рассчитаем по формуле:
 (1.8)
(1.8)

1.1.2 Определим конечные параметры
1.1.2 Определим конечную температуру Т2
Температуру Т2 найдем из соотношения между параметрами политропного процесса:
 (1.9)
(1.9)
 (1.10)
(1.10)
где Т2 – конечная температура, К;
р2 – конечное давление, Па;
n – показатель политропы.

1.1.2.2 Определим конечный объем v2
Из формулы (1.1) для данного случая найдем конечный объем v2:
 (1.11)
(1.11)

1.1.2.3 Определим конечную внутреннюю энергию u2
Аналогично u1 найдем конечную внутреннюю энергию u2 по формуле:
 (1.12)
(1.12)

1.1.2.4 Определим энтальпию h2 в конце процесса
Аналогично h1найдем энтальпию h2в конце процесса по формуле:
 (1.13)
(1.13)

1.1.2.5 Определим энтропию s2 в конце процесса
Аналогично s1находим энтропию s2в конце процесса по формуле:
 (1.14)
(1.14)
где v2– конечный объем, м3/кг,
 .
.
1.1.3 Определим тепло, работу и изменение параметров внутренней энергии, энтальпии и энтропии
1.1.3.1 Определим тепло q1-2 в данном процессе
Количество тепла в политропном процессе рассчитывается по формуле:
 (1.15)
(1.15)

1.1.3.2 Определим работу l1-2 в данном процессе
Для политропного процесса работа рассчитывается по формуле:
 (1.16)
(1.16)

1.1.3.3 Определим изменение внутренней энергии ∆u1-2
Изменение внутренней энергии можно рассчитать по формулам:
 (1.17)
(1.17)
 (1.18)
(1.18)
∆u1-2 находим по формуле (1.1.18):

1.1.3.4 Определим изменение энтальпии ∆h1-2
Аналогично изменение внутренней энергии ∆u1-2 можно рассчитать изменение энтальпии ∆h1-2 по формулам:
 (1.19)
(1.19)
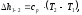 (1.20)
(1.20)
∆h1-2 находим по формуле (1.1.20):

1.1.3.5 Определим изменение энтропии ∆s1-2
Аналогично изменению внутренней энергии и изменению энтальпии можно рассчитать изменение энтропии ∆s1-2.:
 ,
(1.21)
,
(1.21)
или
 (1.22)
(1.22)
∆s1-2 находим по формуле (1.1.22):

Все ответы приведены в таблице 1.2
Таблица
1.2
Неизвестные
v1, u1,
u1, h1,
h1, s1,
s1,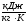 Т2,
Т2, v2,
v2, u2,
u2,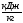 h2,
h2,
параметры
Полученный 0,567 200,1 257,1 0,027 353,07 0,11 235,47 302,58
результат

Неизвестные
s2, q1-2,
q1-2,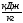 l1-2,
l1-2, ∆u1-2,
∆u1-2,
 ∆h1-2,
∆h1-2, ∆s1-2,
∆s1-2, параметры
параметры
Полученный
результат 3,496 -64,85 -100,249 35,397 45,48 -0,2
Построим процессы в диаграммах р,v и Т,s.
Найдем дополнительные точки:
|
S |
Т |
|
0.06 |
300 |
|
0.1 |
320 |
|
0.14 |
340 |
|
0.17 |
353 |
|
v |
р |
|
0,56 |
1 |
|
0,18 |
3 |
|
0,11 |
5 |
|
0,09 |
6 |
Вывод: политропный процесс носит обобщающий характер, так как здесь не накладывается какого – либо ограничения, например, постоянство одного из параметров в изохорном, изобарном и изотермном процессах, или отсутствия теплообмена в адиабатном процессе.


1.2 Задача 2
В процессе 1-2 с показателем политропы n к 1 кг газа с начальными параметрами р1 = 0,1МПа, Т1 = 300 К подводится тепло q. Определить недостающие начальные параметры v1, u1, h1, s1, конечные параметры р2, Т2, v2, u2, h2, s2, изменение параметров в процессе ∆u1-2, ∆h1-2, ∆s1-2 и работу l1-2. Построить процесс в p, v – и T, s – диаграммах.
Данные к задаче приведены в таблице 1.3
Таблица 1.3
|
№ варианта |
Данные к задаче
| ||
|
газ |
q, кДж/кг |
n | |
|
15 |
Воздух |
350 |
2,35 |
Дано:
"СИ"
газ СН4
процесс
политропный
Т1 = 300 К
р1
= 0.1 МПа
 .
.
q
= 350 кДж/кг

n = 2.35
Найти:
v1, u1, h1, s1, р2,
T2, v2, u2, h2, s2,
l1-2, ∆u1-2, ∆h1-2,
∆s1-2.
|
|
|
|
а |
б |
Рисунок 1- Процессы изменения состояния газа на диаграммах
Решение:
Для расчетов неизвестных параметров необходимо рассчитать газовую
постоянную. Газовая постоянная является индивидуальной для каждого газа,
то есть зависит от молекулярной массы газа и рассчитывается по формуле:

где см – это кажущаяся молекулярная масса, она зависит от пропорции компонентов, из которых состоит смесь газа. В данном случае имеется газ СН4, и для него газовая постоянная будет равна:
 .
.
Так же понадобится для расчетов изобарная (ср) и изохорная (сv) теплоемкости. Так как данный газ: воздух - многоатомный, следовательно изобарная теплоемкость равна:
 ,
,
а изохорная теплоемкость равна:
 .
.
Объем при нормальных условиях будет равен:

1.2.1 Определим недостающие начальные параметры
1.2.1.1 Определим начальный объем v1
Из уравнения Клапейрона:
pv = RT , (1.23)
можно найти объем, выразив его.
Для данного случая начальный объем будет равен:
 (1.24)
(1.24)
где R – газовая постоянная, кДж/кгК;
Т1 – начальная температура, К;
р1
– начальное давление, Па.
1.2.1.2 Определим начальную внутреннюю энергию u1
Величина внутренней энергии газа зависит как от скорости движения молекул и атомов, так и от расстояния между ними. Скорость движения микрочастиц вещества зависит от температуры тела, а силы взаимодействия между ними – от удельного объема. Поэтому внутреннюю энергию можно представить в виде:
 ,
(1.25)
,
(1.25)
где сv– изохорная теплоемкость газа, кДж/кгК;

1.2.1.3 Определим энтальпию h1 в начале процесс
Энтальпия газа так же, как и внутренняя энергия, зависит только от температуры. Следовательно, энтальпия h1 в начале процесса рассчитывается по формуле:
 ,
(1.26)
,
(1.26)
где ср – изобарная теплоемкость газа, кДж/кгК;

1.2.1.4 Определим энтропию s1 в начале процесса
В уравнении первого закона термодинамики dq = du + pdv только du является полным дифференциалом внутренней энергии u. Введением множителя 1/Т можно привести это уравнение к уравнению в полных дифференциалах:
 (1.27)
(1.27)
где ds – полный дифференциал параметра s, то есть энтропии.
Для идеальных газов pv = RT, du = cvdT, поэтому
 .
(1.28)
.
(1.28)
После интегрирования (1.27) получаем расчетную формулу для определения энтропии:
 (1.29)
(1.29)
где v – начальный объем, м3/кг.
Согласно формуле (1.27) энтропию s1 в данном случае рассчитаем по формуле:
 ,
(1.31)
,
(1.31)

1.2.2 Определим конечные параметры
1.2.2.1 Определим конечную температуру Т2
Так как известно количество тепла q и начальная температура Т1, можно найти конечную температуру Т2.
 ,
(1.32)
,
(1.32)
Из формулы (1.2.10) температура Т2 будет равна:
 ,
(1.33)
,
(1.33)
где q1-2 – подводимое тепло, кДж/кг;
n – показатель политропы.
 .
.
1.2.2.2 Определим конечное давление р2
Давление р2 в конце процесса найдем из соотношения параметров:
 (1.34)
(1.34)
 (1.35)
(1.35)
Отсюда давление р2 будет равно:
 (1.36)
(1.36)
где Т2 – конечная температура, К.

1.2.2.3 Определим конечный объем v2
Из формулы (1.2.1) для данного случая найдем конечный объем:
 ,
(1.37)
,
(1.37)
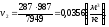
1.2.2.4 Определим конечную внутреннюю энергию u2
Аналогично u1 найдем конечную внутреннюю энергию u2 по формуле:
 (1.38)
(1.38)

1.2.2.5 Определим энтальпию h2 в конце процесса
Аналогично h1найдем энтальпию h2в конце процесса по формуле:
 (1.39)
(1.39)

1.2.2.6 Определим энтропию s2 в конце процесса
Аналогично s1находим энтропию s2в конце процесса по формуле:
 (1.40)
(1.40)
где v2– конечный объем, м3/кг.
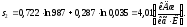
1.2.3 Определим работу и изменение параметров: внутренней энергии, энтальпии и энтропии
1.2.3.1 Определим изменение внутренней энергии ∆u1-2
Изменение внутренней энергии можно рассчитать по формуле:
 (1.41)
(1.41)

1.2.3.2 Определим изменение энтальпии ∆h1-2
Аналогично изменение внутренней энергии ∆u1-2, можно рассчитать изменение энтальпии ∆h1-2:
 (1.42)
(1.42)

1.2.3.3 Определим изменение энтропии ∆s1-2
Аналогично изменению внутренней энергии и изменению энтальпии можно рассчитать изменение энтропии ∆s1-2.
 (1.43)
(1.43)

1.2.3.4 Определим работу l1-2 в данном процессе
Для политропного процесса работа рассчитывается по формуле:
 (1.44)
(1.44)
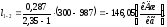
Все ответы приведены в таблице 1.4
Таблица 1.4
|
Неиз-вестные параметры |
v1, |
u1, |
h1, |
s1, |
р2,к
|
Т2, (K) |
v2, |
u2, |
|
Получен-ный результат
|
0,863 |
216,6 |
303,3 |
4,07 |
7,949 |
987 |
0,0356 |
712,61 |
|
Неизвес-тные параметры
|
h2, |
s2, |
∆u1-2
|
∆h1-2,
|
∆s1-2,
|
l1-2,
|
|
Получен- ный результат |
997,857 |
4,01 |
496,014 |
694,557 |
-0,055 |
-146,05 |
Построим процесс в диаграммах р,v и Т,s.
Найдем дополнительные точки:
|
v |
р |
|
0,863 |
0,1 |
|
0,5 |
2 |
|
0,2 |
4 |
|
0,0356 |
7,949 |
|
S |
Т |
|
4,7 |
300 |
|
4,5 |
400 |
|
4,3 |
600 |
|
4,1 |
987 |
Вывод: политропный процесс имеет обобщающее значение, т.к. здесь не накладывается какого-либо ограничения, например постоянства одного из параметров в изохорном, изобарном и изотермном процессах или отсутствия теплообмена в адиабатном процессе.


2 Газовые циклы
Рассмотрим цикл ДВС. Поршневыми двигателями внутреннего сгорания называют тепловые двигатели, основным элементом конструкции которых является цилиндр с поршнем. Сгорание топлива жидкого или газообразного происходит внутри цилиндра в среде сжатого воздуха. Образовавшиеся продукты сгорания расширяются и перемещают поршень, от которого выработанная механическая энергия передается на вал двигателя через кривошипно-шатунный механизм. Горение топлива, соответствующее процессу подвода тепла в цикле, в таких двигателях может осуществляться почти мгновенно в момент нахождения поршня в крайнем левом положении. двигатель с предварительным сжатием смеси воздуха с топливом и последующим его мгновенным сгоранием был впервые построен немецким изобретателем Отто в 1876 г. Двигатели Отто, как и все двигатели внутреннего сгорания, строятся двух- и четырехтактными. В первом случае все процессы двигателя — сжатие смеси, горение топлива, расширение продуктов сгорания и выхлоп отработанных газов— производятся за два рабочих хода поршня (один оборот вала). Во втором случае все процессы совершаются за четыре хода поршня (два оборота вала). Термодинамические циклы, по которым работают двух- и четырехтактные двигатели, являются совершенно одинаковыми, поскольку на них не сказываются взаимно компенсирующиеся процессы всасывания и выталкивания остаточных газов. Недостатком двигателей Отто является невозможность значительного повышения степени сжатия рабочей смеси (в процессе 1 2) из-за опасности ее самовоспламенения. По этой причине, эффективный КПД такого двигателя оказывается относительно низким (25—30%). Другой принцип сгорания топлива осуществляется в двигателях, конструкция которых была разработана Р.Дизелем в 1892—1898гг. В этих двигателях в цилиндр засасывается и затем сжимается только чистый воздух, что позволяет значительно поднять степень сжатия без всякой опасности самовоспламенения. Более того, здесь самовоспламенение используется для зажигания рабочей смеси при впрыске в сжатый горячий воздух распыленного топлива. Регулируя время впрыска, можно достигнуть желательной характеристики процесса горения. В первых двигателях Дизеля в цилиндр впрыскивалась смесь топлива с небольшим количеством воздуха, сжатым в специальном вспомогательном компрессоре. При этом подача топлива осуществлялась таким образом, чтобы давление в цилиндре в период горения сохранялось постоянным. Соответствующий этому идеальный цикл, называемый циклом Дизеля. Он отличается от цикла Отто прежде всего изобарным подводом тепла q1. Вторым, весьма важным отличием является более высокое давление в конце сжатия (до 40—45 бар вместо 10—15 бар в двигателях Отто). Остальные процессы цикла сохраняются теми же. Если в цилиндр двигателя Дизеля впрыскивать только механически распыленное топливо и этот впрыск начать еще до окончания процесса сжатия, то получающаяся при этом на диаграмме верхняя часть цикла оказывается чем-то средним между циклами Отто и Дизеля. Патент на изобретение такого «бескомпрессорного дизеля» был выдан в 1904 г. русскому инженеру Г. В. Тринклеру. Подвод тепла топлива осуществляется частично по изохоре и частично по изобаре. Двигатели Тринклера, так же как и двигатели Дизеля, успешно работают на тяжелых сортах жидкого топлива. Эти двигатели являются самыми экономичными, поскольку они дают возможность достигать таких же высоких степеней сжатия, как и в двигателях Дизеля, и, кроме того, получать добавочную работу за счет изохорного подвода тепла. Они широко применяются в качестве судовых двигателей, двигателей небольших энергетических установок, тракторных двигателей и т. п. Эффективный КПД «бескомпрессорных дизелей» оказывается самым высоким из всех двигателей внутреннего сгорания (ДВС)

Рисунок 2 - Термодинамический цикл «бескомпрессорного дизеля», называемый циклом со смешанным подводом тепла
Поэтому «компрессорные дизели» в настоящее время не выпускаются. Все же в транспортных установках (главным образом в легковых автомобилях) широко применяются бензиновые двигатели типа Отто, обладающие простотой конструкции и малым весом.
Рассмотрим цикл ГТУ. Газотурбинная установка ГТУ представляет собой тепловой двигатель, состоящий в простейшем случае из воздушного компрессора К, камеры сгорания КС и газовой турбины ГТ, приводящей обычно в движение электрический генератор. Принцип работы такой газотурбинной установки следующий: холодный воздух с параметрами р0, t0 сжимается в компрессоре и подается в камеру сгорания. В нее же подается соответствующее количество топлива. Образовавшиеся продукты сгорания заданной температуры направляются из камеры сгорания в газовую турбину. Адиабатически расширяясь в турбине, продукты сгорания понижают свою температуру и выбрасываются наружу. Выработанная в газовой турбине механическая энергия с помощью генератора превращается в электрическую. В зависимости от характера процесса горения топлива в камере сгорания все газотурбинные установки разделяют на два типа: с горением при постоянном давлении (постоянного горения) и с горением при постоянном объеме. В настоящее время созданы новые конструкции газовых турбин с охлаждаемыми рабочими лопатками, в которых температура газа может превышать допустимую температуру металла на несколько сот градусов. Такие ГТУ, имеющие начальную температуру газов до 1200°С, называют высокотемпературными.

Рисунок 3 - Простейшая схема газотурбинной установки
Положительными особенностями газотурбинных установок по сравнению с паротурбинными являются: незначительная потребность в охлаждающей воде, возможность применения более высоких температур рабочего тела по сравнению с паротурбинными установками, меньшие вес установки и расход металла, приходящиеся на единицу мощности, возможность очень быстрого пуска и форсирования нагрузки. Газотурбинные установки в настоящее время широко применяются в транспортной авиации, а также на перекачивающих станциях магистральных газопроводов. Газовые турбины оказываются также особенно выгодными в таких отраслях промышленности, где в ходе производства получаются горячие газы высокого давления. Утилизация энергии таких газов в газовой турбине является весьма экономичной. Газотурбинные установки являются относительно молодым типом двигателей, и направление их развития еще окончательно не определилось.
2.1 Рассчет цикла ДВС
Определить:
- параметры газа в переходных точках цикла ДВС (результаты расчёта свести в табл.);
- тепло, работу и изменение параметров ∆u, ∆h, ∆s, в каждом процессе;
- полезную работу, подведённое и отведенное тепло в цикле ДВС, его КПД (двумя способами);
- построить цикл в масштабе в диаграммах p,v и T,s.
Исходные данные к расчету цикла ДВС представлены в таблице 2.1
Таблица 2.1
|
№ вариана |
Способ подво-да тепла |
Раб. тело |
р1, Мпа |
Т1, К |
|
|
ρ |
|
15 |
P=const |
O2 |
0.1 |
300 |
16.0 |
- |
2,60 |