
- •Введение
- •1.2 Задача 2
- •2. Газовые циклы
- •2.1 Задача 1.Расчет цикла двс
- •2.1.1.4 Определим параметры газа в точке 4
- •2.1.3 Определим полезную работу l, подведенное и отведенное тепло q1, q2 в цикле и его кпд t (двумя способами)
- •2.2 Задача 2. Расчет цикла гту
- •2.2.1.3 Определим параметры газа в точке 3
- •2.2.1.4Определим параметры газа в точке 4
- •2.1.3 Определим полезную работу l, кпд t (двумя способами)
- •3. Циклы паросиловых установок
- •3.1 Задача 1
- •4. Циклы трансформаторного тепла
- •4.1 Задача 1
- •4.1.1 Расчет удельной холодопроизводительности в цикле
- •4.2 Задача 2
- •Библиографический список
Введение
В настоящее время во всех сферах человеческой деятельности используется тепло. Ученые давно изучили основные закономерности переноса и использования теплоты. Но как научиться правильно использовать тепло? Как получить новые и эффективные источники тепла? Именно эти вопросы помогает решить термодинамика. Термодинамика представляет собой науку о закономерностях превращения энергии. Основным содержанием технической термодинамики является изучение процессов взаимного преобразования тепловой и механической энергии.
При изучении термодинамики особое внимание следует уделить усвоению термодинамического метода исследования, который имеет следующие особенности. Во-первых, термодинамика строится по дедуктивному принципу, т. е. от общего к частному. Её основной особенностью являются два закона (начала), установленных опытным путём. Первый из них представляет специфическую форму закона сохранения и превращения энергии и имеет, поэтому всеобщий характер, второй – устанавливает качественную направленность процессов, осуществляемых в физических системах. С помощью математического аппарата термодинамики получают соотношения, позволяющие решать конкретные задачи (например, рассчитывать термодинамические процессы). Во-вторых, термодинамика имеет дело только с макроскопическими величинами. Процессы здесь рассматриваются как непрерывная последовательность состояний равновесия.
Термодинамика рассматривает равновесные процессы и равновесные состояния, так как только равновесные состояния могут быть описаны количественно с помощью уравнений состояния. Лишь равновесные процессы изменения состояния термодинамической системы можно изображать графически.
Цель выполнения работы – закрепление и углубление полученных знаний, ознакомление с необходимой справочной литературой, государственными и отраслевыми стандартами, получение навыков самостоятельного решения инженерных задач и технически грамотного изложения пояснительной записки.
Расчеты в курсовой работе иллюстрированы графиками и рисунками, рассмотрены газовые процессы, циклы, паросиловые установки, а также циклы трансформаторного тепла.
1. Газовые процессы
-
Задача 1
Газ с начальной температурой Т1 = 300 К и давлением р1 = 0.1 МПа
политропно сжимается в компрессоре до давления р2. Определить недостающие начальные параметры v1, u1, h1, s1, конечные параметры T2, v2, u2, h2, s2, тепло
q1-2, работу l1-2, изменение параметров в процессе ∆u1-2, ∆h1-2, ∆s1-2. Построить процесс в диаграммах p, v и T, s (в масштабе).
Данные к задачи указаны в таблице 1.1
Таблица 1.1
|
№ варианта |
Данные к задаче
|
||
|
газ |
р2, Па |
n |
|
|
25 |
SО2 |
0.4 |
1.35 |
Д
 ано:
"СИ"
ано:
"СИ"
газ SО2
сжимается политропно
Т1 = 300 К
р1 = 0.1 МПа =105 Па
р2
= 0.4 МПа
![]() .
.
n = 1.35

Найти:
v1, u1, h1, s1,
T2, v2, u2, h2, s2,
q1-2, l1-2, ∆u1-2,
∆h1-2, ∆s1-2.
Решение:
Для расчетов неизвестных параметров необходимо рассчитать газовую
постоянную. Газовая постоянная является индивидуальной для каждого газа,
то есть зависит от молекулярной массы газа и рассчитывается по формуле:
![]() (1.1)
(1.1)
где см – это кажущаяся молекулярная масса, она зависит от пропорции компонентов, из которых состоит смесь газа.
В данном случае имеется газ SО2, и для него газовая постоянная будет равна:
![]()
Так же понадобится для расчетов изобарная (ср) и изохорная (сv) теплоемкости. Так как данный газ SО2 – многоатомный, следовательно изобарная теплоемкость равна:
![]()
а изохорная теплоемкость равна:
![]()
Объем при нормальных условиях будет равен:
![]()
1.1.1 Определим недостающие начальные параметры
1.1.1.1 Определим начальный объем v1
Из уравнения Клапейрона: pv = RT, (1.1)
Для данного случая начальный объем будет равен:
![]() (1.2)
(1.2)
где R – газовая постоянная, кДж/кгК;
Т1 – начальная температура, К;
р![]() 1
– начальное давление, Па.
1
– начальное давление, Па.
1.1.1.2 Определим начальную внутреннюю энергию u1
Величина внутренней энергии газа зависит как от скорости движения молекул и атомов, так и от расстояния между ними. Скорость движения микрочастиц вещества зависит от температуры тела, а силы взаимодействия между ними – от удельного объема. Поэтому внутреннюю энергию можно представить в виде:
![]() (1.3)
(1.3)
где сv – изохорная теплоемкость газа, кДж/кгК;
![]()
1.1.1.3 Определим энтальпию h1 в начале процесса
Энтальпия газа так же, как и внутренняя энергия, зависит только от температуры. Следовательно, энтальпия h1 в начале процесса рассчитывается по формуле:
![]() ,
(1.4)
,
(1.4)
где ср – изобарная теплоемкость газа, кДж/кгК;
![]()
1.1.1.4 Определим энтропию s1 в начале процесса
В уравнении первого закона термодинамики dq = du + pdv только du является полным дифференциалом внутренней энергии u. Введением множителя 1/Т можно привести это уравнение к уравнению в полных дифференциалах:
![]() (1.5)
(1.5)
где ds – полный дифференциал параметра s, то есть энтропии.
Для идеальных газов pv = RT, du = cvdT, поэтому
![]() .
(1.6)
.
(1.6)
После интегрирования (1.1.6) получаем расчетную формулу для определения энтропии:
![]() (1.7)
(1.7)
где v– начальный объем, м3/кг.
Согласно формуле (1.7) энтропию s1 в данном случае рассчитаем по формуле:
![]() (1.8)
(1.8)
![]()
1.1.2 Определим конечные параметры
1.1.2.1 Определим конечную температуру Т2
Температуру Т2 найдем из соотношения между параметрами политропного процесса:
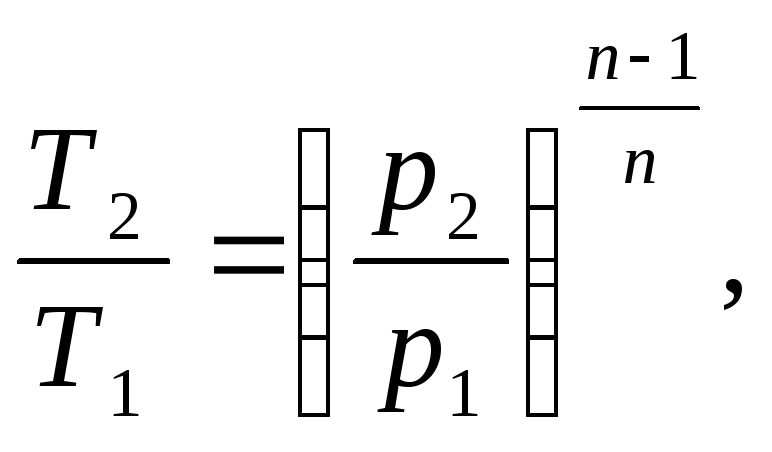 (1.9)
(1.9)
 (1.10)
(1.10)
где Т2 – конечная температура, К;
р2 – конечное давление, Па;
n – показатель политропы.
![]()
1.1.2.2 Определим конечный объем v2
Из формулы (1.1) для данного случая найдем конечный объем v2:
![]() (1.11)
(1.11)
![]()
1.1.2.3 Определим конечную внутреннюю энергию u2
Аналогично u1 найдем конечную внутреннюю энергию u2 по формуле:
![]() (1.12)
(1.12)
![]()
1.1.2.4 Определим энтальпию h2 в конце процесса
Аналогично h1 найдем энтальпию h2 в конце процесса по формуле:
![]() (1.13)
(1.13)
![]()
1.1.2.5 Определим энтропию s2 в конце процесса
Аналогично s1 находим энтропию s2 в конце процесса по формуле:
![]() (1.14)
(1.14)
где v2 – конечный объем, м3/кг,
![]() .
.
1.1.3 Определим тепло, работу и изменение параметров внутренней энергии, энтальпии и энтропии
1.1.3.1 Определим тепло q1-2 в данном процессе
Количество тепла в политропном процессе рассчитывается по формуле:
![]() (1.15)
(1.15)
![]()
1.1.3.2 Определим работу l1-2 в данном процессе
Для политропного процесса работа рассчитывается по формуле:
![]() (1.16)
(1.16)

1.1.3.3 Определим изменение внутренней энергии ∆u1-2
Изменение внутренней энергии можно рассчитать по формулам:
![]() (1.17)
(1.17)
![]() (1.18)
(1.18)
∆u1-2 находим по формуле (1.18):
![]()
1.1.3.4 Определим изменение энтальпии ∆h1-2
Аналогично изменение внутренней энергии ∆u1-2 можно рассчитать изменение энтальпии ∆h1-2 по формулам:
![]() (1.19)
(1.19)
![]() (1.20)
(1.20)
∆h1-2 находим по формуле (1.20):
![]()
1.1.3.5 Определим изменение энтропии ∆s1-2
Аналогично изменению внутренней энергии и изменению энтальпии можно рассчитать изменение энтропии ∆s1-2.:
![]() ,
(1.21)
,
(1.21)
или
![]() (1.22)
(1.22)
∆s1-2 находим по формуле (1.22):
![]()
Все ответы приведены в таблице 1.2
|
Неизвестные параметры |
v1, |
u1, |
h1, |
s1, |
Т2,K |
v2, |
u2, |
h2, |
|
Полученный результат |
0.389 |
137.4 |
176.7 |
0.0586 |
429.74 |
0.139 |
196.82 |
253.12 |
Таблица 1.2
Продолжение таблицы 1.2
|
Неизвестные параметры |
s2, |
q1-2, |
l1-2, |
∆u1-2,
|
∆h1-2, |
∆s1-2, |
|
Полученный результат |
0.0878 |
11.26 |
-48.15 |
59.42 |
76.41 |
0.031 |
Построим процессы в диаграммах р,v и Т,s.
Найдем дополнительные точки:
|
Давление (p)×106,Па |
Удельный объем(v),м3/кг |
Температура (T),K |
Энтропия (s),КДж/кг·К |
|
0.1 |
0.389 |
300 |
0.056 |
|
0.115 |
0.35 |
310.741 |
0.0593 |
|
0.142 |
0.3 |
327.96 |
0.0639 |
|
0.245 |
0.2 |
377.97 |
0.0763 |
|
0.362 |
0.15 |
418.014 |
0.08506 |
|
0.4 |
0.139 |
429.74 |
0.0878 |
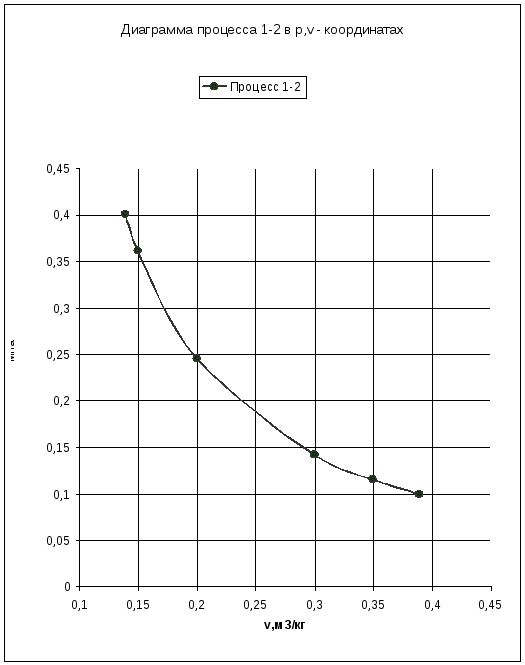
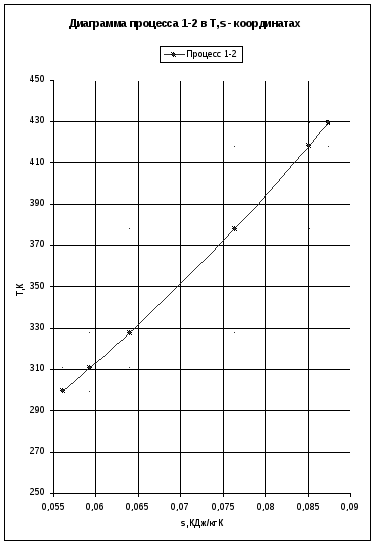
Вывод: политропный процесс носит обобщающий характер, так как здесь не накладывается какого – либо ограничения, например, постоянство одного из параметров в изохорном, изобарном и изотермном процессах, или отсутствия теплообмена в адиабатном процессе.
