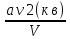- •1.Основные положения молекулярно-кинетической теории.Макроскоп.Системы
- •2. Функция состояния.Температура.Внутр.Энергия
- •3. Идеальный газ.Газовые законы.З-ны Дальтона и Авогадро
- •4.Ур-е состояния идеального г. Постоянные Больцмана и Лошмидта
- •6.Положение Максвела о распередел.Молекул идельнг газа по энергиям
- •7.Вероятная скорость движ.Молекул.Зависимость распределения Максвела от т
- •12.З-н Больцмана о равномерном распеределении энергии по степеням свободы.Внутр э г.
- •13.Первое начало термодинамики.Работа и теплота
- •18.А в цикле Карно.Теплический кпд
- •19.Энтропия.Изменение энтропии в изопроцесах
- •21.Статистическое толкование энтропии. 3ее начало термодинамики
- •24.Уравнение состояния реального газа.Изотермы Ван-дер-Ваальса
18.А в цикле Карно.Теплический кпд
1) Работа в цикле Карно Аполн=Q1-Q2
2)
Термический КПД для цикла Карно η=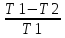
19.Энтропия.Изменение энтропии в изопроцесах
1) Энтропия- мера вероятности осуществления какого-либо макроскопического состояния.
2)
ds=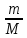 Cv
Cv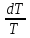 Изохорный процесс, ds=
Изохорный процесс, ds=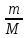 Cp
Cp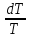 Изобарный процесс, ds=R
Изобарный процесс, ds=R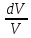
20. 2ое начало термодинамики. Т. Карно.Произвольный обратимый цикл
1) Второе начало термодинамики
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему»
Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара».
2) Первая теорема Карно. КПД обратимого цикла Карно, осуществляемого между двумя источниками теплоты, не зависит от свойств рабочего вещества, с помощью которого этот цикл осуществляется.
Вторая теорема Карно. КПД необратимого цикла Карно всегда меньше обратимого цикла Карно, осуществляемого между одними и теми же источниками теплоты, имеющими постоянные, но разные температуры.
Третья теорема Карно. Обратимый цикл Карно имеет наибольший КПД по сравнению с любыми обратимыми или необратимыми циклами, в которых наибольшая и наименьшая температуры равны соответственно температуре горячего источника и температуре холодного источника цикла Карно.
21.Статистическое толкование энтропии. 3ее начало термодинамики
1) Третье начало термодинамики- Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система.
2) Силы межмолекулярного взаимодействия отталкивания и притяжения- такие силы, взаимодействия которых не приводят к образованию хим.связей, силы краткодействующие.
24.Уравнение состояния реального газа.Изотермы Ван-дер-Ваальса
1)Математическая запись универсального газового закона проста: pV = nRT
p, V и T — соответственно давление, объем и абсолютная температура газа (в градусах Кельвина), R — универсальная газовая постоянная, общая для всех газов, а n — число, пропорциональное числу молекул или атомов газа.
2)
внутренняя энергия моля реального газа
![]() U’=U-
U’=U-