
- •1.Основные положения молекулярно-кинетической теории.Макроскоп.Системы
- •2. Функция состояния.Температура.Внутр.Энергия
- •3. Идеальный газ.Газовые законы.З-ны Дальтона и Авогадро
- •4.Ур-е состояния идеального г. Постоянные Больцмана и Лошмидта
- •6.Положение Максвела о распередел.Молекул идельнг газа по энергиям
- •7.Вероятная скорость движ.Молекул.Зависимость распределения Максвела от т
- •12.З-н Больцмана о равномерном распеределении энергии по степеням свободы.Внутр э г.
- •13.Первое начало термодинамики.Работа и теплота
- •18.А в цикле Карно.Теплический кпд
- •19.Энтропия.Изменение энтропии в изопроцесах
- •21.Статистическое толкование энтропии. 3ее начало термодинамики
- •24.Уравнение состояния реального газа.Изотермы Ван-дер-Ваальса
4.Ур-е состояния идеального г. Постоянные Больцмана и Лошмидта
1) Уравнение состояния идеального газа- формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. pV=(m/M)RT
2) Универсальная газовая постоянная R0 ≈ 8,314 кДж/(кмоль·K) — фундаментальна физическая константа.
3) Постоя́нная Бо́льцмана - физическая постоянная, определяющая связь между температурой и энергией. Её экспериментальное значение в Международной системе единиц (СИ) равно: k=1,3806488(13) x 10-23 Дж/К
4)
Постоянная Лошмидта (число Лошмидта) —
число специфированных структурных
единиц в 1 м³ вещества в состоянии
идеального газа при нормальных условиях
и температуре 0 °C.
![]()
6.Положение Максвела о распередел.Молекул идельнг газа по энергиям
1) Применяя методы теории вероятностей, Максвелл получил функцию f(ν) — закон о распределеня молекул идеального газа по скоростям:
![]()
![]()
функция распределения молекул по энергиям теплового движения
2) Закон Максвелла описывается некоторой функцией f(ν), которая называется функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, которые равны dν, то на каждый интервал скорости приходится число молекул dN(ν), имеющих скорость, которая заключена в этом интервале. Функция f(ν) задает относительное число молекул dN(ν)/N, скорости которых находятся в интервале от ν до ν+dν, т. е.
7.Вероятная скорость движ.Молекул.Зависимость распределения Максвела от т
1) Наиболее вероятная скорость молекул — это скорость, вблизи которой на единичный интервал скоростей приходится наибольшее число молекул
Up=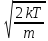 =
=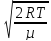
3)
Скорости,
характеризующие состояние газа: 1)
средняя![]() 2) средняя квадратичная
2) средняя квадратичная![]()
8.З-н Максвела о распредел.молекул идеальнг.газа по энергиям.Определение средней Эк
1) Закон Максвелла о распределении молекул идеального газа по скоростям - газ состоит из большого числа N одинаковых молекул, его температура постоянна, а молекулы совершают тепловое хаотическое движение. При этом на газ не действуют силовые поля.
функция распределения f Максвелла по скоростям имеет вид:
f(v) =n(m/2pkT)3/2exp(-mv2/2kT),
Где m — масса молекулы, Т — абсолютная температура системы, k — постоянная Больцмана.
2)
кинетическая
энергия идеального газа Ē=
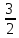 kT
kT
9.Положения з-н Больцмана о распределении частиц газа по высоте
1) Положения Больцмана о распределении частиц газа по высоте:
1. Поле тяготения Земли однородно
2. Т газа =const
3. масса всех молекул одинакова
4. Ускорение свободного падения одинаково g=const
g=
G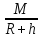 ,
где h- маленькие высоты
,
где h- маленькие высоты
10.
1)
Средняя длина свободного пробега
молекул-путь, проходимый молекулой
между двумя последовательными
столкновениями l(ср)=
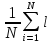 i
i
2)Среднее
число столкновений молекул в 1с ƶ(ср)=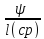
11.Явление переноса.Теплопроводность.Диффузия и внутреннее трение
1) Явления переноса- необратимые процессы, в результате к-рых в физ. системе происходит пространств. перенос электрич. заряда, массы, импульса, энергии, энтропии или к.-л. другой физ. величины.
2) Теплопроводность. Если в одной области газа средняя кинетическая энергия молекул больше, чем в другой, то с течением времени вследствие постоянных столкновений молекул происходит процесс выравнивания средних кинетических энергий молекул, т. е., иными словами, выравнивание температур.
Перенос энергии в форме теплоты подчиняется закону Фурье:
![]()
где
jE — плотность теплового потока,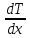 — градиент температуры, равный скорости
изменения температуры на единицу длины
х в направлении нормали к этой
площадке.Знак минус показывает, что при
теплопроводности энергия переносится
в направлении убывания температуры
(поэтому знаки jE и – противоположны).
— градиент температуры, равный скорости
изменения температуры на единицу длины
х в направлении нормали к этой
площадке.Знак минус показывает, что при
теплопроводности энергия переносится
в направлении убывания температуры
(поэтому знаки jE и – противоположны).
коэффициент![]()
где сV — удельная теплоемкость газа при постоянном объеме , r — плотность газа, <v> — средняя скорость теплового движения молекул, <l> — средняя длина свободного пробега.
3) Диффузия- происходит самопроизвольное проникновение и перемешивание частиц двух соприкасающихся газов, жидкостей и даже твердых тел; диффузия сводится к обмену масс частиц этих тел, возникает и продолжается, пока существует градиент плотности.
Явление диффузии для химически однородного газа подчиняется закону Фука:
![]() где
jm — плотность потока массы —, D — диффузия
(коэффициент диффузии),
где
jm — плотность потока массы —, D — диффузия
(коэффициент диффузии),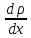 - градиент плотности, равный скорости
изменения плотности на единицу длины
х в направлении нормали к этой площадке.
Знак минус показывает, что перенос массы
происходит в направлении убывания
плотности (поэтому знаки jm и dr/dx
противоположны). Коэффициент
- градиент плотности, равный скорости
изменения плотности на единицу длины
х в направлении нормали к этой площадке.
Знак минус показывает, что перенос массы
происходит в направлении убывания
плотности (поэтому знаки jm и dr/dx
противоположны). Коэффициент![]()
4) Внутреннее трение (вязкость) - из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате чего импульс слоя, движущегося быстрее, уменьшается, движущегося медленнее — увеличивается, что приводит к торможению слоя, движущегося быстрее, и ускорению слоя, движущегося медленнее.
Взаимодействие
двух слоев согласно второму закону
Ньютона можно рассматривать как процесс,
при котором от одного слоя к другому в
единицу времени передается импульс, по
модулю равный действующей силе.
![]()
где
jp — плотность потока импульса,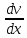 - градиент скорости. Знак минус указывает,
что импульс переносится в направлении
убывания скорости (поэтому знаки jр и
- градиент скорости. Знак минус указывает,
что импульс переносится в направлении
убывания скорости (поэтому знаки jр и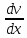 противоположны).
противоположны).
Коэффициент![]()
