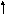- •Химическая связь
- •Методические указания к практическим занятиям по курсу общей химии
- •Для студентов нехимических специальностей дневных, вечерних и заочных факультетов
- •Нижний Новгород 2012
- •Физические основы образования молекул
- •Ch4 : nh3 h2o::
- •Структурные пространственные схемы для различного типа гибридизаций
- •Параметры молекулярных орбиталей и порядок связи для двухатомных молекул II периода
- •Влияние степени окисления и радиуса иона на силу кислот и оснований
- •Зависимость характера соединения от степени окисления элемента
- •Вопросы.
- •Т е с т ы задание 1.
- •Задание 2.
- •Задание 3
- •Задание 4
- •Задание 5.
- •Задание 6
- •Задание 7
- •Задание 8
- •Задание 9
- •Задание 10.
- •Задание 11
- •Задание 12
- •Задание 13
- •Задание 14
- •Задание 15
- •Варианты контрольных заданий задание 1
- •Задание 2
- •Задание 3
- •Задание 4
- •Задание 5
- •Заданиe 6
- •1.Написать электронную формулу кислорода. По электронной формуле определить место его в периодической системе (группу, подгруппу, период) и квантовые числа для валентных орбиталей.
- •Задание 7
- •Задание 8
- •Задание 9
- •Задание 10
- •Задание 11
- •Задание 12
- •Задание 13
- •Задание 14
- •Задание 15
- •Задание 16
- •Задание 17
- •Задание 18
- •Задание 19
- •Задание 20
- •Задание 21
- •Задание 22
- •Задание 23
- •Задание 24
- •Задание 25
- •Приложение
- •Эффективные заряды атомов () в молекулах
Параметры молекулярных орбиталей и порядок связи для двухатомных молекул II периода
|
ВОДОРОДНАЯ СВЯЗЬ.Само понятие и термин «водородная связь» ввели В.Латимер и Р.Родебуш в 1920 г., для того, чтобы объяснить высокие температуры кипения воды, спиртов, жидкого HF и некоторых других соединений. Сопоставляя температуры кипения родственных соединений Н2O, Н2S, Н2Se, и Н2Te, они обратили внимание на то, что первый член этого ряда – вода – кипит намного выше, чем это следовало из той закономерности, которую образовали остальные члены ряда. Из этой закономерности следовало, что вода должна кипеть на 170° С ниже, чем наблюдаемая температура кипения. Точно такое же отклонение наблюдается для аммиака в ряду родственных соединений: NН3, Н3P, Н3As, Н3Sb. Истинная температура кипения аммиака равна –33 °С, что на 80 °С выше ожидаемого значения.
При кипении жидкости разрушаются только Ван-дер-Ваальсовы силы взаимодействия, которые удерживают молекулы в жидкой фазе. Если температуры кипения неожиданно высокие, то это говорит о том, что молекулы чаще всего дополнительно связаны водородными связями.
Водородная связь – зто связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы или между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом той же молекулы (внутримолекулярная водородная связь).
Водородная связь возникает между электроотрицательными элементами (F, O, N, С, S, Cl) и атомом водорода и появляется и проявляется в виде межмолекулярных или внутримолекулярных взаимодействий. В образовании Н-связи определяющую роль играет электроотрицательность участвующих в связи атомов – способность оттягивать на себя электроны химической связи от атома – партнера, участвующего в этой связи. В результате на атоме А с повышенной электроотрицательностью, возникает частичный отрицательный заряд δ-, а на атоме Н – положительный δ+.
Изображенная на схеме структура уксусной кислоты объясняет, почему молекулярный вес уксусной кислоты в паровой фазе достигает 120 (два молекулярных веса уксусной кислоты).

По своей природе водородная связь имеет смешанный электростатический и донорно - акцепторный характер. Электростатическая природа водородной связи, например, в воде, заключается в том, что атом водорода несет избыточный положительный заряд, а атом кислорода - избыточный отрицательный заряд. Электростатическое притяжение между избыточными зарядами атома водорода одной молекулы и атома кислорода другой способствует сближению молекул воды. Одновременно перекрывание электронных облаков одной неподеленной электронной пары кислорода и орбитали водорода другой молекулы воды способствует образованию ковалентной связи. В результате электронная плотность с атома кислорода одной молекулы частично перемещается на атом водорода O-H связи другой. В этом и заключается донорно-акцепторный характер водородной связи.
Водородная связь может возникнуть между двумя разными молекулами, например, между молекулами воды и спирта:
Н – О С2Н5


Н ∙ ∙ ∙ ∙ ∙ ∙ О - Н
В сложных органических молекулах существуют, как межмолекулярные водородные связи, так и внутримолекулярные водородные связи:
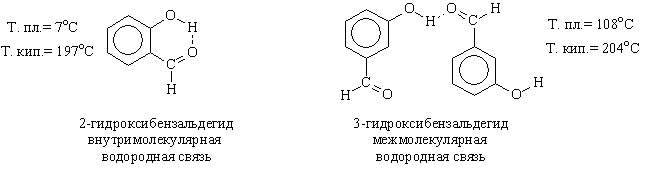
Внутримолекулярная водородная связь Межмолекулярная водородная связь
Молекулы с внутримолекулярными водородными связями не могут вступать в межмолекулярные водородные связи. Поэтому вещества с такими связями не образуют ассоциатов, более летучи, имеют более низкие вязкости и температуры плавления и кипения, чем соединения, способные образовывать межмолекулярные водородные связи.
Водородные связи являются причиной уникального свойства воды – плотность кристаллического льда меньше плотности воды. В структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода – из других молекул воды. В результате образуется очень рыхлая «ажурная» структура. Вот почему лед такой легкий. При плавлении льда (Т = 0 оС) примерно 9 % водородных связей разрушается, и молекулы воды сближаются, заполняя пустоты. По этой причине, плотность жидкой воды при температурах выше 0оС больше, чем плотность льда. С ростом температуры, число льдоподобных структур становится все меньше и при Т = 25, 60 и 100оС их число соответственно равно 11, 16 и 20 %.