- •Химическая связь
- •Методические указания к практическим занятиям по курсу общей химии
- •Для студентов нехимических специальностей дневных, вечерних и заочных факультетов
- •Нижний Новгород 2012
- •Физические основы образования молекул
- •Ch4 : nh3 h2o::
- •Структурные пространственные схемы для различного типа гибридизаций
- •Параметры молекулярных орбиталей и порядок связи для двухатомных молекул II периода
- •Влияние степени окисления и радиуса иона на силу кислот и оснований
- •Зависимость характера соединения от степени окисления элемента
- •Вопросы.
- •Т е с т ы задание 1.
- •Задание 2.
- •Задание 3
- •Задание 4
- •Задание 5.
- •Задание 6
- •Задание 7
- •Задание 8
- •Задание 9
- •Задание 10.
- •Задание 11
- •Задание 12
- •Задание 13
- •Задание 14
- •Задание 15
- •Варианты контрольных заданий задание 1
- •Задание 2
- •Задание 3
- •Задание 4
- •Задание 5
- •Заданиe 6
- •1.Написать электронную формулу кислорода. По электронной формуле определить место его в периодической системе (группу, подгруппу, период) и квантовые числа для валентных орбиталей.
- •Задание 7
- •Задание 8
- •Задание 9
- •Задание 10
- •Задание 11
- •Задание 12
- •Задание 13
- •Задание 14
- •Задание 15
- •Задание 16
- •Задание 17
- •Задание 18
- •Задание 19
- •Задание 20
- •Задание 21
- •Задание 22
- •Задание 23
- •Задание 24
- •Задание 25
- •Приложение
- •Эффективные заряды атомов () в молекулах
Ch4 : nh3 h2o::
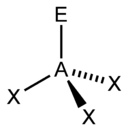
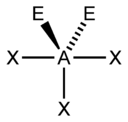
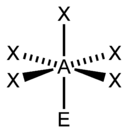
Рис. 5. Несвязывающие электронные пары и углы связи в NH3, H2O и CH4
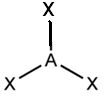
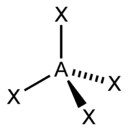
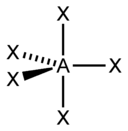
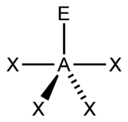
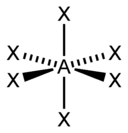
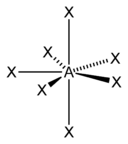
Для трехатомной молекулы AX2, не имеющей неподеленные электронные пары, возможно единственное строение – линейное; четырехатомная молекула AX3будет плоской в форме равностороннего треугольника; пятиатомная AX4– тетраэдрической; шестиатомная AX5будет иметь форму тригональной бипирамиды, а семиатомная AX6– форму октаэдра.
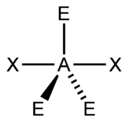
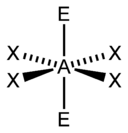
Иное дело – наличие в молекуле неподеленных электронных пар. В этом случае геометрия молекулы существенно меняется. Молекула AX2E будет уже не линейной, а угловой, AX3E будет иметь форму треугольной пирамиды, а AX2E2вновь будет угловой, причем угол будет существенно меньше тетраэдрического (например, H2O). В молекуле AX4E возможная структура – треугольнопирамидальная. Молекула AX5E имеет структуру квадратной пирамиды, а молекула AX4E2– октаэдра (см. табл.1).
Таблица 1
Структурные пространственные схемы для различного типа гибридизаций
|
Базовая структура без несвязывающих электронных пар |
1 электронная пара |
2 электронные пары |
3 электронные пары | |
|
sp |
линейная BeCl2, |
|
|
|
|
sp2 |
Тригональная плоская AX3 BF3, CO32−, NO3−, SO3 |
NO2 −, SO2 , AX2E1 |
|
|
|
sp3 |
тетраэдрическая AX4 CH4, PO43−, SO42−, |
NH3, PCl3 AX3E1 |
H2O, OF2 AX2E2 |
|
|
sp3d1 |
Тригональная бипирамида PCl5, AX5 |
AX4E1, SF4
|
AX3E2, ClF3, BrF3
|
AX2E3, XeF2 |
|
sp3d2 |
AX6 Октаэдрическая, SF6 |
ClF5, BrF5 AX5E1 |
XeF4; AX4E2 |
|
|
sp3d3 |
Пентагональная бипирамида, IF7, AX7 |
XeOF5−, TeCl62−, BiCl63−, AX6E1 |
|
|
Таким образом, согласно метода Гиллеспи пространственное расположение атомов вокруг центрального атома в молекуле и вид гибридизации определяется числом и расположением всех валентных связывающих и несвязывающих электронных пар, окружающих атом.
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ.Полное название метода – метод молекулярных орбиталей (МО) как линейная комбинация атомных орбиталей (ЛКАО). Метод МО рассматривает молекулу как единую систему, как единый коллектив взаимодействующих атомов с их ядрами и электронами, которые и образуют молекулярные орбитали (МО).
Процесс образования МО из атомных орбиталей (АО) является самопроизвольным и приводит к уменьшению общей энергии системы.
Основу метода МО составляют следующие положения: 1). Каждый электрон в молекуле находится на определенном энергетическом уровне, характеризующемся соответствующими квантовыми числами; 2) Энергетическому уровню отвечает МО или волновая функция, которая является полиядерной; 3) Общее число образующихся МО равно числу взаимодействующих АО, т.е. из nвзаимодействующих атомных орбиталей образуетсяn молекулярных орбиталей.
Молекулярная волновая функция имеет тот же физический смысл, что и атомная, т.е. 2определяет плотность вероятности пребывания электронов в данной точке пространства. Заполнение электронами энергетических уровней в молекуле, также происходит по принципу минимума энергии и принципу Паули, согласно которому на одной молекулярной орбитали не может находиться более двух электронов.
Если волновую функцию изолированного атома А обозначить через а, а волновую функцию изолированного атома В -в, то, согласно методу ЛКАО, волновая функция молекулы представляет линейную комбинацию атомных волновых функций:
ав= С1а± С2в, ( )
где Сi– коэффициенты, учитывающие долю участия атомных орбиталей атомов А и В в образовании МО.
Сложение ав = С1а + С2возначает, что оба электрона проводят большую часть времени между двумя ядрами, где реализуется наибольшая электронная плотность, что и способствует связыванию атомов. Такую МО называют связывающей и обозначают(s), (р)и т.д. Заселение связывающей МО электронами приводит к понижению энергии молекулы и повышению ее устойчивости.
При вычитании функций ав = С1а – С2вэлектронная плотность направлена в разные стороны от атомов, концентрируется за ядрами, а между ядрами она мала и практически равна нулю. Такое расположение электронной плотности растягивает межатомную связь, делая ее непрочной. Такую орбиталь называют разрыхляющей, и обозначают(*s), (*р) и т.д.
Заселение разрыхляющих орбиталей электронами приводит к повышению энергии молекулы и понижению ее устойчивости в целом.
В молекуле водорода взаимодействие возможно только по оси молекулы, то каждая из MO±может быть обозначена как σсв= 1s1+ 1s2и σ* = 1s1– 1s2и названа соответственно связывающей (σсв) и разрыхляющей (σ*) молекулярными орбиталями (рис. 6).
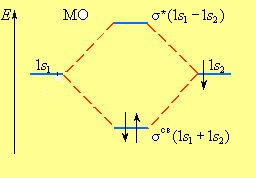
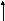
Рис. 6. Энергетическая диаграмма атомных и молекулярных уровней водорода
Таким образом, переход двух электронов на МО σсвспособствует понижению энергии системы; этот энергетический выигрыш равен энергии связи между атомами в молекуле водорода H – H.
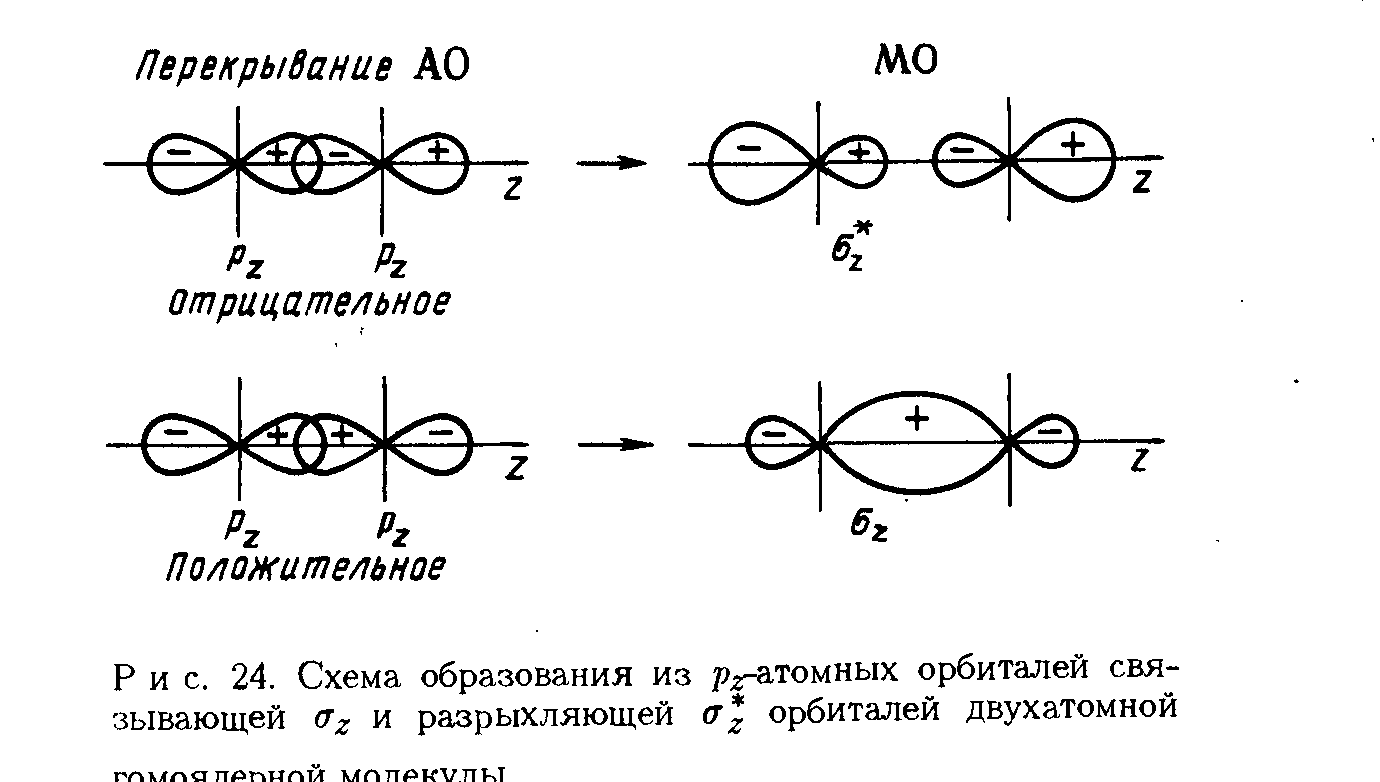
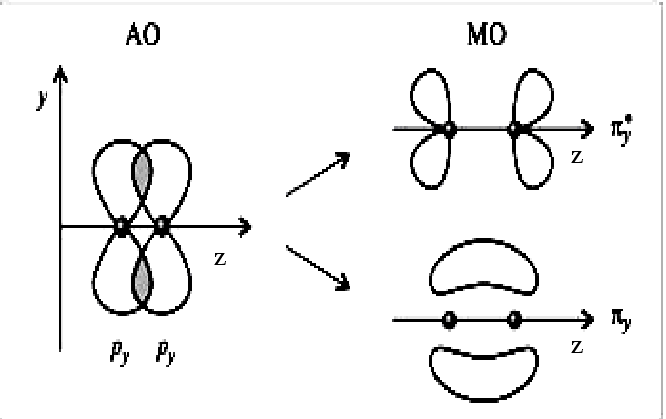
На рис.7 А и Б показано перекрывание рz - АО, т.е.р - орбиталей, вытянутых вдоль осиz, которой мы назовем линию, соединяющую ядра атомов иpy-АО. При этом образуются связывающая и разрыхляющая МО.
А) Б)
Рис. 7. Схема образования σz - связывающих и σ*z - разрыхляющих орбиталей (А) и πу-связывающих и πу*-разрыхляющих орбиталей (Б), образованных из р-атомных орбиталей
В методе МО ЛКАО атомные орбитали должны удовлетворять ряду определенных условий для возникновения МО:
1) взаимодействующие атомные орбитали должны обеспечить максимальное перекрывание электронных облаков;
2) перекрывающиеся АО должны иметь соизмеримо близкие энергии. Если АО сильно отличаются по энергиям, то и волновые функции будут сильно отличаться по частотам (Е=hν) и не будут давать интерференционного эффекта - складывания волн. В этом случае связывания взаимодействующих АО в МО не происходит.
Поэтому более прочные ковалентные связи наблюдаются при перекрывании - s-s- иp-p-орбиталей, близких по энергиям, а перекрываниеs-иp-орбиталей, не приводит к образованию связей, если разница в энергиях между ними велика, либо приводит к образованию менее прочных связей, когда энергии этих орбиталей соизмеримы;
3) АО должны обладать одинаковыми свойствами симметрии относительно оси вращения вокруг линии связи в молекуле. Орбиталь является симметричной, если при повороте ее на 180овокруг линии связи между атомами знак волновой функции не меняется и, наоборот, антисимметричной, если знак функции меняется на противоположный. Симметричные и антисимметричные атомные орбитали не могут образовывать МО
Порядок связи. В методе МО понятие валентности как таковой теряется, поскольку даже спаренные электроны различных уровней заселяют те или иные МО. Вместо понятия валентности или кратности связи в методе МО вводится новое понятие – порядок связи.
Порядок связи определяется как разность числа электронов, находящихся на связывающих орбиталях и числа электронов на разрыхляющих орбиталях, деленная на два. В методе МО порядок связи играет такую же роль, что и валентность в методе ВС:
ПС = (∑(е)связ- ∑(е)раз)/2. ( )
Если ПС = О, то система неустойчива и связь не возникает, так как для образования соединения всегда необходимо, чтобы заселенность связывающих МО была выше, чем заселенность разрыхляющих. Образование системы энергетически выгодно и она устойчива, если ПС > О. Чем выше порядок связи, тем, при прочих равных условиях, прочнее данная молекула.
Если порядок связи равен единице, то связь следует считать одинарной, двум – двойной, однако параметр может иметь и промежуточные значения. Например, для иона Н2+ ПС = 0,5.
Система: электрон - вакантная орбиталь (1 : 0).В данной системе на связывающей МО располагается всего лишь один электрон. Порядок связи в этом случае дробный. Проиллюстрируем это на примере образования Н2+ - иона, который обнаружен экспериментально. Образование Н2+ из атома водорода Н, в котором имеется одинs– электрон, и иона Н+, не содержащего электронов и имеющего свободную атомную орбиталь:H[1s] + □H+=H2+[σs, 1s]. Порядок образующейся ковалентной связи при этом равен ПС = (1 – 0)/2 = 0,5.
Н АО H2+МО Н+АО
s*









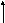 s
s

Система: электронная пара - электрон (2 : 1)
Порядок ковалентной связи в этом случае также равен ПС = (2-1)/2 = 0,5. Данная схема применима, например, к молекулярному иону Не2+.
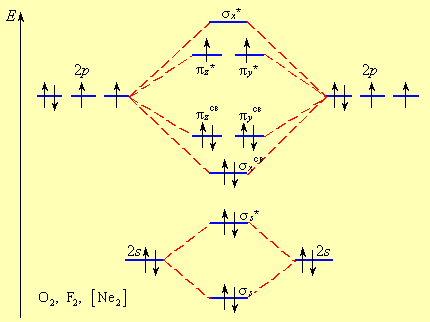
МОЛЕКУЛЯРНЫЕ ОРБИТАЛИ ДВУХАТОМНЫХ МОЛЕКУЛ II ПЕРИОДА. Распределение электронов по молекулярным орбиталям в двухатомных молекулах второго периода отO2доNe2осуществляется в следующем порядке:
1s < *1s < 2s < *2s < 2рх < 2py = 2pz < *2py = *2pz < *2рх
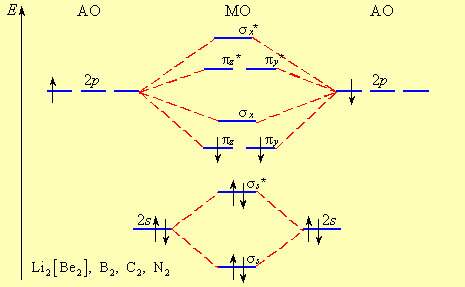
Bряду более легких элементов отLi2 доN2последовательность заселения МО другая:
1s < *1s < 2s < *2s < 2py = 2pz < 2рх < *2py = *2pz < *2рх
На рис. 8 А и Б представлены две схемы заполнения МО на примере молекул второго периода. Из рисунков следует, что порядок заполнения МО в первом и втором случаях отличаются, что связано с тем, что для легких элементов начала IIпериода 2s - и 2р - орбитали близки по энергии (< 6 эВ) и при формировании МО могут «смешиваться» и - орбитали. Для элементовO2-Ne22s - и 2р – орбитали имеют в 3 – 5 раз большую разность в энергиях. Например, для кислорода и фтора разность в энергиях составляет ∆Е = 14,9 (O2) и 20,4 эВ (F2) соответственно и эффекта «смешивания» в этом случае не наблюдается.
А) Б)
Рис. 8. Пример заселения МО электронами для B2 (начало II периода) (А) и для О2 (Б)
Из рис.8Б видно, что порядок связи в молекуле кислорода равен двум, так как на шесть связывающих электронов, приходится два неспаренных электрона на разрыхляющих орбиталях: ПС = (6 – 2)/ 2 = 2.
ГЕТЕРОАТОМНЫЕ МОЛЕКУЛЯРНЫЕ ОРБИТАЛИ. Подобным жеобразом рассматривается с точки зрения метода МО образование молекул, состоящих из различных атомов. Однако в отличие от гомоядерных эти молекулы образованы атомами с неодинаковыми зарядами ядер атомов.
В случае гетероядерных молекул связывающие молекулярные орбитали находятся ближе к орбиталям более электроотрицательного атома (рис. 9). Это означает, что электрон большую часть времени проводит у более электроотрицательного атома, а сама молекула представляет собой диполь.Общую схему образования гетероядерных МО для молекул типа АВ покажем на примере молекулы гидрида лития.. Здесь Δи– мера ионности, которая равна разности ∆ЭО взаимодействующих атомов; Δс– мера ковалентности. Электроотрицательность атома водорода равна 2,1, а атома лития – равна единице. Это полярная молекула и электронная плотность смещена к атому водорода.
Е АОLi
МО LiH
АО Н
АОLi
МО LiH
АО Н



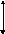
Рис. 9. Схема образования гетероядерных
Ψа Δс МО для молекул типа АВ




ΔиΨ в



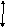
 Δс
Δс
Таблица 2