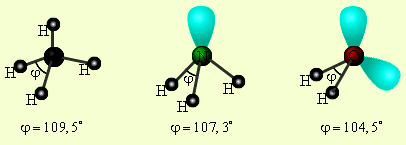- •Химическая связь
- •Методические указания к практическим занятиям по курсу общей химии
- •Для студентов нехимических специальностей дневных, вечерних и заочных факультетов
- •Нижний Новгород 2012
- •Физические основы образования молекул
- •Ch4 : nh3 h2o::
- •Структурные пространственные схемы для различного типа гибридизаций
- •Параметры молекулярных орбиталей и порядок связи для двухатомных молекул II периода
- •Влияние степени окисления и радиуса иона на силу кислот и оснований
- •Зависимость характера соединения от степени окисления элемента
- •Вопросы.
- •Т е с т ы задание 1.
- •Задание 2.
- •Задание 3
- •Задание 4
- •Задание 5.
- •Задание 6
- •Задание 7
- •Задание 8
- •Задание 9
- •Задание 10.
- •Задание 11
- •Задание 12
- •Задание 13
- •Задание 14
- •Задание 15
- •Варианты контрольных заданий задание 1
- •Задание 2
- •Задание 3
- •Задание 4
- •Задание 5
- •Заданиe 6
- •1.Написать электронную формулу кислорода. По электронной формуле определить место его в периодической системе (группу, подгруппу, период) и квантовые числа для валентных орбиталей.
- •Задание 7
- •Задание 8
- •Задание 9
- •Задание 10
- •Задание 11
- •Задание 12
- •Задание 13
- •Задание 14
- •Задание 15
- •Задание 16
- •Задание 17
- •Задание 18
- •Задание 19
- •Задание 20
- •Задание 21
- •Задание 22
- •Задание 23
- •Задание 24
- •Задание 25
- •Приложение
- •Эффективные заряды атомов () в молекулах
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ
УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
“НИЖЕГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ”
им. Р.Е. АЛЕКСЕЕВА
Кафедра "Общая и неорганическая химия"
Химическая связь
Методические указания к практическим занятиям по курсу общей химии
Для студентов нехимических специальностей дневных, вечерних и заочных факультетов
Нижний Новгород 2012
.
УДК 54 (07)
Составители:
Химическая связь: Метод.указания к практическим занятиям по курсу общей химиидля студентов нехимических специальностей дневных, вечерних и заочных факультетов/ НГТУ; Сост. Наумов В.И., Четырбок Л.Н., Паничева Г.А.,; Н.Новгород, 2012 с.
Предложены теоретическая часть, задачи, вопросы и задания для текущего контроля знаний студентов.
Научный редактор Г.А. Паничева
Редактор Э.Б. Абросимова
Подп. к печ. . Формат 60х84 1/16. Бумага газетная. Печать офсетная.
Печ. .л. Уч.-изд. л. Тираж 500 экз. Заказ
.
Нижегородский государственный технический университет.
Типография НГТУ. 603950, Н.Новгород, ул. Минина, 24.
© Нижегородский государственный технический университет, 2012
Физические основы образования молекул
Физическая устойчивость любой молекулы А-В основана на том, что объединение атомов А и В в молекулу сопровождается понижением энергии системы: ЕмолЕа + Ев.
Энергия молекулы может быть представлена суммой электронной, колебательной и вращательной энергий атомов, составляющих молекулу:
Е мол=Еэл+Екол+Евр. (1)
При этом ЕэлЕколЕвр. Основной вклад в энергию связи в молекуле вносит электронная энергия, т.е. энергия взаимодействия электронов с ядрами, электронов и ядер между собой.
Устойчивому состоянию молекулы отвечает минимальное значение энергии и определенное относительное расположение ядер в пространстве, называемое равновесной конфигурацией молекулы. Равновесная конфигурация молекулы характеризуется равновесными расстоянием (rравн) между атомами (длина связи) и энергией связи (Есв) (рис.1).
При образовании молекулы Н2, по мере сближения атомов водорода потенциальная энергия системы понижается, поскольку электроны одновременно притягиваются к двум ядрам. При очень малых межъядерных расстояниях (r<rравн) потенциальная энергия вновь начинает повышаться вследствие возрастания отталкивания между ядрами.
Е
 ,
кДж
,
кДж




 r,
нм
r,
нм
Расстояние Н - Н
 Есв
rравн
Есв
rравн
Рис. 1. Образование молекулы Н2 в результате перекрывания атомных орбиталей водорода
Устойчивость двухатомной молекулы АВ к распаду на атомы характеризуется величиной энергии диссоциации молекулы, или прочностью связи А-В. Связь считается прочной, если ее энергия превышает 400 кДж/моль и слабой – если ее энергия меньше 100 кДж/моль. Если при взаимодействии атомов выделяется энергия менее 15 кДж/моль, то считают, что химическая связь не образуется. Прочность связи обычно уменьшается с увеличением ее длины. Одинарная связь всегда слабее, чем кратные связи – двойная и тройная – между теми же атомами.
Всего известно четыре основных вида химической связи: ионная, ковалентная, металлическая и водородная.
Ионная связьформируется за счет электростатических сил,существующих между частицами с зарядами противоположного знака, которые образуются за счет переноса одного или нескольких электронов от одного атома к другому.
Так, например, для ионного кристалла NaCl, образование ионов Na+u Cl-из нейтральных атомов показывает, что атом натрия теряет электрон, а атом хлора его присоединяет. В результате этого образуются Na+(2s22p6– оболочка Ne) иCl-(3s23p6– оболочкаAr). Эти ионы формируют внутри кристалла правильную трехмерную структуру.
Ионы в кристалле находятся в равновесных положениях, поэтому силы кулоновского притяжения компенсируются силами отталкивания. Отталкивание обусловлено электроста-тическим отталкиванием электронных оболочек и ядер.
Взаимодействие между катионами и анионами в ионном кристалле не зависит от направления, и каждый катион может притягивать любое число анионов, и наоборот. По этой причине ионная связь в кристалле является ненаправленной и ненасыщенной, а число взаимодействий между ионами в твердом состоянии ограничивается лишь размерами кристалла. Поэтому «молекулой» ионного соединения следует считать весь кристалл.
Идеальной ионной связи не существует. Даже в соединениях, которые обычно относят к ионным, не наблюдается полного перехода электронов от одного атома к другому. Электроны всегда частично остаются в общем пользовании. Так, например, связь во фториде лития на 80% ионная, а на 20% – ковалентная. По этой причине, правильнее говорить о степени ионностихимической связи.
Доминирующая роль ионной связи проявляется в том случае, если взаимодействующие атомы сильно отличаются энергиями ионизации, электроотрицательностями и сродством к электрону.
Количественной оценкой полярности(«ионности») связи могут служить эффективные заряды атомов. Атом более электроотрицательного элемента притягивает к себе электроны сильнее. Поэтому электроны оказываются ближе к нему, и он получает некоторый отрицательный заряд (-δ), который называют эффективным, а у его партнера появляется такой же положительный заряд (+δ). Так заряд натрия вNaClравенδ= +0,75; в хлориде, оксиде и сульфиде магния заряд магния равенδ= +1, заряд алюминия в нитриде алюминия (AlN) равенδ= + 1,25.
Из выше изложенного следует, что для поваренной соли изображение молекулы с эффективными зарядами будет иметь вид: Na+δС1-δ (Na+0,75С1-0,75).
Известно выражение для зависимости между разностью электроотрицательностей ∆ЭО и степенью ионности связи ∆u:
∆u = 1 - ∆с = 1 – ехр [-0,25 ∙ (∆ЭО)2] (.2 )
Считается, что связь ионная если разность электроотрицательностей ∆ЭО ≥ 2,0 (по шкале Полинга). Если 0 < ∆ЭО < 2,0, то связь ковалентная, полярная; при ∆ЭО = 0 – связь ковалентная, неполярная.
Например, в оксидах натрия ∆ЭО = 2,51 и лития ∆ЭО = 2,4 связь ионная, а в бромиде магния MgBr2(∆ЭО = 2,96 – 1,31 = 1,65) связь полярная ковалентная.
Разделение связи на ионную и полярную ковалентную в какой-то мере условно. Любая полярная молекула является аналогом электрического диполя и характеризуется дипольным моментом:

1 = q L, (3)
г деq = nе
– заряд;n – целое
или дробное число;L– расстояние
между центрами зарядов;
– вектор, направленный от ( +) к ( - ).
деq = nе
– заряд;n – целое
или дробное число;L– расстояние
между центрами зарядов;
– вектор, направленный от ( +) к ( - ).
Единицей измерения дипольных моментов служит Дебай (Д), равный 3,33.10 -30Кл.м.
Дипольный момент сложной молекулы определяется как векторная сумма дипольных моментов всех ее связей. В том случае, если молекула АВnсимметрична относительно линии каждой связи, суммарный дипольный момент такой молекулы, несмотря на полярность отдельеых связей А–В, равен нулю(СН4, SiCl4, SF6, ВеCl2, SO3 и др.)(рис.2):
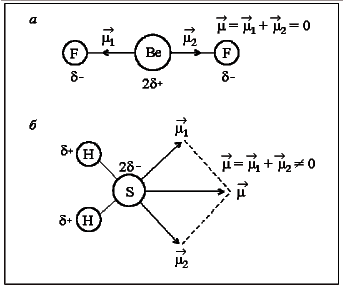 Рис.
2. Дипольные моменты неполярной молекулы
ВеF2
(а)
и полярной - Н2S
(б)
Рис.
2. Дипольные моменты неполярной молекулы
ВеF2
(а)
и полярной - Н2S
(б)
КОВАЛЕНТНАЯ СВЯЗЬ. Большинство химических соединений не обладает характерными признаками ионных соединений. Для этих веществ Льюис создал модель образования ковалентной связи между атомами. Он предположил, что взаимодействующие атомы могут не передавать друг другу электроны, а обобществлять их, создавая, таким образом, электронную конфигурацию благородного газа.
Основные положения метода валентных связей
- Ковалентная химическая связьобразуется двумя электронами с противоположно направленными спинами, принадлежащими двум атомам.
- Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
- Характеристики химической связи определяются типом (s, p, d) атомных орбиталей (АО).
- Ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов.
Обобществление электронной пары осуществляется либо по обменному механизму, когда каждый из взаимодействующих атомов поставляет по одному электрону для связи, либо подонорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
1. Обменный механизм Н. +.С1:::= Н :С1:::
2
 .
Донорно-акцепторный механизм А
+:В = А:В Здесь - свободная
орбиталь атома А.
.
Донорно-акцепторный механизм А
+:В = А:В Здесь - свободная
орбиталь атома А.
При обменном механизме электронная пара, образующая связь, может образоваться как за счет неспаренных электронов, имеющихся в невозбужденноматоме, таки за счет распаренных электронов, образующихся при возбуждении атома. Например, в невозбужденном состоянии атомуглеродаимеет два неспаренных электрона, однако для него характерны соединения, в которых он образует четыре ковалентные связи. Это оказывается возможным в результатевозбуждения атома. При этом один изs - электронов переходит наp - подуровень:
![]()
Увеличение числа создаваемых ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на возбуждение атома. Так как валентностьатома зависит от числа неспаренных электронов, возбуждение атома приводит к повышению его валентности.
Элементы 3-го периода пятой, шестой и седьмой групп (фосфор,сераихлор) могут проявлять валентность, равную номеругруппы. Это достигается возбуждением атомов с переходом 3s- и 3p-электронов на вакантные орбитали 3d-подуровня. На примере атома хлора легко показать, что валентность может быть переменной:
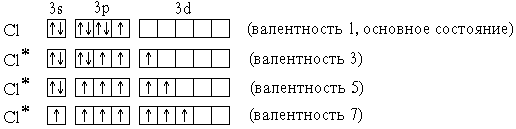
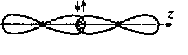
Ковалентная связь может быть полярной и неполярной. Неполярная связь образуется, когда молекула составлена из атомов одинаковой природы с равными ЭО, например, Н2, F2, С12и О2. (так называемая гомополярная связь). В этом случае, общая пара электронов располагается симметрично относительно взаимодействующих атомов. Рассмотрим это на примере образования молекулы фтора.
F
 ns2
np5
F
F
ns2
np5
F
F
F







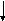
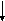
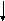
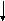
Д ОНОРНО
– АКЦЕПТОРНЫЙ МЕХАНИЗМ СВЯЗИ.Ковалентные
связимогут образовываться и за счет
спаренных электронов, имеющихся на
внешнем электронном слое одного из
атомов. В этом случае второй атом должен
иметь на внешнем слое свободную орбиталь.
Например, образованиеиона
аммонияиз молекулыаммиакаи иона водорода можно отобразить
представленной схемой.Изображение
электронов крестиками и точками на
схеме весьма условно, так как в
действительности электроны неразличимы.
При образовании положительно
заряженного катиона аммония, входящий
в состав молекулы аммиака азот поставляет
пару электронов и является донором, а
ион Н+, имеющий свободную АО и
принимающий электроны, является
акцептором. Донорно-акцепторная связь
по своим свойствам ничем не отличается
от обычной ковалентной связи, образованной
по обменному механизму.
ОНОРНО
– АКЦЕПТОРНЫЙ МЕХАНИЗМ СВЯЗИ.Ковалентные
связимогут образовываться и за счет
спаренных электронов, имеющихся на
внешнем электронном слое одного из
атомов. В этом случае второй атом должен
иметь на внешнем слое свободную орбиталь.
Например, образованиеиона
аммонияиз молекулыаммиакаи иона водорода можно отобразить
представленной схемой.Изображение
электронов крестиками и точками на
схеме весьма условно, так как в
действительности электроны неразличимы.
При образовании положительно
заряженного катиона аммония, входящий
в состав молекулы аммиака азот поставляет
пару электронов и является донором, а
ион Н+, имеющий свободную АО и
принимающий электроны, является
акцептором. Донорно-акцепторная связь
по своим свойствам ничем не отличается
от обычной ковалентной связи, образованной
по обменному механизму.
Таким образом, число возможных связей у атомов зависит не только от количества неспаренных электронов у атомов, но и от числа вакантных орбиталей одного атома и количества неподеленных электронных пар у другого атома соответственно.
Обобществление одной пары электронов является частным случаем ковалентной связи. Во многих молекулах атомы приобретают полный октет электронов, обобществляя больше одной пары электронов, например: Н2С = СН2; НС≡СН; N≡N; О = С = О.
Число связей, образующихся между атомами, называется кратностью,илипорядком связи.
Для примера рассмотрим образование типы и кратность связей в молекуле СО.




 С
С



:



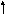
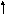



 С
≡ О:
С
≡ О:
О
2s 2p
Электронная структура валентных электронов атома углерода в нормальном состоянии 2s22p2. Невозбужденный атом углерода имеет два неспаренныхp- электрона, которые могут образовать две общие электронные пары (2 связи) с двумя неспаренными электронами атома кислорода (электронная конфигурация 2s22p4 ) по обменному механизму. Однако имеющиеся в атоме кислорода два спаренныхр- электрона могут образовать и третью химическую связь, поскольку в атоме углерода имеется одна незаполненнаяр- орбиталь, которая может принять эту пару. Таким образом, дополнительно образуется третья связь по донорно-акцепторному механизму: Кратность связи в молекуле СО равна трем.
НАСЫЩАЕМОСТЬ И НАПРАВЛЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ. Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определенного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентныхорбиталейв атоме, т.е. тех, которые могут быть использованы для образования химических связей, определяет максимально возможную ковалентность элемента в данном соединении.
Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Это достигается при такой пространственной направленности перекрывания атомных орбиталей, которая совпадает с линией, соединяющей взаимодействующие атомы (см., например, рис.2Б).
Исключение составляют s - электронные АО, сферическая форма которых делает все направления равноценными.
Таким образом, образование ковалентной связи является результатом перекрывания валентных атомных орбиталей АО, которые характеризуются определенными ориентациями в пространстве, и поэтому ковалентная связь имеет строго определенную направленность.
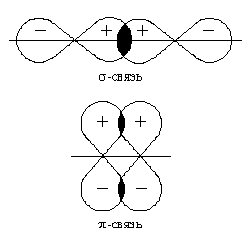
Направление ковалентных связей характеризуется валентными углами – углами между линиями, соединяющими связываемые атомы в молекуле. Совокупность длин связей и валентных углов определяет пространственное равновесное строение молекулы, в которой имеет место равенство сил притяжения и отталкивания и которое обеспечивает минимальное значение ее энергии. Между двумя атомами в химическом соединении возможна только одна σ - связь. Совокупность направленных, строго ориентированных в пространстве σ - связей создает пространственную структуру молекулы вещества.
|
|
После образования между двумя атомами σ-связи для остальных электронных облаков той же формы и с тем же главным квантовым числом остается только возможность бокового перекрывания по обе стороны от линии связи. В результате образуется π - связь. Она менее прочна, чем σ-связь: перекрывание происходит диффузионными боковыми частями орбиталей. Каждая кратная связь (например, двойная или тройная) всегда содержит только одну σ-связь.
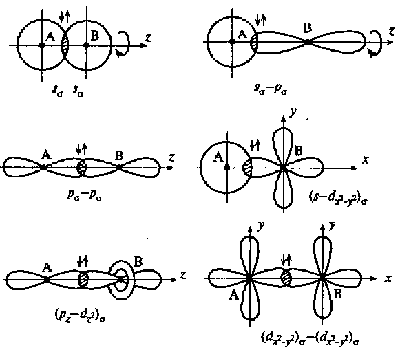
Рис. 3. Схемы образования σ-связей с участием электронных АО различных типов

Рис. 4. Схемы образования π-связей с участием электронных АО различных типов
Таким образом, химическая связь характеризуется энергией, длиной, направленностью, кратностью, насыщаемостью и полярностью. Для молекул, состоящей более чем из двух атомов, существенными являются величины углов между связями и полярность молекулы в целом.
Валентность – это способность атома к образованию химических связей. Согласно обменному механизму, валентность элементов определяется числом содержащихся в атоме одноэлектронных атомных орбиталей. Для s-,p- элементов – это электроны внешнего уровня, дляd- элементов – внешнего (s) и предвнешнего (d) подуровня.
ГИБРИДИЗАЦИЯ И ПРОСТРАНСТВЕННАЯ КОНФИГУРАЦИЯ МОЛЕКУЛ. В нормальном состоянии атом углерода имеет следующую электронную структуру:







 С
С
2s 2p
Казалось бы, что за счет имеющихся двух неспаренных электронов углерод может образовать две ковалентные связи (одну σ- и одну π-связь). Между тем для углерода более характерны соединения, в которых каждый его атом связан с соседними четырьмя ковалентными связями (СО2, СН4, С2Н6и т.д.). Это оказывается возможным благодаря тому, что при затрате небольшого количества энергии один из имеющихся спаренныхs-электронов можно перевести на подуровень 2р, в результате чего атом переходит в возбужденное состояние. В этом случае число одноэлектронных атомных орбиталей возрастает до 4-х и наблюдается вырождение (выравнивание энергий) самих АО
















 С
С*
С
С*
2s 2p
Теперь во внешнем электронном слое углерода находятся четыре одноэлектронных атомных орбитали, которые могут участвовать в образовании четырех ковалентных связей. Процесс смешивания и вырождения АО называется гибридизацией, для него характерно образование «равноценных» или вырожденных орбиталей, которые имеют отличную от s - ир -орбиталей форму и усредненную энергию.
В целом процесс гибридизации включает следующие этапы: возбуждение атома,гибридизация орбиталейвозбужденного атома и образование связей с другими атомами. Затраты энергии на первые два этапа компенсируются выигрышем энергии при образовании более прочных связей с гибридными орбиталями.
Таким образом, гибридизация – это изменение энергии и формы атомных орбиталей одного или нескольких энергетических уровней, обеспечивающих достижение более эффективного перекрывания орбиталей. В результате, обеспечивается максимальная перекрываемость АО, минимум энергии молекулы и достигается большая прочность связей между атомами.
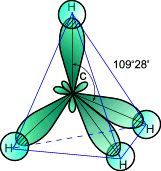
sp3-Гибридизация. В случае углерода и образования четырех σ-связей имеем так называемуюsp3-гибридизацию (1 -sи 3 -р электрона).
Одна s-орбиталь и триp-орбитали превращаются в четыре одинаковые «гибридные»sp3-орбитали, угол между осями которых равен 109°28':
|
|
|
| |
|---|---|---|---|
|
|
| ||
|
|
|
Молекулы, в которых осуществляется sp3-гибридизация, имеют тетраэдрическую геометрию (CH4, CС14, С2Н6).
sp2 -Гибридизация.Данный вид гибридизации характерен для атомовIIIА группы, например, В и А1 (ns2 nр1). Триsp2-орбитали могут образовывать три σ-связи (BF3, AlCl3). Примером молекулы, в которой осуществляется этот вид гибридизации, может служить молекула фторида бора ВF3:






 В
В
2s 2p






 В*
В*
Схема возникновения гибридных орбиталей в этом случае выглядит следующим образом. Однаs-орбиталь и две p-орбитали превращаются в три одинаковые «гибридные» орбитали, угол между осями которых равен 120°: Молекулы, в которых осуществляетсяsp2-гибридизация, имеют плоскую геометрию. Ниже приведены модели и геометрия молекул ВН3и ВС13:


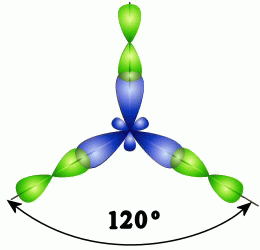
ВН3 ВС13
sp-Гибридизация.sр -гибридизация характерна дляIIА группы периодической системы элементов Ве, Мg, Ca, Ba, Zn, Cd и Hg.





 Ве
Ве
2s 2p
Поэтому для участия в образовании химических связей по обменному механизму атом Ве должен перейти в возбужденное состояние:





 Ве*
Ве*
В этом случае возбужденный атом Ве имеет два неспаренных электрона и может образовывать две связи с другими атомами.
Одна s-орбиталь и однаp-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°. Двеsp-орбитали могут образовывать две-связи (BeH2, ZnCl2). Молекула гидрида бериллия выглядит следующим образом:
|
|
|
|
H Ве H
Молекулы, в которых осуществляется sp-гибридизация, имеют линейную геометрию. Такой же вид гибридизации и такую конфигурацию имеют молекулыMgС12, CaС12 и SrС12.
Следует иметь в виду, что гибридизация осуществляется только по σ - связям, а π - связи участия в гибридизации не принимают. Например, в этилене тип гибридизации для углероданеsp3, аsp2.
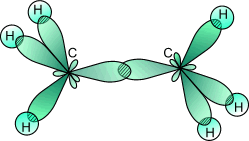
Во всех ацетиленовых углеводородах, имеющих в молекуле одну тройную связь: C2H2, C4H6, C6H10и других органических соединениях со связями -С ≡ С- наблюдаетсяsp-гибридизация..
В ацетилене две гибридные орбитали атомов углерода образуют две σ-связи с соседним атомом углерода и атомом водорода, а две негибридные, сформированные за счет перекрывания pz -иpу - орбиталей углерода образуют две π-связи. Между С и Н всегда формируется σ - связь.
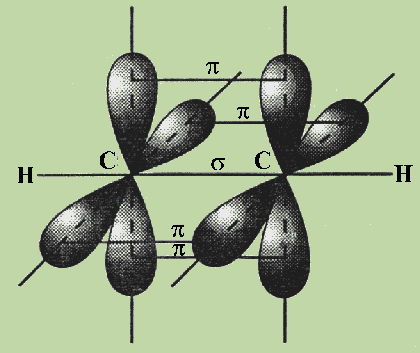
Рис. 5. Схема перекрывания АО в молекуле ацетилена
В некоторых случаях в гибридизации участвуют не образующие связь валентные электронные пары центрального атома, так называемые несвязывающие электронные пары. Пространственную конфигурацию молекулы или иона и тип гибридизации определяет суммарное число связывающих и несвязывающих электронных пар.
Для объяснения строения молекул, их геометрической формы и типа гибридизации, используется теория так называемых локализованных электронных пар (метод Гиллеспи).
ТЕОРИЯ ЛОКАЛИЗОВАННЫХ ЭЛЕКТРОННЫХ ПАР (МЕТОД ГИЛЛЕСПИ).В основе метода Гиллеспи лежит модель отталкивания локализованных электронных пар. Предполагается, что каждая пара электронов, окружающая атом, обозначаемая в формулах двумя точками, образуют электронные облака, которые вследствие отталкивания располагаются на друг от друга как можно дальше..
Реальная геометрия молекулы определяется не только числом σ – связей, но и количеством неподеленных электронных пар (Е). Тогда молекула метана соответствует формуле CH4, аммиака – NH3E, воды – H2OE2 и при этом будет наблюдаться одинаковая гибридизация (рис.5). У азота наsp3-гибридных орбиталях, помимо трех связывающих пар электронов, образующих связь с тремя атомами водорода, остается одна несвязывающая (неподеленная) электронная пара. Именно она, занимая четвертуюsp3- гибридную орбиталь, искажает угол связи H–N–H до 107,3° (в метане, например, где неподеленных электронных пар нет, угол равен 109,5о). В молекуле H2O таких несвязывающих неподеленных пар две, и угол H–O–H равен не 90о(если бы не было гибридизации), а 104,5о (рис. 5).