
- •2 Модуль. Гомогенді және гетерогенді реакцияларға химиялық кинетика теорияларының негіздері. Катализ
- •7 Лекция. Активті соқтығысулар теориясы
- •8 Лекция. Активті комплекс теориясы
- •9 Лекция. Гетерогенді процестердің кинетикасы
- •10 Лекция. Тізбекті реакциялардың кинетикасы
- •11 Лекция. Фотохимиялық және түйіндес реакциялардың кинетикасы
- •12 Лекция. Гомогенді каталитикалық реакциялардың кинетикасы
- •13 Лекция Гетерогенді каталитикалық реакциялардың кинетикасы
- •14 Лекция. Гетерогенді катализдің теориялары
2 Модуль. Гомогенді және гетерогенді реакцияларға химиялық кинетика теорияларының негіздері. Катализ
7 Лекция. Активті соқтығысулар теориясы
Активті соқтығысулар теориясы көзқарастарынан:
экспонента алдындағы көбейткіштің физикалық мағынасын түсіндіруге болады;
реакцияласатын жүйенің потенциалды энергия бетін есептеуге болады;
реакцияның жылу эффектісін есептеуге болады;
реакция реттілігінің физикалық мағынасын түсіндіруге болады;
Боденштейннің квазистационарлы концентрациялар әдісін қорытуға болады.
Активті соқтығысулар теориясы бойынша соқтығысатын бөлшектер:
дөңгелек шарлар түрінде қарастырылады;
екі атомды молекулалар түрінде қарастырылады;
сызықты молекулалар түрінде қарастырылады;
нүктелер түрінде қарастырылады;
құрамы әр түрлі молекулалар болып алынады.
Соқтығысатын екі біртекті бөлшектерден тұратын жүйенің келтірілген массасы келесі теңдеу бойынша анықталады:
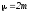 ;
; ;
;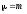 ;
;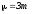 ;
;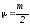 .
.
Соқтығысатын екі әр түрлі бөлшектерден тұратын жүйенің келтірілген массасы келесі теңдеу бойынша анықталады:
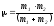 ;
; ;
;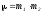 ;
;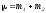 ;
; .
.
Активті соқтығысулар теориясы бойынша
 теңдеу қандай шаманы анықтайды? (r1,
r2
-
соқтығысатын бөлшектердің радиустары).
теңдеу қандай шаманы анықтайды? (r1,
r2
-
соқтығысатын бөлшектердің радиустары).
соқтығысудың эффективті радиусын;
соқтығысудың көлденең қимасын;
бөлшектердің ағын шамасын;
аралық күйдің диаметрін;
активті бөлшек бетінің ауданын.
Газдардың молекулалық-кинетикалық теориясы бойынша бөлшектің екінші бөлшек бойынша орташа қозғалу жылдамдығы
 ;
;
 ;
; ;
; ;
;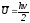 ;
;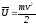 .
.
Қандай теңдеу бойынша бірдей молекулалардың 1 м3 көлемінде 1 секундтың ішінде соқтығысулар санын есептеуге болады? (М - молекулалық масса, г/моль,
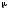 -келтірілген
масса, г; R - универсалды газ тұрақтысы;
CA
заттың концент-рациясы, моль/л).
-келтірілген
масса, г; R - универсалды газ тұрақтысы;
CA
заттың концент-рациясы, моль/л).
ZAA=2CA2d2AA
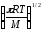 ;
; ZAA=4 CA 2d2AA
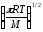 ;
;ZAA= CA 2d2AA
 ;
;ZAA=2NA CA 2d2AA
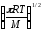 ;
;ZAA=NA CA 2d2AA
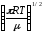 .
.
Қандай теңдеу бойынша әр түрлі молекулалардың 1 м3 көлемінде 1 секундтың ішінде соқтығысулар санын есептеуге болады? m-молекулалардың массалары, г, k-Больцман тұрақтысы; nA, nB-бөлшектердің концентрациясы, м-3, dAB=rA+rB;
ZAB=NAdAB2
 ;
;ZAB=NAdAdB
 ;
;ZAB=dAB2nAnB
 ;
;ZAB=nAnBdAdB
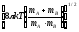 ;
;ZAB=nAnBdAdB
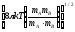 .
.
Әр түрлі молекулалардың активті соқтығысулар санын қандай теңдеу бойынша анықтауға болады? (m-молекуланың массасы, г; nA, nB-молекулалар концентрациясы, м-3; dAB=rA+rB )
Zа=NAdAB2 (8
 kT(
kT(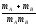 ))1/2
))1/2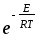 ;
;Zа=NAdAB2nB(8
 kT(
kT(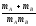 ))1/2
))1/2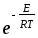 ;
;Zа=NAdAdB(8
 kT(
kT(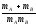 ))1/2
))1/2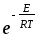 ;
;Zа=nAnBdAdB(8
 kT(
kT( ))1/2
))1/2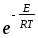 ;
;Zа=nAnBdAB2 (8
 kT(
kT( ))1/2
))1/2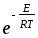 .
.
Қандай теңдеу бойынша бірдей молекулалардың активті соқтығысулар санын есептеуге болады? (М-молекулалық масса, г/моль, R -универсалды газ тұрақтысы, CA заттың концентрациясы, моль/л);
Za=2 CA2d2AA
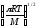
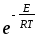 ;
; Za=4 CA2dAA2

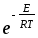 ;
;Za= CA2dAA2
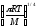
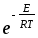 ;
;Za=2(NA(CA2dAA2
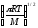
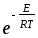 ;
;Za=2NA CA2dAA2

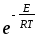 .
.
Активті соқтығысулар теориясы бойынша активтену энергиясының тәжірибелі мәнінің (ЕА) шын мәнімен (Е) байланысы қандай?
1) Е=ЕА-RT ;
2) EА=E-RT ;
3) ЕА=Е+0,5RT ;
4) ЕА=Е-0,5RT ;
5) ЕА=2,5Е .
Қандай соқтығысулар серпімді емес соқтығысулар деп аталады?
соқтығысу нәтижесінде тек қозғалу мөлшерімен алмасу өтетін соқтығысулар;
химиялық әрекеттесуге әкелмейтін соқтығысулар;
соқтығысатын бөлшекетердің электрондық күйлерінің өзгеруіне және де химиялық әрекеттесуіне әкелетін соқтығысулар;
біратомды бөлшектердің соқтығысулары;
молекулалардың орталықтарынан өтетін түзу бойынша бөлшектердің соқтығысулары.
Қандай соқтығысу серпімді соқтығысу деп айталады?
соқтығысу нәтижесінде химиялық әрекеттесу пайда болатын соқтығысуды айтады;
соқтығысу нәтижесінде пайда болатын потенциалды энергия кинетикалық энергияға ауысатын соқтығысуды айтады;
соқтығысатын молекулалар орталықтарын қосатын түзу арқылы өтетін соқтығысуларды айтады;
соқтығысатын бөлшектердің электрондық күйлерінің өзгеруі арқылы өтетін соқтығысуды айтады;
екіатомды молекулалардың соқтығысуын айтады.
Эффективті (тиімді) соқтығысу диаметрі деп нені айтады?
берілген қысымда молекулалар арасындағы орташа арақашықтық;
соқтығысатын молекулалар орталықтары арасындағы минималды арақашықтық;
молекуланың кинетикалық энергиясының молекула диаметріне қатынасы;
молекуланың потенциалды энергиясының молекула диаметріне қатынасы;
ыдыс көлемінің бөлшектер санына қатынасы.
Кеңістік (стериялы ) фактор Р дегеніміз не?
серпімді соқтығысулар нәтижесінде өнімдерге ауысқан бөлшектердің үлесі;
активті соқтығысулар санының жалпы соқтығысу санына қатынасы;
реакцияласушы бөлшектердің размерлеріне тәуелді шама;
активті бөлшектердің әрекеттесуіне қажет белгілі геометриялық конфигурацияның ықтималдығын сипаттайтын шама;
молекулалардың энергия бойынша таралуына түзетулерді кіргізетін шама.
Р стериялық фактордың мәні қандай аралықта өзгереді?
Р=1;
P<0;
P>0;
P барлық мәндерді қабылдайды;
0P1.
Активті соқтығысулар теориясындағы Р стериялық фактордың физикалық мағынасы қандай?
Р мәні молекулалардың энергиялар арқылы таралуына түзеткіш кіргізеді;
Р мәні заттың үгітілу дәрежесін ескереді;
Р мәні жалпы соқтығысулар санын көрсетеді;
Р мәні соқтығысу активті болған жағдайда реакцияның өту ықтималдығын көрсетеді;
Р мәні серпімді емес соқтығысулар санын көрсетеді;
k жылдамдық константасын активті соқтығысулар теориясы бойынша лмоль-1с 1 өлшем бірлігімен есептегенде қандай теңдеуді қолданады (CA,CB-концентрациялар, моль/л):
k=
 d210-3
d210-3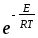 ;
;k=P(NA
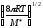 d210-3
d210-3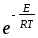 ;
;k=P
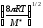 d2
d2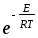 ;
;k=P(NA
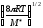 d2
d2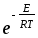 CACB;
CACB;k=P
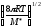 d210-3
d210-3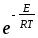 CACBNA
.
CACBNA
.
Активті соқтығысулар теориясы бойынша соқтығысатын молекулалар әр түрлі болған жағдайда бимолекулалы реакцияның жылдамдық константасын м3моль-1с1 өлшем бірлігімен есептегенде теңдеу қалай жазылады?
k=
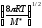 d210-3
d210-3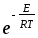 ;
;k=P(NA
 d2
d2 ;
;k=P
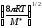 d2
d2
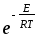 ;
;k=P(NA
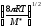 d2
d2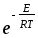 CACB;
CACB;k=P
 d210-3
d210-3 CACBNA
.
CACBNA
.
Активті соқтығысулар теориясы бойынша экспонента алдындағы көбейткіштің (А0) физикалық мағынасы қандай?
А0 молекулалар санына және де активтену энергиясына пропорционал шама;
А0 көлем бірлігінде және де уақыт бірлігінде соқтығысулардың жалпы санына пропорционал шама;
А0 активті молекулалар соқтығысу санына пропорционал шама;
А0 көлем бірлігінде және де уақыт бірлігінде серпімсіз соқтығысулар-дың санына пропорционал шама;
А0 соқтығысулардың жалпы санына және де активтену энергиясына пропорционал шама;
Активті соқтығысулар теориясы бойынша қандай шарт орындалғанда әрекеттесетін бөлшектердің соқтығысуы серпімсіз соқтығысу бола алады?
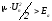 ;
; ;
;Е=ЕА-RT;
Е>ЕА-RT;
Е<ЕА-RT.
Линдеман гипотезасы бойынша газ фазасында өтетін мономолекулалы реакция:
бірінші ретті болады;
екінші ретті болады;
үшінші ретті болады;
реттілігі бір мен екінің аралығында өзгереді;
реттілігі екі мен үштің аралығында өзгереді.
Газ фазасында өтетін мономолекулалы реакцияда түзілген активті бөлшек:
реакция өнімдеріне ыдырайды;
басқа бір бөлшекпен соқтығысып активсізденеді;
реакция өнімдеріне ыдырайды немесе басқа бір бөлшекпен соқтығысып активсізденеді;
ыдыс бетімен соқтығысып реакция өнімдеріне ыдырайды;
ыдыс бетінде қармалады.
Газ фазасында өтетін мономолекулалы реакцияда реакцияға қажетті активтену энергиясы қайдан пайда болады?
бір типтес молекулалар өзара соқтығысу нәтижесінде пайда болады;
радикалдардың ыдыс бетінде қармалуы арүылы пайда болады;
әр түрлі молекулалар өзара соқтығысу нәтижесінде пайда болады;
ыдыс бетінде өтетін хемосорбция нәтижесінде пайда болады;
ыдыс бетінде өтетін физикалық адсорбция нәтижесінде пайда болады.
Линдеман гипотезасы бойынша қысымның жоғары мәндерінде газ фазасында өтетін мономолекулалы реакция қандай реттілікпен өтеді?
1) бірінші; 2) екінші; 3) үшінші; 4) төртінші; 5) бесінші.
Линдеман гипотезасы бойынша қысымның төмен мәндерінде газ фазасында өтетін мономолекулалы реакция қандай реттілікпен өтеді?
1) бірінші; 2) екінші; 3) үшінші; 4) төртінші; 5) бесінші.
Молекулалардың активтенуі қалай өтеді?
молекулалардың активтенуі серпімді соқтығысулар арқылы өтеді;
молекулалардың активтенуі серпімсіз соқтығысулар арқылы өтеді;
молекулалардың активтенуі бөлшектер ішкі энергиясының төмендеуі арқылы өтеді;
молекулалардың активтенуі ыдыс бетіндегі физикалық адсорбция арқылы өтеді;
молекулалардың активтенуі электронның қоздырылған күйге ауысуы арқылы өтеді.
Активті соқтығысулар теориясы бойынша Аррениус теңдеуіндегі экспонента алдындағы көбейткіш:
активтену энтальпиясына тәуелді;
активтену энтропиясына тәуелді;
жалпы соқтығысулар санына тәуелді;
активті соқтығысулар санына тәуелді;
Гиббстің еркін энергиясына тәуелді.
ZAA=2n2
 теңдеу бойынша нені есептейміз?
теңдеу бойынша нені есептейміз?
біртекті молекулалардыңң жалпы соқтығысулар санын;
әр түрлі молекулалардың жалпы соқтығысулар санын;
біртекті молекулалардың активті соқтығысулар санын;
әр түрлі молекулалардың активті соқтығысулар санын;
барлық жауаптар дұрыс емес.
Z= nA nB
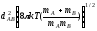 теңдеу бойынша нені есептейміз?
теңдеу бойынша нені есептейміз?
біртекті молекулалардың жалпы соқтығысулар санын;
әр түрлі молекулалардың жалпы соқтығысулар санын;
біртекті молекулалардың активті соқтығысулар санын;
әр түрлі молекулалардың активті соқтығысулар санын;
барлық жауаптар дұрыс емес.
Za= nA nB
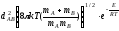 теңдеу бойынша нені есептейміз?
теңдеу бойынша нені есептейміз?
біртекті молекулалардың жалпы соқтығысулар санын;
әр түрлі молекулалардың жалпы соқтығысулар санын;
біртекті молекулалардың активті соқтығысулар санын;
әр түрлі молекулалардың активті соқтығысулар санын;
барлық жауаптар дұрыс емес.
Активті соқтығысулар теориясы қағидаларының бірі:
соқтығысулар саны өскен сайын жылдамдық төмендейді;
химиялық реакцияға активті соқтығысулар әкеледі;
әрекеттесетін молекулалардың құрамы бірдей болуға тиіс;
әрекеттесетін молекулалардың құрамы әр түрлі болуға тиіс;
температура жылдамдыққа әсер етпейді.
