- •10. Температура мен концентрация өрістерінің ұқсастығына талдау жасаңыз.
- •22 - Сурет. Диффузия және температура өткізгіштік коэффициенттерінің арасындағы әртүрлі қатынастардағы жалын фронтында
- •15. Алдын ала араласқан қоспаның жазық ламинарлы жалынының сақталу теңдеулерін келтіріңіз.
- •38 - Сурет. Ламинар алдын - ала араласқан жазық жалынның сызба-нұсқалық суреті
- •20. Тэнфорд пен Пиздің диффузиялық теориясын сипаттаңыз. Ван-Тиггеленің теориясы.
- •25.Игданит дайындау
10. Температура мен концентрация өрістерінің ұқсастығына талдау жасаңыз.
Тәжірибе
жүзінде байқалатын жалынның таралу
жылдамдығының
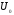 жану температурасына
жану температурасына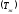 тәуелділігі жану зонасында жүретін
химиялық реакцияның жылдамдығының
тәуелділігі жану зонасында жүретін
химиялық реакцияның жылдамдығының шамасын анықтайтын негізгі фактор
екенін куәландырады. Сондықтан, жалынның
таралу құбылысын зерттеу, қарапайым
жанғыш жалындар жанатын жоғары
температурада жүретін химиялық
реакцияларды зерттеудің принципиалды
мүмкіндігін береді (1500 - 3000 К).
шамасын анықтайтын негізгі фактор
екенін куәландырады. Сондықтан, жалынның
таралу құбылысын зерттеу, қарапайым
жанғыш жалындар жанатын жоғары
температурада жүретін химиялық
реакцияларды зерттеудің принципиалды
мүмкіндігін береді (1500 - 3000 К).
Бұндай
зерттеулердің негізінде
 шамасының жану зонасындағы химиялық
реакция жылдамдығына функционалды
тәуелдігі жатады. Осы тәуелділікті
жалында жүретін процестер мен алып жүру
процестерін (жылу өткізгіштік пен
диффузия) бірге қарастыру арқылы
келтіруге болады. Бастапқы болып
табылатындар:
шамасының жану зонасындағы химиялық
реакция жылдамдығына функционалды
тәуелдігі жатады. Осы тәуелділікті
жалында жүретін процестер мен алып жүру
процестерін (жылу өткізгіштік пен
диффузия) бірге қарастыру арқылы
келтіруге болады. Бастапқы болып
табылатындар:
1) жылуөткізгіштік теңдеуі, бірөлшемді есептер үшін стационарлық жалындарда (сәулелену арқылы жылу беру және реактор қабырғасына жылу беру жоқ деп алынғанда) былай жазылады:
 (24)
(24)
немесе
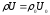 деп алсақ:
деп алсақ:
 (25)
(25)
Мұндағы
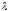 - жылуөткізгіштік коэффициенті,
- жылуөткізгіштік коэффициенті,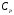 - меншікті жылусыйымдылық,
- меншікті жылусыйымдылық,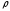 - жалын зонасындағы газдың тығыздығы,
- жалын зонасындағы газдың тығыздығы,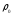 -
- болған кезде,
болған кезде, - жалынның нормаль жылдамдығы (жанбаған
газға қатысты жалынның қозғалу
жылдамдығы),
- жалынның нормаль жылдамдығы (жанбаған
газға қатысты жалынның қозғалу
жылдамдығы),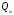 - реакция нәтижесінде жылу бөліну
жылдамдығы,
- реакция нәтижесінде жылу бөліну
жылдамдығы, - жану зонасындағы бірлік көлемдегі
реакция жылдамдығы,
- жану зонасындағы бірлік көлемдегі
реакция жылдамдығы,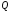 реакцияның жылулық эффектісі.
реакцияның жылулық эффектісі.
2) диффузия теңдеуі, термодиффузияны, яғни диффузияны ескермеген кездегі, температуралық градиент қатысқан кезде мына түрде жазылады:
 (26)
(26)
Мұндағы:
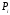 -
-
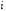 -ші
заттың парциалды қысымы,
-ші
заттың парциалды қысымы, диффузия коэффициенті,
диффузия коэффициенті, -
-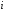 -ші
заттың өзгеруінің химиялық реакциясының
жылдамдығы;
-ші
заттың өзгеруінің химиялық реакциясының
жылдамдығы;
3) реакцияның кинетикалық теңдеуі концентрация және температураның функция ретінде әртүрлі заттардың химиялық өзгерісінің жылдамдығымен бейнеленеді және реакцияның химиялық механизмімен анықталады. Тұрақты жалпы қысымда
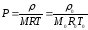 (27)
(27)
Одан басқа жалындағы газдың орташа молекулалық салмағы (М) Мо ден аз ерекшеленеді деп алуға болады,
яғни,
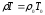 және
және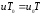
Кейбір жағдайда концентрация өлшемі ретінде берілген заттың бірлік көлемдегі граммен алынған шамасын алады, яғни зат тығыздығы:
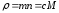 (28)
(28)
 берілген
заттың молекулалық массасы;
берілген
заттың молекулалық массасы;
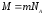 заттың молекулалық салмағы.
заттың молекулалық салмағы.
Немесе берілген заттың парциалды қысымы былай өрнектеледі:
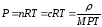 (29)
(29)
Концентрация
берілген заттың бірлік көлемдегі моль
санымен өлшенеді, яғни
 ,
,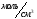 өлшенеді, немесе бірлік көлемдегі
молекулалар санымен өлшенеді:
өлшенеді, немесе бірлік көлемдегі
молекулалар санымен өлшенеді:
 (30)
(30)
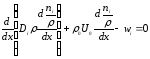 (31)
(31)
Осы зат
есебінде реакциядағы бір өнім немесе
бастапқы заттың біреуі болса, онда
сәйкес
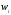 шамасы брутто – реакцияны береді
шамасы брутто – реакцияны береді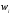 .
Егер одан басқа келесі шарт орындалса:
.
Егер одан басқа келесі шарт орындалса:
(-dnбаст/dt)-dnөнім/dt=w және dnаралық/dt=0.
Стационар реакцияны сипаттай келіп, бастапқы заттар концентрациясы мен реакция өнімінің арасында сызықты тәуелділікті көреміз, ол nаралық пен nбаст және nөнім арасындағы байланысқа ұқсас. Егер әртүрлі заттардың диффузия коэффициенті бір – біріне жақын және орташа D мәніне тең деп қабылдасақ, диффузияның барлық теңдеулері реакцияға алынған заттың немесе өнімнің тек біреуі үшін бір теңдеуге келтіріледі.
Мынадай
жағдайды қарастыра отырып, (25) және (31)
теңдеулерінің ерекшелігін атап өтеміз.
О3
озонның жалынды ыдырауын Льюис пен
Эльбенің алғаш рет және Зельдович пен
Франк Каменецкийдің жалпылама көрсеткендей
кейбір жағдайларда бұл теңдеулерді
ұқсастыруға болады. Расында, Т – ның
орнына өлшемсіз айнымалы
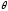 - ны енгізіп:
- ны енгізіп:

және
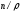 - ның орнына өлшемсіз шамаа
– ны енгізетін болсақ:
- ның орнына өлшемсіз шамаа
– ны енгізетін болсақ:
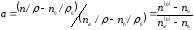 .
.
мұндағы:
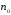 - реакцияға түсетін бастапқы заттың
немесе Т0
температурадағы реакция өнімінің
концентрациясы;
- реакцияға түсетін бастапқы заттың
немесе Т0
температурадағы реакция өнімінің
концентрациясы;
 - Т температурадағы концентрация.
- Т температурадағы концентрация.
 ;
;
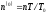
Жылусиымдылықты
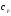 тұрақты шама деп алып, (
тұрақты шама деп алып, (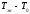 температура
интервалында орташа жылусиымдылыққа
тең) (25) және (31) теңдеулерді мынадай
түрге келтіреміз:
температура
интервалында орташа жылусиымдылыққа
тең) (25) және (31) теңдеулерді мынадай
түрге келтіреміз:
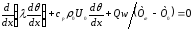 (32)
(32)
және
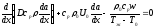 (33)
(33)
Температура мен концентрация өрістерінің ұқсастығы туралы реакция жылдамдығы әрекеттесуші заттар концентрациясына тәуелді болғанда ғана айтуға болады. Мұндай жағдай көбінесе құрамы стехиометриялықтан күрт ерекшеленетін жанғыш қоспаларда жалынның таралуы кезінде байқалады. Мұндай қоспаларда реакция жылдамдығы жетіспеушілікте болатын бір заттың концентрациясында шектелінеді, сонда осы заттың мен Di тепе-теңдігі кезінде концентрация мен температура өрістерінің арасында ұқсастық пайда болады. Бұл жетіспейтін компонентті химиялық энергияның тасымалдағышы деп атайды да, қоспаның соңғы температурасының жану процесінде қол жеткізетін нәтиже оның концентрациясына тәуелді болады.
Энергияның сақталу заңынан:
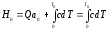 (34)
(34)
жану өнімдерінің соңғы температурасы жанғыш қоспалардың бастапқы жылумөлшерімен (бастапқы концентрация, жетіспеуші реагент және бастапқы температура жылу эффектісі) және р=const кезінде қоспаның орташа жылу сыйымдылығымен анықталады. Тұрақты жылу сыйымдылығы кезінде:
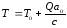 (35)
(35)
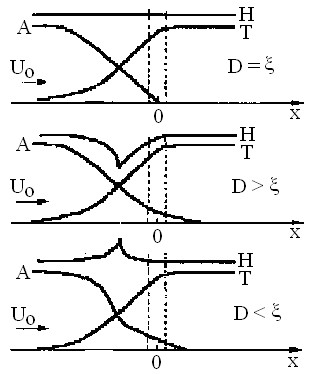
D кезінде жалын ішінде химиялық және жылу энергияларының қосындысы сақталмайды, бірақ жалпы тұжырым бойынша ауытқу қай жаққа ығысатынын айтуға болады (22 - сурет).
Отынға кедей Н2 - ауа қоспасында сутегінің диффузия коэффициенті - химиялық энергия тасымалдағышы қоспасынан бір ретке жоғары, сондықтан диффузия қыздыру аумағындағы газ қоспасынан сутегін қарқынды алып кетеді.
Нәтижесінде Н2 - ауа жағдайында қыздыру аумағындағы толық энтальпия минимумға ие болады.
Керісінше, отынға кедей жоғары молекулалы көмірсутек қоспасында, мысалы С6Н6 – ауа, температура өткізгіштік > D қарқынды өтеді; сондықтан қыздыру аумағында толық энтальпия максимумға жетеді.
Жылу өткізгіштік пен диффузия теңдеулеріне мөлшерсіз Т және а (концентрация) енгізсек және соңғы мүшелері бірдей болады деп есептесек:
(-n0ж + n0)Q =0 ср (Тж – Т0) (36)