
Лаб № 9 Определение pH растворов
.docxМинистерство образования и науки Российской Федерации
Владимирский государственный университет
Кафедра химии
Отчет по лабораторной работе
«Определение pH растворов»
Работу выполнил:
Студент группы С-211
Антропов А.С.
Работу принял: Федоров Н.В.
Владимир 2011г.
Краткая теория к работе:
Как
известно, вода является слабым
электролитом, диссоциирующим по
уравнению: H2O
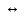 H++OH-
H++OH-
Для
воды, а также для водных растворов любых
электролитов произведение активных
равновесных концентраций водородных
и гидроксильных ионов - величина
постоянная при данной температуре. Она
называется ионным
произведением воды и
при 22°С составляет Kw=1,0 10-14.
Следовательно, для чистой воды можно
записать:
10-14.
Следовательно, для чистой воды можно
записать:
[H+]=[OH-]=1,0 10-7
моль/л.
10-7
моль/л.
Прибавление к воде кислоты или щелочи смещает ионное равновесие воды. Концентрации ионов Н+ или OH- изменяются. Однако произведение концентраций [Н+][ОH-] остается постоянным и равным ионному произведению воды. Это дает возможность, зная концентрацию одного иона, вычислить концентрацию другого:
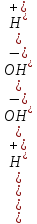
Более удобно характеризовать кислотность и щелочность среды величинами, являющимися десятичными логарифмами концентраций ионов Н+ и ОН-, взятыми с обратными знаками. Эти величины называются водородным (рН) и гидроксильным (рОН) показателями.
pH=-lg[H+]; pOH=-lg[OH-]
В
нейтральной среде: [Н+]
= 1 10-7
моль/л; рН = 7.
10-7
моль/л; рН = 7.
В
кислой среде: [Н+]
> 1 10-7
моль/л; рН < 7.
10-7
моль/л; рН < 7.
В
щелочной среде: [Н+]
< 1 10-7
моль/л; рН>7.
10-7
моль/л; рН>7.
Для определения кислотности или щёлочности среды используют индикаторы - вещества, которые меняют свою окраску в зависимости от рН среды. Это изменение происходит в определенном интервале рН, например, у метилового оранжевого (или кратко - метилоранжа) окраска от желтой до красной изменяется в интервале рН 4,4 - 3,1. При помощи индикаторов возможно определение рН раствора. Например, если в испытуемом растворе индикатор метилоранж желтеет, а лакмус краснеет, то рН раствора лежит между 4,4 - 5,0.
Для характеристики поведения слабых электролитов в растворах используют понятие константы диссоциации слабого электролита, которая, по своему смыслу, является константой равновесия процесса распада молекул этого электролита на ионы. Для слабых кислот она носит название константы кислотности (Кa а для слабых оснований - константы основности (Кb).
Например,
для процесса диссоциации уксусной
кислоты СН3СООН
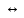 CH3COO‑
+ H+
выражение константы кислотности примет
вид:
CH3COO‑
+ H+
выражение константы кислотности примет
вид:
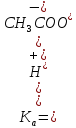
Поскольку
все слабые электролиты диссоциируют
частично и обратимо, существует ещё
одна характеристика глубины протекания
этого процесса, она носит название
степени
диссоциации (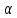 )
и показывает отношение числа молекул,
подвергшихся распаду на ионы Ni,
к
общему количеству молекул Nобщ,
введённых в раствор:
)
и показывает отношение числа молекул,
подвергшихся распаду на ионы Ni,
к
общему количеству молекул Nобщ,
введённых в раствор:
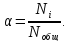
Степень диссоциации и константа диссоциации слабого электролита связаны между собой уравнением разведения Оствальда:
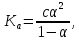
где с - молярная концентрация слабого электролита.
При
малых значениях концентрации вещества
и очень низкой степени диссоциации (т.
е. с
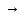 0 и α
0 и α
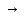 0) уравнение разведения Оствальда можно
упростить до вида
0) уравнение разведения Оствальда можно
упростить до вида
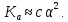
Экспериментальная часть:
Приборы и реактивы: иономер (рН-метр); компаратор; колбы мерные на 50 мл - 2 шт.; стаканчики химические по 50 мл - 2 шт.; пипетки мерные на 5 мл; пробирки. Растворы: уксусная кислота 1 М; гидроксид натрия 0,05 М. Лакмус; метилоранж; фенолфталеин; универсальный индикатор.
Выполнение работы:
Опыт 1: Окраска индикаторов в различных средах
|
Индикатор |
Среда |
||
|
кислая |
нейтральная |
щелочная |
|
|
Лакмус |
красная |
фиолетовая |
синяя |
|
Фенолфталеин |
бесцветная |
бесцветная |
малиновая |
|
Метилоранж |
розовая |
оранжевая |
желтая |
Опыт 2: Определение pH раствора уксусной кислоты
Вычисляю
активную концентрацию ионов OH-
в растворе по формуле:
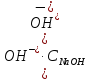
[OH-]
= 0,9
 0.005 = 0.0045 моль/л.
0.005 = 0.0045 моль/л.
|
Экспериментальное значение pH равно: pHэкс = 11,21. Экспериментальное значение оказалось больше, чем теоретическое. |
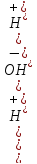
pH = -lg[H+];
pH
= -lg|2.2 10-12|
= 11,65
10-12|
= 11,65
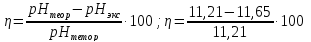 =
0,04
=
0,04
Опыт 3: Определение pH раствора
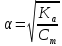 ;
;
 ;
;
[H+]
= α
 Cm
Cm
 b
b
[H+]
= 0.0136
 0.1
0.1
 1 = 0.00136 моль/л.
1 = 0.00136 моль/л.
pH = -lg|0.00136| = 2.82
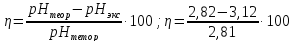 =
0,106
=
0,106
Экспериментальное значение pH: pHэкс = 3.12. Экспериментально значение pH оказалось больше, чем теоретическое. Это может быть обусловлено факторами погрешности визуальной неточностью и погрешностью приборов, использовавшихся в ходе выполнения работы.
