
шпоры
.docxФункции , удовлетворяющие уравнению Шредингера при данных U, называются собственными функциями.
Значения Е, при которых существуют решения уравнения (22), называются собственными значениями.
В качестве примера определим и Е для свободной частицы.
Свободной
называют частицу, на которую не действуют
силы, т.е. ![]() .
Cледовательно, U(x)=const и ее можно принять
равной нулю. Таким образом, в случае
свободного движения частицы, ее полная
энергия совпадает с кинетической, а
скорость
.
Cледовательно, U(x)=const и ее можно принять
равной нулю. Таким образом, в случае
свободного движения частицы, ее полная
энергия совпадает с кинетической, а
скорость ![]() .
Направим ось Х вдоль вектора
.
Направим ось Х вдоль вектора ![]() .
Тогда (22) можно записать в виде
.
Тогда (22) можно записать в виде
![]() .
(23)
.
(23)
Прямой подстановкой можно убедится, что частным решением этого уравнения является функция(х)=Аexp(ikx), где А=сonst, k=const c собственным значением энергии
Е=![]() .(24)
.(24)
C учетом (21) волновая функция
(х)=Аexp(-it+
ikx)= Аexp[-(i/![]() )(Еt-
рxх)].
(25)
)(Еt-
рxх)].
(25)
здесь =Е/![]() ,
k=рx/
,
k=рx/![]()
Функция (25) представляет собой плоскую монохроматическую волну де Бройля [cм. (16)].
Из (24) следует, что зависимость энергии от импульса
Е=![]() 2k2/(2m)=Рх2/(2m)=mv2/2
(26)
2k2/(2m)=Рх2/(2m)=mv2/2
(26)
оказывается обычной для нерелятивиских частиц. Следовательно, энергия свободной частицы может принимать любые значения, т.е. ее энергетический спектр является непрерывным.
Плотность вероятности обнаружить частицу в данной точке пространства
|| 2=*=A2,
т.е. все положения свободной частицы в пространстве являются равновероятными.
____________________________________________________________________
Квантовые числа - это числа, возникающие при решении уравнения Шрёдингера. Они служат для описания квантово-химической модели ядра атома, в простейшем случае - ядра атома водорода (протона) Каждая орбиталь характеризуется набором трёх квантовых чисел n, l, ml, а состояние электрона в атоме - теми же тремя + ещё одним, дополнительным числом ms (итого, четыре). Главное квантовое число n определяет энергию электрона на разрешённых атомных орбиталях. Кроме того, через энергию мы можем рассчитать и размер области нахождения электрона. Решение уравнения Шрёдингера даёт выражение для расчёта энергии электрона. E = -2пи: 2me^4/n^2h^2 = -1312,1/n^2 кДж/моль (для атома водорода) . Оно получается подстановкой конкретных значений чисел в радиальную часть уравнения Шрёдингера. Из чего следует, что n принимает натуральные значения (1, 2, 3 и т. д. )
____________________________________________________________________ Орбитальное квантовое число l характеризует энергетический подуровень. Также характеризует момент количества движения электрона на орбитали относительно выбранного направления в пространстве с волновой точки зрения по x, y или z. Для решения уравнения l может принимать целые значения от 0 до n-1. Спектроскописты выделяют ещё одно значение квантового числа l. Оно характеризует вырождение или расщепление квантового уровня на энергетические подуровни. Это не число, а вид. Число l также определяет форму энергетической орбитали.
____________________________________________________________________ Магнитное квантовое число ml (принимающие целые значения от -l до l) отвечает за проекцию количества движения на выбранное направление в пространстве. Магнитное число говорит о том, как данное облако ориентировано в пространстве, а также самой орбитали. Кроме трёх квантовых чисел собственное поведение электрона, проявляющееся в некоторых опытах, проявляется четвёртым квантовым числом ms, которое называют магнитным спиновым числом. Это число может принимать только два значения: 1/2 и -1/2. Если говорить просто, оно показывает, в какую сторону вращается электрон в данном квантовом состоянии, характеризующимся только тремя квантовыми числами. В таком состоянии могут находиться не более двух электронов согласно принципу Паули. Причём оба они вращаются в разные стороны - отсюда спиновое число одного - положительно, другого - отрицательно. Эти четыре квантовых числа полностью предполагают энергетическое и геометрическое описание свойств в атоме. Образом (или пространственным представлением) и является атомная орбиталь.
При падении электрона на протон угловая скорость движения электрона неограниченно возрастает, что должно приводить к сплошному спектру излучения, неограниченному по частоте.
Все эти выводы противоречат опыту, что показывает невозможность классической теории правильно описать свойства атома водорода. Первый шаг в понимании закономерностей движения электрона в атоме водорода был сделан Бором, который дополнил классические уравнения (II.4.1) – (II.4.4) уравнением квантования момента импульса электрона
![]() ,
n = 1,2, …
, (II.4.8)
,
n = 1,2, …
, (II.4.8)
которое после подстановки в (II.4.6) даёт дискретный энергетический спектр для финитного движения электрона
![]() ,
n=1,2,3, … .
,
n=1,2,3, … .
ереход электронов из состояния финитного движения с дискретным спектром в состояние инфинитного движения со сплошным спектром называется ионизацией. Минимальная энергия, которую необходимо передать электрону в стационарном состоянии с энергией En для того, чтобы произошла ионизация атома водорода, определяется соотношением
____________________________________________________________________
Гиромагни́тное отноше́ние (магнитомехани́ческое отноше́ние) — отношение дипольного магнитного момента элементарной частицы (или системы элементарных частиц) к её механическому моменту.
В системе СИ единицей измерения гиромагнитного отношения является с·А·кг−1 = с−1·Тл−1. Часто подразумевается, что гиромагнитное отношение измеряется в единицах q/2mc, где с — скорость света, q и m — заряд и масса частицы, соответственно. В этом случае оно выражается безразмерной величиной.
Для различных состояний атомной системы гиромагнитное отношение определяется формулой:
![]()
где g — множитель Ланде, γ0 — единица гиромагнитного отношения:
![]()
где e — элементарный заряд, me — масса электрона, с — скорость света.
В случае ядер, за единицу гиромагнитного отношения принимают величину:
![]()
где mp — масса протона.
Согласно классической теории, гиромагнитное отношение является коэффициентом пропорциональности между угловой скоростью прецессии магнитного момента, помещённого во внешнеемагнитное поле, и вектором магнитной индукции.
![]()
____________________________________________________________________
Состояния с одинаковой энергией называют вырожденными, а число различных состояний с определенным значением энергии Еп - кратностью вырожденияданного энергетического уровня. Кратность вырождения n-го уровня водородоподобной системы можно определить, учитывая число возможных значений ℓ и т.Каждому из п значений квантового числа ℓ соответствует 2ℓ + 1 значений т. Поэтому полное число N различных состояний для данного п равно
|
N = |
Электронная оболочка атома — область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Число электронов в каждой электронной оболочке не превышает определенного максимального значения.
Порядок заполнения электронных оболочек (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа
____________________________________________________________________
Правилами отбора в спектроскопии называют ограничения и запрет на переходы между уровнями квантомеханической системы с поглощением или излучением фотона, наложенные законами сохранения и симметрией. Разрешенные переходы гармонического осциллятора удовлетворяют правилу отбора:
____________________________________________________________________
Спин (от англ. spin — вертеть[-ся], вращение) — собственный момент импульса элементарных частиц, имеющий квантовую природу и не связанный с перемещением частицы как целого. Спином называют также собственный момент импульса атомного ядра или атома; в этом случае спин определяется как векторная сумма (вычисленная по правилам сложения моментов в квантовой механике) спинов элементарных частиц, образующих систему, и орбитальных моментов этих частиц, обусловленных их движением внутри системы.
Спин
измеряется в единицах ħ (приведённой постоянной
Планка,
или постоянной
Дирака)
и равен ![]() где J —
характерное для каждого сорта частиц
целое (в том числе нулевое) или полуцелое
положительное число — так
называемое спиновое
квантовое число,
которое обычно называют просто спином
(одно из квантовых
чисел).
где J —
характерное для каждого сорта частиц
целое (в том числе нулевое) или полуцелое
положительное число — так
называемое спиновое
квантовое число,
которое обычно называют просто спином
(одно из квантовых
чисел).
В связи с этим говорят о целом или полуцелом спине частицы
____________________________________________________________________
Взаимодействие спинового и орбитальных магнитных моментов посредством магнитного поля (спин – орбитальное взаимодействие) приводит к сдвигу и расщеплению энергетических уровней, определяемых формулами (II.4.14)-(II.4.16). В результате возникает тонкая структура энергетического спектра атома водорода с характерной энергией
![]() , где
, где ![]() -
постоянная тонкой структуры, Z – заряд
ядра (для атома водорода Z=1) и En –
энергия стационарного состояния
(II.4.14). Из (II.4.21) следует что спин-орбитальное
взаимодействие играет важную роль для
сверхтяжелых элементов.
-
постоянная тонкой структуры, Z – заряд
ядра (для атома водорода Z=1) и En –
энергия стационарного состояния
(II.4.14). Из (II.4.21) следует что спин-орбитальное
взаимодействие играет важную роль для
сверхтяжелых элементов.
____________________________________________________________________
Электроны обладают собственным (спиновым) моментом импульса (1) и собственным магнитным дипольным моментом (2)
В выражениях (1) и (2) е— элементарный заряд, me— масса покоящегося электрона,
s—спиновое квантовое число. При написании выражения (2) учтено, что ; (3)
магнетон Бора — элементарный магнитный дипольный момент, Знак минус в формуле (2) указывает на то, что направления магнитного и механического спиновых моментов вследствие отрицательности заряда электрона противоположны.
Атом водорода — физическая система, состоящая из атомного ядра, несущего элементарный положительный электрический заряд, и электрона, несущего элементарный отрицательный электрический заряд. В состав атомного ядра может входить протон или протон с одним или несколькими нейтронами, образуя изотопы водорода. Электрон преимущественно находится в тонком концентрическом шаровом слое вокруг атомного ядра, образуя электронную оболочку атома. Наиболее вероятный радиус электронной оболочки атома водорода в стабильном состоянии равенборовскому радиусу a0 = 0,529 Å.
Атом водорода имеет специальное значение в квантовой механике и релятивистской квантовой механике, поскольку для него проблема двух тел имеет точное или приближенное аналитическое решения. Эти решения применимы для разных изотопов водорода, с соответствующей коррекцией.
____________________________________________________________________
Движущееся отрицательное или положительное волновое возмущение поля в один квант заряда представляет электрический ток смещения, поэтому может двигаться только по замкнутой боровской орбите - ток, согласно законам электродинамики, всегда замкнут. При этом орбитальное движение совершает только энергия (масса) электрического потока, магнитный же поток создается круговым током смещения и не движется, поэтому масса магнитного потока не участвует в образовании момента количества движения - спина, т.е. возникает "удвоенный магнетизм" спина. В электромагнитной волне энергия (масса) электрического потока равна энергии (массе) магнитного потока. Отсюда спин электрона: L = mcRe/2 = h/4π, где Re - эффективный радиус орбиты, по которому движется электрическое возмущение поля Re = h/2πmc.
____________________________________________________________________
Каждый
электрон в атоме обладает орбитальным
моментом импульса ![]() и
собственным моментом
и
собственным моментом ![]() Механические
моменты связаны с соответствующими
магнитными моментами, вследствие чего
между всеми
Механические
моменты связаны с соответствующими
магнитными моментами, вследствие чего
между всеми ![]() имеется
взаимодействие.
имеется
взаимодействие.
Моменты ![]() складываются
в результирующий момент атома
складываются
в результирующий момент атома ![]() При
этом возможны два случая.
При
этом возможны два случая.
1.
Моменты ![]() взаимодействуют
между собой сильнее, чем с
взаимодействуют
между собой сильнее, чем с ![]() которые
в свою очередь сильнее связаны друг с
другом, чем с
которые
в свою очередь сильнее связаны друг с
другом, чем с ![]() Вследствие
этого все
Вследствие
этого все ![]() складываются
в результирующую
складываются
в результирующую ![]() моменты
моменты ![]() складываются
в
складываются
в ![]() а
затем уже
а
затем уже ![]() дают
суммарный момент атома
дают
суммарный момент атома ![]() Такой
вид связи встречается чаще всего и
называется связью Рёссель — Саундерса
или
Такой
вид связи встречается чаще всего и
называется связью Рёссель — Саундерса
или ![]() вязью.
вязью.
2.
Каждая пара ![]() взаимодействует
между собой сильнее, чем с другими
взаимодействует
между собой сильнее, чем с другими ![]() вследствие
чего образуются результирующие
вследствие
чего образуются результирующие ![]() для
каждого электрона в отдельности, которые
затем уже объединяются в
для
каждого электрона в отдельности, которые
затем уже объединяются в ![]() атома.
Такой вид связи, называемый
атома.
Такой вид связи, называемый ![]() вязью,
наблюдается у тяжелых атомов.
вязью,
наблюдается у тяжелых атомов.
Сложение моментов осуществляется по квантовым законам (см. § 24). Рассмотрим подробнее сложение моментов в случае связи Рёссель — Саундерса.
Орбитальные квантовые числа U всегда бывают целыми. Соответственно квантовое число L суммарного орбитального момента также бывает целым (либо нулем).
____________________________________________________________________
JJ-связь - это один из типов векторной связи, при котором взаимодействие орбитального (момент импульса) и спинового моментов каждого электрона в электронной оболочки сильнее, чем взаимодействие порознь орбитального и спинового моментов различных электронов между собой. Относится к однородным типам связи. Данный тип векторной связи используется для описания уровней энергии тяжёлых атомов и многозарядных ионов.
СВЯЗЬ ВЕКТОРНАЯ - наглядная модель векторного сложения орбитальных li и спиновых siмоментов в полный момент J квантовой системы (атома, атомного ядра, молекулы), характеризующая взаимодействие электронов в атомах и молекулах и нуклонов в атомных ядрах.
![]()
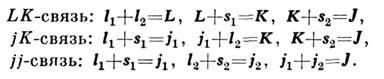
____________________________________________________________________
Магнитный момент, основная величина, характеризующая магнитные свойства вещества. Источником магнетизма, согласно классической теории электромагнитных явлений, являются электрические макро- и микротоки
____________________________________________________________________
Комбинации пространственных (орбитальных) состояний частиц в коллективе легко описать разными способами. Возможные спиновые комбинации в системе двух частиц-фермионов с половинным спином (электронов, протонов) можно представить разными способами. Можно изобразить ориентации спинов разными символами (стрелками, знаками или греческими буквами). Результат сложения компонент момента импульса вдоль оси вращения представим в одной из строк таблицы значениями суммарного магнитного квантового числа.
____________________________________________________________________
Правила и примеры построения векторных диаграмм
Для
определения группы соединения следует
прежде всего построить векторные
диаграммы для обмоток ВН и НН. Считаем,
что векторная диаграмма напряжений ВН
всегда задана в виде треугольника
междуфазовых напряжений АВ, ВС и СА,
точнее, в виде взаимного расположения
вершин А, В и С (рис. 7,а). Тогда условимся,
что положительным направлением векторов
фазных напряжений обмотки ВН, соединенной
в Y, является направление от точки О к
вершинам А, В и С, т. е. векторы OA, OB и ОС.
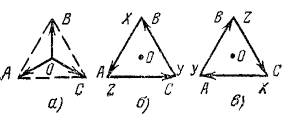
____________________________________________________________________
При́нцип Па́ули , согласно которому два и более тождественных фермиона(частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии.
____________________________________________________________________
Фе́рми —
Дира́ка то
есть, одно и то же квантовое
состояние не
может занимать более одной частицы);
определяетраспределение
вероятностей нахождения фермионов на
энергетических уровнях системы,
находящейся в термодинамическом
равновесии; предложена в позволяет
найти вероятность,
с которой фермион занимает данный
энергетический уровень.
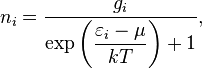
где
![]() —
среднее
число частиц в состоянии
—
среднее
число частиц в состоянии ![]() ,
,
![]() —
энергия
состояния
—
энергия
состояния ![]() ,
,
![]() — кратность
вырождения состояния
— кратность
вырождения состояния ![]() (число
состояний с энергией
(число
состояний с энергией ![]() ),
),
![]() — химический
потенциал (который
равен энергии
Ферми
— химический
потенциал (который
равен энергии
Ферми ![]() при
абсолютном нуле температуры),
при
абсолютном нуле температуры),
![]() — постоянная
Больцмана,
— постоянная
Больцмана,
![]() —
абсолютная температура.
—
абсолютная температура.
В
(идеальном) ферми-газе в
пределе низких температур ![]() .
В этом случае (полагая уровни энергии
невырожденными
.
В этом случае (полагая уровни энергии
невырожденными ![]() ),
функция распределения частиц
называется функцией
Ферми:
),
функция распределения частиц
называется функцией
Ферми:
Два класса Элементарные частицы, в узком смысле - частицы, которые нельзя считать состоящими из других частиц. В современной физике термин "элементарные частицы" используют в более широком смысле: так называют мельчайшие частицы материи, подчиненные условию, что они не являются атомными ядрами и атомами (исключение составляет протон); иногда по этой причине элементарные частицы называют субъядерными частицами. Большая часть таких частиц (а их известно более 350) являются составными системами. И неэлементарные
В
статистике Ферми — Дирака среднее число
частиц в состоянии с энергией εi есть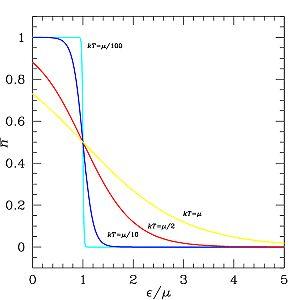
![]() где:
где:
![]() —
среднее
число частиц в состоянии i,
—
среднее
число частиц в состоянии i,
-
— энергия состояния i,
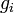 кратность
вырождения состояния i (число
состояний с энергией
кратность
вырождения состояния i (число
состояний с энергией 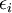 ),
μ — химический
потенциал (который
равен энергии
Ферми
),
μ — химический
потенциал (который
равен энергии
Ферми 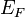 при
абсолютном нуле температуры),
k — постоянная
Больцмана,
T —
абсолютная температура.
при
абсолютном нуле температуры),
k — постоянная
Больцмана,
T —
абсолютная температура.
В
(идеальном) ферми-газе в пределе низких
температур ![]() .
В этом случае (полагая уровни энергии
невырожденными
.
В этом случае (полагая уровни энергии
невырожденными ![]() ),
функция распределения частиц
называется функцией
Ферми:
),
функция распределения частиц
называется функцией
Ферми:
![]()
____________________________________________________________________
Хими́ческий
потенциа́л ![]() — термодинамическая функция,
применяемая при описании состояния
систем с переменным числом частиц.
Определяет изменение термодинамических
потенциалов (энергии Гиббса, внутренней
энергии, энтальпии и т. д.) при изменении
числа частиц в системе. Представляет
собой энергиюдобавления
одной частицы в систему без совершения
работы. Определение химического
потенциала можно записать в виде:
— термодинамическая функция,
применяемая при описании состояния
систем с переменным числом частиц.
Определяет изменение термодинамических
потенциалов (энергии Гиббса, внутренней
энергии, энтальпии и т. д.) при изменении
числа частиц в системе. Представляет
собой энергиюдобавления
одной частицы в систему без совершения
работы. Определение химического
потенциала можно записать в виде:
![]()
где Е — энергия системы, S — её энтропия, N — количество частиц в системе.
____________________________________________________________________
Зонная теория твердых тел - квантовая теория энергетического спектра электронов в кристалле, согласно которой этот спектр состоит из чередующихся зон разрешенных и запрещенных энергий. Зонная теория объясняет, в частности, различный характер электропроводности металлов, полупроводников и диэлектриков. Физически происхождение зонной структуры в кристалле связано с образованием кристалла из N атомов, каждый из которых в свободном состоянии обладает дискретным электронным энергетическим спектром
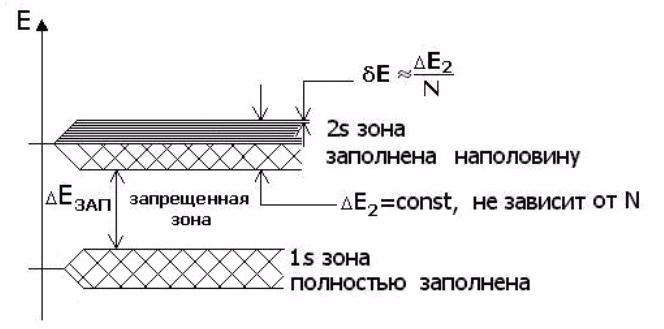
Надо запомнить, что число энергетических уровней, равно числу энергетических подуровней. Это означает, что на первом уровне может быть только один подуровень из четырех (s,p,d,f) и именно s-подуровень, так как его энергия по сравнению с другими подуровнями минимальна 1s.На втором уровне должно быть два подуровня, - это снова s-подуровень, и за ним по энергетике р-подуровень 2s,2p.На третьем уровне три подуровня, - s,p,d - 3s,3p,3d. И, наконец, на четвертом, -все четыре подуровня 4s,4p,4d,4f.
____________________________________________________________________
По мере увеличения суммарного числа электронов в атомах (при возрастании зарядов их ядер, или порядковых номеров химических элементов) атомные орбитали заселяются таким образом, что появление электронов на орбитали с более высокой энергией зависит только от главного квантового числа n и не зависит от всех остальных квантовых чисел, в том числе и от l. Физически это означает, что в водородоподобном атоме (в отсутствие межэлектронного отталкивания) орбитальная энергия электрона определяется только пространственной удаленностью зарядовой плотности электрона от ядра и не зависит от особенностей его движения в поле ядра. Поэтому энергетическая последовательность орбиталей в водородоподобном атоме выглядит просто:
1s<2s=2p<3s=3p=3d<4s=4p=4d=4f<5s...
В металлах всё просто - есть свободные электроны. Это электроны, слабо связанные с ядром атома, и как только атомы металла объединяются в кристаллическую решётку, эти электроны становятся совсем сободны и ведут себя подобно газу (электронный га) . В частности, даже мелейшее электрическое поле приводит к дрейфу электронов под действие этого поля - так появляется электрический ток.
В полупроводниках всё иначе. Там атомы тоже связаны в кристаллическую решётку, однако поскольку число валентных электронов точно соответствует числу связей атома с соседями, своободных электронов нет. И к тому же, если решить уравнение Шредингера для электрона в поле, создаваемой решёткой, окажется, что разрешёнными по энергиями уровнями будут не какие попало, как для свободного электрона, и не строго определённые уровни, как для электрона в одиночном атоме (модель Бора для атома водорода - хороший пример) , а - зоны. Их на самом деле несколько, но до какой-то из них все возможные уровни (возможные исходя из решения уравнения Шрёдингера для решётки) заполнены имеющимися в наличии электронами, а для следующего разрешённого диапазона значений просто нет электронов. И вот промежуток значений энергии, отделяющий два разрешённых диапазона, один из которых заполнен, а второй - ещё нет, и называется запрещённой зоной. Что важно понять: такая зонная структура хнергетических уровней есть следствие строгой пространственной периодичности кристаллической решётки. ЛЮБОЕ нарушение этой периодичности искажает такую простую картинку. А этим нарушением может быть как дефект кристаллической решётки, так и примесь. То есть вместо атома кремния имеется атом, скажем, бора или фосфора или ещё какой-то. И как только идеальная периодическая картинка нарушается - появляются дополнительные разрешённые уровни, расположенные в запрещённой зоне. Где именно - зависит от того, как именно нарушена периодичность решётки (дфект, или атом примеси, или что ещё). Теперь - как вообще появляется проводимость в полупроводниках. Значит, ещё раз - атомы встроены в периодическую кристаллическую решётку, и каждый атом связан с четырьмя соседними (случай кремния или германия) . Если теперь атом кремния заменить атомом фосфора, у которого пять валентных электронов, то четыре уйдут на эти связи с соседями, а пятый останется не у дел. И если пр этом окажется, что уровень, создаваемый данным атомом примеси в запрещённой зоне, находится достаточно близко к верхней её границе, то просто за счёт своей тепловой энергии этот электрон перескочит в следующую разрешённую зону - и получает возможность перемещаться по кристаллу. Так возникает электронная проводимость (n-типа) .
