
Praktikum_Klimnyuk
.pdfРозділ 18. Лабораторна діагностика окремих протозоозів |
421 |
Паразитологічне й біологічне дослідження. Патогенні трипаносоми всіх трьох видів можна культивувати на штучних живильних середовищах для найпростіших. Щоб виділити чисті культури трипаносом від хворих, роблять посіви крові або пунктатів лімфатичних вузлів чи кісткового мозку. Для цього найчастішевикористовуютьагарNNN (Novy-Neal-Nicolle), щоміститьдефібринованукров кролика, середовище Веймана (кров’яний агар з цитратною плазмою крові людини) та ін. Посіви інкубують при температурі 22-26 °С. Характерні маленькі йпрозорі колонії виростають на 3-4-й день після посіву.
Чистікультуритрипаносомотримуютьтакожукурячихембріонах(інокулюючи матеріал у хоріоналантоїсну оболонку), або в культурах ембріональних тканинщурівчиклітинHela. Культуральнийметоддіагностикивикористовуютьрідко, за виннятком хвороби Шагаса-Крузі.
Для діагностики трипаносомозів можна використовувати постановку біологічноїпробинарізнихекспериментальнихтваринах. Приамериканськомуваріан- тіхворобивводять5-10 млкровіінтраперитонеальногвінейськимсвинкам, кошенятам або цуценятам. Через декілька днів у крові заражених тварин появляються трипаносоми. До T. gambiense особливо чутливі мавпочки роду Erythrocebus, а до T. rhodesiense – білі миші та щури.
При діагностиці африканського трипаносомозу важливо не тільки встановитивидзбудника, айстадіюхвороби. Дляцьогодосліджуютьспинномозковурідину на вміст білка і кількість лімфоцитів. До першої (ранньої) стадії відносять ті випадки, коли кількість білка не первищує 250 мг/мл, а число клітин не більше 3-х у 1 мл. Більш високий вміст білка й лімфоцитів свідчить про тяжке ураження центральної нервової системи, а, отже, про другу (пізню) стадію хвороби.
Серологічніреакціїбільшдетальнорозробленідлядіагностикиамериканськоготрипаносомозу. Алетепервжезапропонованіметодивизначенняантитілкласів IgM та IgG в діагностичних титрах у всіх хворих на трипаносомоз. Для цієї мети використовують реакції преципітації, аглютинації, імунофлуоресценції та зв’язування комплементу. Антигеном для їх постановки служить екстракт із серцевих м’язів інвазованих тварин або живих трипаносом. Реакції аглютинації та преципітації використовують при гострих формах хвороби, а РЗК – при хронічних. Результати реакцій краще оцінювати при постановці методом парних сироваток.
Останнім часом розроблено специфічний і чутливий метод діагностики за допомогою ензиммічених антитіл. Антигеном для ІФА служать лізати трипаносом від заражених тварин або лабораторних культур.
Лейшманіози
Лейшманіози – група хронічних антропонозних трансмісивних хвороб, які викликаються лейшманіями і передаються москітами; поширені серед населення тропічних і субтропічних країн.
Розрізняють шкірний лейшманіоз, який викликається Leishmania tropica і характеризуєтьсяураженнямшкіри; шкірно-слизовийлейшманіоз, збудникомякого
422 |
Частина VІ. Протозойні інфекції |
є Leishmania brasiliensis, супроводжується ураженням шкіри і слизових оболонок; вісцеральний лейшманіоз, що викликаєтьсяLeishmania donovani, характеризується переважним ураженням внутрішніх органів. Кожен із трьох видів лейшманіозів реєструється в певних ендемічних регіонах планети.
Всі три види лейшманій відносяться до родини Trypanosomatidae, класу Mastigophora і мають ідентичні морфологічні властивості. Життєвий цикл цих паразитів складається з двох стадій: безджгутикової (амастиготної) – в організмі людини і джгутикової (промастиготної) – в тілі москіта. Безджгутикові форми є внутрішньоклітинними паразитами системи мононуклеарних фагоцитів, мають овальнуформу, розміри3-5 мкмудовжинуі1-3 мкмуширину. Джгутиковіформи більшізарозміром(10-15× 4-6 мкм), монотрихи, активнорухливі, добрекультивуються на живильних середовищах.
Джерелом і резервуаром інфекції в природі є домашні й дикі тварини (собаки, лисиці, шакали) та гризуни.
Матеріалом для лабораторної діагностики лейшманіозів шкіри і слизових оболонок служить вміст виразок і крайового інфільтрату, біоптати уражених тканин, пунктати лімфовузлів, кірочки слизової оболонки. Для збільшення частоти виявленнялейшманійважливоправильновзятиматеріал. Ділянкушкіри, деєгорбикабокрайовийінфільтратнавколовиразки, стискуютьміжвеликимівказівним пальцемлівоїрукидлязнекровлення, потімскальпелемроблятьповерхневийнадріз епідермісу, зскрібають шматочки тканин з стінок і дна розрізу. Зскрібок разом з краплею рідини використовують для виготовлення мазка. У хворих на вісцеральнийлейшманіозберутькров, пунктатикістковогомозку, печінки, селезінки, лімфатичних вузлів. Проводять мікроскопічні, культуральні, біологічні та серологічні дослідження, а також постановку алергічних проб.
Мікроскопічне дослідження є найбільш інформативним і поширеним методом діагностики всіх видів лейшманіозів. Виготовлені мазки фіксують етанолом, метанолом або сумішшю Никифорова, забарвлюють за методом РомановськогоГімзи, мікроскопують під імерсійним об’єктивом. Цитоплазма амастиготів і промастиготівфарбується вголубий, аядро, кінетопласт іджгутики – учервонийабо рожево-фіолетовий колір.
Привісцеральнійформіхворобилейшаміївиявляють у пунктатах кісткового мозку або селезінки у 95-100 % випадків, а в пунктатах лімфатичних вузлів – у 40-75 %. Іноді паразитів можна побачити і в мазках крові (при індійському вісцеральномулейшманіозімайжезавжди). Ухворихнашкірнуіслизовуформилейшманіозувкровізбудниківпрактичноневиявляють; умазкахізвиразокіуражених тканин їх також мало. Тому необхідно повторювати дослідження декілька разів.
Безджгутикові форми лейшманій (амастиготи) розташовуються переважно в цитоплазмі гістофагоцитарних клітин. При виготовленні мазків ці клітини часто руйнуютьсяіпаразитиможутьзнаходитисьіпозаклітинами. Вонимаютькулясту або овальну форму, містять ядро, паличкоподібний кінетопласт, але джгутики відсутні. Наявністьчіткоокресленогоядраікінетопластадозволяєвідрізнитилейшманій від інших утворів, що зустрічаються в мазках (рис. 110).

Розділ 18. Лабораторна діагностика окремих протозоозів |
423 |
|
|
|
|
|
|
|
1 |
2 |
Рис. 110. Leishmania tropica:
1 – безджгутикові форми в макрофагах (а) і позаклітинні (б); 2 – джгутикові форми.
Культуральні й біологічні дослідження. Якщо мікроскопічний метод дає негативні або сумнівні результати, проводять посіви взятих проб на NNN-агар. Одержати культури лейшманій при посівах крові вдається рідко, особливо у хворихнашкірнуформу. Посівиінкубуютьпритемпературі22 °Спротягом2-10 днів, щодня перевіряючи ріст за допомогою мікроскопії колоній під об’єктивом 40× . Для цього виготовляють нативний препарат за методом надавленої краплі. У мазках із культур лейшманії набувають видовженої, веретеноподібної форми, розміри їх досягають 10-20 мкм завдовжки і 5-6 мкм завширшки. Вони обов’язково мають джгутики (промастиготи), часто розміщуються клубками (рис. 116). Якщо протягом 40 днів збудник не виявлено, видають негативний результат, але це не дає права виключити діагноз лейшманіозу. Лейшманії можна також вирощувати на хоріон-алантоїсній оболонці курячого зародка або в культурі клітин.
Порівняно рідко з діагностичною метою ставлять біологічну пробу. Для цього використовують білих мишей, ховрахів, золотистих хом’ячків. Тварин заражують внутрішньовенно або внутрішньоочеревинно пунктатами кісткового мозку, лімфатичних вузлів, рідше кров’ю хворих.
Серологічнідослідженняшироковикористовуютьдляпроведенняепідеміологічних обстежень населення в ендемічних регіонах, але для практичної діагностики захворювання вони мають допоміжне значення. Найчастіше ставлять реакції непрямої гемаглютинації з еритроцитарним діагностикумом, зв’язування комплементу та імунофлуоресценції. В якості антигену для них використовують 15-30-денні культури L. donovani. Однак всі ці реакції недостатньо специфічні й можуть давати позитивний результат при трипаносомозах.
Останнімчасомдлядіагностикивісцеральноголейшманіозурозробленатестсистема для проведення імуноферментного аналізу, в якій антигеном служить нерозведений екстракт із культурL. donovani. Метод ІФА виявився більш чутливим, специфічниміекономічним, ніжнавітьнепрямареакціяімунофлуоресценції. Діагностичний титр становить 1:400 і більше.
Алергічна проба. З метою ретроспективної діагностики, а також при масовихепідеміологічних обстеженнях населення ендемічних регіонівширокопроводять постановку внутрішньошкірної проби злейшманіном (реакція Монтенегро).
424 |
Частина VІ. Протозойні інфекції |
Антигеном для неї служить поверхнева рідина або суспензія лейшманій, убитих нагріванням чи формаліном. Його вводять в об’ємі 0,1-0,2 мл. При позитивній реакції через 6-10 год на місці ін’єкції виникає гіперемія, набряк та інфільтрація. Максимум реакції настає через 48 год.
Амебіаз
Амебіаз (син.: амебна дизентерія) – протозойна інфекційна хвороба, що характеризується виразковим ураженням товстого кишечника, схильністю до рецидивуючого перебігу і позакишковими ускладненнями (абсцеси легень, печінки, головного мозку).
Збудник захворювання – Entamoeba histolytica – належить до класу саркодових. В організмі людини патогенна амеба може існувати у 4-х формах:
1.Велика вегетативна або тканинна форма (forma magna) має розмір 3060 мкм, швидко пересувається за допомогою псевдоподій і здатна фагоцитувати еритроцити. Вонамаєкруглеядро, якеусвіжихнативнихпрепаратахвидимелише при фазово-контрастній мікроскопії. Здатність фагоцитуватиєхарактерною ознакою, що дає змогу відрізнити її від інших видів амеб кишечника.
2.Малавегетативнаабопросвітнаформа(forma minuta) маєрозмір15-25 мкм, яка фагоцитує бактерії та гриби і не пожирає еритроцити.
3.Вегетативна предцистна форма (forma praecystica) має ромір 10-20 мкм. Включення (мікроорганізми, еритроцити) в цитоплазмі відсутні.
4.Цистна форма (forma cystica) має правильну кулясту форму, розміром
8-15 мкм, не містить бактерій та інших харчових включень.
Основним джерелом інфекції є хворі на гостру і хронічну форму амебіазу, реконвалесценти та носії. Виділення цист може продовжуватись роками. Одна людина може щодоби виділяти близько 500 млн цист. Механізм зараження – фе- кально-оральний, цисти потрапляють в організм здорової людини разом із питною некип’яченою водою, харчовими продуктами, через брудні руки і предмети вжитку.
Длялабораторноїдіагностикиамебіазу використовуютьмікроскопічні, культуральні, біологічні та серологічні дослідження. Матеріалом для мікробіологічного аналізу служать випорожнення, аспірати й біоптати, отримані при колонофіброскопії та ректороманоскопії, харкотиння, гній з уражених органів, кров для серологічних реакцій. При пересилці випорожнень до лабораторії, в якості консерванта використовують полівініловий спирт.
Мікроскопічне дослідження. Вирішальним у діагностиці амебіазу є дані паразитологічних досліджень. Великі тканинні форми з еритроцитами є патогномонічною ознакою гістолітичної амеби. Дуже важливим є також знаходження характерних чотириядерних цист.
Мікроскопують 5-6 препаратів “надавленої краплі” із свіжовиділеного калу (непізніше10 хвпіслявипорожнення), атакож мазки, забарвленірозчиномЛюголя, сумішшю Сафарлієва або залізним гематоксиліном за Гейденгайном.
Розділ 18. Лабораторна діагностика окремих протозоозів |
425 |
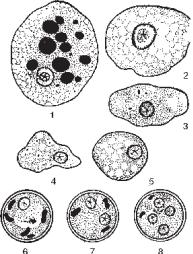
Унативнихпрепаратахтканиннаформадизентерійноїамебимаєвиглядвеликих клітин, що активно рухаються. Ендоплазма і ектоплазма різко відрізняються між собою. Ендоплазма темніша, зерниста, в ній розташовані вакуолі з фагоцитованими еритроцитами або без них та мало помітне ядро, яке краще виявляється підфазово-контрастниммікроскопом. Ектоплазмабільшсвітлайпрозора, нерівномірної товщини. Малапросвітна форма менших розмірівмає такий самийвигляд, алебезфагоцитованихеритроцитів. Інколивцитоплазміможнавиявитиневелику кількість бактерій та грибів. Це основна форма існування гістолітичної амеби, яку виявляють при хронічному амебіазі або у реконвалесцентів. При гострому перебігу хвороби та у носіїв її не знаходять. Цисти в нативних препаратах мають вигляд блискучих світлозаломлюючих кульок, розміром 8-15 мкм, їх внутрішній вміст мало помітний.
При використанні консерванта Сафарлієва цитоплазма дизентерійної амеби забарвлюється в голубий колір, ядро – в інтенсивно-синій, харчові й глікогенові вакуолі залишаються безбарвними. Цей метод дозволяє відрізнити E. histolytica від Entamoeba coli, у якої каріолема розташована ексцентрично, а грудочки хроматину різні за величиною.
У мазках, забарвлених за Гейденгайном, великі тканинні форми гістолітичної амеби чітко видимі на фоні багатьох еритроцитів, поодиноких лейкоцитів та бактерій. Цитоплазма амеби має чіткий поділ на світлу гомогенну безбарвну ектоплазму і темну дрібнозернисту ендоплазму темно-сірого кольору, в якій видно забарвлені в чорний колір еритроцити. Вони мають різну величину і форму залежно від ступеня їх перетравлення. В ендоплазмі амеби видно ядро розміром
3-5 мкмзтонкоюоболонкою, підякоюзнаходять- |
|
|
сядрібнізернапериферійногохроматину. Центр |
|
|
ядразаймаєп’ятикутнакаріосома, такожзабарв- |
|
|
лена в чорний колір (рис. 111). У мазках можуть |
|
|
зустрічатисьдегенеративнозміненіамеби, вяких |
|
|
видно інтенсивну вакуолізацію цитоплазми і |
|
|
пікноз ядра. |
|
|
Цисти дизентерійних амеб мають правиль- |
|
|
ну круглу форму, рідше – овальну, з гладенькою |
|
|
двоконтурною оболонкою. У цитоплазмі цист |
|
|
зрілого віку видно 4 ядра, у незрілих – 1-2 ядра. |
|
|
Під оболонкою ядер знаходяться серпоподібні |
|
|
зернахроматину, вцентрі– каріосома. Унезрілих |
|
|
цистможнавиявитивакуолі, щомістятьглікоген. |
|
|
При забарвленні розчином Люголя великі |
|
|
тканинні й просвітні форми мають типову мор- |
Рис. 111. Різні форми дизентерійної |
|
фологічну структуру, але втрачають рухливість. |
||
Цисти мають форму кілець із п’ятикутною карі- |
амеби: E. histolytica f. magna |
|
з еритроцитами (1) і без них (2); |
||
осомою в центрі. Незрілі цисти мають краплю |
||
E. histolytica f. minuta (3-5); одно-, |
||
глікогену, що фарбується в червоний колір. |
дво- і чотириядерні цисти (6-8). |
426 |
Частина VІ. Протозойні інфекції |
Методика мікроскопічного дослідження слизу, гною, біоптатів, харкотиння така сама, як і при мікроскопії випорожнень, але позитивні результати отримати важко.
Культуральні й біологічні дослідження. Якщо виявити гістолітичні амеби при мікроскопії нативних і пофарбованих препаратів не вдається, роблять посіви досліджуваного матеріалу на середовищеРобінзонаабоПавлової, до складу яких входить печінковий екстракт, виділяють та ідентифікують чисті культури. Але такий паразитологічний методпрактичні лабораторії використовують дуже рідко.
У деяких випадках можна застосовувати постановку біологічної проби. Досліджуваним матеріалом заражають кошенят, хом’ячків та інших лабораторних тварин. Так, при введенні випорожнень хворих, що містять дизентерійні амеби, у прямукишку кошенят, унихрозвивається геморагічний коліт. Уфекаліях заражених тварин збудника легко виявити при мікроскопії нативних препаратів.
Серологічні дослідження при амебіазі також проводять рідко, здебільшого для діагностики його позакишкових форм. При цьому використовують реакції непрямоїгемаглютинаціїзантигеноміззруйнованихультразвукомдизентерійних амеб, латекс-аглютинації, зв’язуваннякомплементу, непрямоїімунофлуоресценції, зустрічного імуноелекрофорезу та метод ІФА. Серологічні реакції випадають позитивними у 60-70 % хворих на кишковий амебіаз і в 90-95 % – при амебному абсцесі печінки, легень чи головного мозку.
Балантидіаз
Балантидіаз(син.: інфузорна дизентерія) – інфекційна протозойна хвороба, що характеризується гарячкою, болями в животі, проносом, виразковим ураженням товстої кишки і значним схудненням.
Збудник– Balantidium coli – належитьдородиниBursayidae, типуCiliophora.
Це найбільший за розміром представник найпростіших (до 500 мкм), що паразитують в організмі людини. Його легко виявити під малим збільшенням мікроскопа. Тіло балантидії несиметричне, має овальну форму, вкрите війками. Передній кінець дещо загострений, задній – більш овальний. Спереду і трохи збоку знаходиться ротова щілина (цистосом), позаду – анальна пора (цитопрокт). Розрізняють 2 форми балантидій – вегетативну і цистну.
Джерелом інфекції є інвазована людина, а також домашні та дикі свині, біля 80 % яких містять у кишечнику непатогенні для них балантидії. Спосіб інфікування фекально-оральний, найчастіше через воду, грунт, гній, предмети догляду за тваринами.
Лабораторна діагностика балантидіазу базується на мікроскопічному дослідженнісвіжихвипорожнень. Вегетативніформипаразитапрактичнозавждиможна виявити в рідких, а цисти (рідше) в оформлених випорожненнях. Краще всього матеріал для дослідження брати при сигмоїдоскопії або ректороманоскопії.
Мікроскопічнедослідження. Свіжіфекаліїабослизрозводятьтеплимізотонічним розчином хлориду натрію, виготовляють препарат надавленої або висячої

Розділ 18. Лабораторна діагностика окремих протозоозів |
427 |
|
краплі й розглядають спочатку під малим, а |
|
|
потім під середнім збільшенням мікроскопа, |
|
|
використовуючинагрівальнийстолик. Віндає |
|
|
змогутривалийчасспостерігатишвидкийрух |
|
|
балантидіїв. Змінюючиінтенсивністьосвітлен- |
|
|
ня, можна побачити миготливі війки, органо- |
|
|
їди живлення і виділення. Ядро живих пара- |
|
|
зитів залишається непомітним. У травних ва- |
|
|
куоляхіендоплазмівиднобагатоеритроцитів, |
Рис. 112. Balantidium coli. |
|
грибів, бактерій та зерен крохмалю (рис. 112). |
||
Вегетативна форма. |
||
Якщо в нативних препаратах не виявля- |
|
ють живих паразитів, досліджують забарвлені. Для фарбування використовують слабкі розчини (1:1000-1:10000) метиленового синього або нейтрального червоного. При цьому балантидії не сприймають барвник і стають чітко видимими на голубому чи рожевому фоні вмісту кишечника.
Для забарвлення мертвих балантидіїв у фіксованих мазках краще всього використовуватизалізнийгематоксилінздодаваннямфуксинуабокарміну. Прицьому стають добре видимі ряди війок, чорного кольору ядро, травні вакуолі з еритроцитами, мікроорганізмами та іншими клітинами.
Цисти в кишечнику людини утворюються рідко. Щоб їх виявити, потрібно взяти невеличку частинку фекалій або слизу і проемульгувати їх на предметному склі в краплі розчину Люголя, накрити покрівним скельцем, витримати 5-10 хв і мікроскопувати. Цисти мають кулясту або овальну форму, діаметром 40-60 мкм, жовто-коричневого кольору з двоконтурною оболонкою. При забарвленні гематоксиліном всередині цист добре видно бобоподібне ядро чорного кольору. Однак, останнімчасомвиявленнюцистненадаютьвеликогодіагностичногозначення.
B. coli можна культивувати in vitro в різних середовищах для найпростіших. Зокрема, добрірезультатиотримуютьприпосівіфекалійнасередовищеРіса(МПБ, розведений 1:5 ізотонічним розчином хлориду натрію, до якого додають кінську сироватку і рисовий відвар). Додавання до середовища антибіотиків пригнічує розвиток супутньої мікрофлори і дає змогу надійніше виділяти чисті культури балантидіїв. Однакупрактичнихлабораторіяхздіагностичноюметоючистікультури виділяють дуже рідко.
Серологічні дослідження і алергічні проби також не проводять.
Лямбліоз
Лямбліоз (син.: гіардіоз) – протозойна інфекційна хвороба, що характеризується ураженням верхнього відділу тонкої кишки (дуоденіт) і жовчного міхура (холецистит). У більшості людей лямбліозна інвазія має безсимптомний перебіг або супроводжується лише дисфункцією кишечника. Збудником захворювання є
Lamblia intestinalis (Giardia intestinalis) з родини Hexamitidae, класу Zoomastigophora.

428 |
Частина VІ. Протозойні інфекції |
Джерелом зараження є хворі люди або паразитоносії. В організмі людини лямблії розмножуються у величезній кількості. Протягом доби одналюдинаможе виділити з випорожненнями до 18 млрд цист цього збудника. Лямбліоз зустрічається повсюдно. L. intestinalis виявляють у 10-12 % дорослих людей і у 50-80 % дітей дошкільного віку.
Механізмінвазії– фекально-оральний, факторамипередачієвода, їжа, іграшки, предмети вжитку, забруднені руки. Інвазивні лише цисти лямблій, які досить стійкі у зовнішньому середовищі.
Матеріаломдляпроведеннялабораторноїдіагностикиєвипорожненняідуоденальний вміст, отриманий при зондуванні, кров для серологічних реакцій.
Мікроскопічнедослідження. Іздоставленихпробвиготовляютьнативніпрепарати надавленої краплі й мазки для забарвлення. Діагноз ставиться при виявленні вегетативних форм лямблій у дуоденальному вмісті або рідких випорожненнях, а також цист у оформлених фекаліях.
У нативних препаратах вегетативна форма лямблій виглядає плоскою, грушоподібною, з переднім заокругленим і заднім вузьким, загостреним краєм, загнутим у бік дорзальної поверхні. Паразит має білатеральну симетрію, його розміри в довжину 18-28 мкм, ширина у верхній частині тіла – 8-12 мкм. Спереду на черевній стороні знаходиться світла, округла заглибина – присмоктуючий диск (рис. 113). Це своєрідний присосок, за допомогою якого лямблія присмоктується до ентероцитів слизової оболонки кишечника.
У надавленій краплі можна спостерігати досить характерний коливальний або танцювальний рух, що нагадує політ листка, що падає.
Крім вегетативних форм лямблій у препаратах і мазках виявляють також цисти. Вони мають правильну овальну форму. Розміри цист становлять 8-17 мкм у довжину і 4-8 мкм у ширину.
При забарвленні мазків залізним гематоксиліном за Гайденгайном у лямблій легковиявитидваокруглихядраічотирипариджгутиків: однапара відходитьвід заднього кінця тіла, решта – спереду, з боків і знизу. Від базальних тілець, що розташовані поблизу ядер, відходять дві паралельні нитки – аксостилі. На межі між передньою і середньою частиною лямблій розташовані одне-два парабазальних тіла, які мають трикутну або серпоподібну форму.
Цистилямблій, забарвленірозчиномЛюголя, маютьжовто-коричневийколір, правильну овальну форму, гладеньку тонку двоконтурну оболонку. Біля переднього кінця цистрозташованіслабоконтурованіядра– два в незрілих і чотири – в зрілих цистах. Всередині цитоплазми можна виявити скручені джгутики. Більш демонстративно виглядають цистивмазках, забарвленихзалізнимгематоксиліном. Ядра мають вигляд очок із темними центральними каріосомами, оточеними світлим незабарвленим обідком.
Розділ 18. Лабораторна діагностика окремих протозоозів |
429 |
Лямблії можна виростити на штучних живильних середовищах, до складу яких додають екстракти дріжджоподібних грибів, але культуральний метод діагностики захворювання не проводять.
Дуже рідко з діагностичною метою використовують серологічні дослідження, восновному, реакціїнепрямоїгемаглютинаціїтанепрямоїімунофлуоресценції. Титри протилямбліозних антитіл випадають більшими при клінічно добре вираженому перебігу захворювання. Були також запропоновані алергічні внутрішньошкірні проби, але й вони не набули широкого використання.
Отже, основним методом лабораторної діагностики лямбліозу і паразитоносійства цих найпростіших є мікроскопічне дослідження дуоденального вмісту і випорожнень.
Трихомоноз
Трихомоноз(трихомоніаз) – протозойна, виключноантропонозна, хронічна хвороба урогенітального тракту, що найчастіше передається статевим шляхом. Ужінок уражаються піхва, уретра, шийка матки, вульва, рідко – пряма кишка; у чоловіків – уретра, передміхурова залоза, придатки яєчок. Захворювання викли-
кає Trichomonas vaginalis із родини Trichomonadidae класу Zoomastigophora. В
організмілюдинипаразитують ще двавидитрихомонад: T. tenax – коменсал ротової порожнини і T. intestinalis – мешканець тонкого і товстого кишечника. Ротова ікишечнатрихомонадидужерідкоспричиняютьзапальніпроцеси, переважнопри дисбактеріозах. НайбільшезначеннявпатологіїлюдинивідіграєT. vaginalis. Джерелом інфекції є хворі люди або безсимптомні носії трихомонад. Захворювання найчастіше зустрічається у жінок дітородного віку.
Матеріалом для лабораторного дослідження на трихомоноз у жінок служать виділення з вагіни (особливо заднього склепіння), каналу шийки матки, уретри і парауретральних ходів. Його беруть за допомогоюложечки Фолькмана, жолобкуватого зонда або катетера. Найчастіше трихомонади виявляють у передменструальний період або в перші дні після закінчення менструацій.
Учоловіківдосліджуютьзскрібкизуретриабовиділенняпіслямасажупередньої уретри, сік простати, отриманий після її масажу, сперму та осад сечі після центрифугування. Дослідженняпроводятьнепізніше, ніжчерезгодинупіслявзяття матеріалу. Виконують мікроскопічні й культуральні дослідження.
Метод мікроскопії. Вагінальні трихомонади легко виявляють при вивченні якнативних, такізабарвлених препаратів. Нативниймазок виготовляють шляхом внесення клінічного матеріалу в краплю теплого ізотонічного розчину хлориду натрію на підігрітому предметному склі. Суміш накривають покрівним скельцем і досліджують під мікроскопом (об’єктив 40× , окуляр 10× ). Особливо результативна фазово-контрастна мікроскопія, яка дає змогу спостерігати коливальний, обертовий та поштовхоподібний рух живих трихомонад. У нативному препараті T. vaginalis має грушоподібну, округлу або овальну форму з середнім розміром 13-20 мкм, інколи до 30 мкм (вдвічі більша за лейкоцит). Кількість джгутиків –

430 Частина VІ. Протозойні інфекції
|
чотири, один з них проходить |
|
|
уздовж тіла, утворюючи разом |
|
|
із складкою плазмолеми унду- |
|
|
люючу мембрану. Вона корот- |
|
|
ша за довжину тіла, тоді як у |
|
|
T. intestinalis – значно довша і |
|
|
закінчується вільним джгути- |
|
|
ком(рис. 114). Трихомонадине |
|
Рис. 114. Трихомонади людини: |
утворюють цист. |
|
Для виготовлення забарв- |
||
1 – піхвова; 2 – кишкова; 3 – ротова. |
||
лених препаратів з клінічного |
||
|
матеріалу готують тонкі мазки, висушують на повітрі, фіксують етанолом, метанолом або сумішшю Никифорова й фарбують за методом Романовського-Гімзи, Грама або метиленовим синім. Після забарвлення 5 % розчином азур-еозину протягом 60 хв цитоплазма джгутиків та ундулююча мембрана видимі дуже чітко. Ядро фарбується у темно-фіолетовий колір. Воно, як правило, розташоване ексцентрично, маєподовжену, часто ромбоподібнуформу(кісточкасливи). Цеодназ основних ознак трихомонад, розташованих всередині епітеліальних клітин. Спереду від ядра розміщені блефаропласти, від яких беруть початок джгутики, ундулююча мембрана і аксостиль, що трохи виступає на задньому кінці тіла.
При фарбуванні за методом Грама мазок має оранжево-червоне забарвлення на тонких місцях мазка і темно-фіолетове – на товстих. Вагінальні трихомонади забарвлюються блідо. Оболонка їх має вигляд тонкої смужки, сітчаста цитоплазма набуває оранжево-червоного кольору, ядро – фіолетового. Джгутики та ундулююча мембрана не помітні.
При забарвленні метиленовим синім продовгувате ядро трихомонад набуває темно-синього кольору. Добре проглядається пінистість голубої цитоплазми. На поверхні епітеліальних клітин видно велику кількість лейкоцитів.
Негативні результати мікроскопічного дослідження не слід оцінювати як остаточні. Обстеження необхідно повторити через 2-3 тижні.
Метод виділення культур. Клінічний матеріал сіють у спеціальне рідке середовище, яке містить гідролізат казеїну, дріжджовий автолізат, сироватку коней, мальтозу, солі натрію, калію, кальцію, пеніцилін і стрептоміцин (по 1000 ОД/мл). Перед посівом середовище заливають вазеліновим маслом. Через 3-5 днів після інкубації посівів при 35-37 °С проглядають пробірки на виявлення росту. Піхвові трихомонади на цьому середовищі дають придонний ріст з утворенням компактного білого осаду. Взятий пастерівською піпеткою осад досліджують мікроскопічно в препараті надавленої краплі. Трихомонади в полі зору можуть розміщуватись поодинці або великими скупченнями. Вони активно рухаються.
При негативному результаті посіви витримують у термостаті 9-17 діб, перевіряючи наявність росту мікроскопічно.
Культуральний метод особливо цінний при діагностиці трихомонозу у чоловіків, а також для перевірки ефективності проведеного лікування.
