
- •1.Які елементи називаються біогенними елементами?
- •9.Яка реакція середовища у водному розчині ch3cooNa? Відповідь аргументувати.
- •10.Яка реакція середовища у водному розчині Na3po4? Відповідь аргументувати.
- •11. Яка реакція середовища у водному розчині ZnSo₄? Відповідь аргументуйте.
- •12. Яка реакція середовища у водному розчині (ch₃coo)₂Mg? Відповідь аргументуйте.
- •13. Яка реакція середовища у водному розчині nh₄Cl? Відповідь аргументуйте.
- •14. Яка реакція середовища у водному розчині k₂co₃? Відповідь аргументуйте.
- •15. Яка реакція середовища у водному розчині Fe(no₃)₂? Відповідь аргументуйте.
- •16. Яка реакція середовища у водному розчині AlCl₃? Відповідь аргументуйте.
- •17. Яка реакція середовища у водному розчині Na₂s? Відповідь аргументуйте.
- •18.Де краще розчиняється кисень: у воді чи у крові? Відповідь аргументуйте.
- •46.Що таке водневий показник? За якою формулою його обчислюють?
46.Що таке водневий показник? За якою формулою його обчислюють?
Водневий показник(рН) – кількісна характеристика кислотності середовища, що дорівнює від’ємному десятковому логарифму активної концентрації вільних іонів гідрогену в розчині.
рН = - lg[H⁺]
47.Що таке йонний добуток води? Чому він дорівнює при кімнатній температурі?
Йонний добуток води(К(Н₂О)) – добуток рівноважних молярних концентрацій іонів Н⁺ і ОН⁻ і є сталою величиною.
К(Н₂О)
= [Н⁺]
· [ОН⁻]
= 10⁻¹⁴
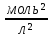 (залежить лише від температури)
(залежить лише від температури)
48.Чому дорівнює рН артеріальної крові? рН венозної крові?
рН артеріальної крові = 7,37-7,43; рН венозної крові = 7,34
49.Що таке ацидоз? алкалоз?
Ацидоз - підвищена кислотність крові, шлункового соку та тканин організму внаслідок зміни кислотно-лужної рівноваги.рН↓
Алкалоз – підвищена основність крові, шлункового соку та тканин організму внаслідок зміни кислотно-лужної рівноваги. рН↑
50.Що таке процес титрування?
Титрування – процес поступового додавання робочого розчину до проби з метою встановлення точного об’єму розчину титранту, витраченого на реакцію з аналітом.
51.Що таке аналіт? Робочий розчин?
Робочий розчин(титрований, стандартний) – розчин реагенту, молярна концентрація еквіваленту якого встановлена з великою точністю.
Аналіт – розчин, в якому визначають молярну концентрацію еквівалента речовини, називають пробою.
52.Який закон лежить в основі титриметричних розрахунків? Навести математичний вираз цього закону.
Обчислення в об’ємному аналізі ґрунтуються на законі еквівалентів: «Маси речовин, що вступили в реакцію, пропорційні молярним масам еквівалентів цих речовин»
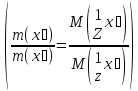
53.Яка реакція лежить в основі методу кислотно-основного титрування?
H⁺+OH⁻=H₂O
54.Які робочі розчини використовують в методі кислотно-основного титрування?
Розчини сильних кислот H₂SO₄,HClта лугів NaOH,KOH. Вихідними речовинами для сильних кислот є: Na₂B₄O₇ · 10H₂O; Na₂CO₃; для лугів: H₂C₂O₄ · 2H₂O
55.Що таке точка еквівалентності?
Точка еквівалентності – момент (стан), при титруванні, коли кількість речовини доданого титрованого розчину хімічно еквівалентна кількості речовини, що титрується.
56.Як визначають точку еквівалентності?
У цей момент змінюється забарвлення або утворюється осад. Якщо вихідні речовини безбарвні то застосовують індикатор. У цей момент без додаткових специфічних умов можна помітити ці зміни.
57.Що таке кислотно-основні індикатори?
Кислотно-основні індикатори – це індикатори, які використовують у методі нейтралізації , і є органічними речовинами, що мають властивості слабких кислот або основ, у яких недиссоційовані молекули та іони, що утворюються при дисоціації цих молекул, мають різне забарвлення.
58.Що таке інтервал переходу індикатору?
Інтервал переходу індикатора – проміжок рН, в якому стає помітною для очей зміна забарвлення індикатора
59.Чому дорівнює інтервал переходу фенолфталеїну? Метилового червоного?
Інтервал переходу фенолфталеїну - рН 8,2-9,8; інтервал переходу метилового червоного рН 4,2-6,2;
60.Чому приблизно дорівнює інтервал переходу індикатору?
рН = рК ± 1, а середина інтервалу рН=рК
61.Що таке крива титрування?
Крива титрування – графічне зображення зміни рН розчину в процесі його титрування.
62.Що таке стрибок титрування?
Стрибок титрування – різка зміна рН розчину, що спостерігається поблизу точки еквівалентності, тобто в кінці титрування.
63.Як за допомогою кривої титрування підбирають індикатор?
Обирають індикатор за допомогою кривої титрування. Для цього на графік кривої титрування наносять інтервал переходу індикатора. У правильно обраного індикатора інтервал переходу повністю або частково перекривається стрибком титрування. Якщо такого перекривання немає, індикатор для даного титрування не підходить.
64.За якою формулою можна розрахувати молярну концентрацію еквівалента аналіту?
с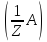 =
=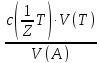
65.За якою формулою можна розрахувати масу аналіту?
m(A)=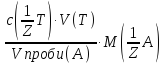 · Vзаг.(A)
· Vзаг.(A)
Якщо
Vзаг.(A)=Vпроби(A):
m(A)=
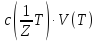 ·
·
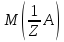
66.Який робочий розчин необхідно взяти для титрування розчину NaOH? За якою формулою можна розрахувати масу NaOH за результатами титрування?
NaOH + HCl → NaCl + H₂O
m(NaOH)=c(HCl) ·V(HCl) · M(NaOH)
67.Який робочий розчин необхідно взяти для титрування розчину NaOH? За якою формулою можна розрахувати молярну концентрацію еквіваленту NaOH за даними титрування?
NaOH+HCl→NaCl+H₂O
c(NaOH)
=
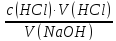
68.Який робочий розчин необхідно взяти для титрування розчину КOH за результатами титрування? За якою формулою можна розрахувати масу КOH за результатами титрування?
KOH + HCl → KCl + H₂O
m(KOH)=c(HCl) ·V(HCl) · M(KOH)
69.Який робочий розчин необхідно взяти для титрування розчину КOH? За якою формулою можна розрахувати молярну концентрацію еквіваленту КOH за даними титрування?
KOH + HCl → KCl + H₂O
c(KOH)
=
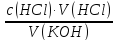
70.Який робочий розчин необхідно взяти для титрування водного розчину NH₃? За якою формулою можна розрахувати масу NH₃ за результатами титрування?
NH₃ + HCl → NH₄Cl
m(NH₃)=c(HCl) ·V(HCl) · M(NH₃)
71.Який робочий розчин необхідно взяти для титрування водного розчину NH₃? За якою формулою можна розрахувати молярну концентрацію еквіваленту NH₃ за даними титрування?
NH₃ + HCl → NH₄Cl
c(NH₃)
=
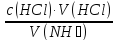
72.Який робочий розчин необхідно взяти для титрування розчину HCl? За якою формулою можна розрахувати масу HCl за результатами титрування?
HCl+KOH → KCl + H₂O
m(HCl)=c(KOH) ·V(KOH) · M(HCl)
73.Який робочий розчин необхідно взяти для титрування розчину HCl?За якою формулою можна обчислити молярну концентрацію еквіваленту HCl за даними титрування?
HCl+KOH → KCl + H₂O
c(HCl)
=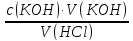
74.Який робочий розчин необхідно взяти для титрування розчину H₂SO₄? За якою формулою можна розрахувати масу H₂SO₄ за результатами титрування?
H₂SO₄ + 2NaOH→Na₂SO₄ + 2H₂O
m(H₂SO₄)=
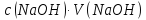 ·
·
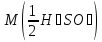
75.Який робочий розчин необхідно взяти для титрування розчину H₂SO₄? За якою формулою можна розрахувати молярну концентрацію еквіваленту H₂SO₄ за даними титрування?
H₂SO₄ + 2NaOH→Na₂SO₄ + 2H₂O
с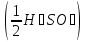 =
=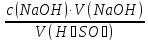
76.Який робочий розчин необхідно взяти для титрування розчину CH₃COOH? За якою формулою можна розрахувати масу CH₃COOH за результатами титрування?
CH₃COOH+NaOH→CH₃COONa+H₂O
m(CH₃COOH)=
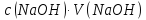 ·
·
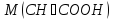
77.Який робочий розчин необхідно взяти для титрування розчину CH₃COOH? За якою формулою можна розрахувати молярну концентрацію еквівалента CH₃COOH за даними титрування?
CH₃COOH+NaOH→CH₃COONa+H₂O
c(CH₃COOH)
=
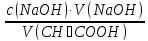
78.Що таке буферна система (буфер)?
Буферна система – розчини, які мають властивість зберігати сталість рН при розведенні і протидіяти зміні рН при додаванні помірних кількостей сильної кислоти або лугу.
79.З яких компонентів складається кислотний буфер? Навести приклад кислотного буферу.
Кислотний буферний розчин містить слабку кислоту та сіль, утворену цією кислотою і сильною основою.
Н₂СО₃, Na₂CO₃;
80.З яких компонентів складається основний буфер? Навести приклад основного буферу.
Основний буферний розчин містить слабку основу та сіль, утворену цією основою та сильною кислотою.
NH₃ ·H₂O,NH₄Cl;
81.Від чого залежить рН буферу?
Значення рН залежить від величини константи дисоціації слабкої кислоти(основи) та співвідношення концентрацій солі і кислоти(основи).
32.Написати рівняння Гендерсона-Гассельбаха для рН кислотного буферу?
pH = pKd + lg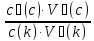
83. Написати рівняння Гендерсона-Гассельбаха для рН основного буферу?
pH = 14 – [
pKd + lg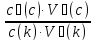 ]
]
84.Що таке буферна ємність?
Буферна ємність – кількість молей еквіваленту сильної кислоти або сильної основи, яку потрібно додати до одного літра буферного розчину, щоб змінити його рН на одиницю.
85.За яких умов буфер має максимальну ємність?
Найбільша величина буферної ємності досягається, якщо компоненти буферної суміші мають однакові концентрації, тоді рН=рК
86.З яких компонентів складається фосфатний буфер?
Na₂HPO₄,NaH₂PO₄;
87.З яких компонентів складається ацетатний буфер?
CH₃COONa,CH₃COOH;
88.З яких компонентів складається амонійний буфер?
NH₃ ·H₂O,NH₄Cl;
89.З яких компонентів складається гідрокарбонатний буфер?
Н₂СО₃, Na₂CO₃;
90.Які буферні системи підтримують рН крові?
Гемоглобінова, бікарбонатна, фосфатна, білкова буферні системи підтримують рН крові.
91.Який з компонентів фосфатного буферу вступає в реакцію при додаванні НСl?
NaH₂PO₄ →H₂PO₄⁻ +Na⁺
Na₂HPO₄ → 2Na⁺ + HPO₄²⁻
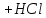
HCl → H⁺ + Cl⁻
Na₂HPO₄ + HCl → NaH₂PO₄ + NaCl
HPO₄²⁻ + H⁺ → H₂PO₄
92.Який з компонентів ацетатного буферу вступає в реакцію при додаванні НСl?
CH₃COOH ↔ CH₃COO⁻ + H⁺
CH₃COONa ↔CH₃COO⁻ + Na⁺
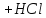
HCl → H⁺ + Cl⁻
CH₃COONa + HCl = CH₃COOH + NaCl
CH₃COO⁻ + H⁺ = CH₃COOH
93.Який з компонентів амонійного буферу вступає в реакцію при додаванні НСl?
NH₃ · H₂O ↔ NH₄⁺ + OH⁻
NH₄Cl → NH₄⁺ + Cl⁻
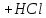
HCl → H⁺ + Cl⁻
NH₃ · H₂O + HCl = NH₄Cl + H₂O
NH₃ · H₂O + H⁺ ↔ NH₄⁺ + H₂O
94.Який з компонентів гідрокарбонатного буферу вступає в реакцію при додаванні НСl?
CO₂ · H₂O ↔ H⁺ + HCO₃⁻
NaHCO₃ → Na⁺ + HCO₃⁻
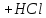
HCl → H⁺ + Cl⁻
NaHCO₃ + HCl = NaCl + CO₂ + H₂O
HCO₃⁻ + H⁺ = CO₂ + H₂O
95.Який з компонентів фосфатного буферу вступає в реакцію при додаванні NaOH?
NaH₂PO₄ → H₂PO₄⁻ + Na⁺
Na₂HPO₄ → 2Na⁺ + HPO₄²⁻
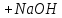
NaOH → Na⁺ + OH⁻
NaH₂PO₄ + NaOH = Na₂HPO₄ + H₂O
H₂PO₄⁻ + OH⁻ = HPO₄²⁻ + H₂O
96.Який з компонентів ацетатного буферу вступає в реакцію при додаванні NaOH?
CH₃COOH ↔ CH₃COO⁻ + H⁺
CH₃COONa ↔CH₃COO⁻ + Na⁺

NaOH → Na⁺ + OH⁻
CH₃COOH + NaOH = CH₃COONa + H₂O
CH₃COOH + OH⁻ = CH₃COO⁻ + H₂O
97.Який з компонентів амонійного буферу вступає в реакцію при додаванні NaOH?
NH₃ ·H₂O↔NH₄⁺ +OH⁻
NH₄Cl→NH₄⁺ +Cl⁻
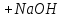
NaOH → Na⁺ + OH⁻
NH₄Cl + NaOH = NH₃ ·H₂O + NaCl
NH₄⁺ + OH⁻ = NH₃ ·H₂O
98.Який з компонентів гідрокарбонатного буферу вступає в реакцію при додаванні NaOH?
CO₂ · H₂O ↔ H⁺ + HCO₃⁻
NaHCO₃ → Na⁺ + HCO₃⁻
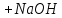
NaOH → Na⁺ + OH⁻
CO₂ · H₂O + NaOH = NaHCO₃ + H₂O
CO₂ · H₂O +H⁺ = HCO₃⁻ + H₂O
99.Які властивості розчинів називаються колігативними?
Колігативними називаються властивості розчинів, що залежать від числа кінетичних одиниць системи(молекул чи іонів). До них відносять зниження пружності насиченої пари розчинника над розчином, підвищення температури кипіння, зниження температури замерзання розчинів, дифузію, осмос та деякі інші властивості.
100.Що таке осмос?
Осмос – це явище, коли 2 розчини різної концентрації, або розчин і розчинник відділені один від одного напівпроникною мембранною перегородкою, яка вільно пропускає молекули розчинника і не пропускає молекули розчиненої речовини. Фактично це напівдифузія молекул розчинника із тієї частини, де його більше в ту частину де його менше.
101.За яким рівнянням розраховують осмотичний тиск розчину?
π =
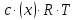
π =
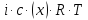 – для електролітів
– для електролітів
102.Які розчини називають ізотонічними?
Ізотонічні розчини – розчини, які мають однаковий осмотичний тиск.
103.Назвіть розчин ізотонічний по відношенню до крові?
Фізіологічний розчин(0,9% водний розчин хлориду натрію)
104.Чому дорівнює осмотичний тиск крові?
π крові =7,6 – 7,7 атм
105.Що таке онкотичний тиск крові?
Онкотичний тиск крові – це частина осмотичного тиску, що створюється білками . В утворенні онкотичного тиску найбільшу роль відіграють низькомолекулярні білки альбуміни – саме від їх вмісту в плазмі залежить, перш за все,рОНкрові. Його нормальна величина складає 25-30 мм рт.ст.
106.Чи будуть ізотонічними водні розчини сахарози та сечовини з однаковою молярною концентрацією розчиненої речовини? Відповідь аргументувати.
107.Який розчин називають гіпертонічним?
Гіпертонічний розчин - це розчин, осмотичний тиск якого вище нормального осмотичного тиску плазми крові або осмотичного тиску в рослинних або тваринних клітинах і тканинах.
108.Який розчин називають гіпотонічним?
Гіпотонічний розчин - це розчин, осмотичний тиск якого нижчий, ніж у плазмі крові, або у клітинах тваринних та рослинних організмів.
109.Яке явище називають гемолізом?
Гемоліз – руйнування еритроцитів крові шляхом розриву їх оболонок з виділенням в навколишнє середовище гемоглобіну.
110.Яке явище називають плазмолізом?
Плазмоліз - відділення протопласту від клітинної стінки при зануренні клітини в гіпертонічний розчин.
111.Що буде спостерігатися(гемоліз чи плазмоліз), якщо еритроцити помістити в гіпертонічний розчин?
Буде спостерігатись явище плазмолізу.
112. Що буде спостерігатися(гемоліз чи плазмоліз), якщо еритроцити помістити в гіпотонічний розчин?
Буде спостерігатись явище гемолізу.
113.Що таке ізотонічний коефіцієнт?
Ізотонічний коефіцієнт – це відношення загального числа частинок(молекул та іонів) розчиненої речовини в розчині до вихідного числа молекул речовини, враховує міжмолекулярні взаємодії в реальних розчинах.
114.Чи будуть ізотонічними водні розчини глюкози та NaCl з однаковою молекулярною концентрацією розчиненої речовини?Відповідь аргументувати.
115. Чи будуть ізотонічними водні розчини CaCl₂ та NaCl з однаковою молекулярною концентрацією розчиненої речовини?Відповідь аргументувати.
116.Чи буде однаковою температура кипіння водних розчинів сахарози та сечовини з однаковою моляльністю? Відповідь аргументувати.
117. Чи буде однаковою температура кипіння водних розчинів сахарози та сечовини в етанолі, якщо їх моляльність однакова? Відповідь аргументувати.
118.Чи буде однаковою температура замерзання водних розчинів глюкози та KCl з однаковою моляльністю? Відповідь аргументувати.
119.Чи буде однаковою температура замерзання водних розчинів глюкози та сечовини з однаковою моляльністю? Відповідь аргументувати.
120.Чи буде однаковою температура замерзання водних розчинів CaCl₂ та NaCl та сечовини з однаковою моляльністю? Відповідь аргументувати.
