
- •Модуль № 2 Частина 2. Мкт агрегатних станів речовини
- •Тема 1. Газоподібний стан речовини. Властивості пари
- •3. Випаровування рідини у герметично закритій посудині
- •4. Вимірювання вологості
- •Тема 2. Рідкий стан речовини
- •1. Характеристика рідкого стану речовини
- •2. Поверхневий шар рідини
- •5. Спостереження явища поверхневого натягу
- •6. Способи визначення коефіцієнта поверхневого натягу
- •3. Внутрішній шар рідини. Поняття про в’язкість середовища
- •Тема 3. Твердий стан речовини
- •2. Ізотропія та анізотропія
- •3. Механічні властивості.
- •2. Класифікація твердих тіл і їх властивості
- •5. Типи кристалів
- •9. Деформація твердих тіл
- •3. Кількісна характеристика деформації.
- •10. Закон пружних деформацій
- •13. Плавлення і кристалізація
- •16. Теплове розширення тіл
Модуль № 2 Частина 2. Мкт агрегатних станів речовини
Фаза – однорідна за хімічним складом і фізичними властивостями деяка частина TДС, відокремлена від інших її частин, що мають інші властивості, межами поділу, на яких відбуваються зміни властивостей.

Існування різноманітних фазових станів у речовини обмовлено так званим агрегатним станом, який визначається тепловим рухом частинок речовини і їх взаємодією.
Агрегатний стан речовини (АСР) – це енергетичний стан її частинок, який визначається співвідношенням кінетичної енергії їх руху і потенціальної енергії їх взаємодії. У залежності від зміни кінетичної і потенціальної енергії частинок речовини відбуваються переходи від однієї її фази до іншої, які супроводжуються стрибкоподібними змінами фізичних властивостей.
Фазові перетворення – переходи речовини з однієї фази в іншу. У термодинаміці розглядають тільки рівноважні фазові переходи, тобто такі перетворення, при яких фізичні властивості речовин змінюються стрибкоподібно, при цьому виділяється або поглинається теплота фазового переходу (наприклад, при пароутворенні, плавленні, сублімації теплота поглинається – Q > 0; при кристалізації, плавленні, десублімації теплота виділяється – Q < 0).

 Газ
Газ![]() >>
>>![]() Рідина
Рідина
Рідина
![]() ≈
≈![]() t↑,Qпар>0
t↓,Qконд<0;
t↓,Qтв<0
t↑,Qпл>0
t↑,Qпар>0
t↓,Qконд<0;
t↓,Qтв<0
t↑,Qпл>0
Тверде тіло
![]() >>
>>![]() t↑,Qсубл>0
t↑,Qсубл>0
Газ Тверде тіло
t↓,Qдесуб<0
Тема 1. Газоподібний стан речовини. Властивості пари
1. Пароутворення – процес перехід рідин у газоподібний стан – пару.
Види пароутворення: випаровування і кипіння
2. Випаровування – пароутворення, яке відбувається з вільної поверхні рідини.
Конденсація – перехід речовини з газового стану у рідкий.
Властивості випаровування і конденсації
Відбувається при будь-якій температурі.
Внаслідок вилітання найшвидших молекул рідина охолоджується (бо зменшується її внутрішня енергія), а пара нагрівається (внутрішня енергія пари збільшується).
Процеси випаровування і конденсації відбуваються одночасно.
При переважанні процесу випаровування над конденсацією рідина охолоджується, а пара нагрівається, при переважанні конденсації над випаровуванням – навпаки: рідина нагрівається, а пара охолоджується.
У відкритій посудині випаровування рідини відбувається доти, поки вся вона не перетвориться на пару.
Швидкість випаровування залежить від:
роду речовини;
температури речовини;
площі вільної поверхні рідини;
зовнішнього тиску і тиску пари над рідиною;
наявності вітру (швидкості віднесення утвореної пари).
3. Випаровування рідини у герметично закритій посудині
Динамічна (рухома) рівновага пари і рідини – це стан, коли процеси випаровування і конденсації зрівноважуються, тобто кількість молекул, які вилетіли з рідини дорівнює кількості молекул, що в неї повернулись.
Насичена пара – це пара, яка перебуває у стані динамічної рівноваги із своєю рідиною (тобто процеси випаровування і конденсації зрівноважені).
Ненасичена пара – це пара без рідини, або пара, яка не досягла насичення (при цьому процес випаровування переважає над конденсацією).
Перенасичена пара– нерівноважний стан пари, коли процес конденсації переважає над процесом випаровування.

пара
рідина
 Nвил >
Nпов
Nвил
= Nпов
Nвил
< Nпов
Nвил >
Nпов
Nвил
= Nпов
Nвил
< Nпов
Ненасичена пара Насичена пара Перенасичена пара
Нерівноважний стан Рівноважний стан Нерівноважний стан
Nвил – кількість молекул, які вилітають з рідини у пару,
Nпов – кількість молекул, які повертаються у рідину з пари.
Властивості ненасиченої пари підлягають усім газовим законам (чим далі від насичення пара, тобто чим менша її конденсація, тим точніше виконується газовий закон). До насиченої пари газові закони не застосовні (бо m ≠ const).
Властивості насиченої пари
Тиск насиченої пари залежить від її виду (р = f (ρ)) і може бути визначений із рівняння стану
![]() (1)
(1)
Згідно p = nkT тиск пари зростає не тільки внаслідок підвищення температури, а й внаслідок збільшення концентрації.
Тиск і густина насиченої пари даного виду є максимальними при даній температурі.
Тиск насиченої пари не залежить від її об’єму (р
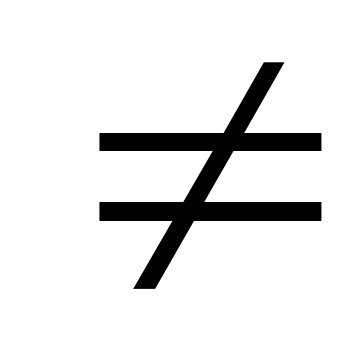 f
(V)).
f
(V)).Концентрація молекул насиченої пари у закритому об’ємі з рідиною завжди встановлюється при даній температурі одна і та сама, незалежно від об’єму, який займає пара (n
 f
(V) = const).
f
(V) = const).При ізотермічному стисканні конденсується рівно стільки насиченої пари, скільки її було у відібраному від пари об’ємі (ρн = сonst при T = const).
Насичену пару можна перевести у ненасичену або ізохорним нагріванням, або ізотермічним розширенням, або одночасно нагріванням і розширенням. Навпаки, ненасичену пару у насичену завжди можна перевести ізохорним охолодженням, або ізотермічним стисканням, або одночасно охолодженням і стисканням.
 р р,
ρ р, ρ
р р,
ρ р, ρ
D газ
рн ркр
пара
А
0 V 0 Ткр Т 0 Ткр Т
Ізотермічне стискання пари: АВ – газ; Залежність тиску Пояснення критичного
ВС – насичена пара+рідина;СD – рідина. пари від температури стану речовини
4. Критичний стан речовини – такий стан речовини, в якому відсутня фізична різниця між рідиною і її парою (ρн = ρр).
Параметри, що описують цей стан, також називають критичними.
Особливості параметрів критичного стану речовини:
Критичний тиск ркр є максимально можливим тиском насиченої пари даної речовини.
Критичний об’єм Vкр є найбільшим об’ємом, який може займати наявна маса речовини у рідкому стані.
При Т > Ткр речовина може існувати тільки у газоподібному стані. У цьому разі ніяким збільшенням тиску не можна перетворити газ на рідину.
При Т < Ткр стисненням газу можна викликати його конденсацію.
Таким чином, визначимо два види газоподібного стану речовини:
газ – це газоподібна фаза речовини при Т > Ткр, яка далека від насичення, у рідину її перетворити не можна.
пара – це газоподібна фаза речовини при Т < Ткр, стисненням перетворюється у рідину.
ρг < ρп [п г < пп].
5 .Кипіння
– пароутворення,
яке відбувається в об’ємі всієї рідини
при сталій температурі tк,
яка називається температурою кипіння.
.Кипіння
– пароутворення,
яке відбувається в об’ємі всієї рідини
при сталій температурі tк,
яка називається температурою кипіння.
Доки не википить вся рідина, ця температура не зміниться.
П
t2<t1
Р
t1
t1
t2
≈ t1
Стикаючись з холодним повітрям, вона конденсується.
У мова
кипіння:
рнас
≥ рзовн.+
ρgh
(2)
мова
кипіння:
рнас
≥ рзовн.+
ρgh
(2)
або (у побуті) рнас ≥ рзовн (3)
Тиск насиченої пари і температура кипіння залежать від зовнішнього тиску: чим більший рзовн., тим вища tк.
Застосування:
Кипіння при високих температурах: автоклави в медицині, харчовій промисловості, хімії, будівельній індустрії; парові двигуни.
Кипіння при низьких температурах: цукрова промисловість (сушарні); у горах частіше смажать, ніж варять (бо tк < 100 0С при низьких тисках і вода не закипає).
6 .Теплота пароутворення
Qп
–
кількість теплоти,
необхідна
.Теплота пароутворення
Qп
–
кількість теплоти,
необхідна
для перетворення рідини на пару при сталій температурі
 Qп
= rm,
(4)
Qп
= rm,
(4)
д е
е![]() (5)
(5)
– питома теплота пароутворення – кількість теплоти, необхідна для перетворення 1 кг рідини на пару при температурі кипіння; залежить від роду речовини і температури.
[r] = Дж/кг.
При однакових зовнішніх умовах і рівних масах однакової речовини теплота пароутворення дорівнює теплоті конденсації.
7. Вологість повітря – вміст водяної пари у повітрі. Її характеристики:
А
 бсолютна
вологість
ρа
– густина,
тобто маса водяної пари, що міститься
за даної температури, в 1м3
повітря
бсолютна
вологість
ρа
– густина,
тобто маса водяної пари, що міститься
за даної температури, в 1м3
повітря
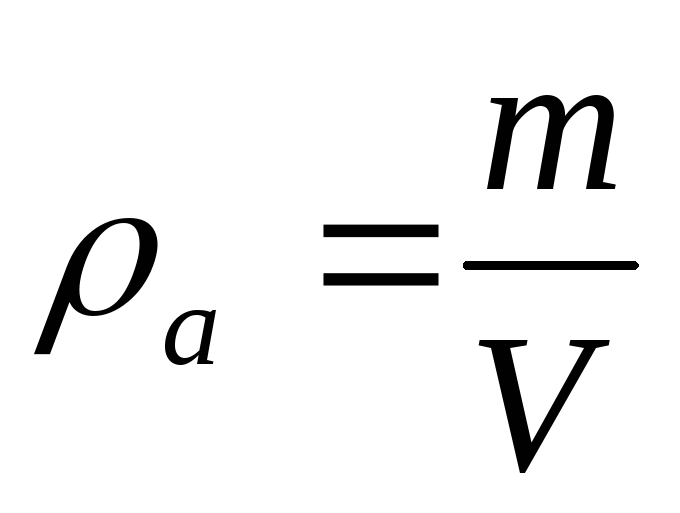 (6)
(6)Парціальний тиск ра – тиск, який чинила б водяна пара, коли б не було інших газів
![]() (7)
(7)
Але за абсолютною вологістю ρа (чи парціальним тиском ра) ще не можна встановити, наскільки повітря сухе чи вологе, бо дана кількість водяної пари може виявитися близькою до насичення (при низьких температурах) і далекою (при високих температурах).
Відносна вологість
Сукупність вологості, тобто характеристику наближення стану пари у повітрі до стадії насичення (при насиченні припиняється випаровування води) показує відносна вологість.
В ідносною
вологістю повітря φ називають величину,
яка вимірюється відношенням абсолютної
вологості до кількості пари, необхідної
для насичення 1 м3
повітря
при тій самій температурі
(виражають
у %)
ідносною
вологістю повітря φ називають величину,
яка вимірюється відношенням абсолютної
вологості до кількості пари, необхідної
для насичення 1 м3
повітря
при тій самій температурі
(виражають
у %)
![]() (8)
(8)
 Оскільки
р
~ ρ,
то
відносною
вологістю повітря називають виражене
в % відношення парціального тиску ра
водяної пари, яка є в повітрі при даній
температурі, до тиску насиченої пари
рн
при
тій самій температурі
Оскільки
р
~ ρ,
то
відносною
вологістю повітря називають виражене
в % відношення парціального тиску ра
водяної пари, яка є в повітрі при даній
температурі, до тиску насиченої пари
рн
при
тій самій температурі
![]() (9)
(9)
 Якщо
кількість молекул пари у повітрі не
змінюється, то при його нагріванні
відносна вологість зменшуватиметься,
а при охолодженні – зростатиме, доки
не досягне значення 100%.
Якщо
кількість молекул пари у повітрі не
змінюється, то при його нагріванні
відносна вологість зменшуватиметься,
а при охолодженні – зростатиме, доки
не досягне значення 100%.
В
А
Якщо пару охолоджувати від t1 (стан А) до tр при сталому тиску, то вона стане насиченою (стан В). За таблицею залежності тиску насиченої пари від температури можна визначити рр (при tр), рн (при t1), а отже і φ.
