
- •История понятия
- •Общее представление Компоненты системы комплемента
- •Основные этапы активации системы комплемента.
- •Биологические функции
- •Активация системы комплемента Классический путь
- •Альтернативный путь
- •Лектиновый (маннозный) путь активации системы комплемента
- •Регуляция системы комплемента
- •Роль системы комплемента при болезнях
- •]Литература
Факторы неспецифической резистентности
Неспецифическая резистентность осуществляется клеточными и гуморальными факторами, тесно взаимодействующими в достижении конечного эффекта - катаболизма чужеродной субстанции: макрофагами, нейтрофилами, комплементом и другими клетками и растворимыми факторами. К гуморальным факторам неспецифической резистентности принадлежат лейкины - вещества, полученные из нейтрофилов, проявляющие бактерицидное действие в отношении ряда бактерий; эритрин - вещество, полученное из эритроцитов, бактерицидное в отношении дифтерийной палочки; лизоцим - фермент, продуцируемый моноцитами, макрофагами, лизирует бактерии; пропердин - белок, обеспечивающий бактерицидные, вируснейтрализующие свойства сыворотки крови; бетта-лизины - бактерицидные факторы сыворотки крови, выделяемые тромбоцитами. Факторами неспецифической резистентности также являются кожа и слизистые оболочки организма - первая линия защиты, где вырабатываются вещества, оказывающие бактерицидное действие. Также подавляют рост и размножение микробов слюна, желудочный сок, пищеварительные ферменты. В 1957 году английский вирусолог Айзекс и швейцарский вирусолог Лин-денманн, изучая явление взаимного подавления (интерференции) вирусов в куриных эмбрионах, опровергли связь процесса интерференции с конкуренцией между вирусами. Оказалось, что интерференция обусловлена формированием в клетках конкретного низкомолекулярного белкового вещества, которое удалось выделить в чистом виде. Ученые назвали этот белок интерфероном (ИФН), поскольку он подавлял репродукцию вирусов, создавая в клетках состояние резистентности к их последующему реинфицированию. Интерферон образуется в клетках в ходе вирусной инфекции и обладает хорошо выраженной видовой специфичностью, то есть проявляет свое действие только в том организме, в клетках которого образовался. При встрече организма с вирусной инфекцией именно продукция интерферона является наиболее быстрой ответной реакцией на заражение. Интерферон формирует защитный барьер на пути вирусов намного раньше специфических защитных реакций иммунитета, стимулируя клеточную резистентность , делает клетки непригодными для размножения вирусов. В 1980 году Комитетом экспертов ВОЗ была принята и рекомендована новая классификация, согласно которой все интерфероны человека разделяются на три класса: - альфа-интерферон (лейкоцитарный) - основной препарат для лечения вирусных и раковых заболеваний. Получают его в культуре лейкоцитов крови доноров, используя в качестве интерфероногенов вирусы, не представляющие опасности для людей (вирус Сендай); - бета-интерферон - фибробластный, продуцируется фибробластами, у этого типа интерферона противоопухолевая активность превалирует над противовирусной; - гамма-интерферон - иммунный, вырабатывается сенсибилизированными лимфоцитами Т-типа при повторной встрече с "известным" им антигеном, а также при стимуляции лейкоцитов (лимфоцитов) митогенами - ФГА и другими лек-тинами. Обладает выраженным иммуномодулирующим действием. Все интерфероны отличаются друг от друга по набору аминокислот и антигенным свойствам, а также по выраженности тех или иных форм биологической активности. Описаны следующие свойства интерферонов: антивирусные, имму-номодулирующие, противоопухолевые; помимо этого интерфероны подавляют рост клеток, изменяют проницаемость клеточных мембран, активируют макрофаги, усиливают цитотоксичность лимфоцитов, активируют последующий синтез интерферона, а также обладают "гормоноподобной" активацией жизнедеятельности клеток. Во всех звеньях взаимодействия компонентов иммунной системы как на уровне образования, активации и проявления их функций остается много белых пятен для того, чтобы создать рабочую схему действия иммунной системы и на этой основе прогнозировать развитие дальнейших событий в организме.
Активные неспецифические механизмы поддержания антигенно-структурного гомеостаза вместе с пассивными являются первым рубежом обороны внутренней среды организма от чужеродных антигенов. Эти механизмы представлены сложным комплексом факторов - морфологических, биохимических, общефизиологических. Способность к их функционированию передастся по наследству от родителей, однако потенциальный максимум этих функций - показатель индивидуальный. Это и определяет неодинаковую степень неспецифической резистентности у различных индивидуумов.
К неспецифической резистентности относят гуморальные и клеточные факторы защиты. Неспецифическая резистентность стереотипна. Она не дифференцирует антигены, имеет фазный характер, что связано с регуляцией ее со стороны нервной и эндокринной систем.
К гуморальным факторам относят: комплемент, интерфероны, лизоцим, бета-лизины и клеточные факторы: нейтрофильные лейкоциты (микрофаги).
Основным гуморальным фактором песпецифической резистентности является комплемент - сложный комплекс белков сыворотки крови (около 20), которые участвуют в уничтожении чужеродных антигенов, активации свертывания , образовании кининов. Для комплемента характерно формирование быстрого, многократно усиливающегося ответа на первичный сигнал за счет каскадного процесса. Активироваться комплемент может двумя путями: классическим и альтернативным. В первом случае активация происходит за счет присоединения к иммунному комплексу (антиген-антитело), а во втором - за счет присоединения к липополисахаридам клеточной стенки микроорганимов, а также эндотоксину. Независимо от путей активации происходит образование мембранатакующего комплекса белков комплемента, разрушающего антиген.
Вторым и не менее важным фактором, является интерферон. Он бывает альфа-лейкоцитарный, бета-фиброластный и гамма-интерферониммунный. Вырабатываются они соответственно лейкоцитами, фибробластами и лимфоцитами. Первые два вырабатываются постоянно, а гамма-интерферон - только в случае попадания вируса в организм.
Кроме комплемента и интерферонов, к гуморальным факторам относятся лизоцим и бета-лизины. Суть действия данных веществ заключается в том, что, являясь ферментами, они специфически разрушают липополисахаридные последовательности в составе клеточной стенки микроорганизмов. Отличие бета-лизинов от лизоцима заключается в том, что они вырабатываются в стрессорных ситуациях. Кроме указанных веществ, к этой группе относятся: С-реактивный белок, белки острой фазы, лактоферрин, пропердин и др.
Неспецифическая клеточная резистентность обеспечивается фагоцитами: макрофагами - моноцитами и микрофагами - нейтрофилами.
Для обеспечения фагоцитоза эти клетки наделены тремя свойствами:
Хемотаксисом - направленным движением к объекту фагоцитоза;
Адгезивностью - способностью фиксироваться на объекте фагоцитоза;
Биоцидностью - способностью переваривать объект фагоцитоза.
Последнее свойство обеспечивается двумя механизмами - кислородзависимым и кислороднезависимым. Кисло-родзависимый механизм связан с активацией мембранных ферментов (НАД-оксидазы и др.) и выработкой биоцидных свободных радикалов, которые возникают из глюкозы и кислорода на специальном цитохроме В-245. Кислороднезависимый механизм связан с белками лизосом, закладывающихся в костном мозге. Только сочетание обоих механизмов обеспечивает полное переваривание объекта фагоцитоза.
Неспецифические факторы защиты
Неспецифические факторы защиты - механические, физические и гуморальные факторы неспецифической резистентности организма.
Главными механическими барьерами зашиты являются кожа и слизистые оболочки. Здоровая кожа наряду с механической барьерной функцией обладает выраженными бактерицидными свойствами, обусловленными наличием нормальной микрофлоры на её поверхности. Определение степени бактерицидности кожи широко применяется в гигиенических и клинических исследованиях.
Неспецифические факторы защиты слизистых оболочек те же, что и у кожи, например кислая реакция (рН) желудочного сока (ниже 3), влагалища (4—4,5). Кроме того, клетки слизистых оболочек содержат лизоцим и секреторный иммуноглобулин класса А (SIgA), играющие важную роль в устойчивости кишечника, респираторных и мочеполовых путей к повреждающим агентам.
К механическим факторам относятся физиологические и патологические процессы, обеспечивающие удаление патогенных микроорганизмов, кашель, повышенное слизеотделение, чихание, рвота, потоотделение и др. Физическими фактором саногенеза, мобилизующим защитные реакции организма, является повышение температуры тела, наблюдаемое при многих заболеваниях.
Особое место среди неспецифических факторов защиты принадлежит фагоцитозу. К гуморальным неспецифическим факторам защиты относятся естественные антитела, комплемент, лизоцим, пропердин, бета-лизины, лейкины, интерферон, ингибиторы вирусов и другие вещества, постоянно присутствующие в сыворотке крови, секретах слизистых оболочек и тканях организма.
Значительную роль в обеспечении неспецифической резистентности организма играют также гормоны коры надпочечников (глюко- и минералокортикоиды).
Фагоцитоз — процесс поглощения, разрушения и выделения из организма патогенов.
В человеческом организме ответственными за него являются моноциты и нейтрофилы.
Процесс фагоцитоза бывает завершенным и незавершенным.
Завершенный фагоцитоз состоит из следующих стадий: • активация фагоцитирующей клетки; • хемотаксис или движение к фагоцитируемому объекту; • прикрепление к данному объекту (адгезия); • поглощение этого объекта; • переваривание поглощенного объекта.
Незавершенный фагоцитоз прерывается на стадии поглощения, при этом патоген остается живым.
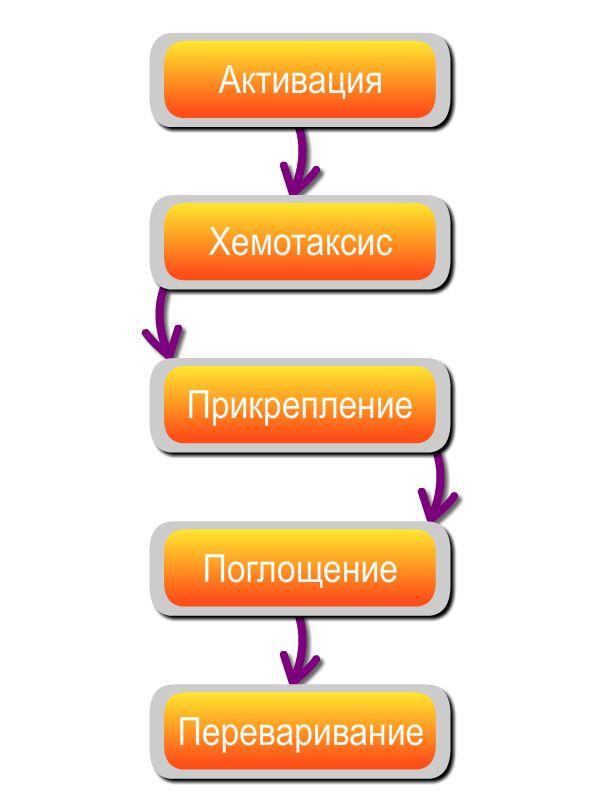
Стадии фагоцитоза
В процессе фагоцитоза образуются следующие структуры:
фагосома – образуется после прикрепления фагоцита к объекту путем замыкания его мембраны вокруг патогена;
фаголизосома – образуется в результате слияния фагосомы с лизосомой фагоцитирующей клетки. После ее образования начинается процесс переваривания.
Вещества из лизосомальных гранул (гидролитические ферменты, щелочная фосфатаза, миелопероксидаза, лизоцим) могут разрушать чужеродные вещества двумя механизмами:
кислороднезависимый механизм —осуществляется гидролитическими ферментами;
кислородзависимый механизм — осуществляется при участии миелопероксидазы, перекиси водорода, супероксидного аниона, активного кислорода и гидроксильных радикалов.
Комплемент: краткое определение
Комплементом называют сложный комплекс белков, действующий совместно для удаления внеклеточных форм патогена; система активируется спонтанно определенными патогенами или комплексом антиген:антитело. Активированные белки либо непосредственно разрушают патоген (киллерное действие), либо обеспечивают лучшее их поглощение фагоцитами (опсонизирующее действие); либо выполняют функцию хемотаксических факторов, привлекая в зону проникновения патогена клетки воспаления.
Комплекс белков комплемента формирует каскадные системы, обнаруженные в плазме крови. Для этих систем характерно формирование быстрого, многократно усиленного ответа на первичный сигнал за счет каскадного процесса. В этом случае продукт одной реакции служит катализатором последующей, что в конечном итоге приводит к лизису клетки или микроорганизма.
Существует два главных пути (механизма) активации комплемента - классический и альтернативный.
Классический путь активации комплемента инициируется взаимодействием компонента комплемента С1q с иммунными комплексами ( антителами, связанными с поверхностными антигенами бактериальной клетки); в результате последующего развития каскада реакций образуются белки с цитолитической (киллерной) активностью, опсонины, хемоаттрактанты. Такой механизм соединяет приобретенный иммунитет (антитела) с врожденным иммунитетом (комплемент).
Альтернативный путь активации комплемента инициируется взаимодействием компонента комплемента С3b с поверхностью бактериальной клетки; активация происходит без участия антител. Данный путь активации комплемента относится к факторам врожденного иммунитета.
В целом система комплемента относится к основным системам врожденного иммунитета, функция которых состоит в том, чтобы отличить "свое" от "не своего". Эта дифференциация в системе комплемента осуществляется благодаря присутствию на собственных клетках организма регуляторных молекул, подавляющих активацию комплемента.
C-белки системы комплемента
Все белки классического пути активации комплемента и белки лизирующего мембрану комплекса имеют буквенное обозначение "C" и арабскую цифру, отражающую последовательность открытия белка, но не последовательность его включения в реакцию. Реакционная последовательность представляет следующий ряд:
C1 , C1q , C1r , C1s , C4
Заметим, что при расщеплении компонентов системы комплемента большему продукту присваивается символ "b", а меньшему - символ "a". Из этого правила есть одно исключение:C2b означает меньший, а C2a - больший фрагмент.
Среди этих белков них много предшественников ферментов - проферментов, которые приобретают активность только после расщепления. Обозначение активного фермента отличается от обозначения его неактивного предшественника обычно надбуквенной чертой, а в данном обзоре - волнистой, например: C1r~.
Белок C1 построен из 5 молекул: одной C1q , двух C1r и двух C1s ( рис. 9.22 ). Пары молекул C1r и C1s располагаются поперек молекулы C1q. Соединение этих молекул зависит от ионов кальция.
С1q состоит из шести идентичных субъединиц, конформационно напоминающих булаву с коллагеноподобной рукоятью.
Взаимодействие С1q с иммунными комплексами приводит к активации комплемента.
C1s содержит участки аминокислотной последовательности из сериновой эстеразы и рецептора липопротеинов низкой плотности, а также короткий общий повтор, встречающийся в суперсемействе регуляторных белков комплемента.
Наиболее важным компонентом системы комплемента является C3 , присутствующий в плазме крови в той же концентрации (1-2 мг/мл), что и некоторые иммуноглобулины.
C3- это бетаглобулин с мол. массой равной 195 кД, секретируется (как про-С3) макрофагами.
C3 постоянно расщепляется на C3а и C3b . Внутренняя тиоэфирная связь в нативной молекуле C3 чувствительна к спонтанному гидролизу. Эта постоянная, происходящая на низком уровне самопроизвольная активация C3 в плазме называется "холостой", и она поддерживает в плазме крови небольшую концентрацию C3b.
Расщепление C3 на C3a и C3b ( C3-конвертазой в процессе активации системы) является центральным моментом любого из каскадов комплемента.
C4 (C4-bp - binding protein) - гептамерный белок плазмы, молекула которого имеет паукообразную форму; относится к суперсемейству регуляторных белков комплемента.
Каскад всех реакций активации комплемента завершается образованием лизирующего (атакующего) мембрану комплекса (ЛМК).
Первый этап образования комплекса - это ферментативное расщепление C5-белка комплемента. Белок C5 гомологичен белкам C3 и C4, но не содержит внутренней тиоэфирной связи. Прежде чем подвергнуться расщеплению C5-конвертазой, белок C5 избирательно связывается с C3b , который находится в составе конвертазы.
При расщеплении C5 высвобождаются небольшой фрагмент C5a и фрагмент C5b . C5a является высокоактивным анафилатоксином. С фрагмента C5b начинается следующий этап формирования ЛМК.
C6 , C7 , C8 и C9 - компоненты лизирующего мембрану комплекса, свойства которых аналогичны перфорину цитотоксических T-клеток и катионному белку эозинофилов.
Опсонины
Опсонины, связываются с клетками-мишенями и облегчают их фагоцитоз.
Нейтрализация антигенов представляет собой лишь начальный этап освобождения организма от патогенов. Следующий, наиболее результативный этап связан с опсонизацией корпускулярных или растворимых антигенов, их захватом фагоцитирующими или иными иммунологически активными клетками и внутриклеточным разрушением патогенов. Процесс усиления фагоцитоза за счет гуморальных факторов вообще (например, белков комплемента) и специфическихантител в частности получил название опсонизации.
Хемокины (Хемотаксические молекулы)
Важный класс провоспалительных цитокинов, необходимых для активации нейтрофилов и моноцитов и привлечения этих клеток в очаг воспаления, составляют хемокины (хемотаксические цитокины). Источником этих небольших белков служат эндотелиальные иэпителиальные клетки , фибробласты , нейтрофилы и моноциты . Хемокины действуют черезрецепторы, состоящие из семи трансмембранных доменов и сопряженные с G-белками . Рецепторы хемокинов относятся к тому же типу поверхностных рецепторов, что и рецепторы классических хемоаттрактантов - трипептида формилметионил-лейцил-фенилаланина и фрагмента компонента комплемента С5а .
Выделяют два основных класса хемокинов: альфа-хемокины (например, ИЛ-8 ) и бета-хемокины(например, макрофагальный воспалительный белок 1альфа ). Альфа-хемокины опосредуют преимущественно хемотаксис нейтрофилов, бета-хемокины - хемотаксис моноцитов и лимфоцитов. Многие из сигнальных молекул обладают хемотаксическими свойствами , в том числе это C5a , лейкотриен B4 и разнообразные низкомолекулярные цитокины . Эта группа цитокинов получила общее название " хемокины ". Это семейство белков длиной около 100 аминокислот, синтезируемые в различных тканях [ Baggiolini, ea 1998 ]. Хемокины содержат четыре консервативных цистеина, связанных дисульфидными мостиками. В зависимости от того, разделены первые два консервативных цистеина одной аминокислотой или нет, различают два подсемейства хемокинов, СС и СХС [ Moser, ea 1998 ]. Избыточные концентрации хемокинов стимулируют фагоцитоз нейтрофилов, дыхательный взрыв , дегрануляцию , повышение [Са2+] , а также синтез белка . Напротив, для стимуляции хемотаксиса достаточны низкие, наномолярные концентрации хемокинов.
Хемотаксическую активность клеток следует отличать от хемокинетической. Хемотаксис - это направленная миграция клеток по градиенту концентрации хемотаксических молекул, ахемокинез - беспорядочное перемещение клеток, которое связано с усилением общей подвижности клеток под действием того или иного медиатора, например, гистамина.
В группу хемокинов входит ряд хемотаксических гепарин-связывающих молекул, которая состоит не менее чем из 25 низкомолекулярных цитокинов , в том числе ИЛ-8 и RANTES . Хемокины высвобождаются в очаге воспаления и могут связываться на поверхности эндотелия. Связанные с поверхностью эндотелия, они могут вызывать повышение авидности интегринов налейкоцитах в первой фазе миграции (краевого стояния), когда движение лейкоцитов останавливается при участии селектинов .
Большинство хемокинов синтезируется лейкоцитами, однако ИЛ-8 и хемотаксический для макрофагов белок 1 (MCP-1) (macrophage chemotactic protein-1) продуцирует, например, культура клеток эндотелия. При этом синтез ИЛ-8 и MCP-1 усиливается при активации этих клеток цитокинами, способствующими развитию воспаления.
Некоторые хемокины только активируют клетки, другие проявляют в первую очередь хемотаксические свойства, третьи сочетают обе функции. Можно предполагать, что за счет этого разнообразия возможна избирательная регуляция перемещения лейкоцитов как у поверхностного эндотелия, так и в тканях.
Хемотаксической активностью помимо хемокинов обладают и такие молекулы, как C5a илейкотриен B4 . Эти белки вызывают хемотаксис нейтрофилов и макрофагов . Оба эти хемоаттрактанта образуются в очаге воспаления: C5a - в результате активации комплемента , а лейкотриен-B4 - при активации разнообразных клеток, чаще всего макрофагов и тучных клеток.
Кроме того хемотаксис фагоцитов вызывают молекулы, образуемые системой свертывания крови, прежде всего фибриновый пептид B и тромбин.
Клетки, прибывшие первыми в очаг воспаления, способны в результате активации вызвать следующую волну лейкоцитарной миграции. Так активированные моноциты выделяют ИЛ-8 , который может вызвать хемотаксис нейтрофилов и базофилов . Подобно этому, активация макрофагов приводит к метаболизированию арахидоновой кислоты с образованием и выделением лейкотриена B4.
Хемотаксические факторы могут стать медиаторами аллергических реакций .
Хемокины являются цитокинами , которые инициируют локальное воспаление в результате вовлечения инфламаторных (воспалительных) клеток в процесс хемотаксиса, а далее в процесс активации их функции.
Регуляция воспалительной реакции комплементом
Воспалительная острая реакция , опосредованная активацией комплемента , разворачивается следующим образом. Начинается активация комплемента по альтернативному пути . C3bBbзакрепляется на поверхности микроорганизма и расщепляет большие количества C3 . ФрагментC3a выделяется, а многочисленные молекулы C3b связываются с микроорганизмом. Это активирует следующий этап с образованием C5a и лизирующего мембрану комплекса .
Далее C3a и C5a способствуют высвобождению медиаторов из тучных клеток и вместе с ними вовлекают полиморфноядерные нейтрофилы и другие компоненты системы комплемента в очаг проникновения микроорганизма. Все это вызывает расслабление стенок артерий и приводит к усилению кровотока и расширению мелких сосудов, в то время как сокращение клеток эндотелия капилляров позволяет выходить белкам плазмы из сосудов. Нейтрофилы замедляют движение у стенок капилляров, проникают в отверстия между эндотелиальными клетками (диапедез ) и перемещаются по градиенту концентрации хемотаксических факторов до тех пор, пока не окажутся лицом к лицу с микроорганизмом, покрытым C3b . Далее происходит связывание микроорганизма с C3b-рецепторами нейтрофилов, C3a и C5a резко активируют клеточное дыхание и мгновенно наступает финал последнего действия.
Фрагмент С5а и другие продукты активации комплемента содействуют хемотаксису , агрегации и дегрануляции нейтрофилов и образованию свободных радикалов кислорода . Введение С5а животным приводило к артериальной гипотонии , сужению легочных сосудов, нейтропении и повышению проницаемости сосудов из-за повреждения эндотелия.
Хемоаттрактанты - хемокины (хетаксические молекулы).
Система комплемента — комплекс сложных белков, постоянно присутствующих в крови. Это каскадная система протеолитических ферментов, предназначенная для гуморальной защиты организма от действия чужеродных агентов, она участвует в реализации иммунного ответа организма. Является важным компонентом как врождённого, так и приобретённого иммунитета.
![]()
Мембраноатакующий комплекс, вызывающий лизис клетки.
История понятия
В конце XIX столетия было установлено, что сыворотка крови содержит некий «фактор», обладающий бактерицидными свойствами. В 1896 году молодой бельгийский ученый Жюль Борде, работавший в Институте Пастера в Париже, показал, что в сыворотке имеются два разных вещества, совместное действие которых приводит к лизису бактерий: термостабильный фактор и термолабильный (теряющий свои свойства при нагревании сыворотки) фактор. Термостабильный фактор, как оказалось, мог действовать только против определенных микроорганизмов, в то время как термолабильный фактор имел неспецифическую антибактериальную активность. Термолабильный фактор позднее был названкомплементом. Термин «комплемент» ввел Пауль Эрлих в конце 1890-х годов. Эрлих был автором гуморальной теории иммунитета и ввел в иммунологию много терминов, которые впоследствии стали общепринятыми. Согласно его теории, клетки, ответственные за иммунные реакции, имеют на поверхности рецепторы, которые служат для распознаванияантигенов. Эти рецепторы мы сейчас называем «антителами» (основой вариабельного рецептора лимфоцитов является прикреплённое к мембране антитело класса IgD, реже IgM. Антитела других классов в отсутствие соответствующего антигена не прикреплены к клеткам). Рецепторы связываются с определенным антигеном, а также с термолабильным антибактериальным компонентом сыворотки крови. Эрлих назвал термолабильный фактор «комплементом» потому, что этот компонент крови «служит дополнением» к клеткам иммунной системы.
Эрлих полагал, что имеется множество комплементов, каждый из которых связывается со своим рецептором, подобно тому, как рецептор связывается со специфическим антигеном. В противоположность этому Борде утверждал, что существует «дополнение» только одного типа. В начале XX века спор был разрешен в пользу Борде; выяснилось, что комплемент может активироваться с участием специфических антител или самостоятельно, неспецифическим способом.
Общее представление Компоненты системы комплемента
Комплемент — система белков, включающая около 20 взаимодействующих компонентов: С1 (комплекс из трех белков), С2, СЗ, …, С9, фактор В, фактор D и ряд регуляторных белков. Все эти компоненты — растворимые белки с мол. массой от 24 000 до 400 000, циркулирующие в крови и тканевой жидкости. Белки комплемента синтезируются в основном в печени и составляют приблизительно 5 % от всей глобулиновой фракции плазмы крови. Большинство из них неактивны до тех пор, пока не будут приведены в действие или в результате иммунного ответа (с участием антител), или непосредственно внедрившимся микроорганизмом (см. ниже). Один из возможных результатов активации комплемента — последовательное объединение так называемых поздних компонентов (С5, С6, С7, С8 и С9) в большой белковый комплекс, вызывающий лизис клеток (литический, или мембраноатакующий, комплекс). Агрегация поздних компонентов происходит в результате ряда последовательных реакций протеолитической активации с участием ранних компонентов (С1, С2, С3, С4, фактора В и фактора D). Большинство этих ранних компонентов — проферменты, последовательно активируемые путем протеолиза. Когда какой-либо из этих проферментов специфическим образом расщепляется, он становится активным протеолитическим ферментом и расщепляет следующий профермент, и т. д. Поскольку многие из активированных компонентов прочно связываются с мембранами, большинство этих событий происходит на поверхностях клеток. Центральный компонент этого протеолитического каскада — С3. Его активация путем расщепления представляет собой главную реакцию всей цепи активации комплемента. С3 может быть активирован двумя основными путями — классическим и альтернативным. В обоих случаях С3 расщепляется ферментным комплексом, называемым С3-конвертазой. Два разных пути приводят к образованию разных С3-конвертаз, однако обе они образуются в результате спонтанного объединения двух компонентов комплемента, активированных ранее в цепи протеолитического каскада. С3-конвертаза расщепляет С3 на два фрагмента, больший из которых (С3b) связывается с мембраной клетки-мишени рядом с С3-конвертазой; в результате образуется ферментный комплекс еще больших размеров с измененной специфичностью — С5-конвертаза. Затем С5-конвертаза расщепляет С5 и тем самым инициирует спонтанную сборку литического комплекса из поздних компонентов — от С5 до С9. Поскольку каждый активированный фермент расщепляет много молекул следующего профермента, каскад активации ранних компонентов действует как усилитель: каждая молекула, активированная в начале всей цепи, приводит к образованию множества литических комплексов.
