
Kospekt_lektsy_po_fiz_khimii
.pdfобусловлен тем, что приближается насыщение поверхностного слоя веществом 2, и рост его концентрации в поверхностном слое замедляется в сравнении с увеличением концентрации в объеме раствора. В бесконечно разбавленных растворах дифференцируют кривую σ(с2), а в идеальных – кривую σ(x2).
Адсорбция газов на поверхности конденсированной фазы
Избыточная энергия, которой обладают частицы поверхностного слоя конденсированной фазы вследствие нескомпенсированности химических связей, обусловливает их взаимодействие с частицами контактирующей фазы, в частности, с газом (рисунок 63, б). Процесс этот протекает самопроизвольно, так как сопровождается уменьшением энергии системы, и всегда имеет отрицательный тепловой эффект Hадс < 0 .
Вещество, на поверхности которого происходит адсорбция, называется адсорбентом, а адсорбирующееся вещество – адсорбатом. Адсорбенты обычно имеют большую удельную поверхность – сотни м2/г.
Непосредственной причиной удержания адсорбата на поверхности адсорбента являются силы связи, которые могут быть Ван-дер-ваальсовыми, и тогда адсорбцию называют физической. Это дисперсионные, ориентационные и индукционные взаимодействия. При образовании более прочных химических связей (например, ковалентной) адсорбция называется химической, или хемосорбцией.
Адсорбция всегда находится в динамическом равновесии с обратным процессом – десорбцией. Но адсорбция требует преодоления меньшего энергетического барьера, чем десорбция, поэтому Hадс = Eадс − Eдес < 0 . Здесь Eадс и Eдес – соответственно энергии
активации процессов адсорбции и десорбции.
В соответствии с принципом Ле-Шателье равновесная величина адсорбции уменьшается с повышением температуры. Химическая адсорбция, кроме того, является активационным процессом, поэтому при низких температурах скорость ее мала. Поэтому, хотя равновесное значение адсорбции при низких температурах может быть велико, равновесие не достигается вследствие крайне малой скорости процесса. При более высоких температурах, когда скорость адсорбции повышается, равновесие может быть достигнуто, причем, как и в случае химической адсорбции, это равновесие является динамическим, определяемым равенством скоростей прямого и обратного процессов.
При адсорбции на твердых поверхностях обычно за адсорбцию принимают число молей адсорбированного вещества на единице площади поверхности адсорбента, считая, что концентрация адсорбата на поверхности значительно выше, чем в объеме газовой фазы.
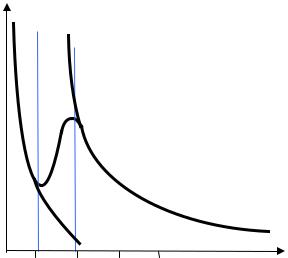
Поскольку адсорбция зависит как от температуры, так и от концентрации адсорбата в газе (пропорциональной его давлению), то различают изобару и изотерму адсорбции. На рисунке 66 изображена изобара адсорбции водорода на никеле.
Представленная кривая позволяет оценить влияние температуры на адсорбцию. На кривой можно выделить три участка. I – это область физической адсорбции. Ее роль велика при низких температурах, при которых химическая адсорбция практически не идет по кинетическим причинам. II – переходная область. Здесь физическая адсорбция интенсивно уменьшается с ростом температуры, а скорость химической адсорбции начинает расти, однако равновесия, по-прежнему, нет. III – область равновесной химической адсорбции.
Наличие подобных максимумов свидетельствует об участии в адсорбции активированных процессов. Они имеются в случае адсорбции кислорода на угле и металлах, азота – на железе. Активированная адсорбция имеет большое значение для гетерогенного катализа. Химическая адсорбция может быть и неактивированной, и тогда она протекает достаточно быстро и при низких температурах.
121
Г
I
II
III
-200 -100 0 |
100 |
t °C |
Рисунок 66 – Изобара адсорбции водорода на поверхности твердого никеля
Изотерма адсорбции
Простейшей модельной теорией адсорбции является так называемая изотерма адсорбции Лэнгмюра. В этой модели сделаны следующие допущения.
1.Адсорбент предоставляет адсорбату ограниченное число мест. В каждом из них может адсорбироваться только одна молекула. Рассматривается монослой.
2.Все адсорбционные места энергетически равноценны (подразумевается однородность поверхности).
3.Частицы адсорбата между собой не взаимодействуют.
4.Изменение энергии частицы при ее адсорбции не зависит от того, заняты или свободны соседние места.
Для вывода уравнения Лэнгмюра уподобим процесс адсорбции химической реакции взаимодействия частиц адсорбата (А) с незанятыми адсорбционными местами адсорбента
(М):
А+ М = АМ
ирассмотрим ее равновесие, поскольку величина адсорбции является равновесной характеристикой системы. Продуктом «химической реакции» является занятое адсорбционное место АМ. Выражение константы равновесия «реакции», т.е. константы равновесия адсорбции, запишем так:
b′ = |
aAM |
= |
xAM |
= |
xAM |
. |
|
aAaM |
PA xM |
PA (1− xAM ) |
|||||
|
|
|
|
Здесь активности «реагентов» заменены их мольными долями, поскольку поверхностный «раствор» можно считать идеальным в силу сделанных допущений. Долю занятых при равновесии адсорбционных мест xАМ выразим в явном виде:
b′PA = b′PA xAM + xAM ;
xAM |
= |
|
b′PA |
. |
|
+ b′PA |
|||
|
1 |
|
||
122 |
|
|
||
Обозначив максимальную, в рамках данной модели, величину адсорбции Gmax, получим выражение для величины равновесной адсорбции, т.е. уравнение Лэнгмюра:
Г = Гmax b′PA
1+ b¢PA
Поскольку парциальное давление вещества А в газовой фазе РА пропорционально его концентрации с, это уравнение нередко записывают так:
Г = Гmax |
|
|
bc |
. |
(92) |
||
|
|
|
|
||||
1 |
+ bc |
||||||
|
|
|
|||||
Для нахождения констант b и Гmax в уравнении изотермы Лэнгмюра используется такой прием. В правой и левой частях уравнения записывают величины, обратные имеющимся. Равенство от этого не нарушится:
1 |
= |
1 |
|
1 + bc |
= |
1 |
|
1 |
+ |
1 |
. |
G |
G |
|
|
|
|
||||||
|
|
bc |
G bc |
G |
|||||||
|
|
max |
|
|
|
max |
max |
||||
Полученное уравнение есть уравнение прямой линии в координатах « 1 - 1 ». Из рисунка 67
G c
ясно, как определяют величины b и Гmax , когда, например, по опытным данным построена эта линия.
1/Г
|
α |
|
1/Гmax |
|
|
tg α = 1/(bГmax) |
||
|
0 |
1/c |
Рисунок 67 – Определение констант в уравнении изотермы Лэнгмюра |
|
Анализ изотермы адсорбции Лэнгмюра |
|
При малых значениях концентрации |
уравнение (92) преобразуется к виду |
G » Gmax bc = const ×c ,
т.е. адсорбция пропорциональна (при данной температуре) концентрации адсорбата в газовой фазе (рисунок 68).
123

При больших значениях концентрации Г ≈ Гmax. Это объясняется насыщением поверхности молекулами адсорбата.
При адсорбции не одного газа, а нескольких на поверхности адсорбента, имеет место так называемое адсорбционное вытеснение. Оно проявляется в уменьшении адсорбции газа из смеси газов, а уравнение Лэнгмюра преобразуется к виду:
Γi = Γmax |
bici |
. |
k |
||
|
1 + ∑bici |
|
|
i =1 |
|
Г |
|
Гmax |
0
0 |
c |
Рисунок 68 – Зависимость адсорбции газа на поверхности адсорбента от концентрации
Лэнгмюровская адсорбция, как и другие идеализированные теории, является полезной абстракцией, передающей важные черты явления. Опыт показывает, что нередко зависимость адсорбции Г от концентрации с сложнее. В более развитых теориях учитывается неравноценность адсорбционных мест, взаимное влияние адсорбированных частиц, возможность образование полимолекулярного слоя на поверхности адсорбента. Иными словами, дальнейшее развитие теории идет по пути отказа от упрощающих допущений, принятых Лэнгмюром. Тем не менее, простота конечного уравнения и его применимость для ряда несложных систем, делают эту модель удобной для полуколичественного описания ряда процессов, связанных с адсорбцией вещества на поверхности конденсированного тела.
Влияние температуры на величину адсорбции
Влияние температуры на величину адсорбции в модели Лэнгмюра проявляется через температурную зависимость константы равновесия b = f(T). Как и прежде, уподобляя процесс адсорбции химической реакции, опишем эту зависимость уравнением изобары (36):
d ln b′ |
= |
Hадс . |
|
||
dT |
RT 2 |
|
Поскольку тепловой эффект адсорбции всегда отрицательный, константа равновесия адсорбции с ростом температуры убывает, уменьшается и величина адсорбции. Это особенно заметно при малых давлениях адсорбата, когда Г пропорциональна PA, а в коэффициент пропорциональности входит константа равновесия адсорбции. Максимальная величина адсорбции не зависит от Т, но достигается при более высоких значениях давления адсорбата по мере роста температуры.
124

Раздел 7. Кинетика гомогенных химических реакций
Лекция 15
Скорость гомогенной химической реакции
Кинетика химических реакций – это раздел физической химии, занимающийся изучением скоростей протекания реакций, их механизма, а также факторов, влияющих на скорость реакции. Если термодинамика установила, что процесс при данных условиях может идти, то она ничего не сообщает о скорости, с которой пойдет этот процесс. А скорости могут меняться в очень широких пределах. Есть реакции, протекающие в форме взрыва и длящиеся тысячные доли секунды. Есть процессы, например, в земной коре, протекающие тысячелетиями.
Изучение механизма процессов и факторов, влияющих на их скорость, позволяет ускорить многие технологические процессы или, напротив, замедлить протекание нежелательных реакций. Формальная кинетика количественно описывает ход реакции, не рассматривая ее механизм.
Химические реакции можно разделить на два больших класса – гомогенные и гетерогенные реакции.
Гомогенными называются реакции, все реагенты (исходные вещества и продукты) которых находятся в одной фазе. Это, в основном, реакции в растворах и в газовой фазе.
Гетерогенные реакции протекают на границе раздела фаз.
Скорость химической реакции (v) характеризуется изменением концентрации реагирующих веществ в единицу времени, т.е. количеством молей или молекул данного вещества, реагирующих в единицу времени в единице объема. Очевидно, что за одно и то же время концентрации разных веществ могут изменяться по-разному, поэтому правильнее говорить о скорости, например, по веществу А в реакции
aA + bB = cC .
Скорости реакции по разным веществам, участвующим в реакции, связаны между собой через стехиометрические коэффициенты соотношением
1 vA = 1 vB = 1 vC . a b c
Средняя скорость реакции за промежуток времени Dt определяется отношением
v = Dτc ,
а истинная скорость –
v = lim |
|
|
= |
dc |
. |
|
v |
||||||
|
|
|||||
τ →0 |
|
dτ |
||||
Поскольку величина скорости всегда положительна, то в полученном выражении ставят знак «+», если речь идет об изменении концентрации продуктов реакции (dc > 0), или знак «–», если имеют в виду исходные вещества, концентрация которых со временем уменьшается.
Концентрацию часто выражают в моль/л или моль/см3, тогда размерность скорости реакции соответственно будет моль/(л×с) или моль/(см3×с).
125
Зависимость скорости реакции от концентрации реагентов
Для установления связи скорости реакции с концентрациями реагентов рассмотрим реакцию А + В = С. Для образования из атомов А и В молекулы С надо, чтобы эти атомы сблизились на такое расстояние, чтобы между ними стало возможным возникновение химической связи. Поскольку силы взаимодействия короткодействующие, то это расстояние соизмеримо с суммой радиусов атомов. Вероятность WA того, что атом А окажется в некотором объеме V, пропорциональна концентрации атомов А в реакционном сосуде: WA = kAcA. То же справедливо и для атома В: WB = kBcB. Вероятность одновременного попадания атома А и атома В в этот объем в случае независимости этих событий равна произведению их вероятностей:
WAB = WAWB = kAkBcAcB .
В свою очередь, скорость химической реакции пропорциональна вероятности встречи частиц, или
v = KcAcB .
Рассуждая аналогично относительно реакции aA + bB = dD + eE , можно показать, что
v = KcAa cBb |
. |
(93) |
Это уравнение экспериментально получил Н.Н. Бекетов в 1865 г. Величина К – константа скорости реакции. Она численно равна скорости при единичных концентрациях реагентов, как следует из уравнения (93).
Уравнение (93) справедливо, если реакция протекает полностью, и можно не учитывать обратный процесс. При этом скорость прямой реакции много больше скорости обратной реакции. Такую реакцию называют кинетически необратимой в данных условиях. В противном случае в реакционном объеме будут накапливаться продукты, и обратная реакция будет тем вероятнее, чем больше концентрация продуктов. Общая скорость реакции равна
v = vпр − vобр = KпрcAa cBb − KобрсEe cDd .
Если через какое-то время в системе устанавливается равновесие (v = 0), то получим
Kпр |
|
сe cd |
|
|
= |
E D |
= Кc , |
Кобр |
|
||
|
cAa cBb |
||
где Кc - константа равновесия реакции. Это соотношение показывает динамический характер химического равновесия.
Реакция может быть односторонней, если продукт выпадает в осадок, т.е. удаляется из реакционной зоны. Если Кпр >> Kобр, то такую реакцию также можно назвать односторонней, в отличие от случая, когда константы скоростей соизмеримы. В принципе, все реакции двухсторонни, но на практике равновесие может быть сдвинуто вправо или влево, и тогда скоростью одного из направлений можно пренебречь. Это говорит о том, что равновесия в системах имеют динамический характер.
Молекулярностью реакции (m) называется число молекул, участвующих в элементарном химическом акте, взаимодействием которых осуществляется химическая реакция.
126
AB = A + B – мономолекулярная реакция (m =1); A + B = AB – бимолекулярная реакция (m = 2); A + 2B = AB2 – тримолекулярная реакция (m =3).
Поскольку вероятность одновременной встречи более чем трех частиц мала, то молекулярность больше 3 обычно не рассматривается. Если же, согласно уравнению реакции, в ней участвует больше трех частиц одновременно, то на самом деле процесс идет более сложно – через ряд последовательных стадий со значениями молекулярности не более трех.
Однако молекулярный механизм реальных реакций очень часто отличается от того, который вытекает из стехиометрического уравнения. Реакции оказывается энергетически выгоднее идти через ряд последовательных или параллельных стадий, в результате чего зависимость ее скорости от концентраций реагентов оказывается иной. Это можно учесть, изменив показатели степени при концентрациях в кинетическом уравнении и записав:
v = KcAn1 cBn2 .
Значения n1 и n2 называют величинами порядка реакции по реагентам А и В. Порядком реакции (n) называется сумма показателей степени, с которыми входят концентрации в уравнение для скорости реакции (93): n = n1 + n2 . Таким образом, лишь в простейших реакциях порядок реакции совпадает с молекулярностью и равен сумме стехиометрических коэффициентов в уравнении реакции. Порядок реакции обычно определяется лишь экспериментально, поскольку реальный механизм ее неизвестен. Его величина, как показывает опыт, не бывает больше трех, но может быть и дробной или нулевой. Знание порядка реакции важно потому, что он определяет характер зависимости скорости реакции от концентраций реагентов, и позволяет, в ряде случаев, судить о механизме протекания реакции.
Изменение концентрации реагирующих веществ со временем для реакций разного порядка
Рассмотрим простейший случай, когда концентрации всех реагирующих веществ одинаковы и равны с. Тогда
v= Kcn .
Сучетом определительного уравнения скорости реакции запишем
− |
dc |
= Kcn , |
(94) |
|
|||
|
dτ |
|
|
и затем проинтегрируем полученное дифференциальное уравнение (94) при различных целочисленных значениях порядка реакции n.
n=1.
Для реакции первого порядка получим
c |
dc |
|
τ |
|
∫ |
= −K |
∫ dτ , |
||
|
||||
c =c0 |
c |
τ =0 |
||
|
|
|||
127
ln c = -Kτ , c0
или
c = c0e− Kτ |
. |
(95) |
Выразим константу скорости реакции
K= 1 ln c0 .
τc
Видим, что для реакции первого порядка константа скорости имеет размерность с-1. Найдем
характеристику реакции, |
называемую периодом полупревращения τ 1 |
. Это промежуток |
|
|
|
2 |
|
времени, по истечении |
которого от начала реакции концентрации исходных веществ |
||
уменьшаются вдвое, т.е. c = c0 . Тогда
2
ln 2 = Kτ 1 , и
|
|
2 |
|
|
||
|
|
|
|
|
||
τ 1 |
= |
ln 2 |
|
. |
||
K |
||||||
|
2 |
|
|
|||
|
|
|
|
|||
Период полупревращения реакции первого порядка не зависит от начальной концентрации исходных веществ.
n = 2.
Для реакции второго порядка
-dc = Kc2 , dτ
|
|
|
|
|
c |
|
|
|
|
|
τ |
|
|
||||
|
|
|
|
- ∫ |
dc |
|
= K ∫ dτ , |
||||||||||
|
|
c2 |
|||||||||||||||
|
|
0 |
|
|
|
|
|
|
0 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
1 |
= |
1 |
|
+ Kτ |
. |
(96) |
|||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
c |
c0 |
|
|
|
|
|
|
|
|
||||
Константа скорости определяется уравнением |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
1 |
|
|
1 |
|
1 |
|
|
||
|
|
|
|
K = |
τ |
|
|
- c |
. |
||||||||
|
|
|
|
|
c |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
||||
Ее размерность – |
см3 |
. Период полупревращения находим из соотношения |
|||||||||||||||
моль× с |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
128


