
- •А.М.Сыркин, н.Е.Максимова, л.Г.Сергеева химия воды
- •Утверждено Редакционно-издательским советом угнту
- •2. Строение молекул воды
- •3. Структура воды
- •4. Физические свойства воды
- •5. Изотопный состав воды
- •6. Химические свойства воды
- •7. Строение водных растворов
- •8. Структура воды на твердых поверхностях
- •9. Характеристика природных вод
- •10. Химический состав природных вод
- •Изменение содержания отдельных ионов от солесодержания в воде [1, 2]
- •11. Воды нефтяных и газовых месторождений
- •Классификация природных вод в.А. Сулина [1] по типам
- •12. Сточные воды
- •13. Значение воды в нефтяной промышленности
- •14. Показатели качества и химический анализ воды
- •15. Отложение солей при добыче нефти
- •16. Основные методы очистки воды
- •17. Очистка сточных вод
- •18. Лабораторные работы
- •18.1. Лабораторная работа «Методы определения жесткости»
- •18.2. Лабораторная работа «Методы умягчения воды»
- •18.3. Лабораторная работа «Качественный анализ химического состава воды»
- •Описание качественных реакций на ионы
- •18.4. Лабораторная работа «Химиический анализ состава пластовой воды»
- •19. Задачи и упражнения
- •Задачи для самостоятельного решения
- •Варианты заданий самостоятельной работы
- •Редактор л.А.Маркешина
19. Задачи и упражнения
Методика решения задач по теме "Жесткость воды и методы её умягчения" основана на понятии жесткости, знании единиц измерения жесткости, методов умягчения воды и некоторых общих формул.
Единой международной единицы измерения жесткости не существует. Различные страны условно принимают свои единицы. В нашей стране жесткость выражают в мг-эквивалентах ионов Са2+ и Mg2+ (либо соответствующих солей кальция и магния), содержащихся в I л воды; I мг-эквивалент жесткости соответствует 20,04 мг Са2+ в I л воды или 12,16 мг Mg2+ в I л воды. В других странах жесткость воды измеряют градусами жесткости:
немецкие градусы I° = I г СаО в 100 л воды
французские I° = I г СаСО3 в 100 л воды
английские I° = I г СаСО3 в 70 л воды
Например, один немецкий градус жесткости соответствует содержанию
I г СаО в 100 л воды. Содержание других металлов пересчитывается на количество эквивалентов СаО. Для пересчета жесткости, выраженной в мг-экв/л в градусы жесткости других стран можно воспользоваться следующими соотношениями (ориентировочно):
I мг-экв /л = 2,8° (немец.) = 5° (франц.) = 3,5° англ.) = 50° (американ.).
Если известны массы ионов или соответствующих им солей, то жесткость считается по формуле
![]()
где m1, m2, m3 – массы ионов металлов (или их солей) в воде, мг;
Э1, Э2, Э3 – эквивалентные массы ионов металлов (или их солей), мг/экв;
V – объём воды, л.
Временную жесткость воды можно определить по объёму кислоты, пошедшей на её титрование. В соответствии с законом эквивалентов количество эквивалентов всех участвующих в химической реакции веществ должно быть одинаково. Следовательно:
![]() ,
,
где
![]() – объём кислоты, пошедшей на титрование,
мл;
– объём кислоты, пошедшей на титрование,
мл;
![]() –объём
пробы воды, взятой для титрования, мл;
–объём
пробы воды, взятой для титрования, мл;
![]() –нормальная
концентрация кислоты, экв./л;
–нормальная
концентрация кислоты, экв./л;
Отсюда:
![]() (мэкв/л).
(мэкв/л).
Аналогично можно рассчитать общую жесткость воды (Жобщ.) по объёму трилона Б, пошедшего на титрование:
![]() (мэкв/л).
(мэкв/л).
Эквивалент
трилона Б равен
![]() г
г
Для устранения жесткости на практике часто используется известково-содовый метод. Добавление к воде Ca(OH)2 устраняет карбонатную жесткость (ЖК), а добавление (Na2CO3) – некарбонатную жесткость (ЖНК).
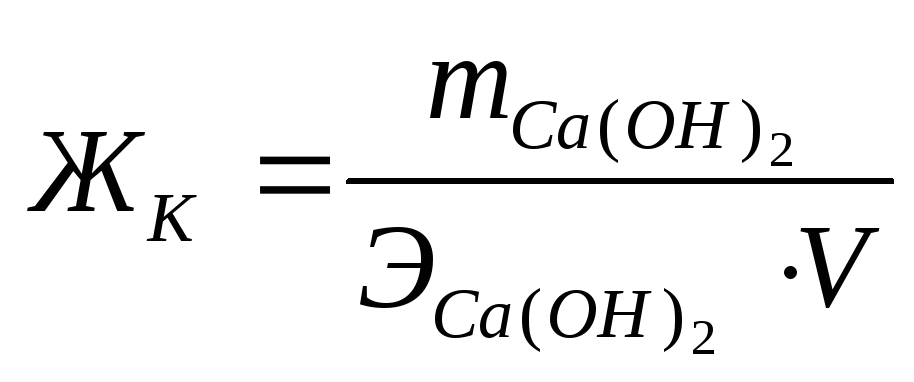 ;
; 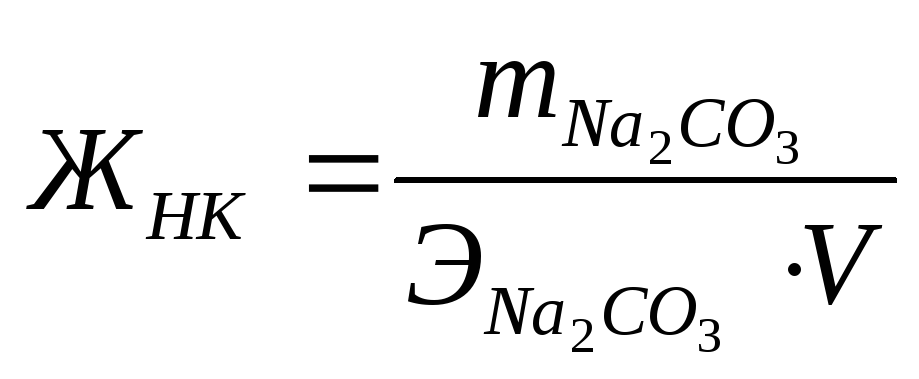 ;
;
![]() .
.
Иногда при умягчении воды известково-содовым методом дозы извести и соды, вводимые в воду, определяются пробным умягчением. Для ориентировочных расчетов можно использовать следующие формулы:
![]()
![]()
где
![]() и
и![]() – содержание извести и соды, мг/л;
– содержание извести и соды, мг/л;
![]() –карбонатная
жесткость, мэкв/л;
–карбонатная
жесткость, мэкв/л;
![]() –магниевая
жесткость, мэкв/л;
–магниевая
жесткость, мэкв/л;
![]() –содержание
диоксида углерода, мэкв/л;
–содержание
диоксида углерода, мэкв/л;
![]() –некарбонатная
жесткость, мэкв/л;
–некарбонатная
жесткость, мэкв/л;
0,5 – избыток реактива, мэкв/л;
28 – масса мг-эквивалента оксида кальция, мг;
53 – масса мг-эквивалента соды, мг.
Широкое применение для умягчения воды нашли ионообменные смолы. В этом случае расчеты обычно связаны с определением обменной емкости (ε) ионитов. Обменной емкостью катионита называют максимальное количество ионов (в мэкв/г и мэкв/л), поглощаемое I г катионита обменным путем. Рассчитывают ε из соотношений:
![]() (мэкв/г),
(мэкв/г),
где V – объём воды, пропущенной через катионит, л;
m – масса катионита, г;
![]() (мэкв/л),
(мэкв/л),
где Ж – жесткость воды, мэкв/л;
V – объём воды, пропущенной через катионит, л;
V1 – объём катионита, см3.
