
- •Министерство высшего образования
- •Введение
- •1. Химическая термодинамика предмет и задачи термодинамики
- •1.1 Основные понятия и определения химической
- •1.2 Первый закон термодинамики
- •1.3 Применение первого закона термодинамики к процессам в любых системах
- •1.6 Теплоемкость. Связь теплоемкости с
- •1.7 Зависимость теплового эффекта oт температуры.
- •1.8 Второй закон термодинамики
- •1.9 Энтропия
- •1.10 Второй закон термодинамики для обратимых и
- •1.12 Постулат планка.Вычисление абсолютной энтропии
- •1.14 Энергия гельмгольца (изохорно-изотермический
- •1.15 Энергия гиббса (изобарно-изотермический
- •1.16 Уравнение гиббса-гельмгольца
- •1.17 Характеристические функции
- •1.18 Химический потенциал.Летучесть
- •1.20 Уравнение изотермы реакции
- •1.21 Зависимость константы равновесия от температуры
- •1.23 Тепловая теорема нернста
- •1.24 Расчет химического равновесия с помощью
- •2. Фазовые равновесия
- •2.1 Общие понятия
- •2.2 Условия фазового равновесия
- •2.3 Правило фаз гиббса
- •2.4 Уравнение клаузиуса-клапейрона
- •2.5 Однокомпонентная система воды
- •2.6 Диаграммы состояния двухкомпонентных
- •2.6.1 Система с неограниченной растворимостью
- •2.6.3 Система с ограниченной растворимостью
- •2.7 Трехкомпонентные системы
- •3. Растворы
- •3.1 Характеристика растворов
- •3.2 Закон рауля
- •3.5 Жидкие бинарные системы. Идеальные растворы
- •3.6 Растворы с положительными и отрицательными
- •3.7 Состав паровой фазы над растворами. Законы
- •3.7.1 Диаграммы состав – давление пара (температура
- •3.7.2 Перегонка. Ректификация
- •Ректификация
- •3.8 Термодинамика концентрированных
- •3.10 Растворимость твердых тел в жидкостях
- •3.12Распределение растворенного вещества между
- •4.2 Математическое описание волнового движения
- •4.3 Уравнение шредингера
- •4.4 Решение уравнения шредингера
- •4.7 Распространение волнового уравнения на
- •4.8 Атомные термы
- •5.1 Ионная связь. Энергия кристаллической решетки
- •5.2 Ковалентная связь
- •5.4 Расчет молекулярного иона водорода
- •5.7 Квантовохимические представления о координационных соединениях
- •5.9 Водородная связь
- •6.1 Дипольный момент молекул
- •Содержание
- •1.Химическая термодинамика
- •2.Фазовые равновесия
- •3.Растворы
- •4.Строение атомов
- •5.Химическая связь
- •6.Электрические и магнитные свойства молекул
5.9 Водородная связь
Водородная связь является промежуточной между молекулярными и химическими силами взаимодействия. Эта своеобразная связь устанавливается между водородным атомом, имеющим отличительные особенности от всех остальных атомов. Отдавая свой электрон на образование связи он остается в виде ядра(протона) без электрона, т.е. в виде частицы, диаметр которой в тысячи раз меньше диаметров остальных атомов. Кроме того, вследствие отсутствия у него электронов ион Н+ не испытывает отталкивания от электронной оболочки другого атома, а наоборот притягивается ею. Это позволяет ему ближе подходить к другим атомам, вступать во взаимодействие с их электронами и даже внедряться в их электронные оболочки. Поэтому в жидкостях водородный ион не сохраняется в виде самостоятельной частицы, а связывается с молекулами других веществ. В воде он связывается с молекулами Н2О, образуя ионы гидроксония Н3О+,с молекулами аммиака NH4+.
Водородная связь представляет собой как бы вторую побочную валентность водородного атома.
Сила связи 20-30 кдж/моль
Весьма важную роль водородная связь играет в структуре воды и льда
Длина связи Н-О ковалентная = 0,99 А°,длина водородной связи - 1,76 А°.
При плавлении льда происходит разрушение водородных связей, а при нагревании происходит расширение. Разрушение водородных связей приводит к уменьшению объема и в результате плотность воды проходит через максимум при 4°С.
6. ЭЛЕКТРИЧЕСКИЕ И МАГНИТНЫЕ СВОЙСТВА МОЛЕКУЛ
6.1 Дипольный момент молекул
При несовпадении центров тяжести электрических зарядов в молекуле возникают электрические полюса - положительный и отрицательный. Такие молекулы называются полярными. Система из двух одинаковых противоположных зарядов называется диполем.
За меру полярности принимается величина дипольного момента , который представляет собой произведение заряда q на расстояние l
= q.l
По порядку величины дипольный момент равен заряду электрона, умноженному на расстояние ( 10-10 эл.ст.ед. 10-8 см ),что составляет 10-18 эл.ст.ед.см и равняется 1 дебаю.
Если в молекуле имеется несколько полярных связей, то суммарный момент равен векторной сумме дипольных моментов отдельных связей
6.2 ПОЛЯРИЗАЦИЯ МОЛЕКУЛ. МОЛЬНАЯ РЕФРАКЦИЯ
Различные изменения, которые претерпевают молекулы под воздействием на них внешнего электрического поля, называются поляризацией. Различают ориентационную, атомную и электронную поляризации.
Ориентационная поляризация представляет ориентацию полярных молекул в пространстве в соответствии с направлением внешнего электрического поля. С повышением температуры ориентационная поляризация уменьшается.
Под атомной поляризацией подразумевается относительное смещение атомов, входящих в состав молекулы. Она характеризует смещение положительно заряженных ядер относительно отрицательного полюса.
При электронной поляризации происходит смещение электронов относительно ядра атома.
Атомная и электронная поляризации от температуры не зависят. Сумму электронной, атомной и ориентационной поляризаций называют общей или мольной поляризацией.
Р = Ра + Рэ + Рор = Рор + Рд
Рд = Ра + Рэ
Сумму атомной и электронной называют деформационной поляризацией.
При взаимодействии молекул с электромагнитными полями, в частности с видимым светом ( = 4000-8000 А ),атомная и ориентационная поляризации не возникают, так как атомы не успевают перемещаться с та кой же скоростью, с которой происходят световые колебания. Электроны реагируют на колебания света. Мольная поляризация при этом равна только электронной поляризации и называется мольной рефракцией
Rm = Рэ
Мольная рефракция обладает аддитивными свойствами и является характерной константой данного вещества.
Аддитивность рефракции используется для выяснения строения органических молекул.
Rm = n Ri ,где n - число атомов
Ri - инкременты мольной рефракции
СН3-СН2-СООН - пропионовая кислота
Rm = 3Rc + 6Rн + Rо-гидрокс + Rо-карбокс =
=32,418 + 61,10 + 1,325 + 2,211 = 17,59 см3/г-ат
Опыт дает 17,68 см3/г-ат.
6.3 ОПРЕДЕЛЕНИЕ ДИПОЛЬНЫХ МОМЕНТОВ И МОЛЬНОЙ
РЕФРАКЦИИ
Широкое распространение получили методы определения дипольных моментов измерением диэлектрической проницаемости паров и разбавленных растворов полярных веществ в неполярных растворителях.
Р
=
![]()
![]() =
=![]() Na
- уравнение Клаузиуса-Моссотти
Na
- уравнение Клаузиуса-Моссотти
- диэлектрическая проницаемость
- поляризуемость
- плотность
= n2
Rm
=
![]()
![]() уравнение Лорентца-Лоренца
уравнение Лорентца-Лоренца
r
=
![]() =
=
![]()
![]() r
– удельная рефракция
r
– удельная рефракция
Для полярных молекул характерно неравенство
![]()
![]()
![]()
![]()
Для полярных молекул Дебай показал
P
=
![]()
![]() = 4/3Na(
+
= 4/3Na(
+
![]() )
)
Для газов
Если переписать уравнение Р = А + В/T , где
А
= 4/3Na
B
=
![]()
Построив график зависимости Р от 1/Т, можно по тангенсу угла наклона прямой рассчитать дипольный момент.
Для жидких и твердых веществ
Растворяют вещество в неполярном растворителе и находят зависимость мольной поляризации Р12 от концентрации раствора
Р12
=
![]()
![]()
Р12 = P1N1 + P2N2
P2
=
![]()
Далее вычерчивают кривую зависимости поляризации от концентрации, экстраполируют кривую до бесконечного разведения раствора и определяют графически поляризацию вещества при его предельном разбавлении и заданной температур - Р. Вычислив Р при нескольких температурах строят зависимость Р = f(1/T) и по tg вычисляют дипольный момент.
Для одной температуры можно найти дипольный момент следующим образом
P
= Rm
+
![]()
Для газов
= 1,281510-20 √(Р - Rm)T эл.ст.ед.
Для твердых и жидких веществ
= 1,281410-20√(Р - Rm)T эл.ст.ед.
6.4 МАГНИТНЫЕ СВОЙСТВА АТОМОВ И МОЛЕКУЛ
Мерой магнитных свойств вeщества служит магнитная восприимчивость К, характеризующая отношение исследуемых объектов к магнитному полю. Вещества с отрицательной восприимчивостью, т.е. такие, которые оказывают большее сопротивление магнитным силовым линиям, чем вакуум называются диамагнитными, вещества с положительной восприимчивостью называются парамагнитными, с очень высокой восприимчивостью называются ферромагнитными.
В кристаллах диамагнитная восприимчивость часто оказывается анизотропной и определением главных восприимчивостей можно воспользоваться для получения информации о структуре кристалла. Этот метод применяется в основном к плоским ароматическим молекулам. Обычно магнитная восприимчивость в плоскости кольца и в направлении перпендикулярно плоскости сильно различаются.
Парамагнетизм связан обычно с наличием неспаренных электронов
( NO,NO2,ClO2,O2,S2 ).
Отсутствие парамагнетизма может служить основой для определения истинной формулы молекулы. Hg2Cl2 a не HgCl, H4P2O6 а не H2PO3, H2S2O4 а не HSO2.
Неспаренный электрон имеет как спиновый, так и орбитальный угловой моменты. Спиновый угловой момент можно рассматривать как результат вращения электрона вокруг собственной оси, а орбитальный момент -как результат движения электрона вокруг атомного ядра. Сочетание этих двух эффектов приводит к возникновению магнитного момента и, следовательно, парамагнетизма.
Если имеется n-неспаренных электронов, то магнитный момент выражается чисто спиновой формулой
эфф
=
![]()
эфф выражается в единицах магнетона Бора (В.М.), представляющего собой естественную единицу измерения магнетизма и равного магнитному моменту электрона, вращающегося вокруг собственной оси.
(В.М.)
=
![]() = 9,283710-21
эрг/гс
= 9,283710-21
эрг/гс
Число неспаренных электронов 1 2 3 4 5
эфф В.М. 1,73 2,83 3,87 4,9 5,92
Если по наблюдаемому магнитному моменту можно определить число неспаренных электронов, то иногда удается получить информацию о валентности парамагнитного атома, его стереохимии или типе связи в комплексах металлов.
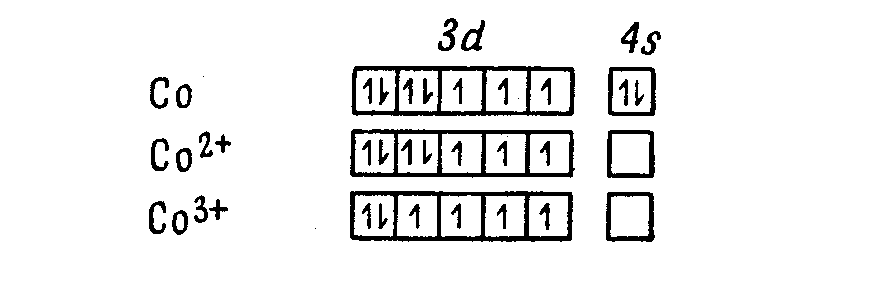
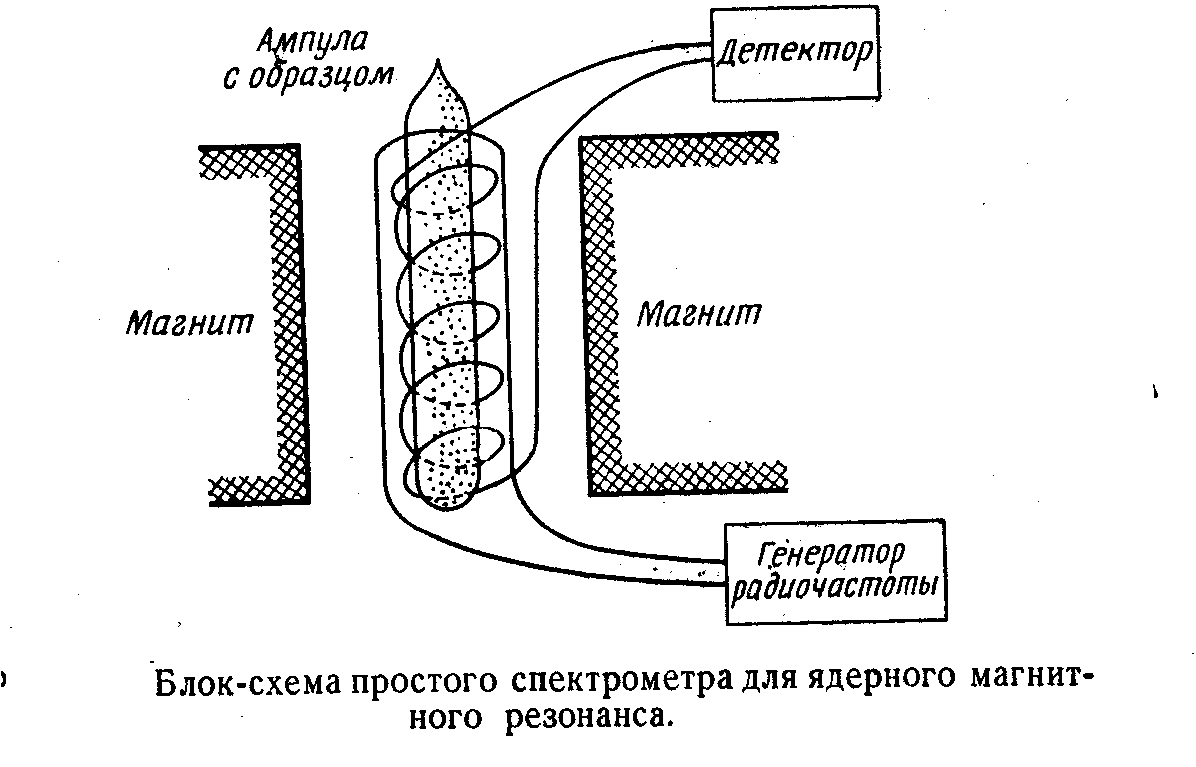
6.5 ЯДЕРНЫЙ МАГНИТНЫЙ РЕЗОНАНС (ЯМР)
Ядра как и электроны обладают собственным магнитным моментом количества движения - спином. Квантовое число mJ = 1/2.Значение mJ = + 1/2 отвечает ориентации вектора в направлении магнитного поля, а -1/2 ориентации в противоположном направлении.
В отcутствии магнитного поля все ориентации ядерного момента вырождены, но при наложении поля вырождение снимается

E = 2H° = h/2 H0 ,где
- магнитный момент
- гиромагнитное отношение
H - напряженность внешнего магнитного поля
Переориентация спина равнозначна переходу с одного уровня на другой и поэтому при этом энергия поглощается или выделяется в виде кванта электромагнитного излучения h
E = h0 = h/2H0
0 = /2H0 - резонансная частота, т.е. частота при которой происходит переориентация спинов.
Можно заставить ядра переходить с одного уровня на другой. Для этого необходимо, чтобы ядра нижнего уровня поглотили количество энергии с резонансной частотой. В этом случае на систему надо наложить еще радиочастотное поле. Так как энергия этого поля будет тратится, то будут появляться сигналы поглощения поля, которые могут быть усилены современной радиоаппаратурой.
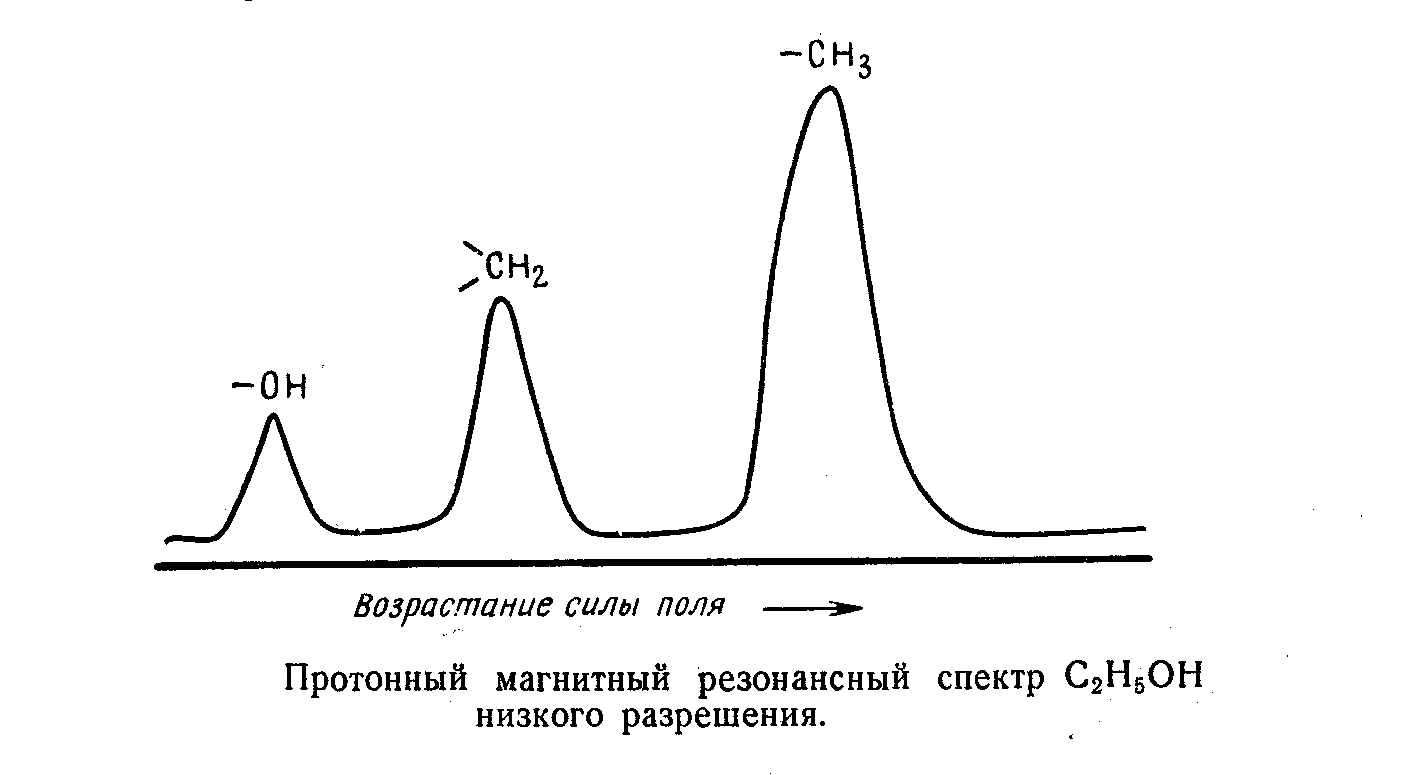
Химический сдвиг
Энергия резонанса зависит от электронного окружения ядра. Электроны экранируют ядро, так что напряженность поля у ядра НN отличается от напряженности приложенного поля Н0
НN = H0 (1 - )
- постоянная экранирования
Электрон прецессирует и создает добавочное поле, направленное против поля Н0
Смещение сигнала ядерного резонанса в зависимости от химического окружения, обусловленное различием в константах экранирования называется химическим сдвигом. Его измеряют в м.д. - миллионных долях приложенного поля.
За О принимается сигнал (СН3)4-Si - тетраметилсилан. Здесь протоны имеют наибольшую плотность. Обычно меняется от 0 дo 10 м.д.
Спин-спиновое взаимодействие


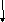
 Спин-спиновое
взаимодействие вызывает расщепление
линий химических сдвигов. Оно обусловлено
тем, что ядерные спины стремятся
ориентировать спины электронов, те в
свою очередь ориентируют спины электронов
других ядер, а через них спины этих ядер.
Спин-спиновое
взаимодействие вызывает расщепление
линий химических сдвигов. Оно обусловлено
тем, что ядерные спины стремятся
ориентировать спины электронов, те в
свою очередь ориентируют спины электронов
других ядер, а через них спины этих ядер.
Д ля
подсчета числа сигналов спин-спинового
взаимодействия пользуются формулой
ля
подсчета числа сигналов спин-спинового
взаимодействия пользуются формулой


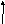





2nJ + 1 , где
n - число протонов в соседней группе
J = 1/2
CH3OH CH3 │ n = 1 2nJ + 1 = 2
OH │ n = 3 2nJ + 1 = 4
-ОН
- СН3









6.6 ЭЛЕКТРОННЫЙ ПАРАМАГНИТНЫЙ РЕЗОНАНС (ЭПР)
Открыт в 1944 году в Казани советским ученым Е.К.Завойским. Также как у ядер при наложении магнитного поля происходит расщепление энергетических уровней электрона.
При наложении добавочного радиочастотного поля можно заставить электроны переходить с одного уровня на другой и при этом будет поглощаться энергия радиочастотного поля, которую можно зарегистрировать.
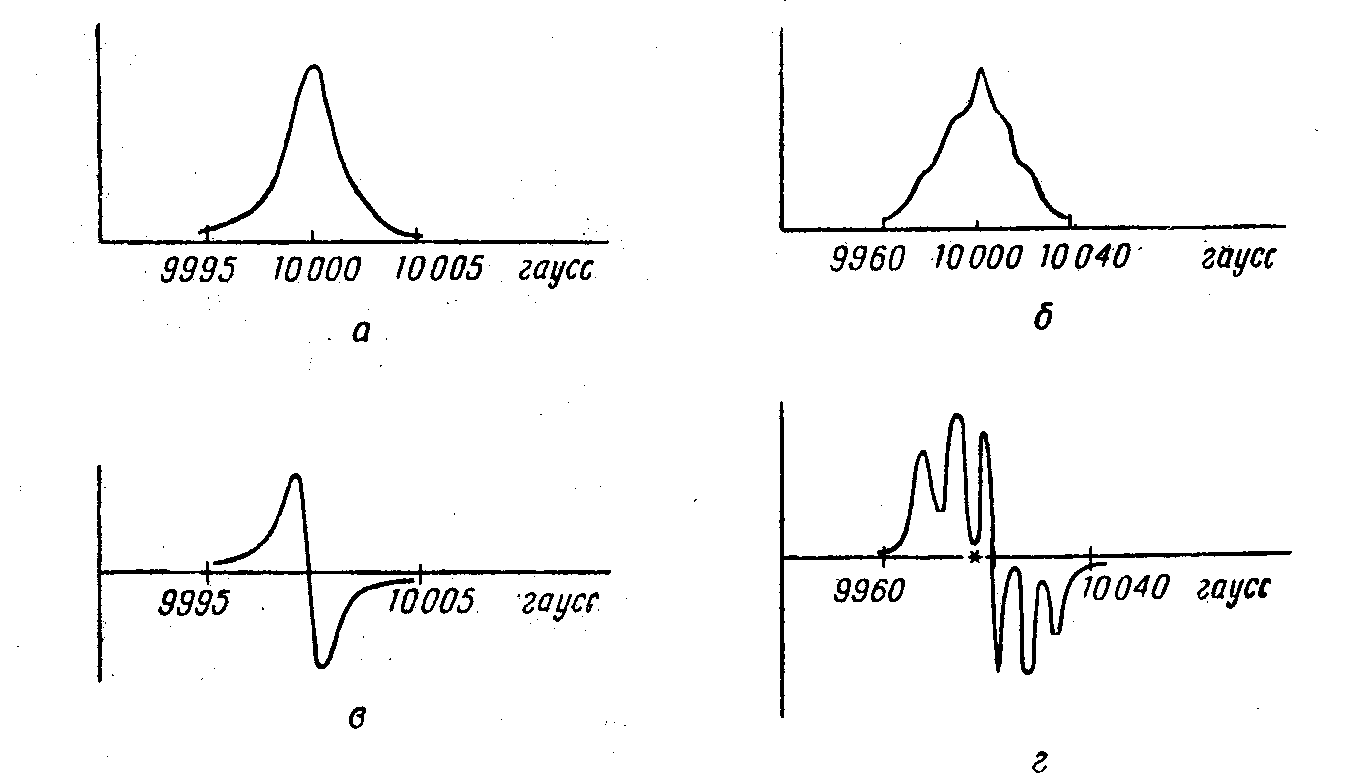
Спектр ЭПР можно представить в виде графика зависимости интенсивности от напряженности наложенного поля, но обычно спектры ЭПР представляются в виде производных кривых, т.е. графиков зависимости первой производной кривых поглощения от напряженности магнитного поля. Такой способ дает возможность получить гораздо большую чувствительность в случае широких линий.
6.7 СПЕКТРОСКОПИЯ
Спектральные методы широко используются при исследованиях структуры и энергетических уровней молекул. Спектральные методы наиболее информированы. Полученные с их помощью значения молекулярных констант широко используются при статистико-термодинамических расчетах констант равновесия и теплофизических свойств газов. Эти методы нашли также повсеместное применение в химическом анализе.
Электромагнитный спектр простирается от области жесткого излучения с очень короткой длиной волны до длинных радиоволн.
Частота электромагнитных колебаний связана с длиной волны света
= с/, где с - скорость света 2,9979241010 см/c
Размерность частоты │ │ = с-1
В спектроскопии принято называть частотой также волновое число (), показывающее сколько длин волн умещается на 1 см. Размерность││=см-1
Схема спектра
|
Радиочас- тотная об ласть |
Микро- волновая область |
Дальняя ИК область |
Ближняя ИК область |
Видимая область |
УФ область |
Рентге- новские и -лучи |
|
3км-30см |
30см-3мм |
3мм-0,03мм |
0,03мм-700нм |
700нм-420нм |
420- 3нм |
3нм-3пм |
Видимая область
700 620 580 530 470 440 420 нм
красный оранжевый желтый зеленый голубой синий фиолетовый
Каждая из областей спектра связана с определенными видами внутримолекулярных движений, процессами в атомах и ядрах. Все виды внутримолекулярных движений взаимосвязаны. Однако для каждой из них существует определенный набор допустимых значений энергии. При переходе с одного энергетического уровня на другой молекула поглощает или испускает квант света - фотон. Переходы с нижнего уровня на верхний порождают спектр поглощения, с верхнего на нижний - спектр испускания.
Наиболее высоки кванты энергии, поглощенные или испускаемые при электронных переходах, затем следуют колебательные кванты и, наконец, самые малые, вращательные. Поэтому электронный переход обычно сопровождается колебательными и вращательными переходами.
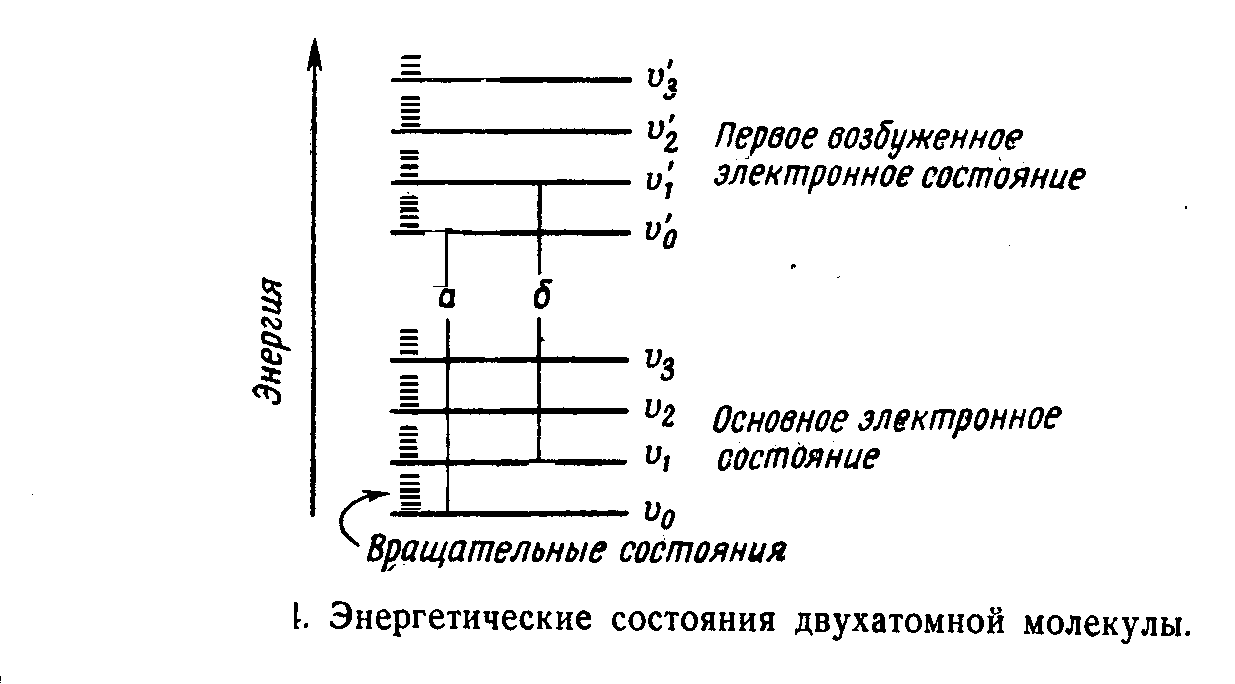
6.8 ВРАЩАТЕЛЬНЫЕ СПЕКТРЫ
Молекулы газообразных веществ постоянно совершают свободное вращательное движение вокруг осей симметрии. Кинетическая энергия молекул будет определяться их моментом инерции
I = r2
где
=
![]() =
=![]()
![]()
mА,mВ - массы атомов, а1,а2 - атомные веса
m0
- масса атома кислорода
![]() = 1,6610-27
кг
= 1,6610-27
кг
Молекулы не могут вращаться с произвольными угловыми скоростями, излучать или поглощать энергию произвольной величины. Вращательное движение молекулы описывается волновым уравнением Шредингера
Н = Евр
Решение этого уравнения дает значение энергии Евр как функцию вращательного квантового числа и момента инерции молекулы.
Евр
=
![]() i(i+1),
i(i+1),
где i = 0,1,2,3 - вращательное квантовое число
Изменение энергии при квантовом переходе с i1 на i2 = =1
E = h2/82I [i2(i2 + 1) - i1(i1 + 1)] =
=h2/82I 2(i + 1)
учитывая соотношение Е = h и Е = hc
получим = E/hc = h/42Ic (i+ 1) = B (i + 1)
В - вращательная постоянная
1 = B(i + 1)
2 = Bi
w = w1 - w2 = B
эту величину можно найти из спектра и использовать для вычисления момента инерции молекул
I = h/42Bc
Зная момент инерции можно определить длину связи между атомами в двухатомной молекуле
r
=
![]()
6.9 КОЛЕБАТЕЛЬНЫЕ СПЕКТРЫ
Колебательный спектр многоатомной молекулы значительно сложен. Колебания многоатомных молекул можно разделить на валентные и деформационные. При валентных колебаниях изменяются межъядерные расстояния, а при деформационных угол между направлением химических связей.
Сопоставление колебательных спектров многих органических соединений, в состав которых входят одинаковые функциональные группировки (СН3,СН2,ОН,NH2 и т.д.) показало, что в этих спектрах всегда присутствуют одни и те же мало отличающиеся друг от друга частоты. Было установлено, что некоторые частоты можно отнести к колебаниям ядер атомов в определенных атомных группировках. Такие частоты называются характеристическими. Обнаружение в спектре какого-либо соединения характеристических частот позволяет определить наличие в нем определенных функциональных групп. Это лежит в основе функционального молекулярного спектрального анализа органических соединений. Инфракрасный спектр является тонкой характеристикой вещества и служит критерием для установления идентичности соединений, дает информацию о наличии или отсутствии тех или иных групп атомов.
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
1.Краткий курс физической химии. Под ред. С. Н. Кондратьева. – М.: Высш. школа, 1978. 312 с.
2. А.Г. Стромберг, Д. П. Семченко. Физическая химия. - М.: Высш. школа, 1973. 480 с.
3.Физическая химия. Под ред. К.С. Краснова. – М.: Высш. школа, 1982. 687 с.
4. Я. И. Герасимов и др. Курс физической химии. т.1. – М.: Химия, 1969. 592 с.
5.Краткий справочник физико-химических величин. Под ред. К.П.Мищенко. – Л.: Химия, 1983. 232 с.
6. И.В. Кудряшов Г.С. Каретников. Сборник примеров и задач по физической химии. – М.: Высш. школа, 1991. 527 с.
