- •Министерство высшего образования
- •Введение
- •1. Химическая термодинамика предмет и задачи термодинамики
- •1.1 Основные понятия и определения химической
- •1.2 Первый закон термодинамики
- •1.3 Применение первого закона термодинамики к процессам в любых системах
- •1.6 Теплоемкость. Связь теплоемкости с
- •1.7 Зависимость теплового эффекта oт температуры.
- •1.8 Второй закон термодинамики
- •1.9 Энтропия
- •1.10 Второй закон термодинамики для обратимых и
- •1.12 Постулат планка.Вычисление абсолютной энтропии
- •1.14 Энергия гельмгольца (изохорно-изотермический
- •1.15 Энергия гиббса (изобарно-изотермический
- •1.16 Уравнение гиббса-гельмгольца
- •1.17 Характеристические функции
- •1.18 Химический потенциал.Летучесть
- •1.20 Уравнение изотермы реакции
- •1.21 Зависимость константы равновесия от температуры
- •1.23 Тепловая теорема нернста
- •1.24 Расчет химического равновесия с помощью
- •2. Фазовые равновесия
- •2.1 Общие понятия
- •2.2 Условия фазового равновесия
- •2.3 Правило фаз гиббса
- •2.4 Уравнение клаузиуса-клапейрона
- •2.5 Однокомпонентная система воды
- •2.6 Диаграммы состояния двухкомпонентных
- •2.6.1 Система с неограниченной растворимостью
- •2.6.3 Система с ограниченной растворимостью
- •2.7 Трехкомпонентные системы
- •3. Растворы
- •3.1 Характеристика растворов
- •3.2 Закон рауля
- •3.5 Жидкие бинарные системы. Идеальные растворы
- •3.6 Растворы с положительными и отрицательными
- •3.7 Состав паровой фазы над растворами. Законы
- •3.7.1 Диаграммы состав – давление пара (температура
- •3.7.2 Перегонка. Ректификация
- •Ректификация
- •3.8 Термодинамика концентрированных
- •3.10 Растворимость твердых тел в жидкостях
- •3.12Распределение растворенного вещества между
- •4.2 Математическое описание волнового движения
- •4.3 Уравнение шредингера
- •4.4 Решение уравнения шредингера
- •4.7 Распространение волнового уравнения на
- •4.8 Атомные термы
- •5.1 Ионная связь. Энергия кристаллической решетки
- •5.2 Ковалентная связь
- •5.4 Расчет молекулярного иона водорода
- •5.7 Квантовохимические представления о координационных соединениях
- •5.9 Водородная связь
- •6.1 Дипольный момент молекул
- •Содержание
- •1.Химическая термодинамика
- •2.Фазовые равновесия
- •3.Растворы
- •4.Строение атомов
- •5.Химическая связь
- •6.Электрические и магнитные свойства молекул
5.4 Расчет молекулярного иона водорода
=
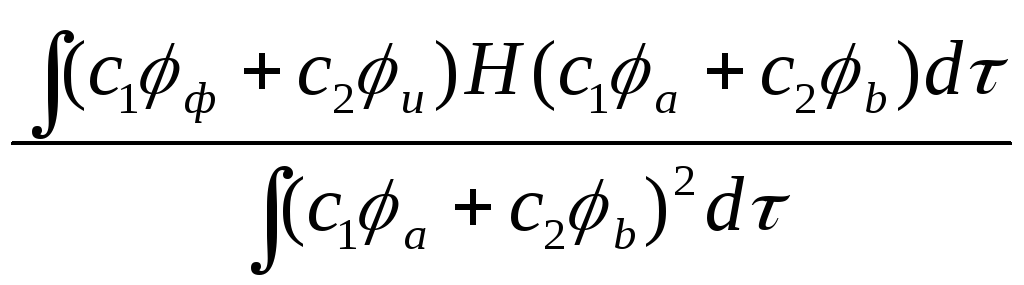
[c12![]() +
c22
+
c22
![]() + 2c1c2
+ 2c1c2
![]() ] = c12
] = c12
![]() + c22
+ c22
![]() +
c1c2
+
c1c2
![]() + с1с2
+ с1с2![]()
S
= Sab
= Sba
=
![]() интеграл перекрывания
интеграл перекрывания
Hab
= Hba
=![]() =
=![]() - резонансный или обменный
- резонансный или обменный
интеграл
Нaa
= Hbb
=
![]() =
=![]() - кулоновский интеграл
- кулоновский интеграл
Интеграл перекрывания отражает степень перекрывания двух
АО а и b.
Кулоновский интеграл равен энергии одного электрона, принадлежащего данному атому -отрицательная величина.
Резонансный интеграл - характеризует взаимодействие электронных орбиталей соседних атомов в молекуле ( энергия электронного заряда, распределенного с плотностью перекрывания в поле притяжения обоих ядер - отрицательная величина)
![]() =
=
![]() = 1
= 1
( c12 + c22 + 2c1 c2 S ) = ( c12 + c22 ) Haa + 2c1 c2 Hab
Используя вариационный метод находим производные
![]()
![]()
и приравниваем их нулю.
2 с1 + 2 c2 S = 2 c1 Haa + 2 c2 Hab
c1 ( Haa - ) + c2 ( Hab - S ) = 0
2 c2 + 2 c1 S = 2 c2 Haa + 2 c1 Hab
c1(Hab - S ) + c2 ( Haa - ) = 0
![]() =
=
c1 + c2 = 0
c1![]() +
c2
= 0
+
c2
= 0
отсюда = 1/
2 = 1
= -1 = 1
Подставив эти выражения в формулу получим энергии двух молекулярных орбиталей
Haa - E = Hab - E S
Haa - E = - Hab + E S
Eu
=
![]()
Eg
=
![]()
В связи с тем, что величина резонансного интеграла < 0, энергия Еg < Eu
Подставляя значения в другое уравнение получим
с1 =с2 с1 = - с2
Возьмем условия нормировки
![]() =
=
![]() (c1
a+c2
b)2
d=
c1`2
+ c22
+ 2c1c2
S=1
(c1
a+c2
b)2
d=
c1`2
+ c22
+ 2c1c2
S=1
Отсюда получим
Cg
= C1
= C2
=
![]()
Cu
= C1
= - C2
=![]()
Подставляя эти значения получим выражение для МО
g
=
![]() (a
+ b)
(a
+ b)
u
=
![]() (a
- b)
(a
- b)
Таким образом, при расчете по методу МО получаются два уровня энергии системы и соответственно две орбитали: связывающая, отвечающая образованию химической связи и разрыхляющая, характеризующая отталкивание.
5.5 ПРИМЕНЕНИЕ МЕТОДА МО К ДВУХАТОМНЫМ МОЛЕКУЛАМ
Молекула Li2 Li 1s2 2s1
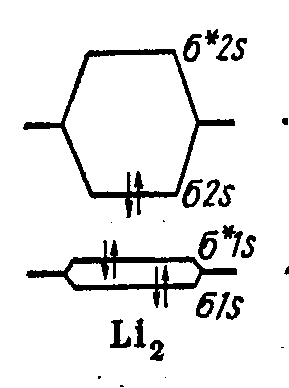
Молекула Ве2 Be 1s2 2s2

Связь не должна образовываться
Молекула В2 В 1s2 2s2 2p1
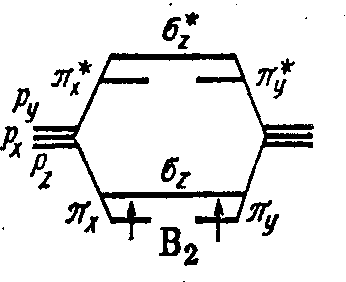
Молекула С2 С 2s2 2p2

Молекула N2 N 2s2 2p3
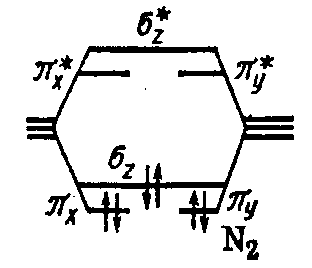
Молекула О2 О 2s2 2p4
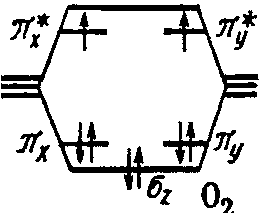
Молекула F2 F 2s2 2p5
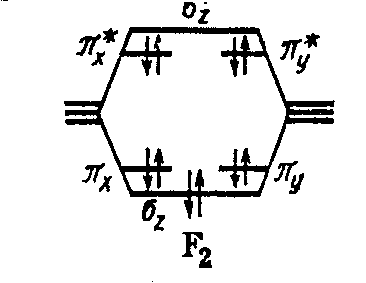
Молекула Ne2 Ne 2s2 2p6
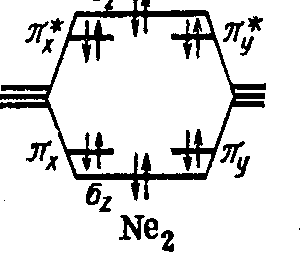
Молекулы Ne2 не существует
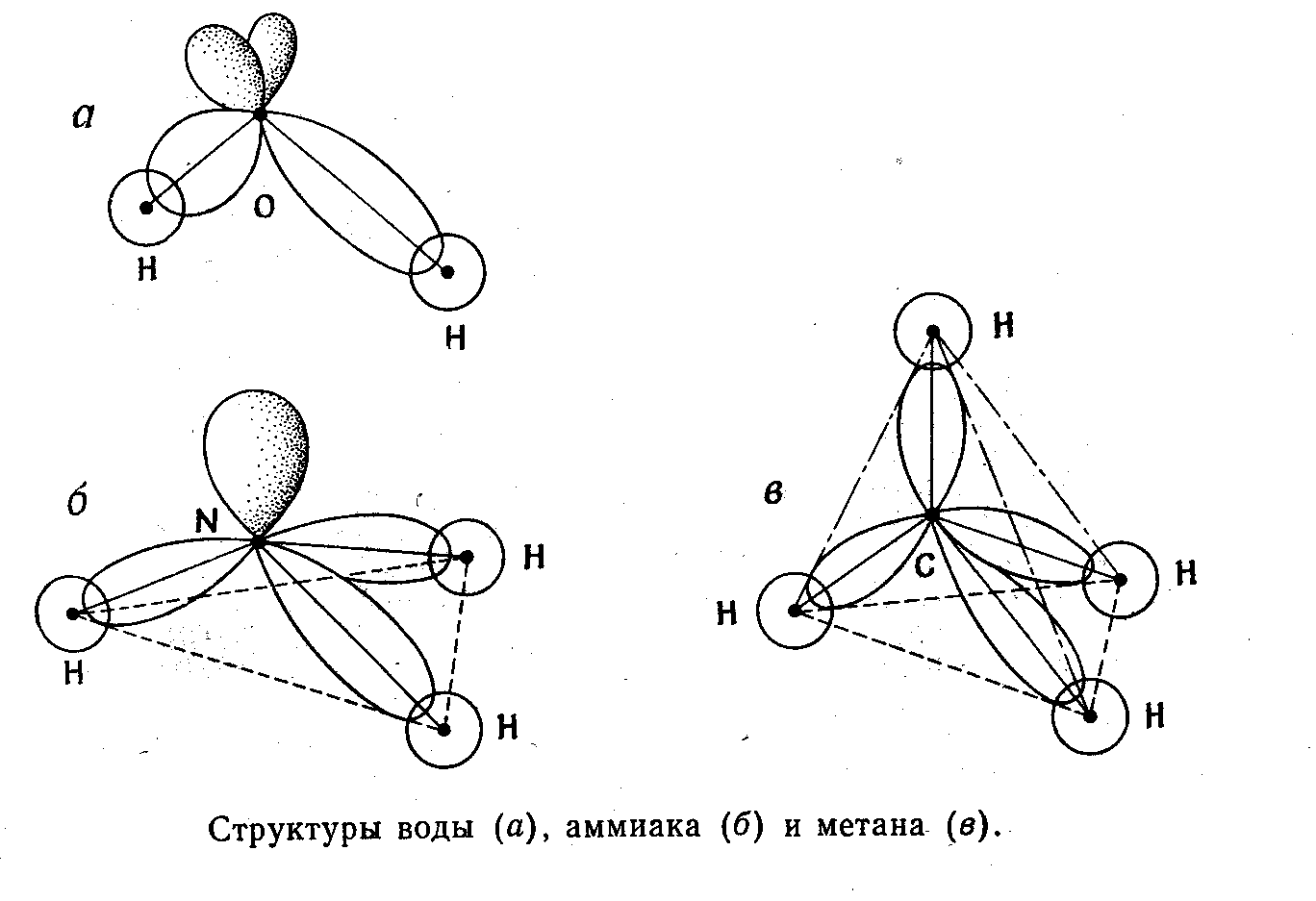
5.6 ТЕОРИЯ ВАЛЕНТНЫХ СВЯЗЕЙ
Сущность теории валентных связей состоит в том, что неспаренный электрон на орбитали одного атома, например Рх-орбитали, находится в состоянии обменного взаимодействия с неспаренным электроном на орбитали соседнего атома (1S).
Ответственным за образование связи считаются два электрона с противоположными спинами, принадлежащими двум соседним атомам. Это соответствует связи, образованной обобществленной
парой электронов.

Наиболее строгий подход в рамках метода валентных связей, позволяющий получать лучшее приближение к экспериментальному значению, основан на концепции гибридизации. В основе этого подхода лежит замена набора водородoподобных атомных орбиталей новыми волновыми функциями.
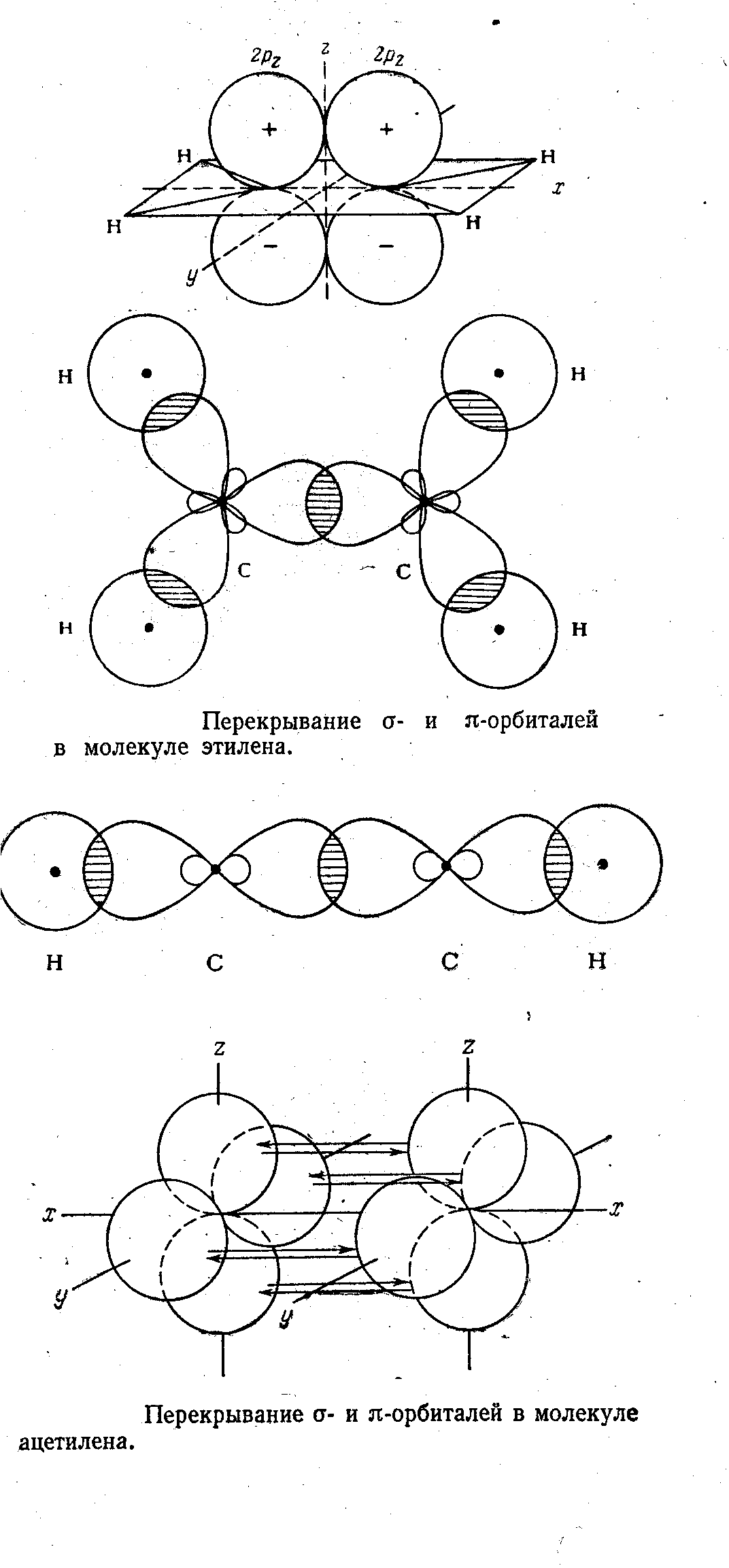
В качестве примера рассмотрим гибридизацию одной S-орбитали с одной Р-орбиталью с образованием гибридных SP-орбиталей.
Процесс гибридизации можно представить математически как сложение отдельных волновых функций.
В случае SP-гибридизации две результирующие волновые функции имеют вид:
1 = 1/√2( s + p )
2 = 1/√2( s - p )
Гибридные орбитали имеют вид:
sp = 1/√2( s p )

Использование двух таких равноценных гибридных орбиталей должно приводить к линейной молекуле. Три гибридные орбитали, образованные из одной S и двух Р-орбиталей по форме аналогичны и ориентированы друг к другу под углом 120°
Наиболее часто встречается SP3-гибридизация.
Волновые функции имеют вид
1 = 1/2( s + px + py + pz )
2 = 1/2( s + px - py - pz )
3 = 1/2( s - px + py - pz )
4 = 1/2( s - px - py + pz )