
6 курс / Медицинская реабилитация, ЛФК, Спортивная медицина / Физиотерапия, лазерная терапия / Пути_практического_использования_интенсивного_теплолечения_Сувернев
.pdf
СИБИРСКИЙ НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ ГИПЕРТЕРМИИ
ПУТИ ПРАКТИЧЕСКОГО ИСПОЛЬЗОВАНИЯ ИНТЕНСИВНОГО ТЕПЛОЛЕЧЕНИЯ
Научный редактор чл.-кор. РАМН, профессор А.В. Ефремов
НОВОСИБИРСК АКАДЕМИЧЕСКОЕ ИЗДАТЕЛЬСТВО “ГЕО” 2009
УДК 615.832.3 ББК 28.072
П901
Авторы:
А.В. Сувернев, Г.В. Иванов, И.В. Василевич, В.Н. Гальченко, Р.П. Алейников, С.Ю. Новожилов
Пути практического использования интенсивного теплолечения
(Второе сообщение) / А.В. Сувернев, Г.В. Иванов, И.В. Василевич и др. ; Сиб. науч.-исслед. ин-т гипертермии. – Новосибирск : Академическое изд-во “Гео”, 2009. – 109 с. – ISBN 978-5-904682-03-3 (в пер.).
В книге обосновывается безопасность искусственной кратковременной (пиковой) общей гипертермии высокого уровня (выше 43 °С) в отношении организма человека и животных для терапевтического применения.
Особое значение в изучении обратимости теплового шока уделено трипсину поджелудочной железы, как неспецифической поливалентной протеиназе с многосторонним патологическим влиянием на живые белки, клетки, ткани и органы. Описана методика общей гипертермии, приведены примеры и некоторые результаты применения интенсивного теплового лечения у человека.
Для биологов, физиологов, патофизиологов и врачей.
|
© |
Коллектив авторов, 2009 |
ISBN 978-5-904682-03-3 |
© Оформление. Академическое |
|
|
изд-во “Гео”, 2009 |
|
В саду сжигают опавшие листья, в городах сжигают мусор; гипертермические ванны сжигают органическую пыль, они подметают соединительные пути – капилляры – и чистят внеклеточные и интерстициальные жидкости. В этом тайна универсальной широты воздействия гипертермических ванн.
А.С. Залманов
Give me the power to create fever and I will heal all illnesses.
Parmenides. Approx. 540–480 b.c.
Глава 1
ОСНОВНЫЕ ПОНЯТИЯ И ПРЕДСТАВЛЕНИЯ
1.1. Тепло и живые структуры
Метаболизм в клетках, тканях, органах и организме зависит от температуры. У гомойотермных температура является одной из основных констант, обеспечивающих функциональную активность и нормальную жизнедеятельность клетки и организма в целом.
Хорошо известно, что биологические системы, особенно живые клетки, более чувствительны к изменениям температуры, чем большинство химических процессов в небиологических системах, и это является отражением свойств ферментов, от действия которых зависит функционирование биологических систем [Диксон, Уэбб, 1961]. Более того, чувствительность клетки к внешним воздействиям связана с чувствительностью не только самих ферментов, но и тех протоплазменных структур, на которых они смонтированы [Опарин, 1961].
Любое отклонение от температурной константы обязательно вызывает изменение скорости обменных процессов как в физиологических параметрах, так и за их пределами, приводя к патологии. Благодаря механизмам теплорегуляции организм теплокровного должен и будет «…бороться за температурный оптимум до конца» [Риккер, 1987].
За «первичной теплоустойчивостью клеток» скрывается чувствительность белковых макромолекул к конформационным изменениям в стереохимии [Александров, 1975]. Конформационная гибкость белковых молекул является ключевой чертой метаболизма
3
[Koshland, 1964], и эта гибкость напрямую определяет теплоустойчивость клеток, органов и всего организма. Выдающийся ученый ХХ века Владимир Яковлевич Александров в 1975 г. сформулировал принцип динамичной стабильности/лабильности основных молекулярных клеточных компонентов: белков, нуклеиновых кислот и липидов. Он полагал, что речь идет о поддержании в промежуточном состоянии стабильности конструкций, соединенных многочисленными слабыми связями [Александров, 1975]. В отношении белков и нуклеиновых кислот это поддержание вторичной, третичной и четвертичной структуры макромолекул в состоянии не слишком высокой и не слишком низкой конформационной гибкости. В отношении липидов – поддержание остатков жирных кислот в состоянии не слишком твердом и не слишком жидком. По мнению В.Я. Александрова, состояние определенной семистабильности необходимо для нормального выполнения этими компонентами возложенных на них функций, а также для регуляции их работы.
На многих белках показано, что при функционировании происходят изменения конформации макромолекул. Такие же изменения наблюдаются у нуклеиновых кислот при авторепродукции, транскрипции и трансляции. От степени «разжиженности» жирнокислотных остатков липидов зависит работа мембранных ферментов. Уровень стабильности всех трех компонентов температурно зависим. Повышение температуры за пределы оптимума приводит к избыточному возрастанию лабильности, снижение температуры – к избыточной стабилизации. Значительное отклонение от установленного эволюцией уровня семистабильности компонентов клетки должно приводить к нарушению ее жизнедеятельности [Александров, 1975]. Связь высокой чувствительности к действию различных повреждающих факторов с интенсивностью обмена веществ живого объекта многократно устанавливалась в различных разделах биологии. Наиболее полное развитие эта идея получила в классических трудах Чайльда в первой половине прошлого века. На большом числе примеров из животного и растительного мира он показал, что у многих организмов, у различных тканей и клеток имеется прямая зависимость между чувствительностью к повреждению и интенсивностью обмена; в частности, снижение повреждаемости сопровождает снижение метаболизма.
Таким образом, было установлено, что общее повышение стабильности протоплазматических белков снижает темп клеточного метаболизма, а повышение их конформационной лабильности ускоряет метаболические процессы.
4
Очень вероятно, что с этими обстоятельствами связана более высокая термолабильность белков у быстро растущих клеток и тканей, а высокая стабильность протоплазматических белков приводит к переходу клеток в состояние покоя и повышает их теплоустойчивость.
Для нас важно, что высокий метаболизм злокачественных клеток, а также макромолекулярные структуры быстро размножающихся вирусов и бактерий сопряжены с низкой термотолерантностью этих объектов.
Первыми определили механические свойства живых раковых клеток, взятых непосредственно у больного, ученые из Калифорнийского университета [Bourzac, 2007].
Проверка раковых клеток на «прочность» выявила, что «злые», активные раковые клетки на 70 % менее устойчивы к внешним воздействиям. В отличие от здоровых клеток они не прочно соединены друг с другом, легко разъединяются и распространяются (метастазируют).
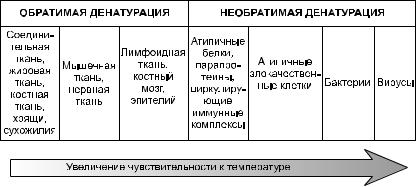
Учитывая разную теплоустойчивость различных биомакромолекулярных соединений, можно предположить, что в одном и том же температурном диапазоне (у человека, например, при температуре 42,5–43,5 °С) степень денатурации термотолерантных и термонетолерантных структур различается. Схематично это предположение можно представить следующим образом (рис. 1).
Если сформулированное предположение справедливо и фактически подтверждается, то появляется возможность намечать области практического применения искусственного теплолечения.
Рис. 1. Степень денатурации различных биоструктур при температуре тела 42,5–43,5 °С.
5
1.2. Денатурация
Физические измерения показывают, что большинство ферментов представляют собой глобулярные белки. Форма их молекул близка к сферической, причем пептидные цепи в нативных белках обычно свернуты в спираль (вторичная структура Эйринга). При сворачивании в спираль отдельные витки удерживаются водородными связями, согласно известной модели альфа-спирали Полинга и Кори. Далее свернутые спиралью пептидные цепи упаковываются «бок о бок», несколькими цепями. Эта третичная структура поддерживается связями трех типов – ионными, водородными и дисульфидными, а также гидрофобными взаимодействиями. Именно при повреждении третичной структуры при денативации (денатурации) обычно утрачивается и функция белка. Таким образом, под денатурацией подразумевают повреждение или изменение стереохимической трехмерной конформации, присущей любой белковой молекуле. Эти изменения могут носить обратимый (временный) или необратимый (постоянный) характер, но и в том и в другом случае аминокислотная последовательность белка остается неизменной. Дальнейшее разрушение возможно только через реакции протеолиза, когда протеиназы разрывают пептидные связи в полипептидной цепи.
При денатурации молекула белка «развертывается» и теряет способность выполнять свою биологическую функцию.
Денатурирующими агентами могут служить химические и физические факторы. К химическим относятся кислоты, щелочи, легко гидратирующие соли, органические растворители, различные окислители. Физическими факторами являются действие высокого давления, многократное замораживание и оттаивание, ультразвуковые волны, УФ-лучи, ионизирующая радиация. Но наиболее распространенным физическим фактором денатурации белка является повышение температуры.
Поскольку конформация белковой молекулы формируется при участии слабых типов связей, то она является подвижной, и белок может изменять свою структуру. В зависимости от условий внешней среды молекула может существовать в разных конформационных состояниях, которые легко переходят одно в другое. Энергетически выгодными для реальных условий являются только одно или несколько конформационных состояний, между которыми существует равновесие. Переходы из одного конформационного состояния в другое обеспечивают функционирование белковой моле-
6
кулы. При изменении конформации часть слабых связей разрушается, и образуются новые связи слабого типа.
Конфигурационная подвижность макромолекулы зависит от температуры. Для разных белков характерна различная чувствительность к тепловому воздействию. Некоторые белки подвергаются денатурации уже при 40–50 °С. Такие белки называют термолабильными (термонетолерантными). Другие белки денатурируют при гораздо более высоких температурах и являются термостабильными (термотолерантными).
1.3. Обратимость денатурации
При денатурации возможны различные степени нарушений строения белковой молекулы. Относительно мягкие денатурирующие агенты, например, растворы мочевины, приводят лишь к некоторым изменениям в третичной структуре белковой глобулы. Нарушение ферментативной активности при подобной денатурации может явиться следствием пространственного разобщения функциональных групп белковой молекулы, принимающих участие в формировании активного центра фермента. Обычно этот вид денатурации допускает восстановление первоначальной структуры белковой глобулы и – после ренатурации – возобновление ферментативной активности.
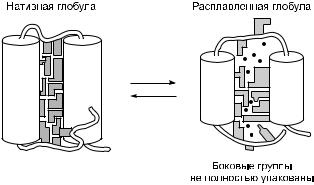
Таким образом, денатурация, при которой нативные белковые молекулы переходят в лишенную биологической активности форму беспорядочно свернуто-развернутого клубка, не является необратимым процессом (рис. 2, 3).
Рис. 2.
7
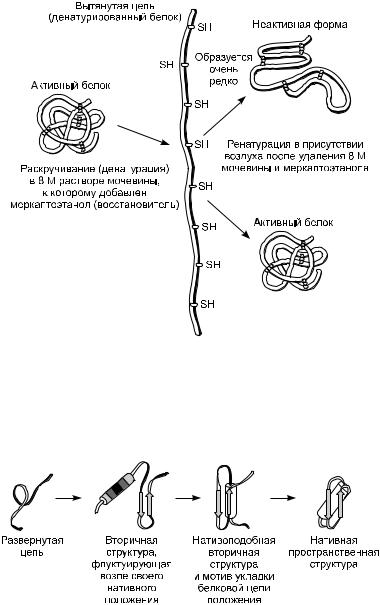
Рис. 3.
Известно много примеров, когда в химической пробирке развернутые молекулы приобретают свою первоначальную форму в результате процесса, называемого ренатурацией, ренативацией, фолдингом, повторным свертыванием или отжигом [Ленинджер, 1985]. Более того, если денатурированный белок является ферментом, то в процессе ренатурации его каталитическая активность также мо-
Рис. 4. Стадийная модель самоорганизации, из: [Птицин, 1973].
8
жет восстановиться, и притом без изменения специфичности катализируемой реакции. Таким образом, при ренатурации денатурированного белка восстанавливается его исходная специфическая биологическая активность. Этот процесс не требует дополнительной химической энергии извне, происходит самопроизвольно, лишь бы окружающая рН и температура были оптимальны, т.е. максимально обеспечивали стабильность нативной формы (рис. 4).
Денатурация многих белков кажется необратимой просто потому, что возвращение к нативному состоянию происходит во многих случаях очень медленно. Причиной стремления восстановить нативную конформацию белковой молекулы является то, что в биологических условиях эта форма наиболее энергетически стабильная, т.е. обладает наименьшей свободной энергией.
1.4. Стабильность структуры белка
иустойчивость к повреждению
Ворганизме человека 31 200 различных белков и среди них 9000 ферментов. Это макромолекулы, молекулярная масса которых колеблется от нескольких тысяч до нескольких миллионов дальтон.
Каждому белку свойственна своя стереохимическая конформация, определяющая, с одной стороны, специфическую функцию, а
сдругой – «индивидуальную» стабильность в отношении агрессии факторов внешней среды.
Убедительно показано, что альфа-спираль представляет собой относительно стабильную структуру, если R-группы полипептидной цепи не заряжены, имеют сравнительно небольшие размеры и не образуют водородные связи. Однако не все альфа-спиральные участки в белках обладают совершенно одинаковыми параметрами и характеризуются одинаковой стабильностью, что следует объяснять различиями в аминокислотном составе и в последовательности чередования аминокислотных остатков. Для альфа-спиральных участков в белках характерно наличие локальных неустойчивых точек, в которых спираль должна обладать способностью изгибаться под действием других сил, в особенности под влиянием стремления всей полипептидной цепи принимать такую конформацию, при которой гидрофобные R-группы максимально защищены от соприкосновения с водой. Таким образом, характерная для данной полипептидной цепи третичная структура в водной среде определяется, с одной стороны, влиянием водородных связей (внутри- и межцепочечных), а с другой – стремлением всей цепи изгибаться в точках, где стабильность альфа-спирали нарушена, и принимать
9
такую конфигурацию, при которой молекулы воды могли бы находиться в условиях, обеспечивающих максимальное значение энтропии системы (А. Ленинджер). Если в белке содержатся дисульфидные мостики, то их число и расположение также являются очень важными факторами, поддерживающими характерную третичную структуру белка.
Белки обладают максимальной стабильностью при определенной, оптимальной для каждого из них температуре. Большинство белков наиболее стабильно при температурах, поддерживаемых в холодильниках. Температура их нормального функционирования гораздо выше. В связи с тем, что температурный максимум стабильности большинства белков лежит значительно ниже температуры их жизненного оптимума, любое повышение температуры относительно максимума стабильности должно снижать стабильность структуры белковых молекул.
Действительно, при температурах, превышающих 40–50 °С, почти все белки утрачивают стабильность и начинается «развертывание» полипептидных цепей. Чем выше температура и больше ее экспозиция, тем более беспорядочной становится конфигурация развернувшейся глобулы белка.
1.5. Возможности ренативации
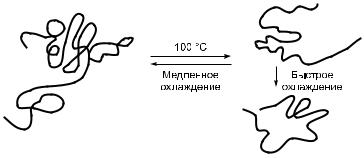
Если подвергнуть белок денатурации путем нагревания, т. е. «развернуть» его полипептидную(ые) цепь(и), а затем быстро охладить его, то исходная третичная структура обычно не восстанавливается. Однако если нагретый раствор белка подвергнуть отжигу (очень медленному охлаждению до комнатной температуры), то нативная конфигурация белка часто восстанавливается (рис. 5).
Рис. 5.
10
