
3 курс / Фармакология / Синтез_и_изучение_свойств_новых_материалов_с_противоопухолевой
.pdf
51
/ мПаЧс
1.1
1.0
0.9
0.8
0.7
0.6
0.5
0 |
2 |
4 |
6 |
8 |
10 |
C / гЧдм−3
Рис. 3.11. Концентрационные зависимости динамической вязкости (η) при скорости сдвига 100 с−1 в бинарной системе соединение 1.57 – H2O при (□) 293,15 К, (○)
303,15 К, ( ) 313,15 К, ( ) 323,15 К, ( ) 333,15 К. C — концентрация соединения
1.57.
Термодинамические характеристики активации вязкого течения (∆G, ∆H, ∆S,
Eа) рассчитывались по следующим уравнениям теории Эйринга (3.4–3.7) (Табл. 3.2)
[94]:
G = RT ln |
|
V |
, |
|
(3.4) |
||||
|
|
|
|
|
|||||
|
|
hNA |
|
|
|||||
G = H -T S , |
|
(3.5) |
|||||||
ln = ln A + |
|
Ea 1 |
, |
(3.6) |
|||||
|
|
|
|
|
|
|
|||
|
S |
|
R T |
|
|
||||
|
|
|
|
|
|||||
TA = |
-Ea |
|
, |
|
|
|
(3.7) |
||
R ln A |
|
|
|
|
|||||
|
|
|
|
|
|
|
|||
|
|
|
S |
|
|
|
|
|
|
где ∆G, ∆H и ∆S — энергия Гиббса, энтальпия и энтропия вязкого течения; AS —
предэкспоненциальный энтропийный фактор; Ea — энергия активации вязкого течения; TA — температура активации; R — универсальная газовая постоянная; T —
абсолютная температура.

52
Табл. 3.2. Концентрационная зависимость энтропийного фактора (lnAS), энергии активации вязкого течения (Ea), температуры Аррениуса (TA), энтальпии активации
( H) и энтропии (ΔS). C — концентрация водного раствора соединения 1.57.
C / г∙дм−3 |
Ea / |
lnAs / |
TA / К |
H / |
S / |
|
Дж·моль−1 |
ln[мПа·с] |
кДж·моль−1 |
Дж·(моль·К)−1 |
|||
|
|
|||||
|
|
|
|
|
|
|
0,025 |
15118,67 |
−6,21 |
292,94 |
14,81 |
−5,09 |
|
0,10 |
15099,15 |
−6,20 |
292,88 |
14,79 |
−5,15 |
|
0,25 |
15115,69 |
−6,21 |
292,94 |
14,81 |
−5,10 |
|
0,55 |
15108,14 |
−6,20 |
292,94 |
14,80 |
−5,13 |
|
1,0 |
15052,56 |
−6,18 |
293,04 |
14,75 |
−5,33 |
|
2,5 |
15124,00 |
−6,20 |
293,22 |
14,82 |
−5,12 |
|
5,0 |
15187,55 |
−6,22 |
293,87 |
14,88 |
−5,01 |
|
10 |
15091,71 |
−6,15 |
295,35 |
14,77 |
−5,62 |
Полученные данные позволяют сделать следующие выводы:
1)значения энтальпии практически постоянны и положительны во всём диапазоне изученных концентраций. Этот факт указывает на наличие специфических взаимодействий в растворе;
2)наблюдается стабильность значений энтропии в изученном диапазоне концентраций. Отрицательная определённость энтропии указывает на упорядочение в растворе, связанное с образованием активированного комплекса.
Температурные зависимости динамической вязкости водных растворов соединения 1.57 описывались с помощью эмпирического уравнения Вант-Гоффа
(3.8) (Рис. 3.12):
T |
|
|
|
|
|
10 |
= |
|
T - T |
=1, 21 0, 05 , |
(3.8) |
|
T |
||||
|
|
|
|
|
|
где γη — коэффициент вязкости Вант-Гоффа.
Анализ Рис. 3.12 показывает, что температурный коэффициент Вант-Гоффа постоянен в изученном интервале температур.
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/

53
1.26
1.24
1.22
γ η
1.20
1.18
1.16
0 |
2 |
4 |
6 |
8 |
10 |
|
|
|
C / гЧдм−3 |
|
|
Рис. 3.12. Зависимость коэффициента вязкости Вант-Гоффа от объёмной
концентрации соединения 1.57: (□) |
278.15 |
, (○) 283.15 |
, ( ) 288.15 |
, ( ) |
293.15 |
, |
||||
|
|
|
|
288.15 |
293.15 |
|
298.15 |
|
303.15 |
|
( ) |
298.15 |
, ( ) |
303.15 |
, ( ) |
308.15 , ( ) |
313.15 . |
|
|
|
|
|
308.15 |
|
313.15 |
|
318.15 |
|
323.15 |
|
|
|
На Рис. 3.13 представлены результаты применения трёхпараметрического уравнения Фогеля — Фулчера — Таммана [94] для описания температурных зависимостей динамической вязкости в бинарной системе соединение 1.57 – вода:
lg (T ) = lg 0 + |
A |
, |
(3.9) |
|
T - B |
||||
|
|
|
где η0, A, B — корреляционные параметры; T — абсолютная температура.
В Табл. 3.3 приведены значения корреляционных параметров уравнения Фогеля — Фулчера — Таммана, а также значения среднего абсолютного отклонения
(AAD) и стандартного отклонения (SD).
|
|
|
54 |
|
|
|
|
1.1 |
|
|
|
|
|
|
1.0 |
|
|
|
|
|
|
0.9 |
|
|
|
|
|
Чс |
|
|
|
|
|
|
/ мПа |
0.8 |
|
|
|
|
|
0.7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.6 |
|
|
|
|
|
|
0.5 |
|
|
|
|
|
|
0.4 |
|
|
|
|
|
|
290 |
300 |
310 |
320 |
330 |
340 |
|
|
|
T / K |
|
|
|
Рис. 3.13. Температурные зависимости динамической вязкости водных растворов соединения 1.57 ((□) 0,1 г∙дм3, (○) 0,25 г∙дм−3, ( ) 0,5 г∙дм−3, ( ) 1 г∙дм−3, ( ) 2,5
г∙дм−3, ( ) 5 г∙дм−3, ( ) 10 г∙дм−3) при скорости сдвига 100 с−1. Точки — экспериментальные данные, линии — результат применения уравнения Фогеля — Фулчера — Таммана.
Табл. 3.3. Корреляционные параметры уравнения Фогеля — Фулчера — Таммана.
Параметр |
|
|
|
C / г∙дм−3 |
|
|
|
||
|
|
|
|
|
|
|
|
||
0,025 |
0,1 |
0,25 |
0,55 |
1,0 |
2,5 |
5,0 |
10,0 |
||
|
|||||||||
|
|
|
|
|
|
|
|
|
|
lgη0 / lg[мПа∙с] |
−1,30 |
−1,32 |
−1,30 |
−1,33 |
−1,33 |
−1,32 |
−1,33 |
−1,29 |
|
A / К |
160,8 |
165,1 |
159,0 |
167,4 |
166,9 |
165,9 |
168,0 |
161,6 |
|
B / К |
170,8 |
168,8 |
171,5 |
167,9 |
167,8 |
168,6 |
168,0 |
170,4 |
|
SD / мПа∙с∙104 |
4,8 |
3,2 |
6,2 |
3,9 |
7,1 |
6,4 |
26,4 |
27,7 |
|
AAD / % |
0,17 |
0,12 |
0,12 |
0,12 |
0,12 |
0,03 |
0,07 |
0,23 |
|
|
|
|
|
|
|
|
|
|
|
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/

55
3.4.3.Рефракции водных растворов соединения 1.57
ВТабл. 3.4 представлены экспериментальные данные по концентрационным
(C = 0,01–25 г∙дм−3) и температурным (T = 293,15–333,15 К) зависимостям показателей преломления (nD) водных растворов соединения 1.57.
Табл. 3.4. Концентрационные (С) зависимости показателя преломления (nD) водных растворов соединения 1.57 в интервале температур Т = 293,15–333,15 К.
nD
C / г∙дм−3
|
293,15 К |
303,15 К |
313,15 К |
323,15 К |
333,15 К |
|
|
|
|
|
|
0,01 |
1,33297 |
1,3319 |
1,33057 |
1,32898 |
1,32716 |
0,025 |
1,33298 |
1,33192 |
1,33059 |
1,32899 |
1,32718 |
0,05 |
1,33301 |
1,33194 |
1,33061 |
1,32901 |
1,32721 |
0,1 |
1,33307 |
1,33199 |
1,33067 |
1,32906 |
1,32726 |
0,25 |
1,33313 |
1,33205 |
1,33073 |
1,32914 |
1,32735 |
0,5 |
1,33337 |
1,3323 |
1,33096 |
1,32938 |
1,32759 |
1 |
1,33375 |
1,33269 |
1,33133 |
1,32979 |
1,32801 |
2.5 |
1,33454 |
1,33349 |
1,33213 |
1,33059 |
1,32882 |
15 |
1,33534 |
1,33428 |
1,33294 |
1,33139 |
1,32971 |
25 |
1,33694 |
1,33588 |
1,33459 |
1,33307 |
1,33168 |
|
|
|
|
|
|
Удельные и молярные показатели преломления растворов рассчитывали по
уравнениям 3.10 и 3.11:
|
|
2 |
-1 |
|
|
|
|
1 |
|
|
|
|
|
|
nD |
|
|
|
|
|
, |
|
|
||||
r = |
|
|
|
|
|
Ч |
|
|
|
(3.10) |
|||
|
2 |
+ 2 |
|
r |
|
||||||||
n |
D |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
n2 |
-1 |
|
|
|
|
|
|
(3.11) |
||||
|
|
M |
|
|
|||||||||
|
|
D |
|
|
|
|
|
|
|
, |
|
||
R = |
|
|
|
|
|
Ч |
|
|
|
|
|
||
|
|
2 |
+ 2 |
|
r |
|
|
||||||
n |
D |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||
где r и R — удельная и молярная рефракции; M — средняя молярная масса раствора
( M = xH2O Ч M H2O + xсоединения 1.57 Ч M соединения 1.57 ).
Данные по показателям преломления в области низких концентраций соединения 1.57 (xсоединения 1.57 < 1,4∙10−4) не использовались для расчётов из-за низкой точности измерения данных величин (Табл. 3.4).
56
Удельная (r) и молярная (R) рефракции водных растворов соединения 1.57
рассчитывались по уравнениям 3.12 и 3.13:
r = (rH2O Ч wH2O + rсоединения 1.57 Ч wсоединения 1.57 ) Ч |
|
1 |
, |
(3.12) |
|
100 |
|||||
|
|
|
|||
R = RH2O Ч xH2O + Rсоединение 1.57 Ч xсоединение 1.57 |
, |
|
|
(3.13) |
|
где ri, Ri — удельная и молярная рефракции компонентов раствора; wi, xi — массовые и мольные доли компонентов раствора. Кроме того, молярная рефракция соединения
1.57 рассчитывалась с использованием правил аддитивности Эйзенлора (3.14) и
Фогеля (3.15) [95]:
R =14RC + 22RH + RO(OH) + 2RO(R-O-R' ) + RN(R2 NH) + 2RN(R3N) +3RN(C-N=C) , (3.14)
R 83,345 см3 Ч |
моль-1 ; |
|
R = 20RC-H +11RC-N +7RC-C +5RC-O +3RC=N + RO-H + RN-H |
(3.15), |
|
R 82, 262 см3 Ч |
моль-1 . |
|
Удельную рефракцию соединения 1.57 рассчитывали по уравнению 3.16:
r = |
|
R |
||
|
|
|
||
M |
(3.16) |
|||
|
||||
|
соединения 1.57 |
|||
Полученные значения удельной составляют 0,259 см3∙г−1 (по правилу Эйзенлора) и 0,255 см3∙г−1 (по правилу Фогеля). Сравнение экспериментальных и расчётных данных по удельной (а) и молярной рефракции (б) представлено на Рис.
3.14.
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/

(а)
|
1.6 |
|
|
|
|
|
|
1.4 |
|
|
|
|
|
−1 |
1.2 |
|
|
|
|
|
|
|
|
|
|
|
|
∙г |
|
|
|
|
|
|
3 |
1.0 |
|
|
|
|
|
/ см |
|
|
|
|
|
|
|
|
|
|
|
|
|
1.57 |
0.8 |
|
|
|
|
|
соединения |
0.6 |
|
|
|
|
|
r |
|
|
|
|
|
|
|
0.4 |
|
|
|
|
|
|
0.2 |
|
|
|
|
|
|
0.0 |
|
|
|
|
|
|
0.0 |
0.5 |
1.0 |
1.5 |
2.0 |
2.5 |
|
|
|
|
w / % |
|
|
57
(б)
|
350 |
|
|
|
|
|
|
|
|
|
|
|
300 |
|
|
|
|
|
|
|
|
|
|
−1 |
|
|
|
|
|
|
|
|
|
|
|
моль∙ |
250 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
см |
200 |
|
|
|
|
|
|
|
|
|
|
/ |
|
|
|
|
|
|
|
|
|
|
|
1.57 |
150 |
|
|
|
|
|
|
|
|
|
|
соединения |
|
|
|
|
|
|
|
|
|
|
|
100 |
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
50 |
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.0000 |
0.0002 |
0.0004 |
0.0006 |
0.0008 |
0.0010 |
0.0012 |
0.0014 |
0.0016 |
||
xсоединения 1.57
Рис. 3.14. Концентрационная зависимость удельной (а) и молярной (б) рефракции соединения 1.57 при 293,15 К. w — массовая доля соединения 1.57, xсоединения 1.57 — молярная доля соединения 1.57. Пунктирная линия соответствует расчётным значениям удельной и молярной рефракций соединения 1.57.
3.4.4.Математическое описание Т-С-зависимостей плотности, вязкости и показателя преломления водных растворов соединения 1.57
Т-С-зависимости плотности, вязкости и показателя преломления водных растворов соединения 1.57 описывались с использованием корреляционного
уравнения (3.17):
4 |
4 |
|
M = a + bi |
ЧT i + c j ЧC j |
(3.17), |
i=1 |
j =1 |
|
где M — физико-химическое свойство раствора соединения 1.57, a, bi, cj (i, j = 1–4)
— корреляционные параметры (Табл. 3.5).
Результаты применения корреляционного уравнения 3.17 к описанию Т-С-
зависимостей физико-химическое свойств раствора соединения 1.57 представлены на Рис. 3.15 (а–в).

58
(а)
ρ / г·см3
(б) |
(в) |
η / мПа·с3
Рис. 3.15. T–C-зависимости плотности (а), динамической вязкости (б), показателя преломления (в) водных растворов соединения 1.57. Точки — экспериментальные данные; поверхности — результат применения корреляционного уравнения 3.17.
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/

59
Табл. 3.5. Корреляционные параметры a, bi, cj (i, j = 1–4) уравнения 3.17 ля Т–С-зависимостей плотности (ρ), вязкости (η) и
показателей преломления (nD) водных растворов соединения 1.57. R2 — коэффициент детерминации.
Свойство |
a |
b1 |
b2 |
b3 |
b4 |
c1 |
c2 |
c3 |
c4 |
R2 |
ρ / г∙см−3 |
−5,12 |
0,076 |
−3,53∙10−4 |
7,32∙10−7 |
−5,76∙10−10 |
3,70∙10−4 |
−1,57∙10−4 |
4.26∙10−5 |
−2,81∙10−6 |
0,99967 |
η / мПа·с |
507,88 |
−6,04 |
0,027 |
−5,46∙10−5 |
4,13∙10−8 |
3.24∙10−3 |
−1,18∙10−3 |
3,07∙10−4 |
−1,84∙10−5 |
0,99960 |
nD |
2,49 |
−0,016 |
8,24∙10−5 |
−1,87∙10−7 |
1,56∙10−10 |
1,64∙10−4 |
−1,32∙10−6 |
1,04∙10−7 |
−2,03∙10−9 |
0,99926 |
|
|
|
|
|
|
|
|
|
|
|
59

60
3.4.5. Растворимость соединения 1.57 в воде
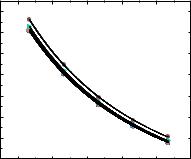
На Рис. 3.16 представлена политерма растворимости соединения 1.57 в
воде в интервале температур 293,15–318,15 К. Видно, что соединение 1.57
совместимо с водой: растворимость соединение 1.57 составляла 26,3–43,0 г∙дм−3
в зависимости от температуры. Температурная зависимость растворимости имеет сигмоидный ход. В то же время растворимость повышается с ростом температуры, что свидетельствует об эндотермическом эффекте растворения соединения 1.57 в воде. Данные термогравиметрического анализа показывают,
что равновесной твёрдой фазой с насыщенным раствором является кристаллогидрат соединения 1.57 (C14H22N6O3∙3H2O).
|
44 |
|
|
|
|
|
|
42 |
|
|
|
|
|
|
40 |
|
|
|
|
|
|
38 |
|
|
|
|
|
−3 |
36 |
|
|
|
|
|
гЧдм |
34 |
|
|
|
|
|
C / |
32 |
|
|
|
|
|
|
|
|
|
|
|
|
|
30 |
|
|
|
|
|
|
28 |
|
|
|
|
|
|
26 |
|
|
|
|
|
|
295 |
300 |
305 |
310 |
315 |
320 |
|
|
|
T / K |
|
|
|
Рис. 3.16. Температурная зависимость растворимости соединения 1.57 в воде.
3.4.6. Распределение соединения 1.57 в системе н-октанол – вода
Главным фактором, определяющим способность лекарственного соединения проникать к мишени и распределяться по организму, является липофильность. Возрастание липофильности коррелирует с повышением биологической активности, снижением водорастворимости, ускорением
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
