
5 курс / Пульмонология и фтизиатрия / Лазерная_терапия_в_онкологии_Москвин_С_В_,_Стражев
.pdf
Лазерная терапия в онкологии
ПМ 5–5,3 мВт/см2, экспозиция 10 мин, ЭП 3,2 Дж/см2). Установлено, что под влиянием ЛО происходит уменьшение объёма опухолевой паренхимы за счёт увеличения площади, занятой некрозом и разрастающейся соединительной тканью, сочетающееся с развитием выраженных дистрофических процессов в клеточных элементах новообразования. Одновременно с морфологической перестройкой наблюдаются изменения ферментативной активности как в опухоли, так и в окружающих её тканях. Под влиянием ЛО нарастает активность сукцинатдегидрогеназы, щелочной и кислой фосфатазы в нейтрофилах крови и снижение их активности в самом новообразовании [Димант И.Н. и др., 1991]. Двукратное удлинение продолжительности жизни наблюдалась у животных, оперированных по поводу саркомы мягких тканей с последующим ЛО (633 нм) нерадикально удалённой опухоли. Отмечено ингибирование нео пластического процесса, уменьшение объёма опухолевой паренхимы за счёт развития альтернативно-дистрофических и склеротических процессов, при этом действие лазерного излучения сохраняется некоторое время и после завершения курса ЛО [Ботвинников И.Я., 1990; Димант И.Н. и др., 1993]. Как мы уже говорили, временны́е показатели ЛО, в том числе порядок и периодичность воздействия, крайне важны. Так, по данным А.В. Иванова (1984), эффективность ингибирующего действия НИЛИ на опухоль тем выше,
чем раньше начато освечивание и продолжительнее курс.
Для изучения возможности использования НИЛИ в клинике были проведены предварительные экспериментальные исследования на крысах с перевиваемой саркомой Уокера (26 животных), раком молочной железы (30 животных), и мышах (100 животных) со спонтанно развивающимся раком молочной железы, проводили ЛО импульсным ИК НИЛИ (длина волны 890 нм), с ЭП 0,46 и 1,5 Дж/см2, причём именно при меньшей ЭП наблюдалось замедление роста опухоли на 37,5%, продолжительность жизни животных увеличилась на 44%. У животных 2-й группы размеры опухоли не отличались от контрольной группы, достоверных различий в продолжительности жизни также не было получено [Михайлов В.А. и др., 1991].
У мышей с асцитной карциномой Эрлиха освечивание НИЛИ жёлто-зелё- ного спектра (длина волны 511 и 578, экспозиция 30 с, ПМ 50–150 мВт/см2) оказало выраженное угнетающее действие на рост опухоли. Так, на 5 е сутки после ЛО торможение роста составило 79%, к 9 м суткам – 85%. Эффект сохранялся в течение месяца, когда составил 83% по сравнению с контролем (р < 0,01), выживаемость в этой группе животных оказалась в два раза выше контрольной [Зырянов Б.Н. и др., 1998].
Выраженные изменения в структуре первичной опухоли, вплоть до гибели клеточных элементов опухоли, при проведении ВЛОК описывают Н.Ф. Гамалея с соавт. (1988), метастазы у животных после ЛО (по сравнению с интактными) имели значительно меньшие размеры и более чёткую форму.
Модулирующее действие жёлто-зелёного НИЛИ (длина волны 511 и 578, экспозиция 1 мин, ПМ 50–150 мВт/см2, ЭП 3 Дж/см2) на эффективность ци-
240

Лазерная терапия в онкологии
тостатической терапии в модельном исследовании проверено Б.Н. Зыряновым с соавт. (1998). Эксперимент выполнен на 160 мышах линии C57BL/6 с перевиваемой сингенной гематогенно метастазирующей аденокарциномой лёгких Льюиса (LLC). Опухоль перевивалась по стандартной методике в область бедра в концентрации 1 млн клеток на мышь. Лазерное освечивание области опухоли проводили ежедневно в течение 5 дней.
В качестве химиотерапевтического агента использовали 5-фторурацил (5-ФУ) – антиметаболит из группы фторпроизводных пиримидина, который вводили внутримышечно в дозе 25 мг/кг через день 3 раза. Цитостатическую терапию и лазерное освечивание начинали на 7-е сутки после перевивки опухоли. Исследования проводились на 4 группах животных:
1-я – контроль, мыши с LLC, без воздействий; 2-я – мыши с LLC, лечение только 5-ФУ;
3-я – мыши с LLC, только ЛО опухоли;
4-я – мыши с LLC, получавшие 5-ФУ и ЛО опухоли.
Эффективность воздействия оценивали по степени торможения роста опухоли. Распространённость метастатического процесса определяли по частоте метастазирования и среднему количеству метастазов в лёгкие, приходящемуся на одно животное. Взятие материала на исследование проводили на 18–20 е сутки роста опухоли после вывода животных из опухоли методом цервикальной дислокации. Для оценки антиметастатической активности вычисляли индекс ингибирования метастазов.
Полученные экспериментальные данные показали, что лечение опухоленесущихмышей,какцитостатикомиЛОпоотдельности,такиприихсочетании, приводило к значительному торможению роста опухолевого трансплантата
(табл. 37).
Освечивание НИЛИ оказывает достаточно выраженное ингибирующее действие на опухоль, однако более низкое, чем 5-ФУ. Наибольшее торможение
Таблица 37
Торможение роста опухоли LLC у мышей C57BL/6 при сочетании цитостатика и лазерного освечивания (Зырянов Б.Н. и др., 1998)
Вариант опыта |
№ эксперимента |
Торможение роста опухоли по суткам, % |
||||
10 |
12 |
14 |
16 |
|||
|
|
|||||
|
1 |
12 |
41 |
37 |
40 |
|
ЛО |
2 |
32 |
16 |
37 |
52 |
|
|
среднее |
22 |
29 |
37 |
46 |
|
|
1 |
44 |
53 |
51 |
60 |
|
5-ФУ |
2 |
49 |
73 |
80 |
86 |
|
|
среднее |
47 |
63 |
66 |
73 |
|
|
1 |
45 |
71 |
60 |
69 |
|
ЛО + 5-ФУ |
2 |
54 |
86 |
91 |
86 |
|
|
среднее |
50 |
80 |
76 |
79 |
|
241
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Лазерная терапия в онкологии
опухолевого роста наблюдалось у мышей, получавших одновременно цитостатический препарат и ЛО. Другими словами, при сочетании имеет место взаимопотенцирующее действие различных агентов.
Во всех группах животных отмечена 100% частота метастазирования в лёгкие. Однако среднее количество метастазов на 1 животное в группе получавших ЛО или химиотерапию по отдельности было практически в два раза ниже – 4,1 ± 1,3 и 5,2 ± 1,4 соответственно – по сравнению с контролем
(8,6 ± 1,5).
Использование 5-ФУ в сочетании с ЛО приводит к 4-кратному уменьшению количества лёгочных метастазов. Индекс ингибиции метастазирования у мышей при сочетанном воздействии достигал 77%, только 5-ФУ – 40%, что даже несколько меньше, чем у мышей, получивших только ЛО. В то же время 5-ФУ обладает более высокой ингибирующей активностью в отношении опухолевого узла (табл. 38, рис. 34 и 35).
Практическиодинаковыйуровеньингибированияростапервичнойопухоли и метастазирования при комбинированном лечении может быть обусловлен суммированием цитостатического и лазерного воздействия (рис. 35). Кроме непосредственного влияния НИЛИ на опухоль его противоопухолевый и ан-
Таблица 38
Метастазирование LLC у мышей C57BL/6 при сочетании цитостатика и лазерного освечивания (Зырянов Б.Н. и др., 1998)
Группы |
Контроль |
5-ФУ |
ЛО |
5-ФУ + ЛО |
Среднее число метастазов |
8,6 ± 1,5 |
5,2 ± 1,4 |
4,1 ± 1,3 |
2,0 ± 0,7 |
Индекс ингибиции |
– |
40 |
51 |
77 |
Рис. 34. Эффект сочетанного применения ЛО и 5-ФУ на рост экспериментальной опухоли LLC (Зырянов Б.Н. и др., 1998)
242

Лазерная терапия в онкологии
Рис. 35. Сочетанный эффект торможения роста опухоли LLC и метастазирования на фоне ЛО и химиотерапии 5-ФУ (Зырянов Б.Н. и др., 1998)
тиметастатический эффект может быть связан с изменением взаимоотношений на уровне организм–опухоль, в том числе с его иммуномодулирующими свойствами лазерного света.
При изучении влияния различных вариантов лазерного освечивания на иммунные процессы у экспериментальных животных Б.Н.Зыряновым с соавт. (1998) было замечено, что ЛО является неспецифическим раздражителем, приводящим к развитию адаптационного синдрома (см. выше). Известно, что фаза резистентности общего адаптационного синдрома обеспечивается гормональной перестройкой, в которой заметное место принадлежит усиленной продукции соматотропного гормона передней доли гипофиза. Последний, в своюочередь,являетсяоднимизрегуляторовпроцессоврегенерации,иможно предположить возможность их модуляции с помощью НИЛИ.
ИзучениерегенерациираннафонеизлучениялазеранапарахмедиБ.Н.Зыряновым с соавт. (1998) в первом эксперименте проводилось на 50 неинбредных крысах-самцах. Крысам под гексеналовым наркозом в области верхней трети бедра удаляли лоскут кожи площадью 20 × 20 мм до фасции, на следующий день начинали освечивать рану в течение 10 дней. Проведено четыре эксперимента:
1 – ЛО проводили на длине волны 511 нм с выходной мощностью 50 мВт и ЭП 0,5 Дж/см2;
2 – ЛО с той же ЭП на длине волны 578 нм; 3 и 4 – ЛО с двумя длинами волн (511 и 578 нм) с общей выходной мощ-
ностью 100 мВт и ЭП 1 Дж/см2.
Контролем служили животные, которым не проводили лазерное освечивание. Площадь раневой поверхности измеряли ежедневно до полной эпителизации.
243
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
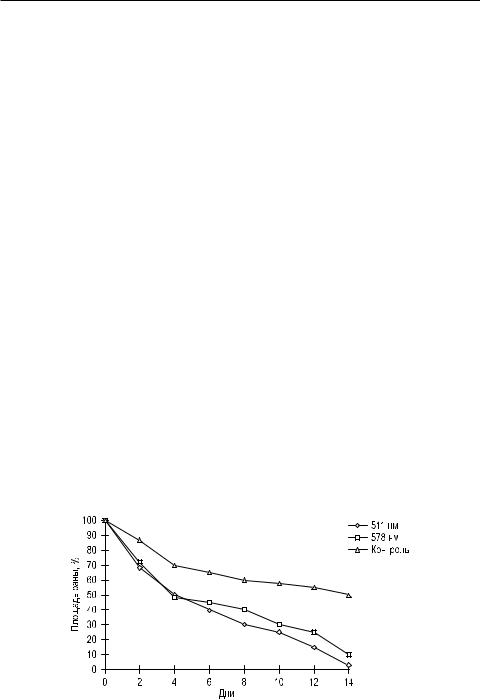
Лазерная терапия в онкологии
Для выяснения степени влияния НИЛИ на заживление ран у животныхопухоленосителей, а также на реакцию опухоли, был поставлен второй эксперимент на 80 белых неинбредных крысах-самцах, которым по общепринятой методике был перевит штамм лимфосаркомы Плисса. После того как первичные опухолевые узлы становились доступны пальпации, животным наносили раны по вышеописанной методике. Опытных групп было две:
1-я – ЛО с двумя длинами волн (511 и 578 нм), ЭП 0,5 Дж/см2; 2-я – ЛО с двумя длинами волн (511 и 578 нм), ЭП 1 Дж/см2.
Контрольсоставилиживотныесперевитойопухольюиэкспериментальной раной на бедре, не получавшие лазеротерапии.
Результаты исследований показали, что ЛО в первой группе (длина волны 511 нм, ЭП 0,5 Дж/см2) существенно стимулирует заживление раны у интактных животных и животных-опухоленосителей. Процент уменьшения площади раневой поверхности превышал таковой в контроле (рис. 36). Так, на вторые сутки уменьшение площади в контроле составило 14%, у опытных животных – 21%; на 3-и сутки он достигал 8 и 17%, на 5-е сутки – 9 и 30%, на 9-е сутки – 10 и 17%, на 15-е сутки – 26 и 40% соответственно. Во 2-й группе (578нм)темпызаживленияраныбылинесколькониже,ноприувеличенииЭП до 1,0 Дж/см2 эффект более выражен (рис. 37), особенно во второй половине срока заживления раны.
Сцельювыявленияморфологическихизменений,возникающихвусловиях ЛО кожнойраны,былипроизведены микроскопическиеисследования биоптатов. Через 7 дней в ранах определялась грануляционная ткань, различающаяся по степени зрелости в контрольной и опытных группах. У животных контрольной группы определялось множество кровеносных капилляров различной величины и формы, переполненных кровью и отделённых друг от друга густым клеточным инфильтратом. Последний был представлен лимфоцитами разной степени зрелости, плазмоцитами, эозинофильными лейкоцитами,
Рис. 36. Динамика уменьшения площади раны под влиянием излучения жёлтого и зелёного спектров лазера на парах меди ЭП 0,5 Дж/см2 (Зырянов Б.Н. и др., 1998)
244

Лазерная терапия в онкологии
Рис. 37. Динамика уменьшения площади раны под влиянием излучения длиной волны 511 нм в зависимости от ЭП НИЛИ (Зырянов Б.Н. и др., 1998)
гистиоцитами и единичными фибробластами. Данные клеточные элементы располагались в отёчной жидкости. Волокнистых структур в межклеточных пространствах не определялось.
У крыс, получивших ЛО, грануляционная ткань характеризовалась значительно более высокой степенью зрелости, что находило своё отражение в изменении клеточного состава и межклеточного вещества. При этом количество лимфоцитов, плазматических клеток и гистиоцитов было существенно уменьшено, а число фибробластов, соответственно, повышено. Часть фибробластов складывалась в лентовидные пучки и формировала тонкие коллагеновые волокна.
На 14-е сутки у контрольных животных имелось незначительное увеличение фибробластов по сравнению с предыдущей точкой фиксации, без заметного формирования волокон. У опытных животных к этому времени имело место образование волокнистой соединительной ткани, характеризующейся тонковолокнистым строением, наличием зрелых фибробластов и фиброцитов, умеренным отёком и незначительными лимфоидными инфильтратами вокруг кровеносных сосудов. Поверхность соединительной ткани была покрыта островками типичного многослойного эпителия.
Таким образом, заживление кожной раны при ЛО происходит за счёт молодой недифференцированной грануляционной ткани, как и у контрольных животных, однако процесс созревания грануляционной ткани в волокнистую происходит в более короткие сроки. Достоверных различий в характере заживления кожных ран у опытных групп животных не замечено.
Сроки и характер заживления ран на фоне ЛО у животных с перевитой опухолью не отличались от таковых у интактных животных. Представляет интерес поведение опухоли. Так, в первой подопытной группе второго эксперимента, получавшей ЛО с 1 Дж/см2, достигнуто торможение роста опухоли на 59% и угнетение метастазирования. Частота метастазирования снизилась
245
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Лазерная терапия в онкологии
Таблица 39
Развитие лимфосаркомы Плисса при освечивании НИЛИ экспериментальной раны (Зырянов Б.Н. и др., 1998)
№ |
|
Торможение |
Частота |
Среднее |
Средняя масса |
|
Опыт |
роста |
метастази- |
||||
группы |
число |
метастазов, мг |
||||
|
опухоли, % |
рования, % |
||||
|
|
|
|
|||
1 |
511 нм, ЭП 1,0 Дж |
59 |
63 |
1 |
213 ± 25 |
|
2 |
511 нм, ЭП 0,5 Дж |
– |
33 |
0,38 |
102 ± 9 |
|
3 |
Контроль |
– |
100 |
2,3 |
733 ± 15 |
до 63% против 100% в контроле, среднее число метастазов на одно животное составило 1,0 (в контроле 2,3), значительно уменьшилась средняя масса метастазов (табл. 39).
Во второй подопытной группе торможения роста опухоли не отмечено, но более выражен эффект подавления процесса метастазирования.
Проведённые эксперименты доказали, что освечивание НИЛИ с длиной волны 511 и 578 нм с ЭП 0,5 и 1 Дж/см2 активизирует процессы регенерации ран у интактных животных и животных-опухоленосителей. Сочетание этих качеств с выявленной возможностью угнетения опухолевого роста открывает перспективу применения ЛТ у онкологических больных при необходимости усиления регенераторных процессов на этапах специфического лечения [Зырянов Б.Н. и др., 1998].
Важно учитывать режим работы лазера в аспекте выбора длины волны лазерного излучения. При прогрессировании экспериментального рака шейки матки система АОЗ в неоплазме, а также в плазме крови и эритроцитах орга- низма-опухоленосителя переходит на более высокий уровень функционирования(активизируется).ИмеютсяданныеобизмененииуровняПОЛидинамики показателей ферментативного звена антиоксидантной системы в эритроцитах, плазме крови и опухолевой ткани у мышей в динамике экспериментального рака шейки матки. Оценка влияния излучения фемтосекундного импульсного волоконного эрбиевого лазера с длиной волны 1550 нм и пиковой мощностью 6000 Вт и излучения непрерывного лазера с рабочей мощностью 5,5 Вт и длиной волны 1265 нм показала, что ЛО имеет дозозависимый характер. При оптимальных режимах повышается уровень функционирования системы АОЗ ине стимулируетсявозникновениеоксидативного стрессав организме,однако превышение уровня допустимых энергий, особенно в импульсном режиме, может привести к негативным последствиям [Воронова О.С., 2012].
Многое известно о биологических процессах, происходящих при реализации противоопухолевого действия НИЛИ, для которого существует великое множествовторичныхмедиаторов:факторыроста,цитокины,белкитеплового шока, матриксные металлопротеиназы, малые молекулы и другие регуляторы [Sonis S.T. et al., 2016]. В табл. 40 представлены лишь некоторые молекуляр-
246

Лазерная терапия в онкологии
Таблица 40
Некоторые механизмы БД НИЛИ и молекулы, связанные с клеточной пролиферацией и восстановлением биотканей
Классификация |
Молекулы |
Действие и/или эффекты |
|
|
BDNF, bFGF, |
Ангиогенез |
|
|
EGF, FGF, |
Дифференцировка |
|
Факторы роста |
GDNF, IGF-1, |
Миграция |
|
|
KGF, PDGF, |
Пролиферация |
|
|
TGF-β, VEGF |
Хемотаксис |
|
|
|
Активация иммунной системы |
|
Противовоспалительные |
IL-2, IL-4, IL-8, |
Ангиогенез |
|
Дифференцировка |
|||
цитокины |
IL-10 |
||
Пролиферация |
|||
|
|
||
|
|
Хемотаксис |
|
|
IL-1α, IL-1β, |
Активация миграции |
|
Провоспалительные |
Ангиогенез |
||
IL-6, TNF-α, |
Анти- и проапоптоз |
||
цитокины |
|||
PGE2, COX-2 |
Пролиферация |
||
|
|||
|
|
Стимулирует и ускоряет воспаление |
|
|
|
Повышение жизненной стойкости клеток |
|
Белки теплового шока |
HSP70, HSP90 |
Рост опухоли |
|
|
|
Шапероны |
|
Матричные |
|
Жизненная стойкость клеток |
|
MMP2, MMP9 |
Предотвращает терминальную дифференцировку |
||
металлопротеиназы |
|||
|
Ремоделирование тканей |
||
|
|
||
|
АТФ, цГМФ, |
Ангиогенез |
|
|
Миграция |
||
Малые молекулы |
АФК, Ca2+, |
||
Нормализация клеточных функций |
|||
|
NO, H+ |
||
|
Пролиферация |
||
|
|
ные механизмы БД НИЛИ на клеточном и тканевом уровне [Gao X., Xing D., 2009; Kim W.S., Calderhead R.G., 2011; Sonis S.T. et al., 2016], где большая часть мессенджеров дана в англоязычной версии, кроме последней строки. Повторяем, в схеме представлен далеко не весь спектр эффектов и вторичных мессенджеров,которыхвдесяткиразбольше,нолишьпозволяющиедостаточно наглядно продемонстрировать их многогранность и разнонаправленность в контексте тематике книги.
Эти вторичные мессенджеры участвуют в большом количестве физиологических процессов: пролиферация, дифференцировка, ангиогенез, активация иммунной системы, анти- и проапоптоз, повышение жизненной стойкости клеток, возможно, потенциально и рост опухолей. Поэтому критически важное значение имеет ограничение дозировок ЛО, если исходить из понимания двухфазного характера ответной реакции организма на воздействие НИЛИ
[Elad S. et al., 2018].
Некоторыевнутриклеточныепути,дополняющиемедиаторы,представлены также на рис. 38 [Sonis S.T. et al., 2016]. Хотя данные в основном получены из исследований, выполненных in vitro, они достаточно наглядно показывают
247
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Лазерная терапия в онкологии
Рис. 38. Общее представление о некоторых путях реализации ответных внутриклеточных реакций на воздействие НИЛИ, которые могут влиять на опухоли или результат лечения (Sonis S.T. et al., 2016):
TLR – толл-подобные рецепторы (toll-like receptor); RTK – рецепторные тирозинкиназы (receptor tyrosine kinase); c-met – рецептор фактора роста гепатоцитов (tyrosine-protein kinase Met или hepatocyte growth factor receptor); EGFR – рецептор эпидермального фактора роста (epidermal growth factor receptor); PIP2 – фосфатидилинозитол-дифосфат (phosphatidylinositol 2-phosphate);
PIP3 – фосфатидилинозитол-трифосфат (phosphatidylinositol 3-phosphate); PI3K – фосфоинозитид-3-киназа (phosphoinositide-3-kinase); Akt – протеинкиназа B (protein kinase B); PTEN – фосфатаза с двойной субстратной специфичностью, продукт гена PTEN; TGFBR1/2 – рецептор трансформирующего фактора роста бета 1/2 (transforming growth factor beta receptor 1/2); mTOR – мишень рапамицина в клетках млекопитающих (mammalian target of rapamycin); PKC – протеинкиназа C (protein kinase C); Sp1 – фактор транскрипции человека, кодируемый геном SP1 на 12-й хромосоме (specificity protein 1); ERK – внеклеточно регулируемая киназа (extracellular signal-regulated kinase)
248

Лазерная терапия в онкологии
взаимосвязь между ЛО и активацией ряда рецепторов и сигнальных путей, которые могут потенциально вызвать нежелательное поведение опухоли или негативную реакцию на лечение.
Противоопухолевое действие обнаружено не только в результате освечивания НИЛИ, но и при использовании низкоинтенсивного электромагнитного излучения (ЭМИ) крайне-высокочастотного (КВЧ) диапазона [Применение КВЧ-излучений…, 1989; Чернов З.С. и др., 1989]. Например, Г.В. Жукова с соавт. (2005) воздействовали на затылочную область крыс с перевивной лимфосаркомой Плисса ЭМИ КВЧ (7,1 мм, 10 мВт/см2) в одночастотном режиме модуляции (7,8 Гц) и многочастотном варианте: частоты 1,7–3,4–7,8–15,6 Гц. В первом случае экспозиция варьировалась в пределах 15–30 мин по алгоритмам активационной терапии, во втором варианте соотношение времени воздействия при модуляции каждой из частот было 2 : 2 : 1 : 1. Выраженный противоопухолевый эффект в отношении чрезвычайно агрессивной, быстро развивающейся и активно метастазирующей опухоли, мало чувствительной к действию цитостатиков и лучевой терапии, был получен в 33 и 39% случаев соответственно, при моно- и многочастотной модуляции.
Несмотря на обнадёживающие результаты, заметим, что не проводилось сравнение с непрерывным режимом работы лазера, а также не выявлено прин ципи аль ных различий в эффектах указанных вариантов модуляции. Да и сами авторы исследования, несмотря на некое теоретическое обоснование частот («шумановский» спектр и «антистрессорная» частота 1,7 Гц), признают этот эксперимент лишь в качестве демонстрации принципиальной возможности влияния ЭМИ КВЧ, а алгоритм выбора частот и схем находится пока в стадии разработки [Жукова Г.В. и др., 2005].
Тем не менее в экспериментах in vivo достоверно показано, что комбинированное применение ЭМИ КВЧ при отсутствии химиотерапии оказывает значительный противоопухолевый эффект, выраженность которого зависит от сезона года. Максимальный эффект, наблюдаемый осенью, и заключается в регрессии саркомы-45 у 38% крыс-самцов и торможении роста опухоли на 71% у остальных животных. Биологически активные добавки, включающие комплекс незаменимых нативных L-аминокислот, витамины, микроэлементы и КВЧ-воздействие оказывают ещё более выраженный противоопухолевый эффект, особенно у старых животных, заключающийся в торможении роста саркомы-45 на 75% у 45% крыс и регрессии опухоли в 15% случаев [Жукова Г.В., 2006]. На основании этих данных даже запатентован способ лечения злокачественных новообразований в эксперименте [Пат. 2261733 RU].
В любом случае, как показано нами многократно, лазерный свет и ЭМИ КВЧ имеют общую природу биомодулирующего влияния, следовательно, и механизмов реализации этих эффектов [Москвин С.В., Хадарцев А.А., 2016].
Немногопрочастоты.Напоминаем,чтодляимпульсныхлазеровизменение частоты эквивалентно пропорциональному изменению средней мощности, тогдакакврежимемодуляциичастотаопределяетсинхронизациюсбиоритма-
249
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
