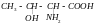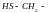- •Карбоновые кислоты
- •Классификация и номенклатура карбоновых кислот
- •4. Непредельные двухосновные карбоновые кислоты
- •Аминокислоты, пептиды и белки
- •Качественная реакции пептидов и белков
- •Сложные эфиры. Жиры. Липиды
- •Углеводы
- •Моносахариды
- •Химические свойства моносахаридов
- •Дисахариды
- •Полисахариды
Аминокислоты, пептиды и белки
Аминокислоты – бесцветные кристаллические вещества, плавящиеся при температурах 200 – 320С, часто с разложением. Они растворимы в воде, большинство нерастворимо в органических растворителях.
-Аминокислоты являются соединениями, из которых строятся молекулы белков. Белки играют роль опорных структур в живых организмах, транспортируют жиры в кровеносной системе, являются гормонами, ферментами, переносчиками кислорода из легких в ткани и др. Природные -аминокислоты, входящие в состав белков, их названия и сокращенные обозначения приведены ниже. В общем виде их можно отобразить следующей формулой:
 .
.
В зависимости от характера радикала R их можно разделить на 8 основных групп.
Моноаминокарбоновые кислоты R

глицин
glu
H -
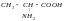
аланин
ala
CH3 -

валин
val


лейцин
leu


изолейцин
ile

Моноаминодикарбоновые кислоты

аспаргиновая кислота
asp
НООС– СН2–

аспаргин
asn


глутаминовая кислота
glt


глутамин
gln

Диаминокарбоновые кислоты

лизин
lys


аргинин
arg

Оксиаминокислоты
|
серин |
ser |
|
|
треонин |
thr |
|
Меркаптоаминокислоты
|
цистеин |
cys |
|
|
метионин |
met |
|
Ариламинокислоты
|
фенилаланин |
phe |
|
|
|
тирозин |
tyr |
|
|
Гетероалкиламинокислоты
|
триптофан |
try |
|
|
гистидин |
his |
|
Гетероциклическая кислота
|
пролин |
pro |
|
Химические свойства
Аминокислоты – амфотерные соединения, сочетающие свойства слабых органических кислот и слабых оснований:
H2N–CH2–COOH + NaOH H2N–CH2–COONa + H2O
H2N–CH2–COOH + HCl Cl–H3N+–CH2–COOH
Растворы
аминокислот имеют нейтральную реакцию:
при растворении в воде аминогруппа
реагирует с карбоксильной группой той
же молекулы с образованием биполярного
иона – внутренней соли: H2N–CH2–COOH
 H3N+–CH2–COO–.
H3N+–CH2–COO–.
Поведение аминокислот при нагревании сходно с таковым для оксикислот: -аминокислоты

-аминокислоты

остальные аминокислоты

Белки – это полимеры аминокислот, полученные в результате конденсации.
Продукт конденсации двух аминокислот – дипептид:

Группа
атомов
 называется пептидной (или амидной), а
связь между ними – пептидной
связью.
называется пептидной (или амидной), а
связь между ними – пептидной
связью.
Дипептид может дальше реагировать с аминокислотами, образуя длинные полипептидные цепочки, содержащие более 40 остатков аминокислот, – белки. Их также называют полипептидами, потому что в молекулах многократно повторяется пептидная группа. Молярные массы белков лежат в пределах от 10000 до нескольких миллионов. В состав природных белков входят 20 -аминокислот. Часть из них может быть синтезирована организмом (заменимые аминокислоты), другая поступает в организм только с пищей (незаменимые аминокислоты).
Порядок соединения аминокислот в молекулах белков называется первичной структурой белка. За счет внутримолекулярных водородных связей молекулы белков сворачиваются в спираль, образуя вторичную структуру белка. Спирали в свою очередь образуют вторичную спираль (третичная структура белка). Спирали могут объединяться попарно за счет межмолекулярных водородных связей, образуя четвертичную структуру.
В зависимости от формы макромолекул различают глобулярные (шаровидные) и фибриллярные (нитевидные) белки.
Под действием высоких температур, сильных кислот и щелочей, солей токсичных металлов, радиации четвертичная, третичная и вторичная структуры белков частично или полностью разрушаются, идет процесс денатурации белков.
При изменении кислотности среды (добавлении разбавленных растворов кислот или щелочей, не вызывающих денатурации) происходит их взаимодействие с концевыми амино- и карбоксильной группами. В более жестких условиях кислоты и щелочи вызывают гидролиз пептидов и белков (расщепление на исходные аминокислоты, которые реагируют с избытком кислоты или щелочи с образованием солей).