

Министерство здравоохранения Российской Федерации
Государственное бюджетное образовательное учреждение высшего профессионального образования
«Саратовский государственный медицинский университет имени В.И. Разумовского» Министерства здравоохранения Российской Федерации
(ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского Минздрава России)
ИЗБРАННЫЕ РАЗДЕЛЫ ФИЗИЧЕСКОЙ, КОЛЛОИДНОЙ ХИМИИ И ХИМИИ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ
(УЧЕБНО-МЕТОДИЧНЕСКОЕ ПОСОБИЕ ДЛЯ СТУДЕНТОВ МЕДИЦИНСКИХ ВУЗОВ)
САРАТОВ
2013
2
УДК
Учебно-методическое пособие является пособием нового типа, рассчитанном прежде всего на формирование химического мышления студентов медицинских вузов. Ясно и доступно изложен материал тем, изучаемый студентами I курса медвузов.
На современном уровне рассмотрены вопросы физической, коллоидной химии и физико-химии высокомолекулярных веществ. В пособии приводятся вопросы для контроля усвоения изучаемого материала, задачи и тесты. Логичность и популярность изложения материала, оригинальность контрольных вопросов способствует усвоению химических знаний, развивает у студентов научное мышление.
Пособие будет полезным студентам вузов, учащимся средних специальных учебных заведений, преподавателям вузов.
Составители:
С.Б. Орлов, заслуженный работник высшей школы РФ, старший преподаватель кафедры общей и биоорганической химии СГМУ; П.В. Решетов, д.х.н., профессор, заведующий кафедрой общей и биоорганической химии СГМУ:
М.И. Скуратова, к.х.н, старший преподаватель кафедры общей и биоорганической химии СГМУ; Л.Н. Куликова, к.х.н., старший преподаватель кафедры общей и биоорганической химии СГМУ; Е.М. Рубцова, к.х.н., ассистент кафедры общей и биоорганической химии СГМУ;
2

3
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ТЕМЕ:
«ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ»
( III стандарт образования; 2011 год)
МОДУЛЬ IV. Часть I
Теория и лабораторные работы по теме:
«ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И АДСОРБЦИЯ»
Изучив данную тему и выполнив практические работы студент обязан:
Знать:
сущность поверхностного натяжения, почему оно возникает; условия самопроизвольного протекания процессов в поверхностном слое;
 понятия «поверхностно-активные» и «поверхностно-инактивные» вещества, «поверхностная активность»; сущность процесса адсорбции; особенности физической и химической адсорбции;
понятия «поверхностно-активные» и «поверхностно-инактивные» вещества, «поверхностная активность»; сущность процесса адсорбции; особенности физической и химической адсорбции;
понятия «избыточная», «абсолютная» и «удельная» адсорбция
Уметь:
 строить изотерму поверхностного натяжения и определять графически поверхностную активность; рассчитывать поверхностную активность по уравнению Гиббса;
строить изотерму поверхностного натяжения и определять графически поверхностную активность; рассчитывать поверхностную активность по уравнению Гиббса;
строить изотерму гиббсовой адсорбции и определять предельную адсорбцию ПАВ;
ВВЕДЕНИЕ
Для всех коллоидных систем, частицы которых диспергированы в инертной среде и образуют в ней физическую поверхность раздела, процесс диспергирования означает значительное увеличение поверхностной энергии системы. Например, если некоторое количество вещества в виде кубика объѐмом 1 см3 имеет общую поверхность 6 см2, то это же количество вещества в виде кубиков в 1мк3 будет иметь общую поверхность 60 000 см2. Таким образом, удельная поверхность вещества в диспергированном состоянии (суммарная поверхность 1 см3 вещества) резко возрастает приблизительно пропорционально уменьшению линейных размеров частиц.
3
4
Значение этого фактора особенно велико для лиофобных коллоидов, частицы которых инертны по отношению к окружающей среде и не имеют сольватной оболочки, так как в этом случае увеличение удельной поверхности непосредственно связано с увеличением свободной поверхностной энергии, что лежит в основе наиболее характерных свойств лиофобных коллоидов.
Дисперсные частицы и дисперсионная среда относятся к различным фазам. (Напомним, что фазой называется однородная часть системы, отделѐнная от других частей поверхностью раздела.) Система может существовать из разных фаз только в том случае, если межмолекулярные взаимодействия в граничных фазах различны. Единственной системой, в
которой межмолекулярные взаимодействия отсутствуют, является идеальный газ. Интенсивность межмолекулярных взаимодействий возрастает при переходе от реальных газов к твѐрдым телам.
Рассмотрим систему, состоящую из жидкости и газа. Силы межмолекулярного взаимодействия в жидкости F1-1 больше сил взаимодействия между молекулами газа F2-2. Молекула жидкости, находящаяся внутри жидкости, окружена себе подобными молекулами. Силы взаимодействия между такими молекулами при этом взаимно уравновешиваются. Поверхностный слой жидкости находится в особых условиях по сравнению со всем объѐмом вещества. Молекулы поверхностного слоя граничат не только с себе подобными молекулами, но и с молекулами газа. Поэтому равнодействующая сила (Р) в этом случае направлена вглубь жидкости; эта сила тем больше, чем больше разность между силами взаимодействия между молекулами жидкости и силами взаимодействия между молекулами газа (Р = F1-1 - F2-2). Таким образом, поверхностная молекула испытывает одностороннее притяжение со стороны жидкости, втягивающее еѐ внутрь жидкости. Равнодействующая сил межмолекулярного взаимодействия поверхностных молекул перпендикулярна поверхности раздела и направлена в сторону фазы с более интенсивным межмолекулярным взаимодействием. Эта сила, отнесѐнная к единице площади поверхности раздела, носит название внутреннего давления и является важной характеристикой жидкости. Под внутренним давлением жидкости понимают силу притяжения между молекулами жидкости в еѐ объѐме. Как правило, внутреннее давление тем больше, чем выше полярность вещества. Втягивая поверхностные молекулы внутрь фазы, внутреннее давление стремится уменьшить поверхность до минимально возможной в данных условиях.
Для увеличения поверхности жидкости нужно преодолеть силу внутреннего давления и совершить определѐнную механическую работу против сил молекулярного сцепления, против внутреннего давления. Очевидно, что чем оно больше, тем больше энергии надо затратить. Эта энергия сосредотачивается в молекулах, находящихся на поверхности, и называется поверхностной энергией. Если увеличение площади поверхности производится при постоянном давлении и температуре (изобарно-
4
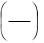
5
изотермический процесс) или при постоянных объѐме и температуре (изохорно-изотермический процесс), то оно сопровождается увеличением поверхностной энергии системы (энергии Гиббса или энергии Гельмгольца). Избыток поверхностной энергии, приходящейся на 1 м2 межфазной поверхности, характеризуется поверхностным натяжением (ζ). Бесконечно малое изменение поверхностной энергии Гиббса (dG) с изменением величины площади поверхности при постоянных р и Т равно
dG = ζdS,
где dS –бесконечно малое изменение площади поверхности; σ – коэффициент поверхностного натяжения. Из приведѐнного выражения следует (при постоянстве числа молей компонентов n):
σ = dG
dS T ,p,n
Таким образом,
поверхностное натяжение можно представить как частную производную от величины энергии Гиббса по величине межфазной поверхности при р = const и Т=const и постоянных числах молей компонентов.
[Гиббс Джозайя Умллард (1839-1903), американский физик теоретик, один из создателей термодинамики и статистической механики. Разработал теоию термодинамического потенциала, открыл общее условие равновесия гетерогенных систем, вывел ряд уравнений.]
Коэффициент поверхностного натяжения или просто поверхностное натяжение ζ, является важной характеристикой любой жидкости. Физический смысл поверхностного натяжения может иметь энергетическое и силовое выражения.
Согласно энергетическому выражению, поверхностное натяжение ζ есть поверхностная энергия Гиббса единицы поверхности (т.е. удельная поверхностная энергия Гиббса). В таком случае σ равно работе, затраченной
на образование единицы поверхности. Энергетической единицей σ является Дж/м2.
Силовое определение поверхностного натяжения формулируется так:
ζ– это сила, действующая на поверхности по касательной к ней и стремящаяся сократить свободную поверхность тела до наименьших возможных пределов при данном объѐме. В этом случае единицей измерения
ζявляется Н/м.
Энергетическое и силовое выражения ζ эквивалентны, и численная
величина совпадает |
в обеих размерностях. Так, для воды при 298 К |
ζ = 71,96∙10-3 Дж/м2 = |
71,96∙10-3 Н/м. Одна размерность легко выводится из |
другой: Дж/м2 = Н∙м/м2 = Н/м. |
|
При площади поверхности раздела фаз S и поверхностном натяжении ζ |
|
поверхностная энергия Гиббса выражается таким образом: GS = ζS.
Таким образом, поверхностное натяжение – это удельная свободная поверхностная энергия, т.е. свободная поверхностная энергия, приходящаяся на единицу межфазной поверхности.
5
6
Поверхностное натяжение характеризует различия в интенсивности межмолекулярных взаимодействий граничащих фаз. Чем больше эти различия, тем больше поверхностное натяжение. Для границы «конденсированная фаза (твѐрдая или жидкая) – воздух» можно пренебречь межмолекулярными взаимодействиями в воздухе (Fгаз-газ ≈ 0) и, значит, поверхностное натяжение характеризует интенсивность межмолекулярных сил в конденсированной фазе.
Поверхностное натяжение на границе «жидкость – жидкость» также зависит от природы соприкасающихся фаз: чем больше разность полярностей фаз, тем больше поверхностное натяжение на границе их раздела.
Поверхностное натяжение жидкостей уменьшается с ростом температуры. Это означает, что при критической температуре границы раздела между фазами исчезают и система «газ – жидкость» из гетерогенной превращается в гомогенную. Поэтому величина поверхностного натяжения является мерой гетерогенности системы, причѐм не только «газ – жидкость», но и «жидкость – жидкость».
При повышении давления увеличивается взаимодействие поверхностных молекул жидкости с молекулами газовой фазы и уменьшается избыток энергии молекул на поверхности. Поэтому с повышением давления в системе «жидкость – газ» поверхностное натяжение уменьшается.
Самопроизвольные процессы в поверхностном слое Для индивидуальных веществ поверхностное натяжение постоянно
(ζ = const, dζ = 0). В этих случаях самопроизвольно могут протекать процессы, сопровождающиеся уменьшением площади межфазной поверхности (dS1,2<0). К поверхностным явлениям, связанным с уменьшением поверхности, можно отнести:
 стремление капель жидкости или пузырьков газа принять сферическую форму (сферические частицы имеют самую маленькую удельную поверхность); слипание твѐрдых частиц дисперсной фазы (коагуляция);
стремление капель жидкости или пузырьков газа принять сферическую форму (сферические частицы имеют самую маленькую удельную поверхность); слипание твѐрдых частиц дисперсной фазы (коагуляция);
слипание капель в эмульсиях или пузырьков газа в пенах (коалесценция);
 рост кристаллов.
рост кристаллов.
Если площадь межфазной поверхности остаѐтся постоянной, то это возможно за счѐт уменьшения поверхностного натяжения (dζ<0), которое может быть обусловлено процессом адсорбции.
Измерение поверхностного натяжения сталагмометрическим методом
Этот метод определения поверхностного натяжения заключается в измерении объѐма или веса капли, медленно отрывающейся от кончика вертикальной трубки, внутренний радиус которой r.
В основе метода лежит предположение, что отрыв капли происходит в тот момент, когда еѐ вес Р становится равным силам поверхностного
6

7
натяжения, действующим вертикально по окружности трубки, т.е. в момент отрыва капли Р = 2πrζ.
При более точном определении ζ следует учитывать, что разрыв происходит в шейке капли, которая имеет меньший радиус, чем трубка. Поэтому значение радиуса r надо умножить на некоторый коэффициент k,
зависящий от отношения объѐма капли v к кубу радиуса трубки, k = f(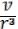 ). Экспериментально показано, что этот коэффициент не очень сильно меняется при изменении объѐма капель даже в 1000 раз. Для капель, сравнительно мало отличающихся по объѐму, этот коэффициент можно считать одинаковым. Так как в момент отрыва F = Р (F- силы межмолекулярного взаимодействия данной конкретной жидкости) то, определив вес образующейся капли Р, можно вычислить поверхностное натяжение жидкости ζ.
). Экспериментально показано, что этот коэффициент не очень сильно меняется при изменении объѐма капель даже в 1000 раз. Для капель, сравнительно мало отличающихся по объѐму, этот коэффициент можно считать одинаковым. Так как в момент отрыва F = Р (F- силы межмолекулярного взаимодействия данной конкретной жидкости) то, определив вес образующейся капли Р, можно вычислить поверхностное натяжение жидкости ζ.
Для определения веса капли пользуются сталагмометром, который представляет собой стеклянную трубку с расширением посредине, заканчивающуюся внизу капилляром. Трубка обычно имеет горизонтальную коленчатую часть, в которую впаян капилляр для того, чтобы жидкость капала медленнее. Расширенная часть трубки ограничена двумя метками. Для измерения поверхностного натяжения сталагмометр заполняют исследуемой жидкостью выше верхней метки; когда уровень жидкости опустится до верхней метки, начинают считать число капель n жидкости, вытекающей из трубки, до тех пор, пока уровень жидкости не достигнет нижней метки. Если известны объѐм расширенной части сталагмометра V и плотность жидкости ρ, то вес капли Р можно вычислить по формуле
Р = V g n
где g – ускорение силы тяжести. Очевидно, что при отрыве капли должно соблюдаться равенство
k2πrσ = V g
n
Обычно проводят относительное определение σ, сравнивая истечение из данного сталагмометра исследуемой жидкости и жидкости с известным поверхностным натяжением. В этом случае пользуются для расчѐта следующей формулой:
σх = σст ∙ |
х |
|
nст |
ст |
|
nx |
|
|
|
В этом уравнении индекс х относится к параметрам исследуемой жидкости, а индекс «ст» – к параметрам жидкости с известным поверхностным натяжением.
Если стандартной жидкостью является вода, величину nст называют «водяным числом сталагмометра», значение этой величины для воды при 20°С равно 72,8 мДж/м2. И для разбавленных водных растворов, плотность которых мало отличается от единицы, формулу можно упростить:
7

8
σх = σводы nводы nx
Из полученной формулы следует, что для определения поверхностного натяжения достаточно подсчитать число капель исследуемой жидкости.
Изменение поверхностного натяжения биологических жидкостей используется в диагностических целях. Например, поверхностное натяжение плазмы крови значительно изменяется при различных заболеваниях (анафилактический шок, рак, и др.). С возрастом у человека поверхностное натяжение сыворотки крови уменьшается.
Из многочисленных методов измерения поверхностного натяжения при биохимических, физиологических и клинических исследованиях чаще всего используют сталагмометрический метод и метод продавливания пузырьков воздуха.
ПОВЕРХНОСТНЫЕ СВОЙСТВА РАСТВОРОВ Поверхностные свойства растворов отличаются от поверхностных свойств
чистых жидкостей прежде всего тем, что состав поверхностного слоя раствора в той или иной степени отличен от состава внутренних слоѐв раствора.
Растворѐнные вещества в зависимости от природы могут по-разному влиять на поверхностное натяжение жидкостей. Способность растворѐнных веществ изменять поверхностное натяжение растворителя называется поверхностной активностью. Все вещества по способности изменять поверхностное натяжение растворителя делятся на три группы.
1. Вещества, понижающие поверхностное натяжение, называются
поверхностно-активными вещества (ПАВ). По отношению к водным растворам поверхностно-активными веществами являются спирты, жирные кислоты и их соли (мыла), сложные эфиры, амины, белки и некоторые другие вещества, имеющие дифильное строение. В молекулах таких веществ различают неполярную (гидрофобную) часть – углеводородный радикал («хвост») и полярную (гидрофильную) часть. Молекулу ПАВ принято изображать следующей схемой:
Прямая линия символизирует неполярную часть - углеводородный радикал («хвост»), а кружок – полярную группу.
Чтобы вещество обладало способностью понижать поверхностное натяжение растворителя, необходимо, чтобы в составе молекулы имелись полярные группы: -ОН, -NH2, -COOH, -SO3 др.
Поверхностно-активными по отношению к воде являются вещества менее полярные, чем вода (так, дипольный момент воды равен 1,84 Д, а у этанола – 1,70 Д). Такие вещества взаимодействуют с водой намного слабее, чем молекулы воды друг с другом. Поэтому, попадая на поверхность, они уменьшают поверхностное натяжение.
8
9
Мерой способности растворѐнного вещества к понижению поверхностного натяжения раствора является величина производной
поверхностного натяжения по концентрации 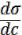 , называемая поверхностной активностью. Единица измерения поверхностной активности названа в честь Дж. Гиббса: 1 гиббс = 10-6 Дж ∙ м / моль.
, называемая поверхностной активностью. Единица измерения поверхностной активности названа в честь Дж. Гиббса: 1 гиббс = 10-6 Дж ∙ м / моль.
Поверхностная активность веществ одного и того же гомологического ряда возрастает приблизительно в три раза при увеличении углеводородной цепи на одну метиленовую группу (- СН2 -).
ПАВ, как и все вещества в зависимости от способности к электролитической диссоциации, делят на электролиты (ионогенные ПАВ) и неэлектролиты (неионогенные ПАВ). Ионогенные ПАВ подразделяют на катионные, анионные и амфотерные.
2.Вещества, повышающие поверхностное натяжение, называются поверхностно-инактивными (ПИВ). К этим веществам относятся сильные электролиты: соли, кислоты, щѐлочи. Ионы этих веществ, образующиеся в результате электролитической диссоциации, взаимодействуют с молекулами воды сильнее, чем молекулы воды между собой. Поэтому значительная часть ионов увлекается молекулами воды внутрь объѐма раствора. Однако некоторые немногие оставшиеся на поверхности создают вблизи поверхности силовое поле, тем самым повышают поверхностное натяжение.
3.Имеются вещества, которые не меняют поверхностное натяжение растворителя. Эти вещества называют поверхностно-неактивными. Молекулы таких веществ в своѐм составе имеют большое число полярных функциональных групп (например, сахароза).
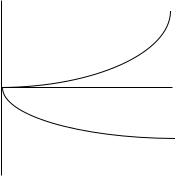
Всѐ многообразие зависимостей поверхностного натяжения от концентрации может быть представлено кривыми трѐх типов:
σT = const
II
σ° |
III |
|
|
I |
|
0 |
|
с |
|
||
Рис. 1. Зависимость поверхностного натяжения водного раствора от концентрации ПАВ (1); ПИВ (2) и не влияющих на величину поверхностного натяжения веществ ПНВ (3).
9

|
10 |
Из графика видно, что для ПАВ |
< 0, для ПИВ > 0, а для ПНВ |
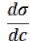 = 0. На графике σ0 – поверхностное натяжение воды. Отметим, что для ПАВ характерно резкое снижение σ даже при малых концентрациях. По мере роста концентрации ПАВ график становится более пологим и, наконец, переходит в горизонтальную прямую, что означает, что поверхностное натяжение достигло своего минимального значения. Увеличение σ под влиянием ПИВ происходит незначительно, что связано с тем, что концентрация ионов в поверхностном слое незначительна и по составу он близок к чистому растворителю.
= 0. На графике σ0 – поверхностное натяжение воды. Отметим, что для ПАВ характерно резкое снижение σ даже при малых концентрациях. По мере роста концентрации ПАВ график становится более пологим и, наконец, переходит в горизонтальную прямую, что означает, что поверхностное натяжение достигло своего минимального значения. Увеличение σ под влиянием ПИВ происходит незначительно, что связано с тем, что концентрация ионов в поверхностном слое незначительна и по составу он близок к чистому растворителю.
Отметим, что понятия ПАВ и ПИВ не носят абсолютный характер, они определяются выбранным растворителем, его поверхностным натяжением.
АДСОРБЦИЯ НА ПОВЕРХНОСТИ РАСТВОРОВ. УРАВНЕНИЕ ГИББСА
Изменение концентрации растворѐнного вещества в поверхностном слое раствора (или вообще на границе раздела фаз) называется адсорбцией.
Дж. Гиббс на основе второго закона термодинамики в 70-х гг. XIX в. вывел важное уравнение, связывающее величину адсорбции со способностью растворѐнного вещества изменять поверхностное натяжение раствора:
Г = |
с |
|
d |
|
|
|
|
RT |
|
dc |
|
|
|
где Г – количество адсорбированного вещества, моль/м2; с – молярная концентрация растворѐнного вещества, моль/дм3, Т – температура, при
которой происходит адсорбция, R – газовая постоянная, |
d |
– |
|
|
|||
dc |
|||
|
|
поверхностная активность.
Уравнение Гиббса отражает следующую зависимость: чем сильнее уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше его поверхностная активность. Это свидетельствует о том, что знак «минус» указывает на обратную зависимость между величиной адсорбции Г и поверхностным натяжением σ.
Если  < 0, то Г > 0, т.е. адсорбция положительна (вещество накапливается на поверхности раздела фаз), это характерно для ПАВ. Если
< 0, то Г > 0, т.е. адсорбция положительна (вещество накапливается на поверхности раздела фаз), это характерно для ПАВ. Если
же 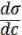 > 0, то Г < 0, т.е. адсорбция отрицательна (вещество накапливается в объѐме), это характерно для ПИВ.
> 0, то Г < 0, т.е. адсорбция отрицательна (вещество накапливается в объѐме), это характерно для ПИВ.
Адсорбция вещества – обратимый процесс, заканчивающийся установлением адсорбционного равновесия, при котором скорость адсорбции равна скорости обратного процесса – десорбции.
10
