

NH3+Н+ NH4+
NH4+
2.Анионные основания, представляющие собой отрицательные ионы, например, Cl-, СН3СОО-, ОН-:
СН3СОО-+Н+  СН3СООН
СН3СООН
3.Катионные основания, представляющие собой положительные ионы, например, Н2N−NH3+.
Растворители типа воды, жидкого аммиака, а так же анионы
многоосновных кислот, которые могут быть и донорам и акцепторами протонов, являются амфолитами.
Например, в реакции
Н2О+ NH3→ОН-+ NH4+
молекула воды отдает протон и является кислотой. Однако в реакции
Н2О+ HCl→ Н3О++Сl-
молекула воды присоединят протон и является основанием. Таким образом, вода - типичный амфолит.
Процесс диссоциации (ионизации) вещества происходит в контакте с растворителем. При этом растворитель выполняет или функцию кислоты или основания. Например, при растворении аммиака вода – кислота
NH3+ Н2О NH4++ ОН-
NH4++ ОН-
При растворении фторида водорода – основание
HF+ Н2О F-+H3O+
F-+H3O+
Если сродство к протону у растворителя больше, чем у растворенного вещества, то растворитель выступает как основание (сродство к протону Н2О больше сродства к протону HF), а если оно меньше – как кислота (сродство к протону Н2О меньше сродства к протону NH3).
Согласно протонной теории, отдавая протон, кислота превращается в основание, которое называют сопряженным этой кислоте:
I.(кислота)1=(сопряженное основание)1+Н+
т.е. каждой кислоте соответствует сопряженное основание. Наоборот, основание, присоединяя протон, превращается в сопряженную кислоту:
II. (основание)2+Н+ =(сопряженная кислота)2
Например, кислоте H2SO4 соответствует сопряженное основание HSO4-, а основанию Cl- - сопряженная кислота НСl.
11
III.(кислота)1+(основание)2=(кислота)2+(основание)1
Для краткости обратимый процесс кислотно-основного взаимодействия называют кислотно-основным равновесием.
Например:
HCl+ NH3 NH4++Cl-
NH4++Cl-
Несмотря на свои достоинства теория Бренстеда, как и теория Аррениуса, не применима к веществам, проявляющим функцию кислоты веществ, не содержащих водорода, например галогенидам бора, алюминия, кремния и олова. Поэтому более общей является теория кислот и оснований Льюиса.
Теория Льюиса (электронная теория). В теории Льюиса за основу взято наиболее общее свойство кислот и оснований – их электронное строение. Согласно этой теории:
кислотой называют вещество, принимающее неподеленную электронную пару, - акцептор электронов;
основанием называют вещество, поставляющее электроны для образования химической связи, - донор электронов.
По Льюису отличительной способностью кислот и оснований является их взаимная нейтрализация путем образования ковалентной связи:
Cl3Br+: NH3 Cl3Br: NH3;
Cl3Br: NH3;
O3S+:OH2 O3S:OH2
O3S:OH2
В приведенных примерах в качестве кислоты выступают молекулы трихлорида брома и оксида серы (VI), а в качестве оснований – молекулы аммиака и воды.
Таким образом, теория Льюиса рассматривает разные химические процессы как однотипные: реакцию аминов с галогенидом бора, комплексообразование.
Коснованиям Льюиса относят галогенид - ионы, аммиак, алифатические и ароматические амины, кислородсодержащие соединения общей формулы R2CO (где R- органический радикал).
Ккислотам Льюиса относят галогениды бора, алюминия, кремния, олова и других элементов.
Рассмотренные теории кислот и оснований не противоречат, а дополняют друг друга и имеют глубокую внутреннюю связь. Так, кислоты, по Бренстеду, можно рассматривать как частный случай льюисовских кислот, поскольку протон характеризуется большим сродством к электронной паре и может рассматриваться, по Люйсу, как кислота.
12

1.3.Константа диссоциации
Кд – константа диссоциации – это отношение произведения концентрации диссоциированных ионов к концентрации
недиссоциированных молекул электролита. Например,
КА  K++A-
K++A-
Кд – показывает во сколько раз скорость диссоциации больше скорости ассоциации. Чем больше Кд, тем сильнее электролит. Кд зависит от природы электролита и растворителя, температуры и не зависит от концентрации раствора.
1.4. Взаимосвязь степени диссоциации и константы диссоциации
Напомним, что степень диссоциации α - отношение числа молекул,
распавшихся на ионы, к общему числу молекул, тогда для уравнения КА K++A-
K++A-
С∙ α – количество диссоциированных моль электролита КА, (С-(С∙ α)) - количество недиссоциированных моль электролита КА.
Подставим эти значения в формулу выражения Кд:
получим 

 .
.
Это математическое выражение закона разбавления В. Оствальда (1888 г). Выражение можно упростить, если принять α→0. Величиной α в знаменателе пренебрегают и уравнение принимает вид:
 ≈ α2C, или α ≈
≈ α2C, или α ≈
Формулировка закона разбавления В. Оствальда: «C разбавлением раствора слабого электролита степень диссоциации увеличивается».
1.5.Ионное произведение воды. Водородный показатель.
Согласно протолитической теории Брэнстеда и Лоури, вода не нейтральный растворитель. Ее молекула может быть донором и акцептором протонов, т.е. является амфолитом. Явление, когда молекулы одного и того же вещества одновременно выступают в качестве кислоты и основания, называются автопротолизом. Сокращенно автопротолиз воды можно записать как процесс ее диссоциации на ионы.
Н2О Н++ОН-
Н++ОН-
13

Применяя закон действующих масс, запишем константу диссоциации воды, значение которой можно вычислить по данным измерения электрической проводимости воды.
Кд= |
|
=1,8∙10-16 (при 22ºС) |
|
В знаменателе дроби - концентрация недиссоциированных молекул воды, которую можно считать постоянной и определить в 1 л, приняв массу 1л воды за 1000г.
[Н2О]=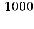
 =55,56молей,
=55,56молей,
тогда
-
Кд= =1,8∙10-16
=1,8∙10-16
Или [Н+]∙[ОН-]=1∙10-14 моль-ион/л (ионное произведение воды или константа автопротолиза).
Ионное произведение воды - произведение равновесных концентраций катионов водорода и гидроксид ионов, величина постоянная и равна 10-14 моль-ион/л.
Таким образом, ионное произведение воды позволяет для любого
водного раствора найти концентрацию ОН- по известной концентрации Н+, и наоборот.
Кислотность растворов обычно выражают через концентрацию ионов
Н+. В нейтральных растворах [Н+]=[ОН-]=√10-14=10-7моль-ион/л. В кислых растворах [Н+]>10-7моль-ион/л, в щелочных [Н+]<10-7моль-ион/л.
Чтобы не писать числа с показателем степени, кислотность раствора выражают через отрицательный логарифм концентрации ионов водорода, называя эту величину водородным показателем и обозначая ее рН.
рН=-lg[Н+], рОН=-lg[ОН-], рН+рОН=14
Величина рН впервые была введена датским химиком С. Серенсоном. Буква «р» - начальная от датского слова potenz (степень), «Н»- символ водорода.
Вкислых растворах рН <7, в нейтральных =7, в щелочных >7.
Вобычной лабораторной практике рН измеряют с погрешностью 0,02. По этой причине не следует приводить значение рН раствора более чем
сдвумя цифрами после запятой.
Врастворах слабых кислот НА кислотно-основное равновесие имеет
вид
НА+Н2О Н3О++А- или
Н3О++А- или
14

НА Н++А- Константа кислотной диссоциации (константа кислотности) Ка
равна:
Ка=[Н+]∙ [А-]/[НА] В растворе слабых оснований В кислотно-основное равновесие имеет
вид |
|
В+ Н2О |
ВН++ОН- |
Где В-основание, а ВН+ - |
сопряженная В кислота. Константа |
кислотно-основного равновесия в этом случае в соответствии с законом
действующих масс равна:
Кb=[BН+]∙ [ОН-]/[В]
Константу Кb называют константой диссоциации основания В или
константой основности.
Величины Ка и Кb для сопряженной кислотно-основной пары связаны также простым соотношением.
Ка Кb=10-14 или рКа+рКb=14, рКb=14-рКа
Таким образом, сила кислот и оснований может быть выражена в общей шкале рКа, подобно тому, как реакция среды характеризуется водородным показателем рН.
1.6.Гидролиз солей
Кроме реакции диссоциации в растворе происходят реакции обмена между протолитом и растворителем (для водных растворов - гидролиз, для неводных – сольволиз). Гидролиз – реакция взаимодействия соли с водой, приводящая к образованию слабого электролита с изменением характера среды.
Гидролизу подвергаются соли, образованные слабым основанием и сильной кислотой и наоборот. Соли, образованные сильным основанием и сильной кислотой гидролизу не подвергаются.
Пример:
1.Взаимодействие соли, образованной слабой кислотой и сильным основанием.
СН3СООNa+ HOH СН3СООH+NaOH
СН3СООH+NaOH
СН3СОО-+ HOH СН3СООH+OH- , рН>7, среда щелочная
2.Взаимодействие соли, образованной сильной кислотой и слабым основанием.
15

NH4Cl+HOH 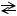 NH4OH+HCl
NH4OH+HCl
NH4++ HOH NH4OH+H+, рН<7, среда кислая
3. Взаимодействие соли, образованной слабой кислотой и слабым основанием.
СН3СООNH4 СН3СОО-+ NH4+
СН3СОО-+HOH СН3СООH+OH-
СН3СООH+OH-
NH4++ HOH NH4OH+H+
NH4OH+H+
СН3СООNH4+HOH NH4OH+ СН3СООH, рН~7, среда нейтральная.
Механизм гидролиза солей заключается в поляризационном взаимодействии ионов соли с их гидратной оболочкой. Чем сильнее это взаимодействие, тем интенсивнее протекает гидролиз.
Все рассмотренные случаи гидролиза касались солей, образованных
однокислотными |
основаниями и одноосновными кислотами. Соли |
|
многоосновных |
кислот |
и многокислотных оснований гидролизуются |
ступенчато, образуя при этом кислые и основные соли.
Например, соли Na2CO3, К3РО4 гидролзуются ступенчато, образуя кислые соли.
Соли AlCl3, Cu(NO3)3, CrCl3 гидролизуются ступенчато с образованием на промежуточных стадиях основных солей.
Процесс гидролиза характеризуется константой гидролиза (Кгидр) и степенью гидролиза (α). Константа гидролиза отвечает за глубину протекания процесса.
Рассмотрим взаимодействие хлорида аммония с водой:
NH4Cl+H2O  NH4OH+HCl
NH4OH+HCl
NH4++ H2O NH4OH+H+, рН<7, среда кислая
NH4OH+H+, рН<7, среда кислая
Запишем константу равновесия, характеризующую процесс взаимодействия хлорида аммония с водой:
Кравн=[NH4OH][H+] = Кгидр [NH4+][H2O]
Кгидр=KHОН
OH
Степень гидролиза представляет собой отношение концентраций гиролизуемой соли к общей концентрации соли и выражают в долях единицы или в процентах:
α =С гидролизуемой части соли
Собщ
16
Степень гидролиза зависит от природы соли, ее концентрации и температуры. Согласно закону действующих масс, степень гидролиза возрастает с разбавлением раствора. Качественно влияние температуры на степень гидролиза можно прогнозировать на основе принципа Ле Шателье. Так, реакция экзотермична (∆Н0=-56,5 кДж /моль), то противоположный ей процесс гидролиза является эндотермическим. Поэтому в соответствии с принципом Ле Шателье с повышением температуры степень гидролиза растет.
Гидролиз характерен для многих классов неорганических и органических соединений. Гидролиз неорганических соединений важен для оценки их токсичности, а гидролиз органических соединений применяют для получения ценных продуктов из древесины, жиров, эфиров и т.п., но особенно важную роль гидролиз играет в жизнедеятельности живых организмов.
Роль гидролиза в биохимических процессах трудно переоценить. Прежде всего, необходимо отметить ферментативный гидролиз, благодаря которому, три основных компонента пищи - жиры, белки, углеводы - в желудочно-кишечном тракте расщепляются водой на более мелкие фрагменты. В общем виде гидролиз пищевых компонентов описывается
R1-O-R2+H2O→ R1-OH + R2-OH
где R1, R2 – фрагменты биоорганической молекулы, связанные через кислород.
Без этого процесса не было бы возможно усвоение пищевых продуктов, так как всасываться в кишечнике способны только относительно небольшие молекулы. Так, например, усвоение полисахаридов и дисахаридов становится возможным лишь после полного их гидролиза ферментами до моносахаридов. Точно так же белки и липиды гидролизуются до веществ, которые лишь потом могут усваиваться.
1.7.Кислотность желудочного сока
Вводных растворах любой слабой кислоты различают общую, активную
ипотенциальную (резервную) кислотность.
Общая кислотность всегда соответствует содержанию всех кислот в растворе, обозначается Собщ., выражается в моль-ион/л.
Активная кислотность количественно определяется концентрацией свободных гидратированных ионов водорода, выражается в моль-экв/л или единицах рН. Например, если СН+=10-7 моль-экв/л, то рН=-lg СН+=- lg 1∙10-7=7 Потенциальная кислотность раствора определяется количеством ионов водорода, содержащихся в недиссоциированных молекулах, но которые
смогут еще диссоциировать.
Например, Собщ (СН3СООН)=0,1N, диссоциирует только 0,01 N кислоты,
то Сакт=0,01N, рН=-lg 10-2=2
17
Спотенц=Собщ-Сакт=0,1N-0,01N=0,09N
Для сильных кислот в разбавленных растворах общая концентрация кислоты и концентрация ионов водорода равны, т.к. сильные электролиты в растворе диссоциируют практически полностью.
Собщ=Сакт
Для слабых кислот или оснований величину СН+(СОН-) и рН (рОН) можно рассчитать, зная степень диссоциации (отношение числа молекул, распавшихся на ионы, к общему числу молекул) или константу диссоциации данной кислоты:
Сакт=α∙ Собщ
Где α- степень диссоциации в долях единицы, при α<1 имеем
СН+= (Кд∙ Собщ )1/2
- lg СН+=- lgКд∙ Собщ рН= рКlgСобщ
2 2
Соответственно, для слабых оснований
СОН- =α∙ Собщ, рН= |
рКlgС |
общ |
рН=14- рКlgСобщ |
2 |
|
2 |
|
Интервалы значений рН для различных жидкостей человеческого организма в норме и патологии. Одним из удивительных свойств живых организмов является кислотно-основной гомеостаз – постоянство рН биологических жидкостей, тканей и органов. В табл.1 представлены значения рН некоторых биологических объектов. Из данных табл. видно, что рН различных жидкостей в организме изменяется в широких пределах в зависимости от места нахождения. Например, рН сыворотки крови 7.4, тогда как рН желудочного сока – выделяемого клетками слизистой желудка, составляет около единицы. Значения рН крови, спинно - мозговой жидкости, слезной жидкости, желудочного сока, слюны практически постоянны. Это постоянство поддерживается их буферными системами.
Смещение значения рН крови в кислую область от нормальной величины рН 7.4 называется ацидозом, а в щелочную область – алкалозом.
При некоторых заболеваниях в организме образуются кислоты, которые удаляются очень медленно. Эти кислоты вытесняют СО2 из присутствующего в крови иона НСО3-. Диоксид углерода выводится через легкие. При этом концентрация НСО3- в крови уменьшается, но изменения рН практически не происходит, так как образующиеся кислоты нейтрализуются, а диоксид углерода удаляется.
18
Таблица 1. Значения рН различных биологических жидкостей и тканей организма.
Биожидкость |
рН (в норме) |
Сыворотка крови |
7,4±0,05 |
Слюна |
6,35-6,85 |
Чистый желудочный сок |
0,9-1,1 |
Моча |
4,8-7,5 |
Спинно-мозговая жидкость |
7,4±0,05 |
Сок поджелудочной железы |
7,5-8,0 |
Содержимое тонкого кишечника |
7,0-8,0 |
Желчь в протоках |
7,4-8,5 |
Желчь в пузыре |
5,4-6,9 |
Молоко |
6,6-6,9 |
Слезная жидкость |
7,4±0,1 |
Кожа (внутриклеточная жидкость, |
6,2-7,5 |
различные слои) |
|
Пока концентрация НСО3- в крови достаточна, образование кислот не приводит к существенному изменению рН. Имеет место компенсированный ацидоз (наблюдается, например, при диабете). Но когда концентрация НСО3- сильно понизится, ацидоз уже не компенсирован, и в этом случае сдвиг рН крови в кислую сторону возрастает со временем. Если рН крови станет ниже 7.0, появляются тяжелые симптомы.
Подобный по масштабу ацидозу сдвиг в щелочную область – алкалоз – образование в организме большого количества щелочи - встречается редко.
Большое значение имеет клиническое исследование на кислотность желудочного сока, что позволяет диагностировать различные заболевания на ранних стадиях. Общую кислотность желудочного сока определяют кондуктометрическим титрованием (изменение электропроводности), потенциометрией (изменение рН среды) и методом кислотно-основного титрования.
1.8.Гетерогеннные равновесия в системе «раствор-осадок».
К обменным реакциям, протекающим в растворе электролитов, относятся реакции осаждения и растворения. Реакции осаждения - это реакции, идущие с выпадением осадков. В этих реакциях устанавливается равновесие между кристаллами малорастворимого в воде сильного электролита и его ионами в растворе. Система, состоящая из насыщенного раствора и осадка, называется гетерогенной (неоднородной) системой.
19
В насыщенном растворе малорастворимого в воде сильного электролита устанавливается равновесие между кристаллами твердого вещества (осадком) и его ионами, находящимися в растворе. Например,
AgCl(тв) 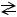 Ag++Cl-
Ag++Cl-
Вэтом случае идут два противоположных процесса. Ионы серебра и хлорид-ионы, из которых построены кристаллы хлорида серебра, диполями воды отрывают от поверхности осадка и переходят в раствор в виде гидратированных ионов, которые сталкиваются с поверхностью осадка и осаждаются на нем.
Всоответствии с законом действующих масс константа равновесия
имеет вид
К=[Ag][Cl-] [AgCl]тв
Выражение, отражающее приведенное равновесие, имеет вид
[Ag][Cl-]=ПРAgCl,
где [Ag+] и [Cl-] равновесные концентрации соответствующих ионов в насыщенном растворе, моль/л; ПРAgCl - произведение растворимости хлорида серебра.
Таким образом, произведение растворимости – произведение молярных концентраций катионов и анионов малорастворимого сильного электролита в насыщенном растворе при данной температуре. Величина ПР для каждого малорастворимого соединения постоянна при постоянной температуре и не зависит от концентрации ионов.
В насыщенном растворе малорастворимого соединения произведение концентраций ионов в растворе равно произведению растворимости.
Для этого же соединения, если произведение концентраций его ионов в растворе меньше произведения растворимости, раствор не насыщен. Осадок при этом не образуется. Если произведение концентраций ионов в растворе будет больше произведения растворимости, из раствора будет выпадать осадок.
Факторы, влияющие на произведение растворимости.
1.Одноименный ион. Если в растворе находится избыток одноименного иона труднорастворимой соли, то растворимость осадка определяется концентрацией в растворе другого иона соли. Растворимость осадка в присутствии одноименного иона понижается.
2.Ионная сила раствора. Противоположное влияние на растворимость оказывает присутствие в растворе сильного электролита, не содержащего одноименного иона с осадком. Повышение растворимости соли в этом случае называется солевым эффектом.
20
