
2 курс / Нормальная физиология / Физиологические_механизмы_компенсации_нарушенных_функций_системы
.pdf51
Определить кислородную насыщенность крови можно также методом оксигемометрии, принцип которой заключается в том, что датчик (фотоэлемент) накладывают на мочку уха больного и определяют показания шкалы прибора при дыхании воздухом, а затем чистым кислородом; значительное увеличение разницы показаний во втором случае свидетельствует о кислородной задолженности крови.
Лабораторные методы исследования
Исследование мокроты. Мокрота представляет собой секрет слизистой дыхательных путей, но в ней содержатся нередко и другие элементы (продукты распада легочной ткани, опухолей, кровь и т.д.). Исследование мокроты помогает установить характер патологического процесса, а в ряде случаев установить его этиологию.
Мокроту для исследования следует брать утреннюю, свежую, по возможности до еды и после полоскания рта. Только для обнаружения микобактерий туберкулеза мокроту можно собирать в течение 1-2 суток (если больной собирает ее мало). В несвежей мокроте размножается сапрофитная микрофлора, разрушаются форменные элементы. Для собирания мокроты используют специальные банки (плевательницы) с завинчивающимися крышками и мерными делениями.
Изучение мокроты начинают с ее осмотра сначала в прозрачной банке, а затем в чашке Петри, которую ставят попеременно на черный и белый фон. Отмечают следующие признаки (В.В. Меньшиков, Л.Н. Делекторская, Р.П. Золотницкая и др., 1987).
Количество. Объем отделяющейся за сутки мокроты колеблется в широких пределах: он может быть небольшим (1-2 мл), например, при остром бронхите, бронхиальной астме, и весьма значительным (более 200300 мл), что наиболее характерно для заболеваний, сопровождающихся образованием полости в органах дыхания. Для определения количества выделенной за сутки мокроты ее собирают и выливают потом в градуированную стеклянную посуду.
Цвет. Окраска мокроты определяется ее составом, она может быть бесцветной или иметь желтоватый оттенок, особенно при примеси гноя; зеленоватый цвет свидетельствует о застое гнойной мокроты и объясняется присутствием фермента вердопероксидазы, содержащейся в нейтрофильных лейкоцитах и освобождающейся при их распаде с последующим превращением железопорфириновой группы фермента. Желтый цвет мокрота может иметь из-за присутствия большого количества эозинофилов. Ржавый цвет мокроты чаще бывает при крупозной пневмонии в связи с появлением гематина, освобождающегося при распаде эритроцитов, проникающих в просвет альвеол в процессе диапедеза. Черный цвет мокроты зависит от примеси к ней частиц угольной пыли. Присутствие билирубина может окрашивать мокроту в желтый или зеленоватый цвет. Некоторые лекарственные вещества или случайные примеси могут также влиять на окраску мокроты.
52
Запах. Обычно свежевыделенная мокрота запаха не имеет. Гнилостный запах она приобретает при абсцессе, гангрене легкого, а также при гнилостном бронхите в результате присоединения гнилостной инфекции; появлению запаха способствует нарушение оттока мокроты.
Консистенция. Различают жидкую, густую и вязкую мокроту. Реологические свойства мокроты зависят от ее состава, а также эластичности и вязкости слизи.
Деление на слои. При обильном отделении не очень густой мокроты она при стоянии расслаивается. При гнилостном бронхите, гангрене легких, бронхоэктазах мокрота обычно разделяется на три слоя: верхний – пенистый, состоящий из слизисто-гнойных комков со значительным содержанием пузырьков воздуха; средний – мутноватая желтовато-зеленая жидкость и нижний – непрозрачная масса желтоватого цвета.
Разделение мокроты на два слоя часто наблюдается при абсцессе легких: верхний слой состоит из серозной жидкости, а нижний – из непрозрачной зеленовато-желтой гнойной массы, содержащей клеточные элементы. Все описанное позволяет сделать заключение о характере мокроты.
Характер. Состав мокроты неоднороден; ее характер зависит от патологического процесса. При описании характера мокроты преобладающий компонент выносит на второе место. Различают следующие виды мокроты:
1)слизистая мокрота – бесцветная, тягучая, вязкая (особенно вязкой – стекловидной – она бывает при бронхиальной астме);
2)гнойная мокрота – без примеси слизи встречается очень редко (например, при вскрытии эмпиемы плевры в полости бронха), так как при прохождении через дыхательные пути к мокроте обычно примешивается слизь;
3)слизисто-гнойная и гнойно-слизистая мокрота встречается наиболее часто; она образуется при многих заболеваниях бронхов и легких и представляет мутную вязкую массу, в которой тесно смешаны слизь и гной;
4)кровянистая мокрота, содержащая прожилки или сгустки крови; иногда примесь крови бывает измененной и ее присутствие можно заподозрить лишь по цвету мокроты (например, ржавая мокрота при крупозной пневмонии);
5)серозная мокрота – прозрачная пенистая, жидкая, иногда слегка розоватого цвета; можно наблюдать при отеке легкого.
Клиническое значение. Результаты макроскопического исследования мокроты с заключением о ее характере позволяют сделать вывод о характере патологического процесса.
Реакция среды. В мокроте реакция среды, как правило, щелочная; кислой она становится при разложении мокроты и от примеси желудочного сока, что помогает дифференцировать кровохарканье от кровавой рвоты.
Химическое исследование мокроты (определение белка и билирубина).
Следы белка содержатся во всякой мокроте. Наибольшие концентрации белка (более 3 %) можно наблюдать при отеке легкого, когда источником
53
белка является плазма крови. Значительные концентрации белка можно обнаружить при крупозной пневмонии и туберкулезе. На основании исследования количества белка в мокроте пытались дифференцировать бронхит и туберкулез легких, когда не находили микобактерий. Однако наблюдения носили разноречивый характер и отмечается, что определение белка в мокроте не может иметь большого диагностического значения (В.В. Меньшиков с соавт., 1987).
Билирубин в мокроте может появиться при прорыве в легкое абсцесса печени, но в незначительных количествах билирубин находят и при пневмонии.
Микроскопическое исследование мокроты. Микроскопическое исследование мокроты включает изучение нативных (естественных, необработанных) и окрашенных препаратов. Для первых отбирают гнойные, кровянистые, крошковатые комочки, переносят их на предметное стекло в таком количестве, чтобы при накрывании покровным стеклом образовался тонкий полупрозрачный препарат. При малом увеличении микроскопа могут быть обнаружены спирали Куршманна в виде плотных тяжей слизи различной величины. Они состоят из центральной плотной блестящей извитой осевой нити и спиралеобразно окутывающей ее мантии (рисунок 2.21, А), в которую вкраплены лейкоциты. Спирали Куршманна появляются в мокроте при спазме бронхов. При большом увеличении в нативном препарате (рисунок 2.21, В) можно обнаружить лейкоциты, эритроциты, альвеолярные макрофаги, клетки сердечных пороков, цилиндрический и плоский эпителий, клетки злокачественных опухолей, друзы актиномицетов, грибки, кристаллы Шарко-Лейдена, эозинофилы. Лейкоциты - серые зернистые круглые клетки. Большое количество лейкоцитов можно обнаружить при воспалительном процессе в органах дыхания. Эритроциты - небольшие гомогенные желтоватые диски, появляющиеся в мокроте при пневмонии, застое в малом круге кровообращения, инфаркте легкого и разрушении ткани. Альвеолярные макрофаги - клетки размером в 2-3 раза больше лейкоцитов с обильной крупной зернистостью в цитоплазме. Путем фагоцитоза они очищают легкие от попадающих в них частиц (пыли, распада клеток). Захватывая эритроциты, альвеолярные макрофаги превращаются в клетки сердечных пороков (рисунок 2.21 - Г, Д). Цилиндрический эпителий дыхательных путей распознается по клиновидной или бокаловидной форме клеток, на тупом конце которых в свежей мокроте видны реснички; его много при остром бронхите и остром катаре верхних дыхательных путей. Плоский эпителий - большие многоугольные клетки из полости рта, диагностического значения не имеют. Клетки злокачественных опухолей - большие, различной неправильной формы с крупными ядрами (для распознавания их требуется очень большой опыт исследующего). Эластические волокна - тонкие, извитые, двухконтурные бесцветные волоконца одинаковой толщины на всем протяжении, разветвляющиеся надвое на концах. Они часто складываются кольцевидными пучками. Встречаются при распаде легочной ткани. Эластические волокна выглядят,

Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
54
как описано выше, но ярко-розового цвета (рисунок 2.21, Ж). Друзы актиномицетов для микроскопирования раздавливают в капле глицерина или щелочи. Центральная часть друзы состоит из сплетения тонких нитей мицелия, его окружают лучисто расположенные колбовидные образования (рисунок 2.21, Е). При окраске раздавленной друзы по Граму мицелий окрашивается в фиолетовый, колбочки в розовый цвет. Грибок кандида альбиканс имеет характер почкующихся дрожжевых клеток или короткого ветвистого мицелия с небольшим числом спор (рисунок 2.21, Б). Кристаллы Шарко-Лейдена - бесцветные ромбические кристаллы разной величины (рисунок 2.21, А), образующиеся из продуктов распада эозинофилов, встречаются в мокроте наряду с большим количеством эозинофилов при бронхиальной астме, эозинофильных инфильтратах и глистных инвазиях легкого. Эозинофилы в нативном препарате отличаются от других лейкоцитов крупной блестящей зернистостью (рисунок 2.21, З). На рисунке 2.21 (И) представлены опухолевые клетки.
Рисунок 2.21 – Фрагменты микроскопического исследования мокроты:
А - спираль Куршмана (вверху) и кристаллы Шарко-Лейдена в мокроте (нативный препарат); Б - сandida albicans (в центре) - почкующиеся дрожжеподобные клетки и мицелий со спорами в мокроте (нативный препарат); В - клетки мокроты (нативный препарат): 1 - лейкоциты; 2 - эритроциты; 3 - альвеолярные макрофаги; 4 - клетки цилиндрического эпителия; Г - клетки сердечных пороков в мокроте (реакция на берлинскую лазурь); Д - клетки сердечных пороков в мокроте (нативный препарат); Е - друза актиномицетов в мокроте (нативный препарат); Ж - эластические волокна в мокроте (окраска эозином); З - эозинофилы (1) и нейтрофилы (2) в мокроте; И - конгломерат раковых клеток в мокроте

Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
55
Показатели общих свойств мокроты, а также ее микроскопического и бактериоскопического исследований заносятся в специальный бланк (рисунок 2.22).
Рисунок 2.22 – Бланк исследования мокроты
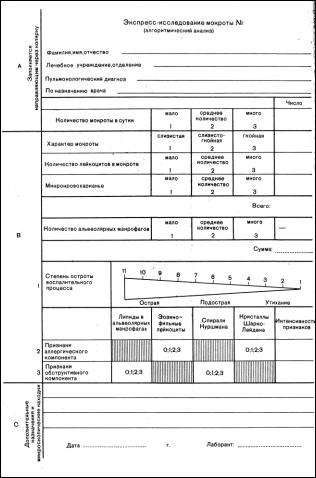
Алгоритмический анализ мокроты (метод Капрала). Для оценки степени активности воспалительного процесса в легких, выраженности аллергического и обструктивного компонентов в течение патологического процесса результатам микроскопического исследования дают количественную оценку, выраженную цифровыми показателями. Результаты заносятся в специальный бланк (рисунок 2.23), состоящий из трех отрезков (А, В и С) (В.В. Меньшиков, Л.Н. Делекторская, Р.П. Золотницкая и др., 1987).
Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
56
Рисунок 2.23 – Бланк алгоритмического анализа мокроты
Ход исследования. I. Оценка активности воспалительного процесса. Измеряют суточное количество мокроты и результат вносят в графу бланка (отрезок А). Если за сутки выделяется менее столовой ложки (менее 15 мл), то это оценивают как «мало» и обводят в бланке цифру 1; если выделяется от 1 до 3 столовых ложек (15-45 мл), то это количество («среднее») оценивают цифрой 2; более 3 ложек (более 45 мл) оценивают как обильное выделение («много»), что соответствует цифре 3. Полученный результат выносят в клетку этого же ряда свободной колонки.
Характер мокроты оценивают следующим образом: слизистая (1), слизисто-гнойная (2), гнойная (3). Результат переносят в соответствующий ряд свободной колонки в отрезке В. В отрезке С фиксируют результаты специальных дополнительных назначений и микроскопических находок.
Количество лейкоцитов определяют, производя подсчет в тонких нативных препаратах при равномерном распределении материала на предметном стекле. Клетки подсчитывают не менее чем в 20 полях зрения). Критерии оценки: до 10 лейкоцитов в поле зрения – мало (1), от 10 до 50 в поле зрения – среднее количество (2), более 50 – много (3). Результаты фиксируются по принципу предыдущих.
57
Количество эритроцитов (микрокровохарканье) как показатель активности воспалительного процесса оценивают по тоношению к числу лейкоцитов (на 1000 лейкоцитов). Подсчет ведут в разных местах тонких препаратов. Критерии оценки: до 25 эритроцитов на 1000 лейкоцитов – мало (1), от 25 до 50 эритроцитов – среднее количество (2) и более 50 – много (3). Оценивают и фиксируют результат в том же порядке, что и в предыдущих показателях. После этого суммируют цифровые показатели четырех описанных выше компонентов (количество мокроты, ее характер, число лейкоцитов и число эритроцитов) и ставят итог против слова «всего».
Количество ольвеолярных макрофагов оценивают при микроскопическом исследовании не менее 2 препаратов. Критерий оценки: единичные в препарате альвеолярные макрофаги – мало (1), единичные скопления из нескольких клеток в поле зрения – среднее количество (2), большие скопления альвеолярных макрофагов – много (3). В противоположность предыдущим показателям число альвеолярных макрофагов вычитывают из суммы первых четырех показателей.
Итоговую величину переносят в графический показатель интенсивности воспалительного процесса. Максимальная активность воспаления выражается цифрой 11. Уменьшение показателя в процессе терапии говорит об ее эффективности.
II. Степень выраженности аллергического компонента оценивают по количеству эозинофильных лейкоцитов и кристаллов Шарко-Лейдена. Критерий оценки: эозинофильные лейкоциты единичные в препарате – 0, единичные небольшие скопления в препарате – мало (1), небольшие скопления по всему препарату – среднее количество (2), если основной состав лейкоцитов представлен эозинофильными – много (3); по такому же принципу производят количественную оценку числа кристаллов ШаркоЛейдена. Для окончательной оценки выраженности аллергического компонента цифры суммируют, и числовой показатель колеблется от 0 до 6.
III. Выраженность интенсивности обструктивного компонента оценивают по наличию и количеству спиралей Куршмана и капель липидов в альвеолярных макрофагах. Критерий оценки капель липидов: отсутствие липидов – 0; в цитоплазме макрофагов маленькие блестящие капли липидов
–1; цитоплазма макрофагов заполнена липидами – 2; блестящие капли липидов видны не только в клетках, но и в окружающем их детрите – 3. критерий оценки числа спиралей Куршмана: спирали Куршмана не найдены
–0, единичные в нескольких (3-4) препаратах – 1, единичные в препарате – 2, почти в каждом поле несколько спиралей – 3. Показатель интенсивности обструктивного компонента может колебаться от 0 до 6.
Бактериологическое исследование (посев мокроты на питательные среды). Используют в том случае, когда бактериоскопическое исследование не обнаруживает предполагаемого возбудителя. Баскериологическое исследование позволяет идентифицировать вид микробов, определять их вирулентность и лекарственную устойчивость, что необходимо для правильного подбора медикаментозных средств.
58
Исследование плевральной жидкости
Общие сведения. Плевра состоит из двух листков, которые выстилают грудную полость и покрывают легкие. Между этими листками плевры имеется небольшое количество жидкости, которая облегчает их скольжение относительно друг друга во время дыхательных движений. Увеличение количества плевральной жидкости, наблюдаемое при различных заболеваниях (рак легкого, туберкулез, опухолевые заболевания системы крови и лимфатической системы), вызывает нарушение дыхания. Для устранения компрессии легкого и облегчения дыхания, а также для исследования плевральной жидкости ее аспирируют путем плевральной пункции.
При подготовке к диагностике:
следует объяснить пациенту, что исследование позволит удалить жидкость, скопившуюся вокруг легкого;
каких-либо ограничений в диете и режиме питания не требуется;
пациент должен знать, кто и где будет выполнять плевральную пункцию;
следует предупредить пациента, что при необходимости ему предварительного будет выполнено рентгенологическое или ультразвуковое исследование грудной клетки;
следует выяснить, нет ли у пациента повышенной чувствительности к местным анестетикам;
пациента предупреждают об уколе при введении раствора местного анестетика и возможности ощущения давления при откачивании плевральной жидкости;
следует предупредить пациента, чтобы он не кашлял, не двигался и не дышал глубоко во избежание повреждения легкого.
Процедуры:
определяют исходные основные физиологические показатели;
при наличии волос в области пункции их сбривают;
пациенту придают положение, при котором межреберные промежутки в области плевральной пункции расширяются. Обычно пациента усаживают поудобнее на край кровати, предлагая ему держаться за спинку стула и упереться в него ногами. Если ему трудно сидеть, то его укладывают на здоровый бок и руку на стороне поражения заводят за голову;
еще раз предупреждают о недопустимости кашля, глубоких вдохов и резких движений во время плевральной пункции и откачивания жидкости;
после укладывания пациента в удобное для него положение, кожу в месте предполагаемой пункции обрабатывают дезинфицирующим раствором, изолируют стерильными пеленками и инфильтрируют раствором местного анестетика. Пункционную иглу вводят непосредственно над верхним краем ребра, чтобы не повредить межреберных сосудов. При проникновении пункционной иглы в плевральную полость в место скопления жидкости к ней подсоединяют 50-миллилитровый шприц и снимают зажим с трубки для откачивания жидкости в контейнер;
59
во время откачивания плевральной жидкости следует обратить внимание, нет ли у пациента затруднения дыхания, слабости, одышки, бледности, цианоза, учащения или урежения пульса, тахипноэ, обильного потоотделения, гипотензии и не появилась ли у него мокрота с примесью крови;
после извлечения пункционной иглы место пункции слегка придавливают и закрывают стерильной наклейкой;
контейнер с плевральной жидкостью маркируют с указанием в бланке направления в лабораторию даты и времени плевральной пункции, количества эвакуированной плевральной жидкости, ее характера и цвета (прозрачная, пенистая, гнойная, кровянистая);
следует отметить точное место пункции, что важно для правильного диагноза;
пациента осторожно укладывают на больной бок и просят оставаться в этом положении не менее 1 ч для закрытия пункционного канала. Для облегчения дыхания головной конец кровати приподнимают;
определяют основные физиологические показатели каждые 30 мин в течение первых 2 ч, затем каждые 4 ч, если состояние пациента стабильное;
пациента просят немедленно сообщить при появлении затруднения дыхания.
Предостережение. Следует помнить о возможности развития
пневмоторакса, в том числе напряженного, повторного скопления жидкости в плевральной полости, а после откачивания значительного количества плевральной жидкости - развития отека легких, сердечной недостаточности вследствие смещения средостения. Обычно для выявления этих осложнений до их клинического проявления назначают рентгенологическое исследование грудной клетки.
Следует проверить, нет ли истечения плевральной жидкости или крови из пункционного канала. Обычно отмечается незначительное промокание повязки. Следует проверить также, нет ли подкожной эмфиземы.
Референтные значения. В норме в плевральной полости отрицательное давление и в ней содержится не более 20 мл серозной жидкости.
Отклонения от нормы. Скопление жидкости в плевральной полости является результатом чрезмерного ее образования и нарушения всасывания. В зависимости от количества белка в плевральной жидкости различают транссудат (жидкость с низким содержанием белка, образующаяся в результате пропотевания из неизмененных сосудов) и экссудат (жидкость с высоким содержанием белка, скапливающаяся при заболеваниях, которые сопровождаются повышением проницаемости сосудов). Плевральная жидкость может содержать кровь (гемоторакс), лимфу (хилоторакс) или гной (эмпиема плевры), а также некротические ткани. Присутствие крови в плевральной жидкости может быть обусловлено повреждением сосудов при выполнении плевральной пункции, в этом случае по мере откачивания
60
жидкости примесь крови в ней уменьшается. Транссудат скапливается обычно при сниженном коллоидном давлении, усугублении отрицательного давления в плевральной полости, при асците, системной и легочной венозной гипертензии, сердечной недостаточности, циррозе печени и нефрите. Причиной образования экссудата являются заболевания и состояния, сопровождающиеся повышением проницаемости сосудов плевры (возможно, на фоне изменений гидростатического или коллоидно-осмотического давления), нарушение оттока лимфы, инфекции, инфаркт легкого и злокачественные опухоли.
Исследование промывных вод бронхов. Для своевременной диагностики туберкулеза легких и трахеобронхиальной системы большое значение имеет раннее распознавание поражения бронхов. Для этой цели в практике применяется исследование промывных вод бронхов. Методика получения промывных вод не сложна, но надо помнить о противопоказаниях ее применения. Людям старческого возраста промывание бронхов следует делать с большой осторожностью. Процедура противопоказана при заболеваниях бронхиальной астмой, а также при явлениях сердечно-легочной недостаточности. Для получения промывных вод бронхов больному анестезируют дыхательные пути. Гортанным шприцем вводят 15-20 мл физиологического раствора, подогретого до 37°. Это усиливает секрецию слизистой бронхов. Откашливая, больной выделяет промывные воды. Их собирают в стерильную посуду и обрабатывают обычным способом для бактериоскопии. Производится исследование отдельного бронха или целого ветвления.
