
2 курс / Нормальная физиология / Основы_физиологии_гемостаза_Струкова_С_М_
.pdf
домен и расщепляя один из высокоаффинных участков связывания фон Виллебранда фактора (рис.2-17). Фактор VIII превращается в фактор VIIIа,
гетеротример (А1/А2/А3-С1-С2), субъединицы которого стабилизированы ионами Са. Фактор VIIIа – эффективный кофактор фактора IXa, активатора фактора X. Инактивация фактор VIIIа происходит вследствие диссоциации двух А доменов тяжелой цепи или специфического расщепления связи между А1
и А2 доменами активированным протеином С. Фон Виллебранда фактор повышает стабильность фактора VIII и защищает его от инактивации АРС.
Контроль активации фактора X является критическим событием гемостаза и тромбоза.
2.2.4. Субстрат свертывания - фибриноген
Фибриноген, составляющий структурную основу тромба, состоит из трех пар не идентичных полипептидных цепей, обозначаемых как А , В и  (рис.
(рис.
2-18).
Рис 2-18
Структура молекулы фибриногена.
71

Молекула фибриногена состоит из трех пар полипептидных цепей-А альфа,В
бета,гамма, об`единенных в три домена DED.
Молекула фибриногена состоит из трех модулей (доменов), выявленных электронной микроскопией. Аминоконцевые части всех трех цепей образуют центральную область взаимодействия двух субъединиц молекулы фибриногена,
ковалентно связанных между собой тремя дисульфидными мостиками, так называемый, Е домен. Карбокси(С)концевые участки  и
и  цепей образуют D
цепей образуют D
домены фибриногена.
Фактор XIII - фибринстабилизирующий фактор, существует в двух формах –плазменный и тромбоцитарный. Плазменный фактор XIIIтетрамер ,
состоящий из двух пар цепей ( и ), а тромбоцитарный содержит только -
цепи.
2.3. Механизм свертывания крови.
Разделение механизма свертывания крови на два пути – внутренний
(контактная фаза свертывания) и внешний существовало по крайней мере три десятилетия от начала 60-х годов XX века, когда был предложен каскадный механизм реакций образования тромбина.
2.3.1. Контактная фаза свертывания крови.
Контактная активация свертывания крови инициируется in vivo при воспалении, in vitro при контакте плазмы с отрицательно заряженной поверхностью.
На отрицательно заряженной поверхности происходит сборка ассамблеи факторов XII, XI и прекалликреина вместе с кофактором фактора XI и
рецептором прекалликреина -высокомолекулярным кининогеном (рис. 2-19).
72

Рис. 2-19
Активация и функции контактной фазы свертывания крови.
Фактор XII превращается в протеиназуфактор XIIa под действием протеиназы – калликреина. Активаторы превращения прекалликреина (ПК)
плазмы в калликреин: фактор XIIa, матриксные металлопротеиназы (ММП)
и пролилкарбоксипептидаза (PRCP). Калликреин расщепляет фактор XII до фактор XIIa в реакции положительной обратной связи. Фактор XIIa превращает фактор XI в XIa. Калликреин отщепляет от молекулы высокомолекулярного кининогена (ВМК)( кофактора ПК и фактора XI) пептид –брадикинин.
Калликреин активирует превращение проурокиназы (проУК) в
урокиназу(УК,uPA).
73
Связывание фактора XII с отрицательно заряженной поверхностью изменяет
конформацию молекулы и делает ее более чувствительной к активации. |
Фактор |
|||||||||
XII |
превращается в |
активную |
сериновую протеиназу, |
фактор |
XIIa, |
|||||
аутокаталитически или |
под |
действием |
другой |
протеиназы – |
калликреина. |
|||||
Активаторами превращения |
прекалликреина плазмы |
в калликреин |
могут |
|||||||
служить ряд протеиназ: |
фактор XIIa ( реципроктная активация), |
матриксные |
||||||||
металлопротеиназы (ММП, MMP), которые |
появляются в участке повреждения |
|||||||||
сосуда |
и воспаления |
из предшественников - ПроММП, а также |
||||||||
пролилкарбоксипептидаза(PRCP), фермент инактивирующий |
ангиотензин II и |
|||||||||
обеспечивающий взаимодействие |
калликреиновой |
и |
ренин-ангиотензиновой |
|||||||
систем. Появившийся калликреин |
быстро расщепляет неактивный фактор XII в |
|||||||||
фактор XIIa в реакции положительной обратной связи, которая |
кинетически |
|||||||||
более эффективна, чем аутоактивация фактора XII. Калликреин расщепляет |
||||||||||
высокомолекулярный |
кининоген |
(ВМК), |
освобождая |
вазоактивный |
пептид- |
|||||
брадикинин (Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg), сильный вазодилататор,
который повышает сосудистую проницаемость, стимулирует ноцицептивные рецепторы и вызывает сокращение ряда гладких мышц (например,
подвздошной кишки). Калликреин стимулирует превращение проурокиназы
(проУК) в урокиназу(УК).
Структурные особенности фактора XII (см.выше) свидетельствуют о его многофункциональности. Основная функция фактора XII -активация фактора
XI. Фактор XI состоит из двух идентичных цепей с высокой степенью гомологии прекалликреину. Подобно прекалликреину он существует в кровотоке в комплексе с ВМК. ВМК обеспечивает связывание фактора XI c
отрицательно заряженной поверхностью и способствует его активации протеиназами, фактором XIIа, XIа и тромбином, каждый их которых расщепляет в мономерах фактора XI пептидную связь Arg369-Ile370.
Фактор XI активирует фактор IX в IXa. На уровне IX фактора объединяются внутренний и внешний пути свертывания. Физиологическое значение внутненнего пути не ясно, хотя участие контактной фазы в процессах воспаления не вызывает сомнений. Показано,что недостаточность фактора XII
не ведет к кровоточивости,напротив обнаружена склонность к тромбообразованию. Приобретенная недостаточность факторов контактной фазы выявлена у пациентов с новообразованиями, сепсисом, аллергическими
74

реакциями. Пептид, брадикинин, освобождаемый из ВМК калликреином,
является модулятором тонуса сосудов. Образование фактора IXa -общая стадия
внутреннего |
и внешнего |
пути, |
согласно устаревшему представлению о |
механизме |
свертывания крови |
в нормальном физиологическом процессе |
|
гемостаза. |
|
|
|
2.3.2. Внешний путь свертывания крови – основной механизм
образования тромбина в кровотоке.
К настоящему времени доказано, что внешний путь свертывания крови, индуцируемый тканевым фактором, является основным механизмом образования тромбина в кровеносном русле (рис. 2-20).
75
РИС 2-20
Схема двухфазной активации системы свертывания крови.
Фактор VIIa в комплексе с тканевым фактором (ТФ/VIIa) запускает активацию
свертывания крови. В фазе 1ойинициации свертывания, комплекс ТF/VIIa
активирует фактор X |
в |
фактор Xа, |
который стимулирует |
появление |
наномолярных концентраций |
тромбина. |
Тромбин (нМ) |
связывает |
|
тромбомодулин эндотелия ( ТМ) и запускает активацию системы протеина С,
активирует PAR1 тромбоцитов, факторы V и VIII в активные формы ( Va и VIIIa( -кофакторы факторов Xa и IXa ). Во 2ой фазе – распространения свертывания, ТF/VIIa активирует фактор IX на мембране активированных тромбоцитов, микрочастиц, эндотелия. Комплекс фактора IXa с кофактором
VIIIa, Са2+ |
и фосфолипидами (тенназа) |
активирует фактор X в форму Xа. |
|||||
Комплекс |
фактора Xа |
с кофактором |
Va, |
Са2+ |
и |
фосфолипидами |
|
(протромбиназа) превращает |
протромбин в тромбин ( >нМ). Тромбин (>нМ) |
||||||
активирует |
рецептор |
PAR4 |
тромбоцитов, |
фактор |
XI |
в XIа, который |
|
превращает фактор IX в IXа. Тромбин запускает процесс образования фибрина,
отщепляя фибринопептиды А и В, и превращая фибриноген в фибрин-мономер.
Тромбин активирует фактор XIII в XIIIa, стабилизирующий полимеры фибрина ковалентными связями. Тромбин в комплексе с ТМ активирует TAFI (ингибитор фибринолиза, активируемый тромбином) в карбоксипептидазу В – TAFIа.
TAFIа ингибирует фибринолиз, удаляя С-концевые остатки лизина от фибрина,
которые необходимы для связывания плазминогена (профермента плазмина), и
активаторов плазминогена - t-PA (тканевой активатор плазминогена) (t-PA ) и u-PA (урокиназа). PAI -ингибитор активаторов плазминогена 1 типа.
2.3.2.1. Тканевой факторинициатор активации
свертывания крови
76
Стимулом к активации внешнего пути свертывания служит экспонирование на поверхности поврежденных клеток сосудистой стенки тканевого фактора, называемого так же тромбопластином (син. фактор III
свертывания крови).
Существуют два пути образования комплекса тканевого фактора с фактором VIIa свертывания крови. Первый – прямое связывание тканевого фактора с фактором VIIa, присутствующим в кровотоке в очень низкой концентрации (1% фактора VII) в конформации, не позволяющей ему контактировать с плазменными факторами свертывания и активировать их.
Тканевой фактор – аллостерический активатор фактора VIIa, связывает фактор,изменяет его конформацию и каталитические свойства, повышая протеолитическую активность протеиназы в отношении специфических субстратов – факторов IX и X свертывания крови в несколько тысяч раз.
Второй путь – связывание тканевым фактором фактора VII крови,
последующее превращение его в активную форму (VIIa), расщеплением одной пептидной связи Arg152-Ile153 фактором Xa и образование активной двухцепочечной молекулы фактора VIIa, субединицы которой соединены дисульфидной связью.
Тканевой фактор (CD142)– 47кДа трансмембранный гликопротеин, член суперсемейства рецепторов цитокинов класса II со значительной степенью гомологии с классом рецепторов интерферона. Тканевой фактор имеет одну полипептидную цепь, состоящую из N-концевого внеклеточного домена (219
а.о. (аминокислотных остатков)), гидрофобного трансмембранного участка (29
а.о.) и С-концевого внутриклеточного ―хвоста‖ (21 а.о.). Внеклеточная часть молекулы тканевого фактора состоит из двух доменов ( F1 и F2), подобных доменам фибронектина. Заякоревание тканевого фактора на мембране клетки существенно для связывания с высоким сродством факторов VII /VIIa,
поддержки протеолитической активности фактора VIIa и инициирования свертывания крови.
В норме эндотелиальные клетки и моноциты не экспрессируют тканевой фактор, формируя дефицитный по тканевому фактору барьер между фактором
VIIa и внесосудистыми его источниками .
77

Тканевой фактор конститутивно экспрессируется клетками субэндотелия, а также фибробластами и ГМК . Тканевой фактор обнаружен в адвентиции сосудов и в перицитах микрососудов мозга. На лейкоцитах и клетках эндотелия тканевой фактор экспонируется в ответ на воспалительные стимулы и повреждение клеток. Тканевой фактор может содержаться в циркулирующей крови в микрочастицах, освобождаемых при активации клеток, и в -гранулах тромбоцитов в неактивной форме и/или в очень низкой концентрации.
Моноциты, активированные при воспалении, синтезируют тканевой фактор,
которой заякорен в специализированных микродоменах, так называемых ― липидных плотах‖. Эти домены служат источником микрочастиц, богатых фосфатидилсерином и тканевым фактором. Микрочастицы,
транспортирующие тканевой фактор, адгезируют с активированными тромбоцитами, нейтрофилами и моноцитами, концентрируются в участке повреждения сосуда и иммобилизованный тканевой фактор стимулирует тромбообразование.
Тканевой фактор обнаружен в микрочастицах крови больных инфарктом миокарда, антифосфолипидным синдромом, сепсисом и др.
Итак, тканевой фактор служит кофактором и рецептором сериновой протеиназы - фактора VIIa и профермента – фактора VII. Фактор VIIa в
комплексе с тканевым фактором (ТФ/VIIa) запускает каскад активации проферментов в активные протеазы и активирует рецепторы PAR на фибробластах, эпителиальных и эндотелиальных и других клетках .
2.3.2.2. Образование сериновых протеаз гемостаза.
Фактор VII- |
зависимый |
от витамина |
К, |
одноцепочечный, |
|
гликозилированный мультидоменный белок (406 а.о.), содержит N-концевой |
- |
||||
карбоксиглутаминовый домен (Гла-домен), содержащий |
10 остатков |
- |
|||
карбоксиглутаминовой |
кислоты, |
гидрофобный стек, |
два |
домена, подобных |
|
эпидермальному фактору роста (EGF-домены), и каталитический (протеазный)
домен, гомологичный трипсину и химотрипсину по аминокислотной последовательности. Доменная структура молекулы белка и организация гена
78
фактора VII подобны таковым других витамин К зависимых факторов – IX, X ,
протеина С и протеина S ( рис. 2-13).
Рентгеноструктурным анализом кристаллической структуры комплекса растворимой формы тканевого фактора (лишенной трансмембранного и цитоплазматического домена) и ингибированного
по активному центру фактора VIIa показано, что фермент, связанный с мембраной через Гла-домен, имеет протяженные контакты с тканевым фактором. Тканевой фактор подобен стержню, включенному в фосфолипидные везикулы мембраны, вокруг которого ―закручивается‖ молекула фактора VIIa.
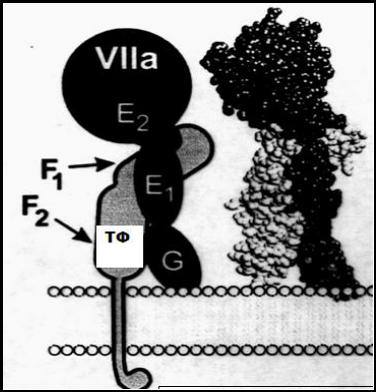
Основные участки контакта фактора VIIa с тканевым фактором локализованы в первом EGF домене и каталитическом домене, а дополнительные точки контакта – в гидрофобном стеке, Гла-домене и втором EGF домене. Благодаря такому контакту комплекс ТФ/VIIa ориентирован перпендикулярно поверхности мембраны(рис. 2-21).
РИС. 2-21
79

Модель структуры комплекса тканевого фактора с фактором
VIIa( ТФ/VIIa)
Тканевой фактор состоит из трех доменов: N-концевого внеклеточного домена ,
гидрофобного трансмембранного участка и С-концевого внутриклеточного
―хвоста‖ . Внеклеточная часть молекулы тканевого фактора состоит из двух доменов ( F1 и F2), подобных доменам фибронектина( FN-1 и FN-2). Фактор
VIIa состоит из N-концевого Гла-домена( G), двух доменов, подобных эпидермальному фактору роста (EGF-домены Е1 и Е2), и С- концевого каталитического (протеазного) домена(VIIa)
Тканевой фактор изменяет локализацию и ориентацию активного центра фактора VIIa относительно мембраны: расстояние от активного центра фермента до мембраны уменьшается, что способствует эффективному расщеплению пептидных связей субстратов ( факторов X и IX ), также связанных с мембраной через Гла-домены.
Взаимодействие фактора VII с тканевым фактором является зависимым от ионов кальция (Са2+). Девять участков молекулы фактора VII участвуют в связывании Са2+ : семь сайтов в Гла-домене, один – в EGF I домене и еще один в каталитическом домене. Для высокоаффинного связывания фактора VII с
тканевым фактором очень важно низкоаффинное ( Kd < 1mM) связывание Са2+
с Гла-доменом.
Комплекс ТФ/VIIa связывает фактор X и превращает его в
фактор Xа.
В отличие от других зависимых от витамина К факторов протромбинового комплекса фактор X состоит их двух цепей, соединеных дисульфидной связью.
Легкая цепь (139ао) содержит в структуре N-концевой Гла-домен с 11
остатками -карбоксиглутаминовой кислоты, гидрофобный стек, два домена,
подобных эпидермальному фактору роста (EGF-домены), в первом их которых локализован β-гидроксилированный Asn63 . Тяжелая цепь(306 ао), содержащая
80
