
2 курс / Нормальная физиология / Основы_физиологии_гемостаза_Струкова_С_М_
.pdfОпределенные участки доменной структуры факторов свертывания отвечают за высокоаффинное связывание белков с клеточными мембранами, рецепторами и кофакторами, что существенно ускоряет процесс образования ферментов и процесс свертывания.
Связывание многих факторов происходит при участии фосфолипидов и ионов Са2+ . Благодаря связыванию факторов свертывания с поверхностью клетки и
белок-белковым взаимодействиям факторов происходит изменение их
конформации, благоприятствующее эффективному течению реакций, и защита
ферментов от их ингибиторов. |
Третья особенность процесса свертывания |
|
- необходимость кофакторов свертывания, рецепторов, ингибиторов |
и |
|
активация механизмов отрицательной и положительной обратной связи,
регулирующий образование тромбина.
Итак, свертывание крови происходит на поверхности поврежденного эндотелия и активированных тромбоцитов, на которой происходит сборка комплексов -профермент, фермент, активатор (кофактор), активация проферментов, каскад образования активных протеиназ и реакции положительной и отрицательной обратной связи, регулирующие свертывание крови.
2.2.Cтруктурные особенности факторов свертывания крови.
Всоответствии со структурными особенностями факторы свертывания и белки крови, участвующие в образовании основного фермента системы свертываниятромбина, можно разделить на несколько групп.
1)Факторы протромбинового комплекса (табл. , рис.2- 12). К ним относят протромбин (фактор II), свертывания крови VII(проконвертин), IX(фактор Кристмаса, антигемофильный фактор В), X (фактор Стюарта) и белки антикоагулянтной системы протеина С- протеин С, протеин S и протеин Z .
Характерной особенностью этой группы служит наличие на амино(N)конце
каждого белка специфической последовательности, осуществляющей связывание молекулы с фосфолипидами поверхности активированной клетки,
преимущественно тромбоцита. На карбокси(C)конце всех факторов
протромбинового комплекса, кроме протеинов S и Z, находится
61
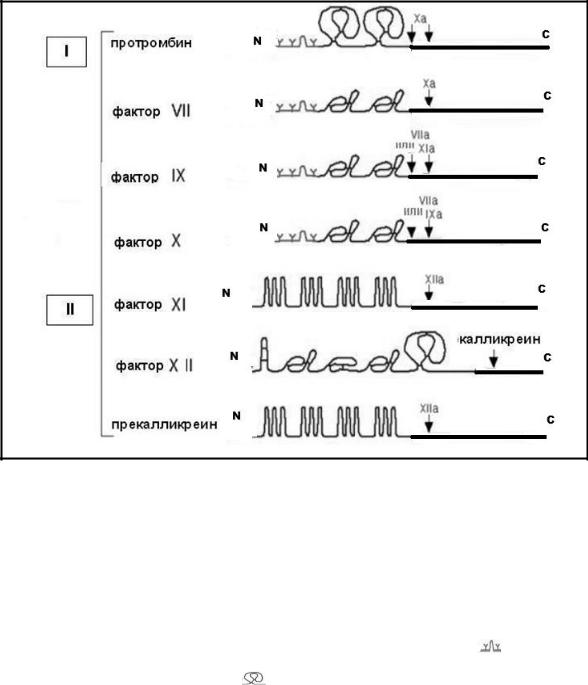
каталитический ( протеазный) домен, расщепление в структуре которого одной или двух пептидных связей ведет к образованию фермента-протеиназы.
Протеины S и Z служат кофакторами и не активируются в ферменты. Протеин
S - кофактор активированного протеина С( АРС) и ингибитора пути тканевого фактора(TFPI), а протеин Z – кофактор ингибитора фактора Xa, который именуют - ингибитором, зависимым от протеина Z(IPZ).
Рис.2-13
Доменная структура прокоагулянтных факторов и факторов контактной
системы свертывания крови.
Факторы протромбинового комплекса(I) и факторы контактной фазы(II).
Домены, начиная с NH2 конца(N) зрелых молекул: Гла-домен - |
, |
крингл-домены (протромбин) , домены EGF ( предшественника |
|
эпидермального фактора роста)  и каталитический домен на COOH-
и каталитический домен на COOH-
конце(С) молекулы. Домены(II), N- конца зрелых молекул: фактора XI
и прекалликреина, домены повторяющихся последовательностей и
62
каталитический домен на C-конце; фактора XII- , |
домены, подобные |
доменам типа I (FN-1) и типа II( FN-2) фибронектина, крингл-домен и |
|
каталитический домен на COOH-конце молекулы. |
Стрелки к |
каталитическим доменам указывают участки пептидных связей,
расщепляемых протеиназами.
2)Факторы контактной фазы свертывания( рис.2-13). К ним относят проферменты-факторы XII (фактор Хагемана) и XI свертывания крови и прекалликреин (Таблица 4). Характерной особенностью белков этой группы является способность связываться с отрицательно заряженной поверхностью и образовывать ферменты-протеиназы.
3)Кофакторы: факторы свертывания V(проакцелерин),VIII (антигемофильный фактор А, VIII:С) и высокомолекулярный кининоген
(ВМК), которые характеризуются тем, что имеют высокий молекулярный вес,
мультидоменную структуру и выполняют роль высокомолекулярной подложки для проферментов системы свертывания крови, а не служат предшественниками протеиназ.
Разделение на группы достаточно условно, поскольку некоторые факторы могут быть отнесены к двум группам, например факторы протромбинового комплекса протеин S и протеин Z служат кофакторами протеина С и ингибитора фактора
Xa – ZPI, соответствено. Фактор I свертывания крови - фибриноген – основной субстрат тромбина.
2.2.1. Факторы протромбинового комплекса
Структурное подобие факторов протромбинового комплекса,
свидетельствует в пользу дупликации гена предшественника, его модификации в течение эволюции. Каталитические домены свертывающих протеиназ относятся к трипсиноподобным сериновым протеиназам, каталитический участок активного центра которых формируется триадой аминокислот,
соответствующих Гис57, Сер195, Асп102 химотрипсина. Ферменты находятся в крови в форме проферментов, которые превращаются в активные формы вследствие ограниченного протеолиза, те гидролиза одной или двух пептидных связей. Синтез проферментов протромбинового комплекса в основном
63

происходит в печени и зависит от витамина К, который служит коферментом фермента - γ-глутамилкарбоксилазы (рис.2- 14 и рис.2- 15). Витамины группы К
( рис.2- 14)- производные 2-метил-1,4- нафтохинона: К1 (филлохинон)
получен из люцерны, так же им богаты шпинат, капуста и др. растения, а К2
(менахинон)–синтезируется микроорганизмами, например кишечной палочкой и обнаружен в печени млекопитающих.
РИС. 2-14
Структура витаминов К1(филлохинон), витамина К2 (менахинон) и антагонистов витаминов К – кумарина и варфарина.
64

Витамин К переходит в активную форму гидрохинона (КН2 ) после восстановления из эпоксида под действием фермента печени – редуктазы (
рис.2-14) .
Рис 2-15.
Цикл витамина К и его функция как кофактора γ-глутамилкарбоксилазы.
Y - γ-Глутамилкарбоксилаза карбоксилирует остатки глутаминовой кислоты
(Glu) витамин К-зависимых факторов свертывания крови в присутствии
активной формы витамина К гидрохинона (КН2). Витамин К –редуктаза(2),
устойчивая к варфарину, восстанавливает Витамин К1 в активную форму – Витамин КН2. Витамин КН2 окисляется в КО - витамин К эпоксид, в реакции сопряженной с карбоксилированием остатков глутаминовой кислоты факторов
свертывания крови. Витамин К-зависимые факторы свертывания крови функционально активны после карбоксилирования. Витамин КО (эпоксид)
65

затем восстановливается |
в витамин К1 |
в реакции, катализируемой |
витамин |
||
КО редуктазой. Варфарин, |
ингибируя |
витамин КО |
редуктазу, |
блокирует |
|
образование витамина |
К1 |
и витамина КН2 |
, необходимых для |
||
карбоксилирования остатков глутаминовой кислоты в факторах свертывания крови. Действие варфарина может быть заблокировано витамином К1 ,
поступающим с пищей или данным как лекарство.
Витамин КН2 окисляется в КО - витамин К эпоксид, в реакции сопряженной с карбоксилированием остатков глутаминовой кислоты факторов свертывания
крови. Витамин К-зависимые факторы |
свертывания крови |
функционально |
|||
активны |
после |
карбоксилирования. |
Витамин КО (эпоксид) затем |
||
восстановливается |
в витамин К1 |
в реакции, катализируемой |
витамин КО |
||
редуктазой . |
Кумариновые препараты (Рис 14,15 ) (например, варфарин, |
||||
кумарин, |
дикумарин и др.) ингибируя витамин КО редуктазу, |
блокируют ее |
|||
действие |
и образование витамина КН2, |
необходимого для карбоксилирования |
|||
остатков глутаминовой кислоты (Glu) в |
протромбине и других факторах |
||||
протромбинового комплекса. |
|
|
|
||
Фермент печени γ-глутамилкарбоксилаза в присутствии восстановленной формы витамина К (КН2) катализирует карбоксилирование 10 или 12 остатков глутаминовой кислоты на N(амино)-концевом участке молекул факторов протромбинового комплекса( рис.2- 14). В результате реакции образуются, так называемый Гла-домен на аминоконце факторов, содержащий остатки -
карбоксиглутаминовой кислоты ( -кГлу). Два или три остатка -кГлу связывают один ион кальция, вызывая конформационные изменения в молекуле и экспонирование участков связывания мембран клеток. Кроме того, эти остатки прямо связываются с мембраной через кальциевые мостики. Связывание кальция крови хелаторами предотвращает ее свертывание.
Иммобилизованные на мембране клетки факторы протромбинового
комплекса могут подвергаться ограниченному протеолизу в активные
66
формы белков свертывания крови (кроме протеинов S и Z , выполняющих функции кофакторов) .
Витамин К участвует также в γ-карбоксилировании остатков глутаминовой
кислоты в некоторых |
других |
Ca-связывающих |
белках, в частности, |
в |
|||
остеокальцине костной ткани. |
|
|
|
|
|
||
В присутствии антагонистов витамина К - кумарина, варфарина и др., |
|||||||
синтезируются |
аномальные белки |
протромбинового |
комплекса, |
которые |
не |
||
связываются |
с фосфолипидами |
мембраны и не |
активируются. |
На |
основе |
||
дикумарина создано много непрямых синтетических |
антикоагулянтов, |
широко |
|||||
используемых для лечения |
тромботических осложнений сердечно-сосудистых и |
||||||
других заболеваний. |
|
|
|
|
|
|
|
Передозировка или отравление антагонистами витамина К может привести к
тяжелому кровотечению, для коррекции которого используют |
высокие |
|||
концентрации препаратов витамина |
К. |
Давно |
известно, что |
кумарины |
используются в качестве крысиного яда. |
|
|
|
|
Многие белки, вовлекаемые в |
гемостаз, |
имеют ―крингл‖-домены, |
||
названные так Магнуссоном (Дания), |
который расшифровал структуру этих |
|||
доменов в молекуле протромбина (рис. 2-13). Крингл-домены содержат 80-85
аминокислотных остатков, образующих, благодаря трем дисульфидным мостикам, характерные триплетные петли (похожие по форме на шведские бублики - кринглы). Крингл-домены отвечают за связывание профермента с поверхностью.
Другой домен, структурно подобный доменам эпидермального фактора роста (EGF), обнаружен у многих факторов свертывания(VII,IX,X,XII) и
отвечает за связывание с поверхностью клеток (рис. 2- 13).
В структуре молекул протромбина и факторов VII,IX и X содержится пятичленная последовательность ароматических аминокислот Phe-Trp-X-X-Tyr,
экспонированных наружу молекулы, которые создают гидрофобный домен,
взаимодействующий с клеточными мембранами.
2.2.2. Факторы контактной фазы свертывания
К факторам контактной фазы свертывания относят фактор XII ( Хагемана),
фактор XI, и прекалликреин, поскольку для активации этих проферментов в условиях in vitro требуется контакт с отрицательно заряженной поверхностью,
67
на которой эти белки легко сорбируются. Для активации фактора XI и
прекалликреина необходим также |
белковый кофактор – высокомолекулярный |
|
кининоген (ВМК). |
|
|
Фактор XII – гликопротеин, |
содержащий |
6 доменов (рис.2- 12). На |
аминоконце молекулы фактора XII локализованы блоки типа II и типа I,
структурно подобные доменам фибронектина ( FN-2 и FN-1), связывающим коллаген и фибрин, соответственно. Между этими блоками расположен домен
2, подобный домену |
эпидермального фактора роста(EGF).За доменом3 типа I |
фибронектина (FN-1) |
следует еще один домен EGF и далее один крингл домен(5 |
домен), который через связывающий участок соединен с каталитическим (
протеазным) шестым доменом, локализованным на С-конце молекулы.
Фактор XI циркулирует в кровотоке в нековалентном комплексе с
высокомолекулярным кининогеном (ВМК). Молекула фактора XI – крупный гомодимер, состоит из двух идентичных полипептидных цепей, соединенных дисульфидными связями (рис.2-12). В структуре каждой из двух цепей фактора
XI обнаружены четыре домена повторяющихся последовательностей с высокой степенью гомологии и каталитический домен на С-конце молекулы. Триада
каталитического центра фактора XI образована остатками His 413, Asp462 и
Ser557. Все повторяющиеся домены по структуре подобны яблоку (apple-
домены), содержат 6 |
высококонсервативных остатков цистеина, образующих |
||
три дисульфидные |
связи, |
и |
имеют высокую степень гомологии |
соответствующим доменам прекалликреина. Аpple - домены повторяющихся
последовательностей |
отвечают |
за связывание фактора XI с |
кофактором - |
||
высокомолекулярным кининогеном. |
|
||||
Высокомолекулярный кининоген (ВМК)- крупная молекула, |
состоит из 6 |
||||
доменов.На |
N –конце ВМК |
в |
домене1 локализован сайт связывания ионов |
||
кальция,в |
доменах2 |
и3 |
обнаружен консервативный мотив QVVAG, |
||
ответственный за ингибиторную активность ВМК в отношении цистеиновых протеиназ (кальпаина,катепсинов В и H, папаина). В доменах 3 и 5
локализованы сайты связывания с поверхностью клеток (
тромбоцитов,эндотелиальных клеток, нейтрофилов), присутствием которых могут быть обусловлены антиадгезивные свойства ВМК.В домене 5 обнаружен участок, содержащий положительно заряженные остатки Lys,His, а также Gly ,
который несет ответственность за связывание с отрицательно заряженной поверхностью активированных клеток и формирование ансамбля факторов
68

контактной фазы свертывания. В домене 4 локализована структура брадикинина,
который выщепляется из ВМК калликреином и подобными ему ферментами. С-
концевой домен 6 имеет протяженные участки связывания фактора XI и
прекалликреина(ПК).
2.2.3. Кофакторы факторов свертывания
Кофакторы - факторы V и VIII свертывания крови, крупные молекулы
(табл.2- 4, рис. 2-16), имеющие значительную гомологию структур.
РИС. 2-16
Структура кофакторов - факторы V и VIII свертывания крови
Оба белка содержат три разных типа доменов в последовательности А1-А2-В-
А3-С1-С2. Три А домена имеют высокую степень гомологии доменам церулоплазмина. Два подобных друг другу С домена (F5/8-C –домены)
гомологичны доменам дискоидина. Большой центральный B домен называют связывающей областью, поскольку он локализован между тяжелой цепью,
состоящей из двух А доменов и легкой цепью, образуемой одним А доменом и двумя С доменами. Существенные различия между факторами V и VIII
обнаружены в структуре связывающей области, которая отщепляется при активации факторов и функционирует как пептид активации.
Тромбин расщепляет фактор V |
по остаткам Arg709, |
Arg1018 и |
Arg1545(рис.2-17) Активированная тромбином форма фактора V- |
фактор Vа, |
|
69

гетеродимер (А1-А2/А3-С1-С2), состоит из тяжелой и легкой цепей,
стабилизированных ионами Са. Фактор Vа – кофактор фактора Xa, активатора протромбина. Участки связывания протромбина, фактора Xa и протеина S,
кофактора активированного протеина С (АРС), локализованы в тяжелой цепи фактора Va, а за связывание фосфолипидов мембраны клеток и АРС отвечают участки легкой цепи.
РИС.2-17
Домены кофакторов факторов свертывания крови-
факторы V и VIII.
Стрелками указаны связи, расщепляемые тромбином при активации факторов V и VIII.
Фактор VIII секретируется как гетеродимер вследствие расщепления по крайней мере двух связей в В домене. В циркуляции белок стабилизирован фон
Виллебранда фактором и |
имеет время полужизни около 10 часов. Тромбин |
гидролизует фактор VIII |
по остаткам Arg372, Arg740 и Arg1689, выщепляя В |
70
