
2 курс / Нормальная физиология / Гемостаз_Физиологические_механизмы,_принципы_диагностики_основных
.pdf
ОТЕЧЕСТВЕННОЕ И ИМПОРТНОЕ ОБОРУДОВАНИЕ ДЛЯ ИССЛЕДОВАНИЯ СИСТЕМЫ ГЕМОСТАЗА
Санкт-Петербургский государственный медицинский университет имени академика И.П.Павлова Российский НИИ гематологии и трансфузиологии
Гемостаз
Физиологические механизмы, принципы диагностики основных форм геморрагических заболеваний
Учебное пособие
Под редакцией: проф. Н.Н.Петрищева проф. Л.П.Папаян
Санкт-Петербург 1999
УДК 616-005.2:616.151.5-07
Авторский коллектив:
Т.В. Вавилова, О.Г. Головина, М.С. Зайнулина, В.И. Иванов, И.В. Миндукшев, Л.П. Папаян, Н.Н. Петрищев, А.С. Шитикова, В.Л. Эмануэль.
Гемостаз. Физиологические механизмы, принципы диагностики основных форм геморрагических заболеваний. /Под ред. Н.Н.Петрищева,
Л.П.Папаян.
ISBN 0340-6245
В учебном пособии изложены современные представления о механизмах гемостаза, описаны наиболее доступные методы исследования тромбоцитарных, плазменных и сосудистых компонентов системы гемостаза, а также ряд информативных методов, которые еще не нашли широкого применения в клинических лабораториях. Большое внимание уделено алгоритмам диагностики нарушений гемостаза и вопросам обеспечения качества лабораторных исследований.
Пособие предназначено для врачей-лаборантов, специализирующихся в области гемостазиологии, а также может быть полезным и врачам других специальностей.
УДК 616-005.2:616.151.5-07 ISBN 0340-6245
©Издательство СПбГМУ, 1999
©Коллектив авторов, 1999
Настоящее пособие рассчитано на тех, кто решил ознакомиться с физиологией и патологией системы гемостаза и основными методами её исследования. Эти знания требуются не только врачам клинической и лабораторной диагностики. Они необходимы клиницистам любого профиля, поскольку нет такой специальности, при которой врач не сталкивался бы с больными, страдающими кровоточивостью или тромбозами. Понимание основ гемостаза позволяет лечащему врачу назначить больному адекватное лабораторное исследование и соответственно патогенетическое лечение.
Преподавание основ физиологии и патологии гемостаза, практическое обучение методам оценки сосудисто-тромбоцитарных и коагуляционных реакций проводятся на специальном цикле
"КЛИНИЧЕСКАЯ ГЕМОСТАЗИОЛОГИЯ" факультета постдипломного
образования СПб Государственного Медицинского Университета им. акад. И.П. Павлова. Обучение
проходит на базе лаборатории свертывания крови Российского НИИ гематологии и трансфузиологии. После окончания цикла слушатели получают удостоверение о повышении квалификации; сдавшим сертификационный экзамен выдается сертификат врача по клинической и лабораторной диагностике. Продолжительность цикла 2,5 мес., для иногородних слушателей возможно очно-заочное обучение.
ЗАПИСЬ НА ОБУЧЕНИЕ – ПО ТЕЛ. 277-35-82 (ЛАБОРАТОРИЯ СВЕРТЫВАНИЯ КРОВИ).
На базе лаборатории свертывания крови Российского НИИ гематологии и трансфузиологии проводится также исследование больных, с целью установления причины повышенной кровоточивости или повышенной склонности к развитию тромбозов (тромбофилии). Запись на исследование системы гемостаза проводится по телефону 277- 35-82 с 10 до 16 часов по рабочим дням.
ПОМНИТЕ, ЧТО КАЧЕСТВЕННАЯ ДИАГНОСТИКА – ОСНОВА ЭФФЕКТИВНОГО ЛЕЧЕНИЯ!
МЕХАНИЗМЫ ГЕМОСТАЗА
Тромбоцитарное звено гемостаза
Адгезия и агрегация тромбоцитов
Остановка кровотечения при повреждении стенки сосуда начинается с сосудисто-тромбоцитарных реакций. Уже через доли секунд после травмы в зоне повреждения наблюдается спазм сосудов и развивается цепь реакций кровяных пластинок, которая приводит к образованию тромбоцитарной пробки. Прежде всего, происходит прилипание (адгезия) тромбоцитов к коллагеновым волокнам, находящимся в сосудистой стенке, к другим адгезивным белкам субэндотелия (фактору Виллебранда, фибронектину, витронектину, ламинину, тромбоспондину), а также к поступающему из плазмы фибриногену (рис. 1). Из адгезировавших тромбоцитов высвобождается аденозиндифосфат (ADP) - важнейший индуктор агрегации кровяных пластинок. Под влиянием ADP циркулирующие кровяные пластинки присоединяются к уже фиксированным на раневой поверхности и друг к другу (агрегируют). Процесс агрегации вызывается также всеми активными субстанциями, которые высвобождаются в области повреждения не только из стимулированных при адгезии тромбоцитов, но и из форменных элементов крови и эндотелия (например, ADP из гемолизированных эритроцитов, активирующий пластинки фактор - PAF и ADP из стенки сосудов). Агрегация индуцируется и первыми малыми количествами тромбина, генерируемого по внешнему и внутреннему пути коагуляции. В результате в процесс вовлекается все большее число тромбоцитов, поступающих в зону повреждения. Однако на данной стадии, определяемой как стадия обратимой или первичной агрегации, связи между тромбоцитами еще не прочные, и часть из них может отрываться током крови.
Позже на стадии необратимой или вторичной агрегации агрегаты уплотняются, становятся непроницаемыми для крови и плотно закрывают имеющийся дефект в сосудах малого и среднего размера. Таким путем достигается первичный гемостаз, т.е. ранняя начальная остановка кровотечения за счет спазма сосудов и образования тромбоцитарной пробки. Поэтому первичный гемостаз называют также сосудисто-тромбоцитарным.
Уже на ранних стадиях тромбоцитарных реакций стимулируется коагуляционная активность тромбоцитов - в плазматической мембране становятся доступными коагуляционно активные фосфолипиды, которые принимают существенное участие во внутреннем пути свертывания крови. В связи с этим в дальнейшем на основе тромбоцитарной пробки формируется фибриновый сгусток. Тромбоцитарно-фибриновая гемо-статическая пробка может противостоять повышенному кровяному давлению после восстановления тока крови в поврежденных сосудах среднего размера. Таким образом, на этой стадии осуществляется окончательный, или вторичный
гемостаз.
Необходимо остановиться на основных функциональных, биохимических и молекулярных процессах, которые развиваются в ходе осуществления тромбоцитарного гемост аза, поскольку без понимания механизма гемостатических реакций, протекающих в организме, невозможно адекватно интерпретировать результаты исследований при патологии.
В фазе адгезии прилипание кровяных пластинок к субэндотелиальным структурам, прежде всего к коллагену (рис.1), различается по своему механизму в зонах циркуляции с малой скоростью тока (и низким напряжением сдвига) и с большой скоростью тока крови (и высоким напряжением сдвига). При низком напряжении сдвига (в случае повреждения стенок крупных артерий, вен) тромбоциты присоединяются к коллагену непосредственно через коллагеновые рецепторы их плазматической мембраны - гликопротеины la-lla (GPIa-lla). При высоком напряжении сдвига (при повреждении мелких артерий и артериол) прилипание кровяных пластинок к коллагену опосредовано высокомолекулярным кофактором адгезии - фактором Виллебранда (vWF), который в зоне повреждения поступает из плазмы, высвобождается из эндотелия, секретируется тромбоцитами. vWF при большой скорости тока крови способен соединяться, с одной стороны, с коллагеном, а с другой, - с тромбоцитарным рецептором GPIb. Таким путем формируется «ось адгезии»: коллаген -vWF - GPIb.
Генетически обусловленное отсутствие или снижение числа названных адгезивных рецепторов в тромбоцитарной плазматической мембране приводит к развитию геморрагического диатеза из-за нарушения адгезии (и как следствие - последующих стадий первичного гемостаза). Однако подобные мембранные дефекты (дефицит GPIb при болезни Бер-нара-Сулье и особенно дефицит GPIa-lla) наблюдаются достаточно редко. В отличие от этого нарушение фазы адгезии из-за недостаточности или дефекта кофактора адгезии (vWF) является причиной наиболее часто встречающегося врожденного геморрагического заболевания - болезни Виллебранда.
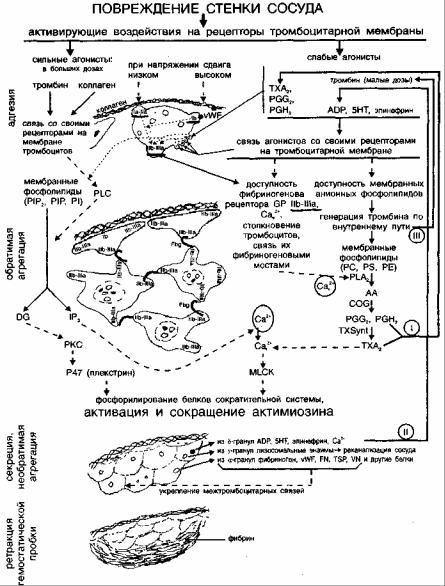
Рис. 1. Тромбоцитарное звено гемостаза Сокращения, применяемые в рис.1: АА-арахидоновая кислота ADP - аденозиндифосфат
Са2+е - ионы кальция экзогенные по отношению к тромбоцитам Са2+, - свободный цитоплазматический Са2+ тромбоцитов
COG - циклооксигеназа
DG-диацилглицерол
DTSплотная тубулярная система Fbg - фибриноген
FN - фибронектин
GP - гликопротеины: GP llb-llla,GP la-lla,GP Ib 5НТ - серотонин 1Рзинозитол 1,4,5-трисфосфат
MLCK - киназа легкой цепи миозина Р47 - плекстрин
PC - фосфатидилхолин
РЕ - фосфатидилэтаноламин PG - простагландины (G2н2) PI - фосфатидилинозитол
PIP - фосфатидилинозитол 4-фосфат РIР2 - фосфатидилинозитол 4,5-бифосфат РКС - протеинкиназа С PLA2-фосфолипаза А2
PLC - фосфолипаза С
PS - фосфатидилсерин
TFPI -ингибитор пути тканевого фактора TSP - тромбоспондин
ТХА2 - тромбоксан A2
TXSyn - тромбоксансинтетаза
VN - витронектин vWF фактор Виллебранда
I , II , III - положительные обратные связи активации тромбоцитов
Для оценки реакций адгезии тромбоцитов в зонах с высоким напряжением сдвига протекающей крови используют антибиотики ристомицин и ристоцетин, которые по своим адгезивно-агрегационным свойствам оказались близкими к субэндотелиальным структурам сосудов, т.е. для взаимодействия их с тромбоцитами необходим и vWF. и GPIb. Поэтому состояние основных компонентов, участвующих в адгезии в области микроциркуляции, может быть оценено на основании агрегации кровяных пластинок in vitro с этими антибиотиками - она снижена или отсутствует как при болезни Виллебранда, так и при болезни Бернара-Сулье. Участие мембранных GPIa-IIa во взаимодействии с коллагеном в зонах с низким напряжением сдвига может быть определено в агрегационных исследованиях с коллагеном.
Следующая стадия тромбоцитарных гемостатических превращений - первичная агрегация - является результатом последовательных реакций активации кровяных пластинок в зоне повреждения. Стимуляция их вызывается и химическими, и физическими воздействиями на плазматическую мембрану. Тромбоциты могут активироваться при действии на их поверхность гемодинамических сил, возникающих при турбулентном токе или при повышении скорости движения крови в местах сужения просвета сосуда. Но большее значение имеет химическая мембранная активация, опосредованная рецепторами. Так, описанное взаимодействие субэндотелиальных субстанций с рецепторами пластинок в фазе адгезии приводит к дальнейшей передаче сигнала активации внутрь клетки. Кроме того, как указывалось выше, тромбоциты активируются при действии на них целого ряда растворимых естественных агонистов, которые присутствуют в зоне повреждения. Важно подчеркнуть, что способностью стимулировать кровяные пластинки обладают в основном те субстанции, для которых в плазматической мембране имеются соответствующие рецепторы. Исключением являются немногие вещества, способные проникать через
мембрану - арахидоновая кислота, ионофор А23187.
Естественные агонисты разделяют на сильные и слабые, отличающиеся по механизму вызываемых ими реакций активации. К сильным агонистам относят коллаген и тромбин в больших дозах. Для осуществления их стимулирующего действия не нужны дополнительные линии усиления активации - так называемые положительные обратные связи (рис.1). Напротив, для эффекта слабых агрегирующих агентов, т.е. всех остальных естественных агонистов при больших и средних дозах (а также сильных агонистов в малых дозах) необходимы эти сложные обратные пути активации.
Взаимодействие слабых агрегирующих агентов со своими рецепторами плазматической мембраны, прежде всего, приводит к развитию доступности фибриногеновых рецепторов - GPIIb-IIIa. После этого фибриноген, который является симметричной молекулой, в присутствии ионов Са2+ связывается с рецепторами двух близлежащих тромбоцитов. Необходимое для осуществления связей столкновение отдельных пластинок достаточно часто происходит в условиях тока крови в организме или в перемешиваемой плазме в агрегометре. При соблюдении всех этих дополнительных условий именно образование фибриногеновых мостов между рецепторами тромбоцитов обусловливает первичную агрегацию. Поэтому основными причинами ее нарушения являются снижение (или отсутствие) в тромбоцитарной мембране GPIIb-IIIa (при врожденном наследственном заболевании - тромбастении Гланцмана) и полное отсутствие фибриногена - плазменного кофактора агрегации (при врожденной афибриногенемии).
Тромбоцитарная секреция и вторичная агрегация. Первичная аг-
регация - это только одна из начальных ступеней в цепи гемостатических реакций тромбоцитов, и она не способна обеспечить эффективный гемостаз. Для этого необходимо осуществление всех последующих стадий и финальных функциональных реакций клетки - реализации ее коагуляционной активности, секреции, образования вторичных консолидированных агрегатов, непроницаемых для крови. Стимулы слабых агонистов для этого не достаточно сильны и для завершения гемостаза требуется включение ряда дополнительных механизмов активации с развитием положительных обратных связей, что «происходит следующим образом (рис.1). Изменения, вызываемые в плазматической мембране при взаимодействии рецепторов с экзогенными слабыми агонистами, при контакте мембран в процессе первичной агрегации и связи их с фибриногеном, в результате последующего начального повышения уровня свободного ионизированного цитоплазматического кальция (Са2+) приводят к активации мембранной фосфолипазы А2 (PLA2). PLA2, в свою очередь, индуцирует цепь реакций простагландин-тромбоксановой системы, которая начинается с высвобождения из мембранных фосфолипидов арахидоно-вой кислоты и завершается образованием таких активных продуктов как лабильные простагландины (PGG2,PGH2) и особенно тромбоксан А2 (ТХА2). Последний является вазоконстриктором, ионофором и эндогенным агонистом агрегации.
Выделяясь из тромбоцитов и связываясь с рецепторами плазматической мембраны (как данной клетки, так и других кровяных пластинок, приносимых током крови), ТХА2 и PGG2 с PGH2 осуществляют первую положительную обратную связь, т.е. рекрутируют дополнительное количество фибриногеновых рецепторов, расширяют плацдарм агрегации и усиливают сигнал активации, передаваемый к внутренним эффекторным структурам клетки. При этом большое значение имеет способность ТХА2 активировать фосфолипазу С (PLC) и включать полифосфоинозитидный путь активации. ТХА2 является также ионофором и вызывает выделение в цитоплазму ионов Са2+ из плотной тубулярной системы (DTS), где они находятся в интактных кровяных пластинках. Повышение уровня Са2+ создает необходимые условия для всех Са2+-опосредованных ферментных реакций финальных стадий тромбоцитарного гемостаза. К этим реакциям прежде всего относится стимуляция тромбоцитарной актомиозиновой системы. Для последней, помимо повышения концентрации Са2+, необходима стимуляция процессов фосфорилирования белков этой системы, что также является результатом полифосфоинозитидного пути активации (рис.1). Этот путь начина-.ется со стимуляции фосфолипазы С (PLC) и завершается активацией протеинкиназы С (РКС) с образованием инозитолтрисфосфата (1Р3), способного, как и ТХА2, повышать уровень Са2+. PLC может быть стимулирована как в процессе первичной агрегации, так и прямо при взаимодействии сильных агонистов с их рецепторами в плазматической мембране. Необходимо отметить, что следующая обратная связь осуществляется именно через взаимодействие сильнейшего тромбоцитарного активатора - тромбина, который генерируется по внутреннему пути с участием фосфолипидов тромбоцитов. Фосфорилирование белков тромбоцитарной сократительной системы с участием активированной РКС, энергетическое обеспечение процесса и само сокращение актомиозина принципиально осуществляются теми же механизмами, что и в сократительной системе гладкомышечных клеток. Сокращение тромбоцитарного актомиозина имеет два важнейших последствия - благодаря этому процессу осуществляются секреторные реакции кровяных пластинок и происходит уплотнение тромбоцитарно-фибриновой пробки.
Тромбоцитарные секреторные реакции имеют большое значение для завершения эффективного гемостаза. Сокращение актомиозина обеспечивает передвижение гранул хранения, контакт их мембран с мембранами открытой канальциевой системы (OCS) и плазматической, а также повышение внутриклеточного давления и выброс содержимого этих гранул в окружающую среду.
Из 8 гранул (плотных телец) высвобождаются гемостатически активные субстанции, необходимые для усиления активации и агрегации тромбоцитов в зоне сосудистого повреждения. Через секрецию ADP, серотонина, адреналина после их связи с соответствующими мембранными рецепторами пластинок реализуется важнейшая вторая положительная обратная связь, которая вместе с первой, делает возможной развитие
вторичной агрегации при действии слабых агонистов.
Из а гранул секретируется более 30 протеинов, которые играют большую роль не только в гемостатических реакциях, но и в других физиологических и патологических процессах организма. Такие белки этих гранул как фибриноген, фактор V, XIII, тромбоцитарный фактор 4 и др., принимают участие в процессах коагуляции; адгезивные протеины (фибриноген, фактор Виллебранда, тромбоспондин, фибронектин, витронек-тин) - в дальнейшем развитии процесса адгезии и укреплении фибрино-геновых связей агрегировавших тромбоцитов; фактор роста тромбоцитов (PDGF - platelet derived growth factor) - в репарации поврежденных стенок сосудов, а в патологических условиях - в развитии атеросклероза.
Из у гранул (лизосом) высвобождаются лизосомальные энзимы, принимающие участие в реканализации сосуда после завершения гемостаза.
Итак, на основании изложенного понятно, почему рассмотренная фаза агрегации называется вторичной (в основе ее лежит более позднее высвобождение из тромбоцитов агрегирующих агентов) и необратимой (тромбоциты не могут отделяться от агрегата, поскольку они максимально сближены вследствие сокращения актомиозиновых структур, а фибриногеновые связи укреплены секретированными адгезивными протеинами). Фазу необратимой агрегации называют также фазой секреции и необратимой вторичной агрегации, т.к. секреторные реакции достигают в это время своей кульминации и являются основой развития этой фазы агрегации.
О значении фазы секреции может, свидетельствовать нередко наблюдаемая и приводящая к кровоточивости недостаточность секреторного процесса, которая особенно часто бывает приобретенной, т.е. возникает в результате инфекционных, токсических, лекарственных, иммунных, радиационных воздействий. Среди тромбоцитопатий высвобождения выделяют два основных вида: функциональную тромбоцитопатию высвобождения при нарушении внутриклеточной передачи сигнала активации, чаще всего в простагландин-тромбоксановой системе, и структурную, связанную с неполноценностью гранул хранения - со снижением их числа и/или наполнения хранимыми в них субстанциями.
Определение механизма нарушения секреции достаточно сложно, т.к. требует проведения тонких биохимических исследований. В клинических условиях факт нарушения тромбоцитарной секреции обычно устанавливают с помощью агрегометра на основании оценки характера агрегационных кривых с несколькими индукторами агрегации. О снижении или отсутствии секреции свидетельствует уменьшение или отсутствие второй волны агрегации с оптимальными средними дозами всех агрегирующих агентов и единственной волны агрегации с коллагеном, т.к. эти агрегационные феномены опосредованы секреторным процессом.
Поскольку актомиозиновые филаменты пересекают всю цитоплазму тромбоцита и с внутренней стороны мембраны связаны с теми же трансмембранными гликопротеинами IIb-IIIa, с которыми с наружной стороны соединены межтромбоцитарные фибриногеновые (фибриновые)
