
- •Раздел I. Хбп – важная проблема ветеринарной медицины
- •Раздел II. Определение, критерии диагноза и классификация хбп
- •Раздел III. Скрининг и мониторинг хронической болезни почек
- •Препараты, противопоказанные при уо:
- •1. Увеличение объема потребляемой жидкости
- •2. Модификация среды обитания
- •3. Анксиолитики
- •4. Продолжить терапию, направленную на снижение боли и спазмов (в течение 5-7 дней после извлечения уретрального катетера). 5. Антибиотикотерапия (по результатам посева).
- •Ключевые моменты
- •Глава 9. Принципы интенсивной терапии
- •9.1. Коррекция метаболизма
- •9.2. Искусственная вентиляция легких
- •9.3. Инфузионно-гемотрансфузионная терапия и парентеральное питание
- •9.3.1. Гемотрансфузии
- •9.3.2. Инфузионно-трансфузионная тактика при некоторых тяжелых состояниях
- •9.3.3. Парентеральное питание
- •9.3.4. Энтеральное питание
- •9.4. Ингаляционная терапия
- •9.5. Антибактериальная терапия
- •9.6. Профилактика и лечение пролежней
- •9.7. Гемодиализ и перитонеальный диализ
- •Глава 113. Катетеризация мочевого пузыря Steven Mensack, d.V.M., Orna Kristal, d.V.M.
Обзор 253 случаев ХБП у кошек: критерии диагноза и проводимая терапия

Автор: к.в.н. Роман-А. Леонард, практикующий ветеринарный врач, президент Российской Научно-практической Ассоциации Ветеринарных Нефрологов и Урологов (НАВНУ, www.vetnefro.ru)
Введение
Заболевания почек у мелких домашних животных широко распространены во всем мире. Наиболее подвержены этой патологии кошки, у которых нефропатии иногда считаются едва ли не нормальным состоянием для стареющих животных. Правда, тут же возникает вопрос: а что, для профилактики и лечения ренальной дисфункции у молодых еще животных ничего нельзя сделать до момента, пока не грянули очевидные признаки неблагополучия? Да и тяжелые, сопровождающиеся выраженными клиническими проявлениями нефропатии, встречаются нередко и у совсем не старых, в т.ч. не достигших годовалого возраста, кошек.
Между тем кошки могут страдать от очень широкого спектра патологий почек, некоторые из них протекают остро/подостро и имеют потенциально обратимый характер, если их своевременно и правильно лечить. Подавляющее большинство иных нефропатий кошек имеют хроническое течение, и для того, чтобы добиться значимого снижения скорости необратимой ренальной дисфункции, вызванной ими, требуется проведение долговременной комплексной специфической терапии (не настолько сложной и дорогостоящей, кстати сказать).
Следует учитывать, что закономерным исходом большинства септических и асептических хронически протекающих нефропатий является клинический этап хронической болезни почек (ХБП) (его еще можно обозначить как тяжелую степень ХБП или ХБП с хронической почечной недостаточностью (ХПН) II-VI степени по классификации IRIS (http://iris-kidney.com). И именно эта патология является наиболее частой причиной гибели или усыпления кошек, не достигших физиологической старости, во всем мире.
Поэтому чем на более ранних этапах развития клиницисту удается диагностировать нефропатию, тем больше вероятность остановить или значительно замедлить ее течение и этим существенно продлить жизнь своего пациента, в т.ч. и при сохранении ее качества. И нужно помнить о том, что почки обладают огромными компенсаторными возможностями и годами могут поддерживать гомеостаз организма даже на фоне тяжелых поражений своей паренхимы и лоханочного комплекса.
Патологические изменения выявляются сначала в анализах мочи (микроальбуминурия, селективная (альбуминурия) и неселективная протеинурия, лейкоцитурия, гипостенурия и т.д.) и лишь затем, иногда спустя годы/десятилетия, в анализах крови (гиперкреатининемия, гиперфосфатемия, гиперпаратиреоз и т.д.). Последним изменениям обычно сопутствуют и клинические проявления ХБП. Поэтому у лечащего врача достаточно часто имеется возможность начать эффективную (именно эффективную, а не симптоматическую или заместительную, как это обычно бывает на клиническом этапе ХБП) терапию нефропатии у пациента задолго до появления очевидных признаков неблагополучия.
Может показаться, что диагностика и лечение ХБП на доклиническом этапе невозможны из-за отсутствия жалоб со стороны владельцев. Но что мешает взять врачу инициативу в свои руки? Ведь скринингу, как важнейшей стратегии в предотвращении развития тяжелых патологий, все больше и больше придается решающее значение. (Например, основная задача клиницистов в борьбе с сосудистыми катастрофами у человека заключается именно в профилактике, а не в пустопорожних разговорах о том, что «вот уж тяпнет вас инсульт или инфаркт, тогда и придете».)
Если ближе к теме, то, например, стойкая протеинурия более 0,3 г/л, особенно в сочетании с гипостенурией (плотность мочи менее 1,045), у кошки является таким же очевидным признаком угрожающей жизни нефропатии, как и множественные ренальные кисты. А ведь скрывать от владельцев, что у пациента поликистоз почек, вряд ли кому придет в голову. Напротив, об этом будет сообщено с воодушевлением, с активной визуальной демонстрацией, с чувством выполненного долга. В том числе и потому, что впоследствии на поликистоз почек можно списать многие проблемы со здоровьем у пациента, а то и собственные ошибки: мы же вам говорили, предупреждали, чего же вы хотите, поликистоз, знаете ли!..
Тем не менее и на сегодняшний день наиболее популярными диагнозами среди практикующих врачей ветеринарной медицины являются ХПН и ХБП. Причем при выставлении этих диагнозов врачи обычно руководствуются только фактом нарастания уровня азотемии у пациента выше формальной нормы и клиническими проявлениями. Иными словами, речь идет именно о клиническом этапе ХБП со всеми вытекающими из этого неутешительными прогнозами, неизбежным и стремительным ухудшением качества жизни и пациентов, и владельцев. Да и о возможностях эффективной терапии можно забыть.
Приведенные в статье данные убедительно свидетельствуют о том, что подобная практика, к несчастью, является преобладающей и сегодня. Хотя некоторые сдвиги в лучшую сторону уже имеются.
В предлагаемом читателям материале приведен анализ 253 историй болезней кошек с диагнозом ХБП, присланных для консультации владельцами животных (из самых разных мест в мире) и лечащими ветеринарными врачами в адрес НАВНУ (www.vetnefro.ru) в 2013-2017 гг. Рассмотрены критерии, на основании которых был выставлен диагноз (таблица 1), и препараты, рекомендованные для терапии заболевания (таблица 2). В целом будет сделан анализ достаточности и корректности проведенных диагностических мероприятий, а также целесообразности и полноты назначенной ветеринарными специалистами терапии.
Диагноз |
Критерий диагноза |
Количество клинических случаев |
Комментарий |
Хроническая болезнь почек I степени (доклинический этап почечного континуума, уровень азотемии в пределах формальной нормы) |
Изменения, выявляемые в анализах мочи: стойкая неселективная (нефротоксичная) протеинурия >0,01 г/л; хроническая гипостенурия (плотность мочи < 1,045); лейкоцитурия, билирубинурия, уробилиногенурия, глюкозурия и т.д.) |
4 |
Исследование мочи наиболее ранний, доступный, простой и информативный способ выявления у пациента тех или иных угрожающих здоровью и жизни нефропатий. Важно, что различные изменения в анализах (обычно сочетанные) выявляются за месяцы/годы до появления клинических проявлений неблагополучия и тогда, когда еще есть широкие возможности для этиопатогенетического лечения и диетотерапии и достаточное количество времени для ее подбора каждому конкретному пациенту. |
Хроническая болезнь почек II-IV степени по классификации IRIS (http://iris-kidney.com) |
Повышение уровня азотемии, клинические проявления. Общеклинического исследования мочи не проводилось |
222
|
Если при обследовании пациента с нефропатией или подозрением на нее не было проведено, по крайней мере, общеклинического исследования мочи и не были учтены его результаты, то это является грубой врачебной ошибкой. Как это ни странно, но на сегодняшний день для ветеринарных специалистов во всем мире в подавляющем числе случаев ведущим, а часто и единственным, критерием для выставления пациенту диагноза ХБП (а то и вовсе любой нефропатии) является повышение уровня азотемии и наличие у животного тех или иных клинических проявлений (жалоб со стороны владельца). Но следует прежде всего учесть, что клинический (или азотемический, что, правду сказать, далеко не всегда одно и то же) этап почечного континуума характеризуется безвозвратной утратой почками более 75% форменных элементов и стромы. В целом это приводит к тому, что в арсенале врача остаются только средства симптоматической и заместительной терапии (а эффективность ее уже по определению не может быть высокой), а большинство лекарственных средств приобретают те или иные нефротоксичные свойства (даже те из них, которые нанефротоксичные свойства (даже те из них, которые на доклиническом этапе проявляли нефропротективные эффекты), а также плохо предсказуемую фармакодинамику и фармакокинетику. |
То же. Общеклиническое исследование мочи проводилось |
12 |
Анализы мочи на клиническом этапе ХБП не только помогают в быстрой оценке уровня почечной функции, прогноза и тяжести сопутствующих заболеваний, но также являются удобным и доступным исследованием для оценки эффективности проводимой терапии. Кроме того, как и на иных стадиях ХБП, исследование мочи является низкозатратным инструментом, способным весомо повысить как престиж каждого конкретного врача, так и значимо увеличить прибыльность ветеринарного бизнеса. |
|
|
То же плюс биохимическое исследование мочи, включая UPC-тест (соотношение белок/креатинин мочи) |
15 |
Группа терапевтических средств, использующихся для лечения пациентов с ХБП |
Частота назначения каждой из терапевтических групп или их сочетания |
Комментарии |
Антибактериальные средства |
||
Антибиотики (кроме аминогликозидов) |
189 |
Антибиотики, пожалуй, самая назначаемая группа препаратов первого выбора для лечения ХБП. Что не может не вызывать изумления, поскольку ни на одном из этапов своего течения эта патология не связана с бактериальным инфицированием. И даже поверхностный анализ этиопатогенеза ХБП дает об этом более чем исчерпывающую информацию. В любом случае, поскольку бактериальные инфекции мочевыделительной системы у кошек встречаются на несколько порядков реже асептических нефропатий, то для рекомендации пациенту антибиотикотерапии у врача должны быть веские основания. Такие, как неселективная лейкоцитурия, пиурия, бактериурия, с обязательным последующим выявлением в моче, полученной чрезбрюшинным уроцистоценетезом, патогенной микрофлоры (с определением чувствительности к антибиотикам). |
Аминогликозидные антибиотики |
4 |
Препараты этой группы даже после однократного системного использования способны вызвать у кошек острый канальцевый некроз с последующим стремительным усугублением почечной дисфункции вплоть до анурической/уремической стадии. |
Стероидные гормоны |
168 |
Еще одна группа препаратов с интенсивностью, достойной лучшего применения, назначаемая кошкам на клиническом этапе ХБП. Так же, как и в случае с антибиотиками, целесообразность их использования для терапии становится очевидной после анализа причинно-следственных связей развития и течения ХБП. Превалирующим процессом в ренальной паренхиме на клиническом этапе ХБП является склерозирование. Стероидные гормоны не только не способны реновировать или хотя бы купировать этот процесс (как, собственно говоря, и иные другие препараты), но и активно участвуют в процессах гломеруло- и нефросклероза (в т.ч. из-за непосредственного и активного участия в гиперактивации ренин-ангиотензин-альдостероновой системы (РААС)), а также проявляют иные нефротоксичные эффекты. |
Фосфат-байндеры |
55 |
Одним из значимых механизмов патогенеза и причиной появления многих клинических проявлений ХБП является развитие гиперпаратиреоза (необратимая гиперплазия паращитовидных желез с плохо контролируемым уровнем синтеза и выделения паратиреоидного гормона (ПТГ). С увеличением уровня этого фосфатурического гормона напрямую связано и развитие компенсированной, а затем и декомпенсированной гиперфосфатурии. Поэтому использование препаратов, связывающих фосфор в кишечнике, как и снижение его количества в потребляемой пище (например, с помощью «почечных» диет), является одной из важных органопротективных стратегий у пациентов с ХБП. Хотя нужно особо подчеркнуть, что эффективность мероприятий по снижению потребления фосфора высока только на доклинических этапах ХБП, т.е. до момента необратимой гиперплазии паращитовидной железы и развития у пациентов гипо- или анорексии. Это, однако, не означает, что попытки (именно попытки, поскольку общепризнано, что одним из ведущих признаков клинического этапа ХБП является значительное снижение и/или извращение аппетита или даже полная анорексия) использования данного типа терапии должны быть полностью прекращены и на клиническом этапе заболевания. |
Препараты, контролирующие активность РААС |
||
Ингибиторы ангиотензин-образующего фермента (иАПФ) |
48 |
Гиперактивация как тканевого, так и плазматического компонентов РААС является неотъемлемым звеном патогенеза ХБП на любом этапе ее течения: от инициации и поддержания процессов интрагломерулярной и системной гипертензии и уровня нефротоксичной протеинурии до прямого влияния ангиотензина II (АТ II) и альдостерона на интенсивность и тяжесть гломеруло- и нефросклероза. Поэтому использование препаратов этой группы необходимо начинать у пациентов с ХБП как можно раньше после постановки диагноза. Причем БРА, сочетающим в себе как высокую точечность воздействия на вазоконстрикционное, гипертензивное, антидиуретическое и склеротическое звенья РААС, так и широту терапевтического индекса, высокую комплаентность, нейтральный метаболический профиль и самые низкие в классе нефротоксичные свойства на заключительных этапах почечного континуума (речь прежде всего идет о телмисартане, Seminta, Микардис), необходимо отдать предпочтение. В то же время из-за активации т.н. альтернативных путей образования АТ II при использовании иАПФ уровень этого нейрогормона, равно как и образующегося под его воздействием альдостерона (также обладает антидиуретическими свойствами и принимает активное участие в процессах гломеруло- и нефросклероза), в организме может значительно возрасти (о чем чаще всего свидетельствует нарастание уровня протеинурии и/или гипостенурии). Что требует осторожности при использовании иАПФ у кошек с ХБП, особенно на клиническом этапе заболевания, когда, кроме прочего, возрастает уровень нефротоксичности у препаратов, имеющих преимущественную или даже просто частичную экскрецию почками (все иАПФ). |
Блокаторы рецепторов ангиотензина (БРА) |
12 |
|
Прямые ингибиторы ренина (ПИР) |
1 |
|
|
|
|
Блокаторы кальциевых каналов (БКК), или антагонисты кальция |
||
Амлодипин |
96 |
Амлодипин является препаратом первого выбора для лечения ренальной гипертензии у кошек на клиническом этапе ХБП по рекомендации IRIS (www.iris-kidney.com). Однако амлодипин обладает рядом иных нефропротективных свойств и может использоваться с этой целью на любых этапах почечного континуума, за исключением заключительных, когда из-за нарушения почечной экскреции он приобретает ряд нефротоксичных свойств. |
Прочие БКК |
2 |
Кроме амлодипина (имеющего достаточно грубое и не всегда положительное воздействие на интрагломерулярный кровоток) среди БКК заслуживают внимания лерканидипин (Занидип-рекордати и т.д.) и верапамил (прежде всего Изоптин, содержащий несколько изомеров д.в.). Основным преимуществом лерканидипина является лучшая в классе способность снижать тяжесть протеинурии, вызванной процессами гипертензии/гиперфильтрации в первичной микрокапиллярной сети почек (один из значимых механизмов этиопатогенеза ХБП), реализуемой за счет избирательного воздействия на низковольтные кальциевые каналы, расположенные преимущественно на эфферентных артериолах клубочка, что приводит к их избирательной дилатации (при отсутствии такового влияния на высоковольтные кальциевые каналы на афферентных артериолах, позволяя последним не менять свой просвет). Уникальным свойством БКК из подгруппы производных фенилалкиламинов (Изоптин) является способность к протекции/реновации канальцевого аппарата нефронов, дисфункция которого также является неотъемлемой частью течения ХБП на всем ее протяжении. |
Сочетанная нефропротективная терапия |
||
Сочетанное использование иАПФ, БРА, ПИР и БКК |
29 |
На сегодняшний день не существует ни одного нефропротективного препарата, способного значимо влиять на все механизмы этиопатогенеза ХБП (аутоиммунные реакции в гломерулах, микронекрозы, микротромбозы и фатальная репарация в фильтрационном барьере, гиперактивация тканевого и плазматического компонентов РААС, интрагломерулярная и системная гипертензия, нефротоксичная протеинурия, канальцевая дисфункция, гломеруло- и нефросклероз и т.д.). Поэтому для значимого сдерживания в т.ч. и процессов ренальной деструкции, как правило, необходимо использование двух-, трех- и даже четырехкомпонентной нефропротективной терапии, индивидуально подобранной для каждого конкретного пациента. |
Диуретики |
||
Торасемид |
53 |
Петлевой диуретик со свойствами калийсберегающего и иАПФ торасемид по целому ряду особенностей фармакодинамики и фармакокинетики, а также по набору эффекторных механизмов значительно превосходит широко применявшийся ранее в нефрологии фуросемид. Это прежде всего сочетание стойкого дозазависимого мочегонного эффекта при длительном использовании при даче 1-2 раза в сутки, ряд нефропротективных свойств, отсутствие негативного влияния на систему альдостерона и тубулярный аппарат нефронов. Пожалуй, единственным «недостатком» этого петлевого диуретика является отсутствие зарегистрированной в РФ инъекционной формы. |
Калийсберегающие диуретики |
19 |
Спиронолактон (Верошпирон), являясь антагонистом рецепторов альдостерона, обладает крайне низкими мочегонными свойствами у животных с ХБП. Его использование при этой патологии оправданно только в сочетании с фуросемидом для преодоления альдостерон-активирующих эффектов последнего и лишь у животных, которым по тем или иным причинам торасемид назначен быть не может. |
Антипаратиреоидные препараты |
||
Парикальцитол (Земплар) |
3 |
Необходимость в назначении препаратов из этой группы в монотерапии или сочетанно возникает уже на стадии компенсированной гиперфосфатемии (когда, как правило, отсутствуют выраженные клинические проявления ХБП), что позволяет значимо отсрочить необратимые процессы гиперплазии паращитовидной железы, а следовательно, отдалить момент лавинообразного проявления клинических признаков неблагополучия, связанных с увеличением количества и силы рецепторных взаимодействий ПТГ со своими рецепторами второго типа, расположенными в различных органах и тканях. Использование антипаратиреоидных препаратов на клиническом этапе ХБП позволяет значимо улучшить качество жизни пациентов и их владельцев и увеличить сроки и качество дожития животных. Препараты сочетают высокую эффективность, широкий терапевтический индекс, нейтральный метаболический профиль и низкий уровень побочных эффектов. Высокая стоимость, пожалуй, единственный сдерживающий фактор, препятствующий их широкому применению в рутинной практике ветеринарной нефрологии. |
Цинакальцет (Мимпара) |
9 |
|
Низкомолекулярные гепарины – сулодексид (Вессел Дуэ Ф, Ангиофлюкс) |
12 |
Сулодексид значимо улучшает реологические свойства крови (а через почки проходит от 20 до 25% крови от сердечного выброса), что способствует нормализации кровотока в первичной (гломерулярной) и вторичной (паратубулярной) микрокапиллярных сетях почек и, следовательно, положительно влияет на процессы мочеобразования, а так же снижает скорость и выраженность ренальной деструкции. |
к.в.н. Роман-А. Леонард
Анемия у животных с хронической болезнью почек: от причин развития до конкретных пациентов
Автор: к.в.н. Роман-А. Леонард, практикующий ветеринарный врач, президент Российской Научно-практической Ассоциации Ветеринарных Нефрологов и Урологов (НАВНУ, www.vetnefro.ru)
Введение
Почечная анемия — это одно из многочисленных осложнений клинического этапа почечного континуума, значимо снижающая качество жизни животных и их владельцев. Также анемия является одним из факторов, ухудшающих прогноз заболевания и общую летальность пациентов с нефропатиями по ряду прямых и косвенных причин [1, 16].
Ренальная анемия, как правило, развивается у пациентов с тяжелыми деструктивными изменениями почечной паренхимы (поражено — обычно процессами склерозирования — не менее 75% тканей органа) и напрямую связана прежде всего с дефицитом эритропоэтина [1,2,5].
В подавляющем числе случаев назологической формой нефропатии, приведшей к этому типу анемии, является хроническая болезнь почек (ХБП). Однако выраженность этого осложнения зависит от вариабельности поражения ренальной паренхимы, а также от иных особенностей течения ХБП у конкретного пациента. Поэтому может значительно отличаться у животных даже с приблизительно одинаковым уровнем почечной недостаточности/деструкции. У некоторых животных ренальная анемия не регистрируется даже на терминальной стадии ХБП, в то время как у части пациентов выявляется и на ранних клинических этапах почечного континуума[1].
Ренальная анемия, как и любая другая, приводит к развитию гипоксии тканей и органов, а также к снижению общей и специфической резистентности организма. Причем сами почки страдают от этого едва ли не сильнее других органов, поскольку процессы реабсорбции в канальцевом аппарате этого органа требуют больших затрат кислорода и энергии. Помимо этого хроническая анемия приводит к усугублению тяжести ренальной гипертензии, тахиаритмиям, ремоделированию миокарда и, как следствие, к усугублению тяжести застойных явлений в организме пациентов с ХБП. А патологическое перераспределение жидкости в организме у кошек в 99% случаев характеризуется прежде всего явлениями гидроторакса и гидроперикарда и — как итог — прогрессирующими признаками сердечной и дыхательной недостаточности. У собак в подобных случаях чаще наблюдаются периферические отеки.
Еще одним фактором, значимо влияющим на качество жизни и продолжительность периода дожития пациентов с ренальной анемией, является усугубление тяжести различных иммуннодефицитных состояний (и без того нередко встречающихся на клиническом этапе ХБП). У кошек, например, это часто приводит к обострению различных вирусных инфекций, доселе пребывавших в латентном состоянии. Что, помимо прочего, ведет к усугублению антигенемии и дополнительному поражению фильтрационного барьера ЦИК[2]ами. Поэтому важной частью комплексной терапии ХБП является использование интерферонов, интерфероногенов и иммуннокорректоров (например, интерлейкина-2, Ронколейкина, помимо прочего способного эффективно стимулировать и собственный противовоспалительный статус почки).
Кроме того, коррекция ренальной анемии требует значимых материальных затрат, включающих как стоимость препаратов для заместительной терапии (определенные долгосрочные успехи достигнуты пока только при использовании препаратов, содержащих дарбэпоэтин-альфа (ДЭ-α), имеющих высокую стоимость), так и расходов на проведение различных (многократных) диагностических исследований, в т.ч. связанных с необходимостью подбора индивидуальной терапевтической программы для каждого конкретного пациента.
Также следует отметить, что терапия ренальной анемии в отрыве от лечения нефропатии, к ней приведшей, нерациональна, что также требует от владельцев изрядных материальных, психосоматических и временных затрат.
Причины развития ренальной анемии
Эритропоэтин — гликопротеиновый гормон, ведущий фактор, инициирующий циклы пролиферации клеток — предшественников эритроцитов в костном мозге, а также регулирующий интенсивность образования эритроцитов в зависимости от текущих потребностей организма. У взрослых собак и кошек подавляющее количество эритропоэтина образуется в клетках эндотелия первичной микрокапиллярной сети и фибробластах коры почек и лишь около 10% в печени.
Эндогенный эритропоэтин (или его рекомбинантные аналоги), связываясь с эритропоэтиновыми рецепторами препотентных клеток эритропоэза, вызывает увеличение скорости их пролиферации и дифференциации. Он также активно влияет на сроки выживания всех клеток эритроидного ростка.
Сигналом для увеличения синтеза эритропоэтина является анемия или гипоксия любого генеза, или конкретнее — снижение парциального давления кислорода в интерстициальной жидкости коркового слоя почек. При этом количество гормона, выделяемого каждой конкретной эритропоэтинпродуцирующей клеткой почек, не увеличивается, т.е. и в норме их функциональный резерв невелик (что важно прежде всего для прогноза развития и течения ренальной анемии). Но в синтез этого биологически активного вещества вовлекается все большее количество ренальных клеток, до этого остававшихся в этом отношении неактивными, и уровень эритропоэтина может увеличиться более чем в 1000 раз. Поэтому, как и подавляющее число иных осложнений клинического этапа различных нефропатий и хронической болезни почек (ХБП), анемия развивается только тогда, когда не менее 75% ренальной паренхимы у пациента оказывается в состоянии тяжелой и необратимой деструкции (склероза) и синтез эритропоэтина значительно снижается или прекращается вовсе. Хотя следует отметить, что не у всех пациентов на клиническом этапе ХБП тяжесть анемии прямо пропорциональна степени выраженности почечной деструкции, а причины такого положения дел не до конца понятны.
Ренальная анемия — это полиэтиологическое осложнение ХБП, глубоко вовлеченное в порочный круг патогенеза этой нефропатии. Этот тип анемии имеет гипорегенераторный характер, а также обычно проявляется нормохромностью и нормоцитарностью со сниженным уровнем ретикулоцитов.
Ведущими механизмами развития и стойкости почечной анемии являются:
недостаточность эндогенного эритропоэтина: как абсолютный дефицит этого гормона (снижение выработки почками), так и выраженное уменьшение активности его рецепторных взаимодействий (относительный дефицит);
сокращение срока жизни эритроцитов, во многом связанное с уремической интоксикацией; а уровень гемолиза, значительно превосходящий физиологическую норму (у здоровых животных в сутки разрушается/регенерируется не более 2% эритроцитов), не только значимый этиологический фактор развития анемии, но и одна из причин, усугубляющих почечное поражение, поскольку гемоглобин, попадающий в первичную мочу, вызывает канальцевую деструкцию/дисфункцию, и без того являющуюся неотъемлемой частью патогенеза ХБП;
нарушение обмена железа, фолиевой кислоты и цианокобаламина в организме больных животных.
Иные причины развития анемии при ХБП
Кроме дефицита эритропоэтина и снижения средней продолжительности жизни эритроцитов (у кошек эритроциты особенно подвержены оксидативному и токсическому стрессу, диагностируемому по увеличению в крови телец Хайнца[3]) к анемии у пациентов с ХБП могут приводить:
кровотечения в ЖКТ, связанные с уремическим гастроэнтеритом и дисфункцией тромбоцитов;
дефицит пластических и энергетических веществ в организме (особенно тяжело переносится облигатными хищниками — кошачьими), связанный со снижением и/или извращением аппетита (анорексией), тошнотой (рвотой) вследствие действия уремических токсинов на хеморецепторы триггерной зоны и на подлежащие ей структуры в ЦНС, и нарушением всасывания питательных веществ из ЖКТ (опять же по причине уремического гастроэнтерита);
уремическая интоксикация, и прежде всего гиперпаратиреоз (паратиреоидный гормон (ПТГ), помимо прочего, прямо и косвенно участвует процессах нефросклероза и — как итог — в снижении объема эритропоэтинпродуцирующих клеток); однако, с другой стороны, гиперфосфатемия, являющаяся ведущей непосредственной причиной необратимого развития гиперплазии паращитовидной железы, до некоторой степени способна снизить выраженность анемии (гипоксии) при ХБП, и связано это с тем, что повышенное содержание фосфора в эритроцитах увеличивает их кислородную емкость[4];
хронический дистресс (особенно у кошачьих), вызванный как тяжелым общим состояниям пациентов, так и необходимостью проведения им разнообразных лечебных мероприятий;
патологическое перераспределение жидкости в организме и/или относительная гиповолемия, когда воды в организме в целом достаточно, но в кровяном русле и некоторых тканях ощущается ее значительный дефицит;
различные ятрогении, например, назначение пациентам с ХБП антибиотиков и стероидов и, напротив, необоснованное пренебрежение рациональными нефропротективными тактиками;
прогрессирующая астения, анорексия и кахексия как итог перечисленных выше причин.
Дефицит железа, как ведущий этиологический фактор развития анемии при ХБП, часто значительно переоценивается врачами. У кошек эта причина снижения уровня гематокрита при ХБП встречается крайне редко. А у собак хотя и диагностируется, но прежде всего у пациентов с выраженными воспалительными явлениями в ЖКТ, при которых всасывание трехвалентного железа снижено, и тяжелыми хроническими кровотечениями в просвет ЖКТ. Но не в пример эритропоэтиндефицитной, железодефицитная анемия хорошо поддается коррекции доступными лекарственными препаратами, в состав которых входит та или иная форма органического железа. То же можно сказать и об анемиях, ведущим этиологическим фактором которых является дефицит витаминов группы В.
Следует отметить, что у животных с приблизительно одинаковой степенью почечного поражения уровень дефицита эритропоэтина может быть различным. И, как следствие, у одних пациентов анемия будет значимым осложнением нефропатии, а у других не будет диагностироваться вовсе.
Например, до конца не понятны причины того, почему при поликистозе почек, даже у пациентов на терминальной стадии почечного континуума, тяжелая анемия наблюдается очень редко (или, во всяком случае, степень ее тяжести мало коррелирует с выраженностью ренальной деструкции).
Лечение
Лечение ренальной анемии при ХБП может быть начато не ранее того, как пациент был подвергнут комплексному нефрологическому обследованию, а также были проведены необходимые мероприятия, направленные на подбор этиопатогенетической (если это возможно), нефропротективной и симптоматической терапии заболевания, приведшего к развитию анемии.
Лечения стимуляторами эритропоэза должно быть начато не ранее того, как уровень гемотакрита у пациента опустится ниже нормы.
На сегодняшний день коррекция ренальной анемии и ее последствий возможна только средствами заместительной терапии. К ней относятся: переливание цельной крови, использование рекомбинантных эритропоэтинов человека и стимуляторов гемопоэза (ДЭ-α, Аранесп).
Анаболические стероиды
Эта группа препаратов определенное время пользовалась большой популярностью (иными словами, была модным трендом[5]) среди врачей как для терапии ХБП в целом, так и для лечения анемии, связанной с этим заболеванием, в частности. Но никаких доказательств целесообразности или, по крайней мере, безопасности назначения анаболических стероидов (АС) пациентам с ХБП на сегодняшний день не получено. Тем более что, как и подавляющее число иных лекарственных средств, имеющих преимущественно почечный клиренс, АС при ХБП приобретают плохо прогнозируемую фармакодинамику и фармакокинетику, что верно как для самих действующих веществ этой группы препаратов, так и для их метаболитов. Причем степень непредсказуемости фармакологических эффектов АС прогрессирует параллельно ухудшению почечной функции.
В целом можно сказать, что для пациентов с ХБП уровень значимых побочных эффектов (особенно отдаленных) от использования АС значительно превосходит любую ожидаемую пользу [16].
Переливание крови
Переливание крови, пожалуй, самый оперативный метод лечения анемии любого генеза. Но даже однократное проведение этой процедуры животным с тяжелыми степенями хронических нефропатий и ХБП (на доклиническом этапе почечного континуума анемия не регистрируется) связано с рядом значимых, даже летальных, осложнений для пациента и, кроме того, обычно представляет серьезные сложности и чисто технического характера. И тем паче если речь идет о кошках.
В подавляющем числе ветеринарных клиник нет банка крови для животных. Поэтому в дело часто идут абы какие доноры, способные наградить реципиента, например, целым набором новых для него инфекционных (раньше всего вирусных) агентов (в случае с кошками в этом можно быть уверенным на сто процентов).
Однократное переливание крови относительно безопасно для пациента. Но уже от второго можно ожидать осложнений различной степени тяжести (в том числе и усугубления тяжести почечного поражения, например, из-за нефротоксичной протеинурии и острого канальцевого некроза, проистекающих из гемолиза) или даже летального исхода. К этому чаще всего приводят различные иммунные реакции. От аутоиммунных, с образованием антител на компоненты перелитой крови, до тяжелой иммунносупрессии (это в добавок к той, которая является прямым или косвенным следствием самого заболевания почек), обычной для пациентов, которым «посчастливилось» пережить ряд процедур по переливанию крови.
Поэтому целесообразность переливания крови должна быть оценена для каждого конкретного пациента, процедуру должен проводить врач, имеющий опыт работы в этом направлении, а владельцев необходимо заранее проинформировать об эффективности и осложнениях данного вида лечения анемии.
Заместительная гормонотерапия
С теоретической точки зрения, заместительная терапия эритропоэтином должна являться самым эффективным долгосрочным методом лечения анемии при ХБП. Но и здесь сразу есть несколько оговорок. Раньше всего, если вспомнить, например, сахарный диабет, то инсулин заместительная терапия, хотя и спасает миллионы жизней, но решает далеко не все проблемы пациентов с этой патологией. И, кроме прочего, приводит к развитию диабетической нефропатии, которая и является ведущей причиной эутоназии (гибели) собак, и особенно кошек, с сахарным диабетом. А ведь речь в этом случае идет о недостаточности/атрофии клеток Лангенгарса, выделяющих в основном инсулин и гликогон, т.е. принимающих активное участие по большей части лишь в углеводном обмене. И, несмотря на то, что подбор терапии инсулином у человека на сегодняшний день чисто технически не представляет большой сложности, это ни в коей мере не гарантирует развития у пациента осложнений различной степени тяжести и значимого повышения летальности у этой группы пациентов. Иными словами, колебание уровня одной лишь глюкозы в организме (даже на фоне отсутствия других патологий) способно значимо снизить как качество жизни пациентов, так и ее продолжительность.
Дефицит эритропоэтина у собак и кошек при ХБП, во-первых, развивается на фоне патологии органа, выполняющего большое количество разнообразных экскреторных, эндокринных, экзокринных, иммунных и метаболических[6]функций. И во-вторых, осложняется отсутствием коммерческих препаратов, содержащих видоспецифичные для собак и кошек эритропоэтины[7]. Однократное введение рекомбинантных «человеческих» эритропоэтинов животным (как и в случае с переливанием крови), возможно (при корректном подборе дозы, что осуществимо в таком режиме далеко не всегда), будет иметь положительный для пациента эффект и приведет к росту уровня гематокрита. Но уже второе-третье введение препаратов из этой группы, скорее всего, не будет иметь ожидаемого эффекта даже при значительном увеличении дозы относительно первоначальной. Связано это с высоким уровнем аутоантител к этим эритропоэтинам, сформировавшимся вследствие первичного их использования. Мало того, подобная иммунная реакция может привести к тому, что уровень эндогенного эритропоэтина, и без того невысокий, снизится у пациента еще больше. Причем высокий уровень антител к эритропоэтинам, как экзо-, так и эндогенным, может сохраняться длительное время. Поэтому если после использования рекомбинантных эритропоэтинов уровень гематокрита снижается, то это является показанием к их незамедлительной отмене. Также на сегодняшний день выпускаются диагностические тесты, с помощью которых можно определить у животных уровень антител к эритропоэтинам (хотя доступность их в РФ невелика).
Поэтому назначение рекомбинантных эритропоэтинов человека, как и переливание крови (описание этих методов лечения анемии в литературе можно найти без труда) нерационально не только для профилактики анемии, но и для животных, уровень гематокрита у которых снижен незначительно.
Большие успехи в борьбе с почечной анемией достигаются при использовании стимулятора гемопоэза (антианемическое средство) ДЭ-α [8] (коммерческий препарат, доступный в РФ, — Аранесп) [14, 15]. Несмотря на то что механизм действия у этого препарата аналогичен эффектам рекомбинантного эритропоэтина человека, он имеет, по крайней мере, два очевидных преимущества. Даже его многократное введение вызывает у большинства пациентов незначительный (или, по крайней мере, преодолимый прогрессирующим повышением дозы) аутоиммунный ответ. Это раз. А поскольку ДЭ-α имеет значительно более низкий клиренс, то это позволяет после его введения более длительное время поддерживать эквивалентный уровень активации эритропоэтиновых рецепторов (т.е. биологического ответа), и вводить его собакам и кошкам нужно в три, а то и в четыре раза реже (1 раз в 7-28 дней, что также повышает уровень комплаенса), чем рекомбинантные эритропоэтины. Это два. Следует также учитывать, что период полувыведения ДЭ-α зависит от способа использования содержащих его препаратов. При подкожном введении этот срок в 1,5-2 раза больше, чем при внутривенном.
Основные принципы лечения ренальной/эритропоэтиндефицитной анемии у пациентов с ХБП
Заместительная терапия анемии при ХБП нерациональна в отрыве от нефропротективного/симптоматического лечения основного заболевания.
Подбор дозы ДЭ-α осуществляют индивидуально. Причем в расчет принимается не масса пациента и даже не степень его почечной недостаточности, а динамика изменения уровня гематокрита, последовавшая на первые инъекции препарата.
Заместительная терапия ренальной анемии у пациентов с уровнем гематокрита в пределах видовой нормы (так сказать, для профилактики) недопустима, поскольку может привести к ряду значимых осложнений (усугубление тяжести почечной гипертензии[9], причем даже у пациентов, получающих комбинированную гипотензивную терапию, и полицитемии) и усугубить тяжесть почечной дисфункции.
Если уровень гематокрита у пациента с ХБП снижен не более чем на 10-15% от нижней границы видовой нормы, то это не является единственным (достаточным) основанием для начала лечения у него анемии. В этом случае требуется индивидуальная оценка как возможной эффективности лечения, так и рисков, сопряженных с ним. Проконсультируйтесь, если это будет необходимо, с экспертом по поводу необходимости назначения ДЭ-α таким пациентам.
Резкое повышение уровня гематокрита, даже до пределов нормы, может привести к ряду значимых осложнений и ухудшить общее состояние пациента. Поэтому терапию ДЭ-α у пациентов начинают с минимальных доз и лишь затем по результатам повторных анализов производят их коррекцию. Не следует стремиться при терапии ДЭ-α к повышению уровня гематокрита более чем на 20-25% от исходного уровня сразу после первого-второго его применения.
Терапия стимуляторами гемопоэза не должна приводить к повышению уровня гематокрита у пациента до средних или верхних значений видового интервала нормы или тем более превышать ее, поскольку это может привести к разнообразным и значимым побочным эффектам и усугубить тяжесть почечного поражения (например привести к образованию большого числа эритроцитов с коротким сроком жизни и тем самым спровоцировать нефротоксичный уровень гемолиз).
Поскольку алюминиевая интоксикация приводит к снижению действия эритропоэтинов в общем и ДЭ-α в частности на препотентные клетки костного мозга, использование солей алюминия в комплексной терапии ХБП, как фосфатбайндеров, так и гастропротекторов, должно быть прекращено[10].
У пациентов, которым проводится терапия ДЭ-α, должны быть исключены или выявлены и по возможности скорректированы иные факторы, способные усугубить тяжесть ренальной анемии. Это прежде всего кровотечения (особенно в ЖКТ) и дефицит железа (для коррекции последнего состояния используются препараты Fe3+ , например, железа гидроксид декстран в дозе 50-300 мг на животное), фолиевой кислоты и витамина В12.
Поскольку почечный клиренс ДЭ-α минимален, при подборе дозы препарата нет необходимости учитывать СКФ пациента и/или тяжесть его почечной деструкции.
Режим дозирования ДЭ-α
Сигналом для начала терапии ДЭ-α является снижение уровня гематокрита ниже видовой нормы. Поэтому у всех пациентов, у которых диагностирован клинический этап почечного континуума, необходимо систематическое определение уровня гематокрита. Регулярность оценки этого показателя зависит как от стадии ХБП, так и от общего состояния пациента.
Поскольку как уровень гемоглобина и эритропоэтина, так и реакция на введение стимуляторов гемопоэза и ее продолжительность могут значимо варьироваться у животных даже одного вида, сопоставимой массы тела и стадии основного заболевания, то подбор дозы ДЭ-α осуществляется по индивидуальной программе для каждого пациента. Связано это с тем, что резкое повышение уровня гемоглобина даже до пределов нормы у пациента может привести к ряду тяжелых осложнений как для организма в целом, так и негативно повлиять (прежде всего из-за усугубления тяжести гипертензии) на функцию сердечно-сосудистой и мочевыделительной систем, патогенезы патологий которых, и без того стремительно замыкаются в порочный круг, образуя кардио-ренальный и рено-кардиальный континуумы.
Авторы одного исследования, изучавшие действие ДЭ-α у кошек с ренальной анемией [15] подтвердили гипотезу об эффективности этого антианемического препарата и предлагают использовать его в дозе 1 мкг/кг 1 раз в неделю.
Автор статьи предлагает в качестве начальной дозы 10 мкг ДЭ-α (Аранеспа) подкожно для всех пациентов на стадии коррекции ренальной анемии. Затем необходимо определение уровня гемоглобина на 3-5-й день после инъекции. Если уровень гематокрита достигает пределов нижней границы нормы, то производят дальнейшее измерение этого показателя каждые 3-5 дней в течение 3 или даже 4 недель до тех пор, пока его значения вновь не начнут снижаться. Затем производят введение Аранеспа в первоначальной дозе. А срок для третьей и последующих инъекций (поддерживающая терапия) определяют исходя из временного промежутка на стадии коррекции, когда уровень гематокрита у пациента был в пределах нижнего диапазона нормы.
Например, у животного после введения первоначальной дозы ДЭ-α уровень гематокрита определялся в следующие сроки: 0, 3, 8, 13, 18 и 23-й дни, но значимое реципрокатное снижение уровня гематокрита было зарегистрировано на 23-й день. Тогда в последующем введение ДЭ-α необходимо проводить каждые 18 (±2) дней, а определять уровень гематокрита за 1-2 дня до каждой последующей инъекции, что необходимо для того, чтобы произвести в случае необходимости коррекцию в сторону увеличения или уменьшения дозы препарата.
Если после введения первой корригирующей дозы ДЭ-α произошло повышение уровня гематокрита до средних–верхних пределов нормы или тем более превысило ее, то алгоритм дальнейшего подбора препарата следующий. Проводят динамический контроль уровня гемоглобина до момента его снижения ниже нормы в описанные выше сроки от начала лечения. А дальнейший подбор начинают с 5 мкг (50% первоначальной базовой нормы) ДЭ-α.
Если положительной динамики на первую инъекцию ДЭ-α на 3-4-й день не последовало или она была недостаточной, то необходимо прогрессирующее увеличение дозы в размере от 50 до 100% от начальной (предыдущей). Однако следует учитывать, что тот или иной уровень ДЭ-α в организме пациента присутствует и сохраняет свою биологическую активность от 1 до 4 недель.
В последующем контроль и коррекцию уровня гематокрита у пациента необходимо производить пожизненно.
Abstract
Anemia is a widespread complication of a clinical stage of renal continuum (chronic kidney disease above all), significantly influence patient’s quality of life and its life-span. The principal cause of renal anemia is complete and relative (associated with the vigor reduction of receptor interaction) erythropoietin deficiency.
For the remedy of renal anemia the whole blood transfusion and human recombinant forms of erythropoietin. However greater progress in correction of this complication of CKD is achieved by using Darbepoetin- alfa in a complex nephroprotective therapy.
Литература
Elliott J, Barber PJ. Feline chronic renal failure: Clinical findings in 80 cases diagnosed between 1992 and 1995. J Small Anim Pract 1998;39:78–85
Cowgill LD. Application of recombinant human erythropoietin in dogs and cats. In: Kirk RW, Bonagura JD, eds. Current Veterinary Therapy XI. Philadelphia, PA: WB Saunders; 1992:484–487.
Cowgill LD. Pathophysiology and management of anemia in chronic progressive renal failure. Semin Vet Med Surg (Small Anim) 1992;7:175–182.
Erslev AJ, Besarab A. Erythropoietin in the pathogenesis and treatment of the anemia of chronic renal failure. Kidney Int 1997;51:622–630.
King LG, Giger U, Diserens D, Nagode LA. Anemia of chronic renal failure in dogs. J Vet Intern Med 1992;6:264–270.
MacLeod JN. Species-specific recombinant erythropoietin preparations for companion animals. Paper presented at 2001 ACVIM Veterinary Medical Forum, Denver, CO.
Nephrology and urology of small animals / edited by Joe Bartges, David J. Polzin. Willey-Blackwell, 2011
Polzin DJ, Osborne CA, Jacob F, Ross S. Chronic renal failure. In: Ettinger SJ, Feldman EC, eds. Textbook of Veterinary Internal Medicine, Vol 2, 5th ed. Philadelphia, PA: WB Saunders; 2000:1634–1661.
Polzin DJ, Osbornes CA, Ross S. Chronic kidney disease. In: Ettinger SJ, Feldman EC, editors. Textbook of Veterinary Internal Medicine. 6th ed. St Louis, Missouri: Saunders (Elsevier); 2005. pp. 1756–1785.
Randolph JE,Scarlett JM, Stokol T, Saunders KM, MacLeod JN. Expression, bioactivity, and clinical assessment of recombinant feline erythropoietin. Am J Vet Res. 2004 Oct;65(10):1355-66.
Randolph JE,Scarlett J, Stokol T, MacLeod JN. Clinical efficacy and safety of recombinant canine erythropoietin in dogs with anemia of chronic renal failure and dogs with recombinant human erythropoietin-induced red cell aplasia. J Vet Intern Med. 2004 Jan-Feb;18(1):81-91.
Randolph JF, Scarlett JM, Stokol T, et al. Expression, bioactivity, and clinical assessment of recombinant feline erythropoietin. Am J Vet Res 2004;65:1355–1366.
Randolph JF, Scarlett JM, Stokol T, MacLeod JN. Clinical efficacy and safety of recombinant canine erythropoietin in dogs with anemia of chronic renal failure and dogs with recombinant human erythropoietin-induced red cell aplasia. J Vet Intern Med 2004;18:81–91.
Ross SJ. Treatment of anemia of kidney disease using darbepoetin. Paper presented at 2006 ACVIM Veterinary Medical Forum, Louisville, KY.
Chalhoub S., Langston C.E., Farrelly J.The Use of Darbepoetin to Stimulate Erythropoiesis in Anemia of Chronic Kidney Disease in Cats: 25 Cases. J Vet Intern Med 2012;26:363–369
Современный курс ветеринарной медицины Кирка / Пер. с англ. / В двух частях. Часть 1 (С. 1-674). - М.: ООО «Аквариум Принт», 2014. - 674 с.: ил.
[1] Диагностика нефропатий, в т.ч. ХБП, на этом этапе осуществляется чаще всего на основании изменений в анализах мочи и/или при УЗИ органов мочевыделительной системы (например, поликистоз).
[2] Циркулирующие иммунные комплексы, состоящие из вирусных антигенов, антител, их нейтрализующих и компонента комплемента (С3). ЦИКи, фиксируясь между слоями фильтрационного барьера, вызывают первоначально микротромбозы в нем, а затем и микронекрозы. Процессы восстановления целостности поврежденного участка фильтрационного барьера в этом случае всегда заканчиваются склерозированием всей капиллярной петли и поэтому носят название фатальной репарации (это один из механизмов развития некоторых форм хронических гломерулонефритов).
[3] Тельца Хайнца (также известные как тельца Гейнца или Гейнца-Эрлиха) — это эритроциты с преципитатами окисленного гемоглобина внутри клетки, часто выступающими за ее пределы.
[4] Что, в свою очередь, служит стимулом для снижения синтеза эритропоэтина.
[5] Сегодня в тройку лидеров для «лечения» пациентов с ХБП среди ветеринарных врачей входят антибиотики, стероиды и с большим отрывом иАПФ. Да и стероиды полностью еще не сданы в архив.
[6] Именно поэтому поражение почек накладывает ограничения на использование большинства лекарственных препаратов, поскольку они тем или иным образом взаимодействуют с ренальной паренхимой или экскретируются почками в неизменном виде или в форме метаболитов (имеющих ту или иную биологическую активность или даже проявляющих токсичность, особенно при накоплении в организме).
[7] Хотя многократное использование в эксперименте видоспецифичных эритропоэтинов собак и кошек также пока приводит к неоднозначным результатам [12, 13].
[8] Хотя говорить о решительной победе над эритропоэтиндефицитной анемией пока нельзя.
[9] Почки являются не только причиной развития ренальной гипертензии, но и сами оказываются органом-мишенью этого осложнения. В итоге нефропатии и гипертензия, вызванная ими, стремительно замыкают свои патогенезы в порочный круг.
[10] На сегодняшний день и в той, и в другой группе препаратов имеется достаточное количество эффективных и доступных лекарственных средств, у которых уровень и значимость побочных эффектов значительно ниже, чем у препаратов алюминия.
к.в.н. Роман-А. Леонард
Рекомендации IRIS по лечению хронической болезни почек (ХБП) у собак (2013)
Рекомендации IRIS[1] по лечению хронической болезни почек (ХБП) у собак (2013)
Перевод с английского и комментарии: к.в.н. Леонард Р.А (vetnefro@mail.ru)
Источник: http://www.iris-kidney.com/pdf/003-n378.008-iris-website-treatment-recommendation-pdfs-dogs_041113.pdf
Лечение ХБП должно подбираться индивидуально для каждого отдельного пациента.
Нижеследующие рекомендации являются важными отправными точками для начала лечения большинства собак, находящихся на той или иной стадии ХБП (таблица 1).
В идеале необходим постоянный контроль за состоянием пациентов, а лечение должно корректироваться в зависимости от его эффективности.
Необходимо обратить внимание на то, что лечебные мероприятия начинают проводить после выставления диагноза ХБП. Однако увеличение уровня только креатининемии выше референсных значений не является основанием для диагностики у пациента ХБП (при диагностике у пациента ХБП необходимо также опираться на результаты других неинвазивных (анализы мочи, визуализирующие методы) и инвазивных (пункционная нефробиопсия) методов диагностики - Р.Л.).
Часть препаратов (терапевтических схем), рекомендуемых нами для лечения собак, не разрешена к использованию у этого вида животных (имеется в виду в Западной Европе и США – Р.Л.), поэтому указанные дозы являются эмпирически подобранными.
Это обстоятельство каждый раз ставит врача перед необходимостью оценивать как ожидаемый положительный эффект от использования препарата, так и степень риска ухудшения состояния пациента после начала его применения.
Стадия 1[2]
Прекратите, по возможности, использование всех потенциально нефротоксичных препаратов (например, аминогликозидных антибиотиков и НПВП, если не имеется жизненно важных показаний к их применению - Р.Л.).
Диагностируйте и, при необходимости, проведите адекватное лечение всех патологических состояний, способных вызвать пре- и постренальную почечную недостаточность (гиповолемия, гипотензия, острая задержка мочи т.д. – Р.Л.).
Исключите любые потенциально поддающиеся излечению заболевания, такие как пиелонефрит и/или инфекция мочевыделительного тракта, а так же визуализируемый при УЗИ и/или рентгенографии ренальный уролитиаз.
У пациента должен быть определен уровень кровяного давления и соотношение белок/креатинин мочи (UP/C).
Лечение обезвоживания:
У пациентов на этой стадии способность к концентрации мочи может быть несколько сниженной, поэтому:
- скорректируйте, если нужно, клинически определенную дегидратацию/ гиповолемию при помощи изотонических полиионных жидкостей (например, раствора Рингер-Лактата);
- животные должны иметь постоянный доступ к свежей воде для питья.
Системная гипертония:
Уровень системной артериальной гипертензии (АГ), при котором может развиться поражение почек, не известен.
Наша цель состоит в том, чтобы снизить уровень систолического артериального давление (АД) до уровня
Если нет прямых доказательств повреждения целевых органов, но уровень систолического АД у животного постоянно превышает 160 мм. рт. ст., то лечение гипертензии все равно должно быть начато.
Стойкое повышение уровня АД должно быть зарегистрировано при многократных измерениях и соотнесено с временным промежутком, в течение которого патология персистировала.
В зависимости от этого выделяют:
- Умеренный риск (AP2): АД находилось в пределах 160-179 мм. рт. ст. в течение 1-2 месяцев;
- Серьезный риск (AP3): АД ≥ 180 мм. рт. ст. в течение 1-2 недель.
Если же у пациента диагностируется поражение какого-либо целевого органа (например, ярко выраженные изменения на глазном дне - Р.Л.), то его лечение должно быть начато, даже если уровень АД находиться в пределах нормы.
Постепенная нормализация уровня кровяного давления является долгосрочной целью в лечении пациентов с ХБП, однако при этом терапия не должна приводить к внезапному и/или значительному снижению АД и развитию гипотонии.
Известно, что некоторые породы (например, борзые собаки) имеют в норме более высокий уровень артериального давления (см. Приложение 1). И это должно учитываться у них при оценке этого показателя.
Логический пошаговый подход к контролю АГ следующий:
Снижение потребления поваренной соли. Нет никаких доказательств того, что уменьшение потребления Na+способствует снижению уровня АД. Поэтому диетотерапия с ограниченным содержанием соли должна сочетаться с медикаментозным лечением гипертензии.
Терапия стандартными дозами ингибиторов ангиотензинпревращающего фермента (иАПФ).
Увеличьте в два раза дозу иАПФ (у некоторых пациентов это может привести к более выраженному антигипертоническому эффекту этой группы препаратов).
Сочетанное использование иАПФ и блокаторов кальциевых каналов (БКК) (например, амлодипина).
Сочетанное использование иАПФ, БКК и гидралазина.
Контроль ответа на антигипертензивную терапию:
Собакам с гипертензией обычно показана пожизненная терапия, которая должна корректироваться в зависимости от потребностей пациента. Важно последовательное мониторирование. После стабилизации контроль уровня АД должен происходить, по крайней мере, каждые 3 месяца.
АД
Уровень креатининемии. Снижение АД может привести к незначительному повышению концентрации уровня креатинина (<0,5 мг/дл или 45 мкмоль/л). Но более значительное увеличение уровня креатининемии, скорее всего, свидетельствует о неблагоприятном влиянии препарата и прогрессировании почечной дисфункции.
Протеинурия
UP/C >2.0: обследуйте пациента на наличие болезней ведущих к протеинурии (см. п. 1 и 2 ниже) и назначьте антипротеинурическое лечение (см. п. 3 и 4 ниже).
UP/C от 1.0 до 2.0: требует тщательного изучения и внимательного наблюдения (см 1, 2 и 5 ниже).
UP/C от 0.5 до 1.0: требует внимательного наблюдения (см. п. 1 и 5 ниже).
Постарайтесь выявить любой сопутствующий заболеванию патологический процесс, который можно вылечить или скорректировать.
Рассмотрите возможность проведения почечной биопсии (пункционной - Р.Л.) как варианта для идентификации нозологической формы нефропатии (смотри приложение 2 или проконсультируйтесь с экспертом).
иАПФ плюс «почечная» диета.
Ацетилсалициловая кислота в небольших дозах (1-5 мг/кг раз в день) если сывороточный альбумин
Контролируйте эффективность лечения/ прогрессирования заболевания:
- стабилизация концентрации креатинина и уменьшение индекса UP/C – положительный ответ (замедление темпов деструкции в почечной паренхиме – Р.Л.);
- прогрессирующее увеличение концентрации креатинина в крови и/или значения индекса UP/C – болезнь прогрессирует.
Обычно требуется пожизненная терапия, если основное заболевание не было устранено. При этом дозы (лекарственных средств – Р.Л.) могут быть сокращены, но при постоянном контроле индекса UP/C.
ОТКРЫТЬ ТАБЛИЦУ №1
_______________________
Примечания:
Использование иАПФ противопоказано животным, которые имеют клинические признаки обезвоживания и/или гиповолемии. Обязательно гидратируйте пациента перед использованием этих препаратов, иначе СКФ может значительно снизиться.
Начало корректировки уровня протеинурии (т.н. точка вмешательства) отличается в зависимости от стадии ХБП. У неазотемичных животных (стадия I/ ранняя II[3] стадия) число нефронов, через которые может происходить потеря белка, значимо. Поэтому причины появления даже пограничной или низкоуровневой протеинурии (UP/C <1,0) на начальных стадиях ХБП должны исследоваться более тщательно. В то время как на II-IV стадиях начинать лечение рекомендовано и при более низком соотношении UP/C.
Стадия 2
Все вышеупомянутые рекомендации для пациентов, находящихся на I стадии ХБП, и дополнительные меры, описанные ниже.
Прекратите, по возможности, использование всех потенциально нефротоксичных препаратов (если не имеется жизненно важных показаний к их применению - Р.Л.).
Диагностируйте и, при необходимости проведите адекватное лечение всех патологических состояний, способных вызвать пре- и пост-ренальную почечную недостаточность (гиповолемия, гипотензия, острая задержка мочи т.д. – Р.Л.).
Исключите любые потенциально поддающиеся излечению заболевания, такие как пиелонефрит и/или инфекция мочевыделительного тракта, а так же визуализируемый при УЗИ и/или рентгенографии, ренальный уролитиаз.
У пациента должен быть определен уровень кровяного АД и соотношение UP/C.
Рассмотрите возможность для начала почечной диетотерапии, переход на которую на этой стадии ХБП осуществить значительно легче, прежде чем у пациента разовьется анорексия.
Лечение обезвоживания:
У этих пациентов снижена способность к концентрации мочи и поэтому:
- скорректируйте, если нужно, клинически определенную дегидратацию/гиповолемию при помощи изотонических полиионных жидкостей (например, раствора Рингер-Лактат);
- животные должны иметь постоянный доступ к свежей воде для питья.
Системная гипертония:
Уровень системной артериальной гипертензии (АГ), при котором может развиться поражение почек, не известен.
Наша цель состоит в том, чтобы снизить систолическое АД до уровня
Если нет прямых доказательств повреждения целевых органов, но уровень систолического АД у животного постоянно превышает 160 мм. рт. ст., то лечение гипертензии все равно должно быть начато.
Стойкое повышение уровня АД должно быть зарегистрировано при многократных измерениях и соотнесено с промежутком времени, в течение которого патология персистировала. В зависимости от этого выделяют:
- умеренный риск (AP2): АД находилось в пределах 160-179 мм. рт. ст. в течение 1-2 месяцев;
- серьезный риск (AP3): АД ≥ 180 мм. рт. ст. в течение 1-2 недель.
Если же у пациента диагностируется поражение какого-либо целевого органа (например, ярко выраженные изменения на глазном дне - Р.Л.), то его лечение должно быть начато, даже если уровень АД находиться в пределах нормы.
Постепенная нормализация уровня кровяного давления является долгосрочной целью в лечении пациентов с ХБП, избегая при этом внезапного и/или значительного снижения АД и развития гипотонии.
Известно, что некоторые породы (например, борзые собаки) имеют в норме более высокий уровень артериального давления (см. Приложение 1). И это должно учитываться у них при оценке этого показателя.
Логический пошаговый подход к контролю АГ следующий:
Снижение потребления поваренной соли. Нет ни каких доказательств того, что уменьшение потребления Na+способствует снижению уровня АД. Поэтому диетотерапия с ограниченным содержанием соли должна сочетаться с медикаментозным лечением гипертензии.
Терапия стандартными дозами ингибиторов ангиотензинпревращающего фермента (иАПФ).
Увеличьте в два раза дозу иАПФ (у некоторых пациентов это может привести к более выраженному антигипертоническому эффекту этой группы препаратов).
Сочетанное использование иАПФ и БКК (например, амлодипина).
Сочетанное использование иАПФ, БКК и гидралазина.
Контроль ответа на антигипертензивную терапию:
Собакам с гипертензией обычно показана пожизненная терапия, которая должна корректироваться в зависимости от потребностей пациента. Важно последовательное мониторирование. После стабилизации контроль уровня АД должен происходить, по крайней мере, каждые 3 месяца.
АД
Уровень креатининемии. Снижение АД может привести к незначительному повышению концентрации уровня креатинина (<0,5 мг/дл или 45 мкмоль/л). Но более значительное увеличение уровня креатининемии, скорее всего, свидетельствует о неблагоприятном влиянии препарата и прогрессировании почечной дисфункции.
Протеинурия
Собаки со II стадией ХБП при UP/C >0,5: обследуйте пациента на наличие болезней, ведущих к протеинурии (см. п. 1 и 2 ниже) и назначьте анти-протеинурическое лечение (см. п. 3 и 4 ниже).
Собаки с UP/C от 0,2 до 0,5: требуют внимательного наблюдения (см. п. 1 и 5 ниже).
Постарайтесь выявить любой сопутствующий заболеванию патологический процесс, который можно вылечить или скорректировать.
Рассмотрите возможность проведения почечной биопсии (пункционной- Р.Л.) как варианта для идентификации нозологической формы нефропатии (смотри приложение 2 или проконсультируйтесь с экспертом).
иАПФ плюс «почечная» диета.
Ацетилсалициловая кислота в небольших дозах (1-5 мг/кг раз в день) если сывороточный альбумин
Контролируйте эффективность лечения/ прогрессирование заболевания:
- стабилизация концентрации креатинина и уменьшение индекса UP/C – положительный ответ (замедление темпов деструкции в почечной паренхиме – Р.Л.);
- прогрессирующее увеличение концентрации креатинина в крови и/или значения индекса UP/C – болезнь прогрессирует.
Обычно требуется пожизненная терапия, если основное заболевание не было устранено. При этом дозы (лекарственных средств – Р.Л.) могут быть сокращены, но при постоянном контроле индекса UP/C.
Обратите внимание: использование иАПФ противопоказано животным с клинической дегидратацией и/или с признаками гиповолемии. Устраните обезвоживание перед использованием этих препаратов, иначе СКФ может резко упасть.
Сокращение потребления фосфата:
Данные свидетельствуют, что хроническое сокращение потребления фосфата, чтобы поддержать его плазменную концентрацию ниже 1,5 ммоль/л (не меньше чем 0,9 ммоль/л или 4.6 мг/дл, но не > 2,7 мг/дл), благоприятно для пациентов с ХБП.
Для достижения этого могут быть последовательно предприняты следующие меры:
Диетическое сокращение потребления фосфата (почечная диетотерапия).
Если плазменная концентрация фосфата остается выше 1,5 ммоль/л (5 мг/дл) после его диетического ограничения, используйте кишечные фосфат-байндеры[4] (например, гидроокись или карбонат алюминия, карбонат кальция[5], ацетат кальция, карбонат лантана), эффективные дозы которых начинаются с 30-60 мг/кг/сут. Препараты следует давать вместе с едой, разделив суточную дозу на количество приемов пищи.
Необходимая доза изменяется в зависимости от количества поступающего с пищей фосфата и стадии ХБП. Лечение фосфат-байндерами должно приводить к должному эффекту, обрисованному в общих чертах ранее. Верхняя доза используемого препарата ограничивается развитием интоксикации у каждого конкретного пациента.
Мониторинг содержания кальция и фосфата в сыворотке крови необходимо проводить каждые 4-6 недель до стабилизации, а затем каждые 12 недель.
Микроцитоз и/или общая мышечная слабость являются свидетельством алюминиевой интоксикации, вызванной алюминий-содержащим фосфат- байндером и требует перехода на другой препарат из этой группы[6]. Гиперкальциемии в некоторых случаях можно избежать, комбинируя алюминий- и кальций-содержащие фосфат-байндеры.
Метаболический ацидоз:
Если у пациента однажды диагностирован метаболический ацидоз (бикарбонат крови или общий CO2 у животных с гипокалиемией). Целью терапии является достижение уровня бикарбоната крови /общего CO2 в диапазоне от 18 до 24 ммоль/л.
Стадия 3.
Все вышеупомянутые рекомендации для пациентов, находящихся на I и II стадиях ХБП, и дополнительные меры, описанные ниже.
Прекратите, по возможности, использование всех потенциально нефротоксичных препаратов (если не имеется жизненно важных показаний к их применению - Р.Л.).
Диагностируйте и, при необходимости, проведите адекватное лечение всех патологических состояний, способных вызвать пре- и постренальную почечную недостаточность (гиповолемия, гипотензия, острая задержка мочи т.д. – Р.Л.).
Исключите любые потенциально поддающиеся излечению заболевания, такие как пиелонефрит и/или инфекция мочевыделительного тракта, а так же визуализируемый при УЗИ и/или рентгенографии ренальный уролитиаз.
У пациента должен быть определен уровень кровяного давления и соотношение белок/креатинин мочи (UP/C).
«Почечная» диетотерапия.
Лечение обезвоживания:
У этих пациентов снижена способность к концентрации мочи и поэтому:
- скорректируйте, если нужно, клинически определенную дегидратацию/гиповолемию при помощи изотонических полиионных жидкостей (например, раствора Рингер-Лактата);
- животные должны иметь постоянный доступ к свежей воде для питья.
Системная гипертония:
Уровень системной артериальной гипертензии (АГ), при котором может развиться поражение почек, не известен.
Наша цель состоит в том, чтобы снизить систолическое АД до уровня
Если нет прямых доказательств повреждения целевых органов, но уровень систолического АД у животного постоянно превышает 160 мм. рт. ст., то лечение гипертензии все равно должно быть начато.
Стойкое повышение уровня АД должно быть зарегистрировано при многократных измерениях и соотнесено с промежутком времени, в течение которого патология персистировала. В зависимости от этого выделяют:
- умеренный риск (AP2): АД находилось в пределах 160-179 мм. рт. ст. в течение 1-2 месяцев;
- серьезный риск (AP3): АД ≥ 180 мм. рт. ст. в течение 1-2 недель.
Если же у пациента диагностируется поражение какого-либо целевого органа (например, ярко выраженные изменения на глазном дне- Р.Л.), то его лечение должно быть начато даже если уровень АД находиться в пределах нормы.
Постепенная нормализация уровня кровяного давления является долгосрочной целью в лечении пациентов с ХБП, избегая при этом внезапного и/или значительного снижения АД и развития гипотонии.
Известно, что некоторые породы (например, борзые собаки) имеют в норме более высокий уровень артериального давления (см. Приложение 1). И это должно учитываться у них при оценке этого показателя.
Логический пошаговый подход к контролю АГ следующий:
Снижение потребления поваренной соли. Нет никаких доказательств того, что уменьшение потребления Na+способствует снижению уровня АД. Поэтому диетотерапия с ограниченным содержанием соли должна сочетаться с медикаментозным лечением гипертензии.
Терапия стандартными дозами иАПФ.
Увеличьте в два раза дозу иАПФ (у некоторых пациентов это может привести к более выраженному антигипертоническому эффекту этой группы препаратов).
Сочетанное использование иАПФ и БКК (например, амлодипина).
Сочетанное использование иАПФ, БКК и гидралазина.
Контроль ответа на антигипертензивную терапию:
Собакам с гипертензией обычно показана пожизненная терапия, которая должна корректироваться в зависимости от потребностей пациента. Важно последовательное мониторирование. После стабилизации контроль уровня АД должен происходить, по крайней мере, каждые 3 месяца.
АД
Уровень креатининемии. Снижение АД может привести к незначительному повышению концентрации уровня креатинина (<0,5 мг/дл или 45 мкмоль/л). Но более значительное увеличение уровня креатининемии, скорее всего, свидетельствует о неблагоприятном влиянии препарата и прогрессировании почечной дисфункции.
Протеинурия
Собаки с III стадией ХБП при UP/C >0,5: обследуйте пациента на наличие болезней ведущих к протеинурии (см. п. 1 и 2 ниже) и назначьте анти-протеинурическое лечение (см. п. 3 и 4 ниже).
Собаки с UP/C от 0,2 до 0,5: требуют внимательного наблюдения (см. п. 1 и 5 ниже).
Постарайтесь выявить любой сопутствующий заболеванию патологический процесс, который можно вылечить или скорректировать.
Рассмотрите возможность проведения почечной биопсии (пункционной- Р.Л.) как варианта для идентификации нозологической формы нефропатии (смотри приложение 2 или проконсультируйтесь с экспертом).
иАПФ плюс диета со сниженным количеством белка.
Ацетилсалициловая кислота в небольших дозах (1-5 мг/кг раз в день), если сывороточный альбумин
Контролируйте эффективность лечения/ прогрессирования заболевания:
- стабилизация концентрации креатинина и уменьшение индекса UP/C – положительный ответ (замедление темпов деструкции в почечной паренхиме – Р.Л.);
- прогрессирующее увеличение концентрации креатинина в крови и/или значения индекса UP/C – болезнь прогрессирует.
Обычно требуется пожизненная терапия, если основное заболевание не было устранено. При этом дозы (лекарственных средств – Р.Л.) могут быть сокращены, но при постоянном контроле индекса UP/C.
Обратите внимание: использование иАПФ противопоказано животным с клинической дегидратацией и/или с признаками гиповолемии. Устраните обезвоживание перед использованием этих препаратов, иначе СКФ может резко упасть.
Сокращение потребления фосфата:
Данные свидетельствуют, что хроническое сокращение потребления фосфата, чтобы поддержать его плазменную концентрацию ниже 1,5 ммоль/л (не меньше, чем 0,9 ммоль/л или 4.6 мг/дл, но не > 2,7 мг/дл), благоприятно для пациентов с ХБП.
Для достижения этого могут быть последовательно предприняты следующие меры:
Диетическое сокращение фосфата (почечная диетотерапия).
Если плазменная концентрация фосфата остается выше 1,6 ммоль/л (5 мг/дл) после его диетического ограничения, используйте кишечные фосфат-байндеры (например, гидроокись или карбонат алюминия, карбонат кальция, ацетат кальция, карбонат лантана), эффективные дозы которых начинаются с 30-60 мг/кг/сут. Препараты следует давать вместе с едой, разделив суточную дозу на количество приемов пищи.
Необходимая доза изменяется в зависимости от количества поступающего с пищей фосфата и стадии ХБП. Лечение фосфат-байндерами должно приводить к должному эффекту, обрисованному в общих чертах ранее. Верхняя доза, используемого препарата ограничивается развитием интоксикации у каждого конкретного пациента.
Мониторинг содержания кальция и фосфата в сыворотке крови необходимо проводить каждые 4-6 недель до стабилизации, а затем каждые 12 недель.
Микроцитоз и/или общая мышечная слабость являются свидетельством алюминиевой интоксикации, вызванной алюминий-содержащим фосфат- байндером и требует перехода на другой препарат из этой группы. Гиперкальциемии в некоторых случаях можно избежать, комбинируя алюминий- и кальций-содержащие фосфат-байндеры.
Имеются данные, что разумное использование кальцитриола (от 1,5 до 3,5 нанограмм на кг) продлевает продолжительность жизни у собак на III стадии. Но при этом требуется постоянный контроль уровня фосфатов, ионизированного кальция и паратиреоидного гормона (в сыворотке крови- Р.Л.).
Метаболический ацидоз:
Если у пациента однажды был диагностирован метаболический ацидоз (бикарбонат крови или общий CO2 2 в диапазоне от 18 до 24 ммоль/л.
Дополнительные рекомендации для пациентов на III стадии:
Рассмотрите возможность лечения анемии, если это может оказать положительное влияние на качество жизни пациента. Необходимость этого, как правило, возникает тогда, когда гематокрит[7]
Лечение рвоты/ сниженного аппетита/ тошноты производят с помощью ингибиторов протоновой помпы (например, омепразол) и противорвотных препаратов (например, маропитант или ондансетрон).
Проведите адекватное парентеральное введение жидкостей в объеме, необходимом для гидратации пациента.
Лекарственные препараты, которые элиминируются из организма в основном через почки, должны использоваться с осторожностью у пациентов на III стадии ХБП. Это необходимо, что бы подобрать дозу этих препаратов (в зависимости от широты их терапевтического индекса), во избежание их накопления в организме.
Стадия 4.
Все вышеупомянутые рекомендации для пациентов, находящихся на I, II и III стадии ХБП, и дополнительные меры, описанные ниже.
Прекратите, по возможности, использование всех потенциально нефротоксичных препаратов (если не имеется жизненно важных показаний к их применению - Р.Л.).
Диагностируйте и, при необходимости, проведите адекватное лечение всех патологических состояний, способных вызвать пре- и постренальную почечную недостаточность (гиповолемия, гипотензия, острая задержка мочи т.д. – Р.Л.).
Исключите любые потенциально поддающиеся излечению заболевания, такие как пиелонефрит и/или инфекция мочевыделительного тракта, а так же визуализируемый при УЗИ и/или рентгенографии, ренальный уролитиаз.
У пациента должен быть определен уровень кровяного давления соотношение белок/креатинин мочи (UP/C).
«Почечная» диетотерапия.
Лечение обезвоживания:
У этих пациентов снижена способность к концентрации мочи и поэтому:
- скорректируйте, если нужно, клинически определенную дегидратацию/гиповолемию при помощи изотонических полиионных жидкостей (например, раствора Рингер-Лактата);
- животные должны иметь постоянный доступ к свежей воде для питья.
Системная гипертония:
Уровень системной артериальной гипертензии (АГ), при котором может развиться поражение почек, не известен.
Наша цель состоит в том, чтобы снизить систолическое АД до уровня
Если нет прямых доказательств повреждения целевых органов, но уровень систолического АД у животного постоянно превышает 160 мм. рт. ст., то лечение гипертензии все равно должно быть начато.
Стойкое повышение уровня АД должно быть зарегистрировано при многократных измерениях и соотнесено с промежутком времени, в течение которого патология персистировала. В зависимости от этого выделяют:
- умеренный риск (AP2): АД находилось в пределах 160-179 мм. рт. ст. в течение 1-2 месяцев;
- серьезный риск (AP3): АД ≥ 180 мм. рт. ст. в течение 1-2 недель.
Если же у пациента диагностируется поражение какого-либо целевого органа (например, ярко выраженные изменения на глазном дне- Р.Л.), то его лечение должно быть начато, даже если уровень АД находиться в пределах нормы.
Постепенная нормализация уровня кровяного давления является долгосрочной целью в лечении пациентов с ХБП, избегая при этом внезапного и/или значительного снижения АД и развития гипотонии.
Известно, что некоторые породы (например, борзые собаки) имеют в норме более высокий уровень артериального давления (см. Приложение 1). И это должно учитываться у них при оценке этого показателя.
Логический пошаговый подход к контролю АГ следующий:
Снижение потребления поваренной соли. Нет никаких доказательств того, что уменьшение потребления Na+способствует снижению уровня АД. Поэтому диетотерапия с ограниченным содержанием соли должна сочетаться с медикаментозным лечением гипертензии.
Терапия стандартными дозами иАПФ.
Увеличьте в два раза дозу иАПФ (у некоторых пациентов это может привести к более выраженному антигипертоническому эффекту этой группы препаратов).
Сочетанное использование иАПФ и БКК (например, амлодипина).
Сочетанное использование иАПФ, БКК и гидралазина.
Не используйте иАПФ и БКК для лечения обезвоженных собак в нестабильном состоянии, поскольку это может привести к резкому падению СКФ. Перед использованием этих препаратов обязательно гидратируйте пациента.
Контроль ответа на антигипертензивную терапию:
Собакам с гипертензией обычно показана пожизненная терапия, которая должна корректироваться в зависимости от потребностей пациента. Важно последовательное мониторирование. После стабилизации контроль уровня АД должен происходить, по крайней мере, каждые 3 месяца.
АД
Уровень креатининемии. Снижение АД может привести к незначительному повышению концентрации уровня креатинина (<0,5 мг/дл или 45 мкмоль/л). Но более значительное увеличение уровня креатининемии, скорее всего, свидетельствует о неблагоприятном влиянии препарата и прогрессировании почечной дисфункции.
Протеинурия
Собаки с IV стадией ХБП при UP/C >0,5: обследуйте пациента на наличие болезней ведущих к протеинурии (см. п. 1 и 2 ниже) и назначьте анти-протеинурическое лечение (см. п. 3 и 4 ниже).
Собаки с UP/C от 0,2 до 0,5: требуют внимательного наблюдения (см. п. 1 и 5 ниже).
Постарайтесь выявить любой сопутствующий заболеванию патологический процесс, который можно вылечить или скорректировать.
Рассмотрите возможность проведения почечной биопсии (пункционной- Р.Л.) как варианта для идентификации нозологической формы нефропатии (смотри приложение 2 или проконсультируйтесь с экспертом).
иАПФ плюс «почечная» диетотерапия.
Ацетилсалициловая кислота в небольших дозах (1-5 мг/кг раз в день), если сывороточный альбумин
Контролируйте эффективность лечения/ прогрессирование заболевания:
- стабилизация концентрации креатинина и уменьшение индекса UP/C – положительный ответ (замедление темпов деструкции в почечной паренхиме – Р.Л.);
- прогрессирующее увеличение концентрации креатинина в крови и/или значения индекса UP/C – болезнь прогрессирует.
Обычно требуется пожизненная терапия, если основное заболевание не было устранено. При этом дозы (лекарственных средств – Р.Л.) могут быть сокращены, но при постоянном контроле индекса UP/C.
Обратите внимание: использование иАПФ противопоказано животным с клинической дегидратацией и/или с признаками гиповолемии. Устраните обезвоживание перед использованием этих препаратов, иначе СКФ может резко упасть.
Сокращение потребления фосфата:
Данные свидетельствуют, что хроническое сокращение потребления фосфата, чтобы поддержать его плазменную концентрацию ниже 1,5 ммоль/л (не меньше, чем 0,9 ммоль/л или 4.6 мг/дл, но не > 2,7 мг/дл), благоприятно для пациентов с ХБП. Для собак на IV стадии ХБП более реалистичной является достижение плазменной концентрации фосфата < 1,9 ммоль/л (6,0 мг/дл).
Для достижения этого могут быть последовательно предприняты следующие меры:
Диетическое сокращение фосфата (почечная диетотерапия).
Если плазменная концентрация фосфата остается выше 1,6 ммоль/л (5 мг/дл) после его диетического ограничения, используйте кишечные фосфат-байндеры (например, гидроокись или карбонат алюминия, карбонат кальция, ацетат кальция, карбонат лантана), эффективные дозы которых начинаются с 30-60 мг/кг/сут. Препараты следует давать вместе с едой, разделив суточную дозу на количество приемов пищи.
Необходимая доза изменяется в зависимости от количества поступающего с пищей фосфата и стадии ХБП. Лечение фосфат-байндерами должно приводить к должному эффекту, обрисованному в общих чертах ранее. Верхняя доза используемого препарата ограничивается развитием интоксикации у каждого конкретного пациента.
Мониторинг содержания кальция и фосфата в сыворотке крови необходимо проводить каждые 4-6 недель до стабилизации, а затем каждые 12 недель.
ОТКРЫТЬ "Алгоритм для определения стадии ХБП у собак"
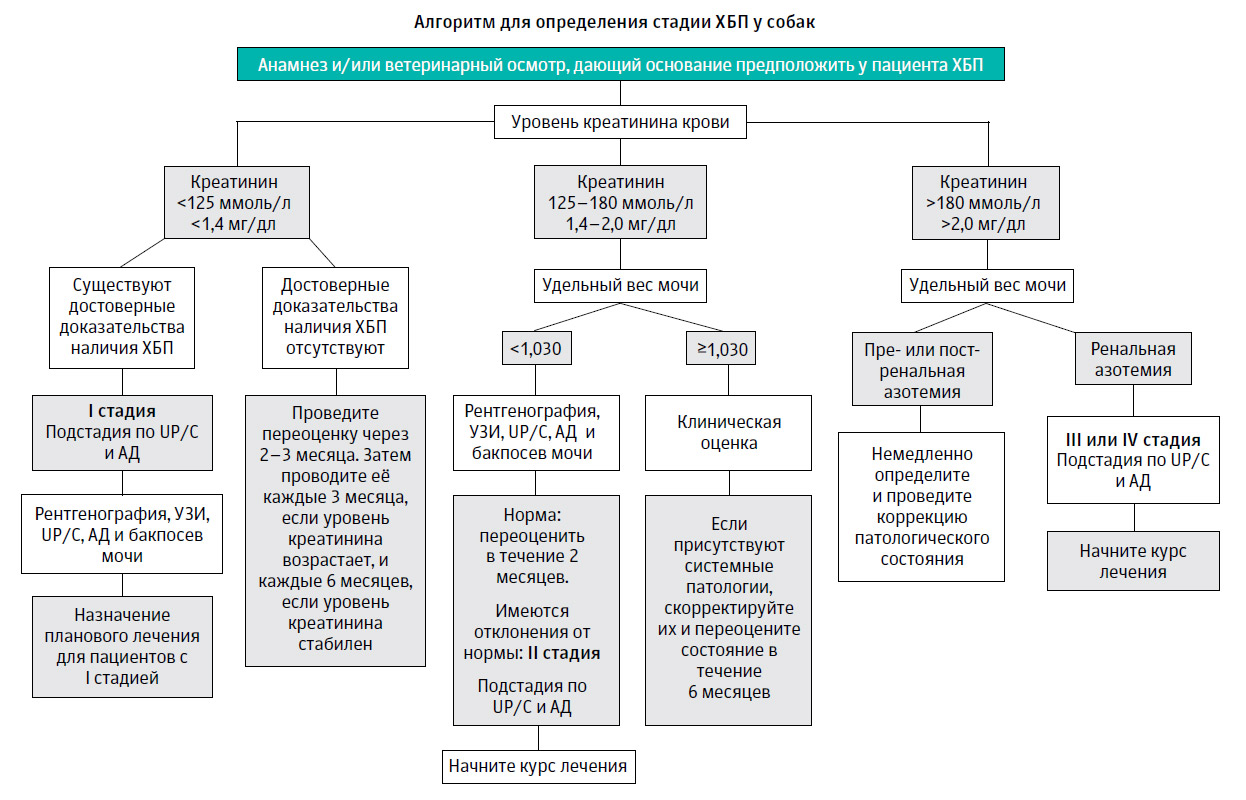
Микроцитоз и/или общая мышечная слабость являются свидетельством алюминиевой интоксикации, вызванной алюминий-содержащим фосфат- байндером и требует перехода на другой препарат из этой группы. Гиперкальциемии в некоторых случаях можно избежать комбинируя алюминий- и кальций-содержащие фосфат-байндеры.
Имеются данные, что разумное использование кальцитриола (от 1,5 до 3,5 нанограмм на кг) продлевает продолжительность жизни у собак на IV стадии. Но при этом требуется постоянный контроль уровня фосфатов, ионизированного кальция и паратиреоидного гормона (в сыворотке крови- Р.Л.).
Метаболический ацидоз:
Если у пациента однажды диагностирован метаболический ацидоз (бикарбонат крови или общий CO2 2 в диапазоне от 18 до 24 ммоль/л.
Дополнительные рекомендации для пациентов на IV стадии:
Рассмотрите возможность лечения анемии, если это может оказать положительное влияние на качество жизни пациента. Необходимость этого, как правило, возникает тогда, когда гематокрит
Лечение рвоты/ сниженного аппетита/ тошноты производят с помощью ингибиторов протоновой помпы (например, омепразол) и противорвотных препаратов (например, маропитант или ондансетрон).
Проведите адекватное парентеральное введение жидкостей в объеме, необходимом для гидратации пациента.
Приложите все возможные усилия для профилактики дефицита у пациента в организме белков/ калорий. Рассмотрите возможность принудительного кормления пациента через интервенционную трубку (например, через чрескожную гастростому).
Приложите все возможные усилия для предотвращения развития у пациента обезвоживания. Пищеводные зонды для введения питательных смесей также могут помочь в контроле уровня гидратации организма.
Рассмотрите возможность диализа и/или почечной трансплантации.
Лекарственные препараты, которые элиминируются из организма в той или иной степени через почки (или метаболизируются в них -Р.Л.), должны использоваться с осторожностью у пациентов на IV стадии ХБП. Возможно, необходимо будет скорректировать дозу препаратов (как правило, уменьшить её в два и более раза –Р.Л.), в зависимости от ширины терапевтического индекса лекарственного средства, во избежание его накопления (или его метаболитов –Р.Л.) в организме.
Приложение 1
Адаптированная подорганизация уровней кровяного давления
Признано, что некоторые породы, особенно собак, склонны иметь более высокий уровень кровяного давления, чем в популяции в целом.
Поэтому, имея дело с породами, для которых характерно более высокое кровяное давление, классификация рисков поражения органов – мишеней может быть пересмотрена следующим образом:
Высокий риск: >40 мм. рт. ст. выше установленного справочного диапазона;
Умеренный риск: от 20 до 40 мм. рт. ст. выше установленного диапазона;
Низкий риск: от 10 до 20 мм. рт. ст. выше установленного диапазона;
Минимальный риск: менее 10 мм. рт. ст. выше установленного диапазона.
Приложение 2
Показания к проведению нефробиопсии (пункционной -Р.Л.)
Реномегалия
ХБП у молодого пациента
Стойкая и тяжелая протеинурия (UP/C >2,0) у не азотемического пациента
Усугубление тяжести протеинурии у пациента с ХБП
Острая почечная недостаточность, в том случае, когда биопсия может помочь в определении прогноза заболевания
Примечания
Нижний порог диапазона уровня креатининемии для II стадии ХБП лежит в пределах границы нормы диапазона для многих лабораторий.
Инфузионные растворы, использующиеся для поддержания уровня гидратации должны иметь низкий уровень натрия (30-40 ммоль/л) и в идеале должны быть дополнены калием (около 13 ммоль/л), чтобы гарантировать ежедневную потребность пациента в жидкости и электролитах (например, Normosol-M или 5% декстроза плюс 0,18% NaCl c добавлением Kl).
Отказ от ответственности (дисклеймер[8])
Хотя были предприняты все усилия, чтобы гарантировать полноту и точность вышеизложенной информации для обеспечения здоровья животных, ни совет IRIS, ни Novartis Animal Health не принимает на себя ответственность за полноту и точность информации. Вся информация представлена без каких-либо гарантий, выраженных или подразумеваемых.
[1] IRIS (International Renal Interest Society, www.iris-kidney.com) – одно из самых авторитетных научных обществ, занимающихся проблемами ветеринарной нефрологии. В научный совет общества входят 15 независимых ветеринарных специалистов, экспертов в области ветеринарной нефрологии из десяти различных стран.
[2] Следует обратить внимание на то, что первая стадия ХБП по классификации IRIS не является гипер-азотемической.
[3] Ранняя вторая стадия была в некоторых публикациях определена как состояние, при котором уровень креатинина находился в пределах второй стадии ХБП по классификации IRIS, но при этом был ниже верхней границы справочного диапазона для этого показателя в конкретной лаборатории.
[4] Одно из значений англ. слова binder-это связывать (Р.Л.).
[5] Вместе с хитозаном входит в состав таких зарегистрированных в РФ ветеринарных фосфат-байндеров, как Ренал (Кандиоли) и Ипакитине (Р.Л.).
[6] В медицине человека алюминий-содержащие фосфат-байндеры (например, включающий в себя гидроксид алюминия (он же алгелдрат) препарат Алмагель) из-за их токсичности, значительно возрастающей при длительном использовании, практически не применяются. Кроме того, в эти препараты добавлены мятный или апельсиновый ароматизаторы, обычно вызывающие отвращение у собак. Единственным преимуществом перед другими препаратами из этой группы является их низкая стоимость (Р.Л.).
[7] В оригинале употреблен такой идентичный гематокриту термин как PCV (packed cell volume), эквивалент которого редко встречается в русскоязычной литературе.
[8] Дисклеймер (англ. Disclaimer) — письменный отказ от ответственности за возможные деликатные последствия того или иного поступка в результате действий заявившего данный отказ либо третьих лиц. Под деликатными понимаются любые виды ответственности заявителя.
Леонард Роман Александрович
Методы терапевтического контроля почечной гипертензии у собак и кошек
Автор: к.в.н. Роман-А. Леонард, практикующий ветеринарный врач, руководитель Центра ветеринарной нефрологии и урологии, президент Российской Научно-практической Ассоциации Ветеринарных Нефрологов и Урологов (НАВНУ)
Основные положения
Почечной гипертензией (ПГ) называется хроническое повышение артериального давления (АД), этиопатогенетически связанное с какой-либо нефропатией.
Артериальная гипертензия (АГ) и нефропатии всегда взаимно усугубляют течение друг друга вне зависимости от того, кто конкретно из них явился первопричиной патологии. У собак и кошек, в отличие от человека, наиболее часто регистрируют вторичную (в т.ч. почечную) АГ.
Все лекарственные средства (ЛС), применяемые для контроля ПГ у собак и кошек, как и цели их использования, заимствованы из медицины человека. А их дозы для животных первоначально были предложены тем или иным ветеринарным экспертом (врачом).
Лечение ПГ и вызвавшей ее нефропатии неразрывно связаны друг с другом. Поэтому препараты, используемые для терапии данной патологии, должны в идеале иметь не только выраженные гипотензивные, но и нефропротективные свойства.
Достижение полной нормализации АД у животных при ПГ возможно, как правило, при использовании двух- и более компонентной гипотензивной терапии.
На положительные и стабильные результаты в контроле ПГ можно рассчитывать, как правило, лишь на доклиническом этапе почечного континуума. Особенности патогенеза клинического этапа течения любых нефропатий приводят к тому, что эффективность даже комбинированной терапии ПГ значительно снижается или отсутствует вообще.
Средние и тем более тяжелые степени хронической болезни почек (ХБП) налагают значимые ограничения на использование большого числа гипотензивных препаратов, в том числе и тех, которые при более легком поражении почечной паренхимы обладают выраженными нефропротективными свойствами.
Введение
Нефрогенная артериальная гипертензия (НАГ), или почечная гипертензия (ПГ), – это системная АГ, этиопатогенетически связанная с каким-либо заболеванием почек. Подавляющее большинство из ныне известных хронических нефропатий, как инфекционного, так и неинфекционного характера (аутоиммунные, наследственные, обменные и т.д.), рано или поздно могут приводить к ее возникновению. А на стадии хронической ренальной недостаточности, по мере истощения компенсаторных возможностей почек и снижения скорости клубочковой фильтрации (СКФ), частота встречаемости НАГ приближается к 100 процентам случаев, вне зависимости от первичной нозологической формы нефропатии, к ней приведшей.
А поскольку, например, у кошек нефропатии регистрируются очень часто (причем речь идет не только о возрастных животных), то ПГ может быть названа самой распространенной причиной АГ у этого вида. У собак почечная и кардиогенная гипертензии регистрируются приблизительно в одинаковом числе случаев. Первичная (эссенциальная), или, как принято говорить в ветеринарной медицине, идиопатическая, АГ у мелких домашних животных, в отличие от человека[1], встречается редко.
Осложнения ПГ (как, собственно говоря, и любой другой) проявляются, в первую очередь, в значительном увеличении риска поражения так называемых органов-мишеней – ССС, ЦНС[2], глазные яблоки. Не в последнюю очередь от повышения АД страдают и сами почки, в которых начинают развиваться необратимые процессы деструкции (повреждение фильтрационного барьера и тубулоинтерстиция, увеличение числа и размеров резидентных клеток клубочка, гломеруло- и нефросклероз) и, следовательно, прогрессирующе снижается кровоток и СКФ. Кроме того, АГ и нефропатии всегда значительно усугубляют тяжесть течения друг друга, замыкая свои патогенезы в единый порочный круг. Поэтому почки являются одномоментно и причиной развития АГ, и органом-мишенью.
Кроме того, рано или поздно нефропатии и АГ вкупе приводят к развитию сердечной дисфункции и к формированию, кроме прочего, рено-кардиального синдрома из-за патологических адаптивных процессов. На терминальной (заключительной) ХБП АГ усугубляет (особенно у кошек) тяжесть сердечной и дыхательной недостаточности, причиной которой может являться гидроторакс и/или гидроперикард.
На сегодняшний день в медицине человека убедительно доказано, что адекватная антигипертензивная терапия, начатая на доклиническом этапе почечного континуума, может значительно замедлить прогрессирование процессов ренальной деструкции. Причем чем раньше начато лечение (в идеале, например, на этапе микроальбуминурии), тем больше вероятность того, что ХПН разовьется у пациента значительно позже.
Вместе с тем на азотемическом этапе ХБП преимущества нормализации АД стремительно утрачиваются параллельно ухудшению почечных функций (что часто, хотя и не всегда, сопровождается повышением уровня азотемии у пациента).
Поэтому возможно более ранняя диагностика и лечение как АГ, так и неразрывно связанной с ней почечной дисфункции являются важными задачами клинициста. Особое значение при этом, что весьма существенно именно для ветеринарной нефрологии, придается скрининговым исследованиям[3].
Особенности лечение ПГ
Кардинальное отличие ПГ от других типов АГ состоит в том, что нормализацию уровня АД приходится проводить на фоне заболевания почек различной степени тяжести. А этот парный орган и оказывает выраженное и многофакторное влияние на оптимальный уровень АД в условиях физиологической нормы, и принимает непосредственное участие в инициации и поддержании разнообразных механизмов АГ при нефропатиях.
Кроме того, заболевания почек в большей или меньшей степени накладывают ограничения на использование различных гипотензивных препаратов, которые, особенно на клиническом этапе почечного континуума, в той или иной степени утрачивают свои гипотензивные свойства, а то и вообще приобретают выраженные нефротоксичные. Последнее обстоятельство связано с тем, что большое число ЛС либо метаболизируется в почках, либо экскретируется ими из организма в составе мочи.
Иными словами, в арсенале врача нефролога априори меньше гипотензивных препаратов (особенно когда речь идет о клиническом этапе ХБП), чем, например, у врача кардиолога (разумеется, при условии того, что у пациента здоровые почки).
Ситуация осложняется еще и тем, что терапия АГ у животных с нефропатиями должна быть направлена на полную нормализацию АД (<150/95). Поскольку только такая тактика позволяет нормализовать интраренальную гемодинамику и привести к снижению темпов прогрессирования почечной недостаточности.
В принципе для лечения ПГ у собак и кошек на доклиническом этапе могут быть пригодны все те классы препаратов, которые применяются для лечения других форм АГ. К ним относятся:
ингибиторы ангиотензин-превращающего фермента (иАПФ);
блокаторы рецепторов первого типа к ангиотензину II, или иначе, блокаторы рецепторов ангиотензина (БРА);
блокаторы медленных L-кальциевых каналов, они же блокаторы кальциевых каналов (БКК), или антагонисты кальция;
прямые ингибиторы ренина (ПИР);
α- и β-блокаторы;
прямые миолитики,
а также тиазидные и петлевые диуретики.
Но, несмотря на очень большое число ЛС, назначаемых для терапии АГ у людей, в ветеринарной медицине в целом и, особенно, в нефрологии МДЖ, в частности, на данный момент используется весьма незначительное их количество (а разработанных специально для животных гипотензивных средств сегодня не существует). По большей части, эти препараты, как и дозы их использования, когда то были произвольно предложены тем или иным ветеринарным специалистом. Так же следует признать, что не только количественное, но и качественное изучение влияния гипотензивных препаратов на АГ у МДЖ оставляет желать лучшего, хотя и открывает широкие возможности для исследователей в будущем.
Кроме того к рациональной терапии ПГ у собак и кошек на сегодняшний момент должны предъявляться особые требования, поскольку для нее необходимы ЛС или их комбинации, не только эффективно снижающие АД. Одномоментно с этим они как минимум должны иметь положительное влияние на внутрипочечную гемодинамику, а как максимум обладать еще какими-либо нефропротективными свойствами, т.е. необходимо сочетание гипотензивной и этиопатогенетической терапии. Именно такой подход к выбору терапевтических средств позволяет наиболее эффективно вмешиваться в замкнутый порочный круг патогенезов нефропатии и ПГ.
Следует учитывать, что эффект от гипотензивной/нефропротективной терапии развивается в полной мере как правило не сразу, а через 5-10 дней от её начала. Сама же терапия требует постоянного контроля, как уровня АД, так и изменений в анализах биологических жидкостей (для многих гипотензивных/нефропротективных препаратов характерны эффекты ускользания, что требует подбора новой схемы лечения).
Также необходимо обращать внимание на частоту встречаемости и значимость побочных эффектов ЛС, используемых для терапии ПГ, наличие у них нефротоксичных и гипертензивных свойств, а также на широту их терапевтического индекса. Последнее облегчает подбор корректной дозы препарата для каждого конкретного пациента.
Клинический этап почечного континуума значительно ограничивает и без того небогатый выбор терапевтических средств, используемых для контроля АГ в ветеринарной медицине, поскольку даже те из них, которые имели выраженные нефропротективные эффекты, параллельно с развитием ХПН, напротив, в большей или меньшей степени начинают приобретать нефротоксичные свойства. Также на этом этапе ХБП антигипертензивные препараты зачастую оказывают неблагоприятное влияние на интраренальный кровоток, понижая его интенсивность. Это приводит к уменьшению СКФ, которая и без того значительно снижена в результате процессов деструкции в почечной паренхиме.
Кроме того, ренальная ХПН даже средней степени тяжести может сделать непредсказуемой фармакодинамику и фармакокинетику большинства ЛС, поскольку внушительная часть из них метаболизируются в почечной паренхиме и/или экскретируются с мочой. Поэтому антигипертензивные препараты, назначаемые животным на клиническом этапе ХБП, должны иметь как минимум два пути элиминации (в противном случае из-за значительного сниженного уровня выведения неизбежно произойдет накопление лекарственных средств и/или их метаболитов в крови и тканях), а в идеале вообще покидать организм преимущественно внепочечными путями.
В связи с этим к подбору гипертензивных ЛС на клиническом этапе ХБП необходимо подходить с осторожностью (тех, которые элиминируются в основном почками, желательно избегать вообще), начиная терапию с низких доз (в среднем ¼-1/2 от минимально рекомендованной), постепенно увеличивая их до оптимального эффекта у конкретного пациента на фоне постоянного контроля общего состояния, уровня АД и диуреза, а также изменений в анализах биологических жидкостей (например, усугубление протеинурии и прогрессирующее снижение плотности мочи будет являться веским основанием для отмены гипотензивного/нефропротективного препарата). Также следует учитывать, что резкое снижение АД даже до нормы может негативно сказаться на состоянии пациента в целом и почечной функции в частности.
Также следует учитывать, что стероидные гормоны, часто и без всякого на то основания назначаемые животным на клиническом этапе ХБП, могут усугубить тяжесть НАГ, поскольку приобретают на клиническом этапе почечного континуума выраженные нефротоксичные свойства, а также усиливают задержку натрия и воды в организме (в результате гиперальдостеронемии и активизации натрий-объем-зависимых механизмов развития АГ). В полной мере сказанное относится и к нестероидным противовоспалительным препаратам.
То, как и почему большое число препаратов, используемых для лечения нефропатий и ПГ, меняют свои протективные эффекты на нефротоксические вместе с переходом почечного континуума с доклинического на клинический этап, можно проиллюстрировать следующим сравнением.
Массаж тела для большинства является хорошим средством релаксации, а также профилактики и немедикаментозной терапии целого ряда заболеваний. В некоторых культурах он длительное время вообще был единственным доступным средством лечения целого ряда патологий. Однако правда это только в том случае, если, например, пациент не склонен к тяжелому контактному аллергическому дерматиту или большая часть его тела не обожжена. Даже легкий массаж в подобной ситуации не только не облегчит состояние больного, а, напротив, наверняка приведет к тяжелым страданиям, а то и к мучительной смерти.
Протеинурия и ПГ
Протеинурия является весьма распространенным и, что особенно важно, ранним и легко выявляемым симптомом и фактором патогенеза большого числа нефропатий как гломерулярного, так и тубулоинтерстициального ряда и имеет выраженную корреляцию с такими угрожающими состояниями, как снижение СКФ, олигонефрония и развитие стойкой ПГ.
Доказано, что снижение тяжести протеинурии имеет выраженное нефропротективное действие. А ухудшение почечной функции происходит быстрее у пациентов с нефротоксичной, т.е. превышающей 0,3 г/л, протеинурией. Поэтому уменьшение уровня протеинурии на фоне использования того или иного гипотензивного/нефропротективного препарата или их сочетаний является благоприятным признаком и значительно улучшает прогноз заболевания.
Кроме того, стойкая тяжелая ренальная протеинурия требует более агрессивных терапевтических тактик, направленных на снижения уровня АГ. И чем тяжелее протеинурия у пациента, тем большего снижения уровня гипертензии (в идеале <150/95) желательно у него добиться.
Группы препаратов, используемые в лечении ПГ, и цели их применения
Ингибиторы ангиотензин-превращающего фермента (иАПФ). В основе клинических эффектов препаратов этой группы лежит их способность контролировать гиперактивность ренин-ангиотензин-альдостероновой системы (РААС) путем подавления образования АПФ (кининаза II), превращающего ангиотензин (АТ) I в АТ II, который, в свою очередь, воздействуя на свои рецепторы первого типа (АТ1), вызывает целый ряд негативных эффектов как в организме в целом, так и в почечной паренхиме в частности.
иАПФ — это, пожалуй, самый используемый и изученный класс гипотензивных средств (всего в этой группе более 30 препаратов[4]). В медицине человека доказано, что иАПФ обладают также выраженным нефропротективным действием, которое проявляется уменьшением у пациентов уровня протеинурии, замедлением прогрессирующего снижения СКФ и процессов гиперклеточности и гипертрофии резидентных клеток клубочка, а также более поздним и менее интенсивным развитием явлений гломеруло- и нефросклероза. В целом это приводит к отдалению конечных точек исследования (развитие терминальной стадии почечной недостаточности, необходимость в гемодализе, смерть пациента и т.д.).
С теоретической точки зрения, ведущим механизмом протективного действия иАПФ является снижение тонуса выносящей артериолы клубочка, что уменьшает не только интрагломерулярную гипертензию, но и патологическую гиперфильтрацию белков в первичную мочу. Последнее понижает токсическое действие протеинурии на канальцевый аппарат нефрона[5]. Также, по мнению некоторых ученых, иАПФ оказывают непосредственное влияние на фильтрационный барьер гломерулы, снижая его проницаемость для белковых молекул.
Однако под действием иАПФ тонус приносящей артериолы клубочка также снижается, что может в той или иной степени нивелировать нефропротективные свойства различных препаратов из этой группы. Ряд авторов считают, что положительное влияние на почечный кровоток иАПФ оказывают, только если удается достичь нормализации уровня АД. Кроме того, препаратами этой группы не удается полностью контролировать гиперактивность РААС, поскольку АГ II в крови, и особенно в тканях, образуется далеко не только под воздействием ангиотензин-превращающего фермента.
АТ II образуется в организме человека и животных не только с участием АПФ. Этот пептид может синтезироваться непосредственно из ангиотензиногена или из АТ I под воздействием тонина, тканевого активатора плазминогена, катепсина G, сериновых протеаз и т.д. Причем в тканях (миокардиальные интерстиции, адвентиции и медии сосудов и т.д.) даже в норме преобладают альтернативные пути образования АТ II и лишь в плазме крови — АПФ-зависимые.
В почечной паренхиме у здоровых животных, благодаря колоссальному кровоснабжению и большой массе т.н. эндотелиального дерева микрокапиллярных сетей (в эндотелии сосудов во всем организме синтез АТ IIосуществляется сбалансированно различными путями), значимыми могут считаться оба пути образования АТ II. Однако при использовании иАПФ, и особенно при их передозировке, начинают преобладать альтернативные пути, а также в разы возрастает синтез АТ II тубулярным эпителием.
В ветеринарной медицине имеются данные, что иАПФ (в частности эналаприл, беназеприл, рамиприл) также способны снижать уровень протеинурии у МДЖ. Однако, несмотря на то что, например, беназеприл показал у кошек с ХБП хорошую переносимость и достоверно снижал уровень протеинурии, он не оказал влияния на время почечного выживания (т.е. на конечные точки исследования) [25].
Еще одним негативным свойством иАПФ является их узкий терапевтический индекс. Это особенно актуально для ветеринарной медицины, поскольку значительно затрудняет подбор дозы препарата для каждого конкретного пациента, чей вес может различаться более чем в 100 раз.
К основным правилам назначения иАПФ для животных с ПГ относятся следующие:
Терапию начинают с минимальной дозы, постепенно увеличивая ее до эффективной.
На клиническом этапе почечного континуума необходимо снижение дозы иАПФ, выводящихся преимущественно почками, как минимум в два раза от минимально рекомендуемой. Препараты, элиминирующиеся из организма также и внепочечными путями (печень, ЖКТ), требуют снижения дозы только у пациентов с II-III степенями почечной недостаточности по классификации IRIS[6]. Пациентам на терминальной (IV) стадии ХБП иАПФ назначать не рекомендуется (т.к. все из них в той или иной степени выводятся из организма почками).
Необходимо регулярно контролировать функцию почек. Повышение уровня протеинурии и креатининемии более чем на 50% от исходного значения, а также усугубление протеинурии и гипостенурии требует немедленной отмены препарата (это в полной мере относится ко всем гипотензивным/нефропротективным ЛС). А поскольку иАПФ обладают выраженными калийсберегающими свойствами, необходим регулярный контроль уровня К+ .
Блокаторы рецепторов ангиотензина. Группа препаратов, также контролирующих активность РААС. В отличие от иАПФ действуют они более точечно, препятствуя взаимодействию АГ II с его рецепторами первого типа, через которые реализуются его вазоконстрикционные, пролиферативные и антидиуретические эффекты. При этом уровень АГ II в некоторых случаях даже повышается, что имеет положительный эффект, поскольку свободные молекулы этого нейрогормона более интенсивно взаимодействуют со своими рецепторами второго типа, количество которых в поврежденных тканях почки значительно возрастает. Это взаимодействие приводит в организме в целом и в почечной паренхиме в частности к такому положительному эффекту, как вазодилятация, стимулирует антипроливеративные и антигипертрофические процессы в клубочках, а также увеличивает уровень диуреза, в т.ч. за счет уменьшения синтеза и экскреции альдостерона.
БРА, как и иАПФ, оказывают положительное влияние на интраренальный кровоток и обладают выраженным нефропротективным потенциалом. В медицине человека на данный момент доказано, что БРА при ПГ превосходят по своему ренопротективному потенциалу другие антигипертензивные препараты, за исключением иАПФ. Однако очень важно, что этот эффект напрямую не зависит от снижения ими уровня системной гипертензии у пациентов. Также антигипертензивный и нефропротективный эффекты БРА возрастают при повышении дозы, что очень ценно, учитывая, что эта группа препаратов обладает широким терапевтическим индексом, а уровень вызываемых ими побочных эффектов настолько низок, что соизмерим с плацебо.
Кроме того, представитель этой группы — телмисартан выводится из организма практически на 100 процентов через печень, что позволяет использовать его у пациентов с тяжелыми степенями почечной недостаточности, на которых остальные нефропротективные и/или гипотензивные препараты (в т.ч. те из них, которые имеют двойной путь элиминации) неизбежно приобретают нефротоксичные свойства и их фармакокинетика и фармакодинамика значительно изменяется.
Уникальное сочетание терапевтических характеристик и хорошей переносимости послужило тому, что несколько лет назад на рынке ветеринарных препаратов появилось новое, содержащее 4 мг/мл телмисартана, лекарственное средство Semintra[7] [21,22]. В РФ только один препарат из группы контролирующих активность РААС зарегистрирован для ветеринарного использования. Это иАПФ рамиприл (Вазотоп), который, однако, позиционируется больше как кардио-, нежели нефропротектор. Столь скудный выбор зарегистрированных для ветеринарного использования нефропротективных препаратов, контролирующих активность РААС, указывает на недостаточное внимание к проблеме ХБП, и особенно к ее доклиническому этапу течения, на котором наиболее эффективны органопротективные стратегии.
Прямые ингибиторы ренина (ПИР). Единственным представителем этой группы препаратов является алискирен (Расилезтм, 300 мг). В продажу этот препарат поступил в 2008 году, и поэтому сведений о его нефропротективных свойствах у животных крайне мало.
Блокируя образования ренина (т.е. воздействуя на более высокие участки РААС), алискирен теоретически должен вызывать более значимую и продолжительную ее блокаду уже потому, что альтернативных путей образования АТ I из ангиотензиногена, кроме как с участием ренина, пока не выявлено[8].
В небольшом исследовании, поведенном в клинике Научно-практической ассоциации ветеринарных нефрологов и урологов в 2012-2013 гг., в котором участвовало 7 кошек и 2 собаки с хроническим гломерулонефритом (ХГН) на доклиническом этапе течения, он показал хорошую переносимость и значимо, даже в монотерапии, снижал уровень протеинурии и гипостенурии. Причем эффект сохранялся у всех животных в полном объеме спустя 3 месяца после начала терапии.
БКК. Гипотензивный эффект БКК реализуется благодаря расширению артериол и уменьшению общего периферического сосудистого сопротивления, вследствие торможения проникновения катионов кальция в клетку. Также считается доказанной способность БКК снижать выработку эндотелием сосудов эндотелина-1, обладающего в высоких физиологических концентрациях в десять раз более выраженными вазоконстрикционными свойствами, чем АГ II. БКК, помимо прочего, обладают еще и антиагрегационными свойствами.
В медицине человека БКК часто применяются в комплексной терапии АГ. Все препараты этой группы обладают приблизительно равной способностью снижать уровень АД.
Дигидропиридиновый БКК 3-го поколения — амлодипин (всего дигидропиридиновых производных на сегодняшний день насчитывается около 20) очень широко используется в ветеринарной медицине как гипотензивный препарат при лечении АГ любого генеза[9] (табл. 1-5). В ряде исследований было показано, что его использование у кошек может приводить к снижению АД на 30-50 мм рт. ст. У собак гипотензивный эффект амлодипина выражен меньше.
Однако амлодипин может усугублять интраренальную гипертензию за счет достаточно грубого и неселективного вазодилатирующего влияния на тонус как выносящей, так и приносящей артериол. Дело в том, что афферентная артериола большей части нефронов значительно шире выносящей, поэтому даже их равноценное расширение (не говоря уже о более выраженной дилатации приносящей артериолы) обычно только усугубляет нарушение почечного кровотока и обусловливает выраженное и необратимое гипертензивное повреждение фильтрационного барьера.
Этого недостатка лишен дигидропиридиновый БКК 3-го поколения лерканидипин. Этот препарат обладает не только гипотензивными, но и выраженными нефропротективными свойствами, реализуемыми за счет снижения тонуса преимущественно выносящей артериолы клубочка (что благоприятно влияет на кровоток в первичной микрокапиллярной сети почек и увеличивает СКФ), подавления пролиферации мезангиальных клеток гломерул и снижения уровня протеинурии. Препарат выводится почками и кишечником после биотрансформации.
Более выраженными нефропротективными эффектами по сравнению с дигидропириридиновыми БКК (исключая лерканидипин) обладает препарат из подгруппы фенилалкинаминов верапамил (для лечения желательно использовать только пролонгированную формы этого препарата, например Изоптин SR). Однако 100-процентная элиминация через почки ограничивает его использование в лечении ПГ у животных на клиническом этапе почечного континуума. Ограничением для использования верапамила также являются нарушения атриовентрикулярной проводимости, синдром слабости синусового узла и выраженная сердечная недостаточность.
β-адреноблокаторы. Гиперактивация симпато-адреналовой системы (САС) служит одной из причин формирования и развития стойкой ПГ. Так, например, один из механизмов, приводящих к увеличению синтеза и секреции ренина (что в конечном счете заканчивается гиперактивацией всей РААС), напрямую связан с β-адренорецепторной стимуляцией. Поэтому контроль активности САС может являться одной из стратегий в терапии ПГ.
β-адреноблокаторы — это группа ЛС, основным свойством которых является способность обратимо блокировать β-адренергические рецепторы. Блокада β1-адренорецепторов приводит по преимуществу к кардиальным эффектам: снижается число и сила сердечных сокращений (отрицательное инотропное и хронотропное действие). При блокаде β2-адренорецепторов происходит повышение тонуса артериол, бронхов и беременной матки.
β-адреноблокаторы различаются по способности одновременно блокировать β-адренергические рецепторы как первого, так и второго типа (неселективные, например пропранолол) и только первого типа (селективные, например, атенолол и метопролол). Однако следует учитывать, что селективность действия β1 -адреноблокаторов значительно уменьшается или даже исчезает с повышением дозы (а терапевтический индекс этой группы препаратов не очень широк).
Из β-адреноблокаторов в ветеринарной медицине для контроля уровня АГ и частоты и силы сердечных сокращений чаще всего назначается атенолол и пропраналол (табл. 1-5). Однако их использование (особенно такого неселективного и, кроме того, обладающего большим числом значимых побочных эффектов β-адреноблокатора как пропроналол) может негативно сказываться на внутрипочечном кровотоке и уровне СКФ из-за вызываемой ими вазоконстрикции артериол клубочка. Это существенно ограничивает их использование (тем более длительное) для контроля ПГ, особенно у пациентов на клиническом этапе ХБП.
В медицине человека доказано, что β-адреноблокаторы проявляют свое благоприятное влияние на прогноз заболевания только в том случае, если они вызывают отчетливую блокаду β-адренорецепторов. О наличии последней можно судить по степени уменьшения числа сердечных сокращений (ЧСС) от первоначально зафиксированного уровня. Также хорошо известно, что одна и та же доза β-адреноблокаторов у различных пациентов может по-разному снижать ЧСС. Поэтому рекомендуется лечить больных (что скорее всего верно и для ветеринарной медицины) не фиксированными дозами препаратов, а теми, которые вызывают у них ожидаемый и отчетливый эффект.
ЛС этой группы не являются препаратами первого выбора для лечения ПГ и назначаются только в том случае, если иАПФ, БРА, БКК или их сочетания оказались не достаточно эффективными и/или пациенту требуется лечение по поводу какой-либо сопутствующей кардиологической проблемы (например, рено-кардиального синдрома или аритмии). При этом предпочтение следует отдавать селективным β1 -адреноблокаторам.
Если есть прямые показания к назначению β-адреноблокаторов, а их прием по тем или иным причинам невозможен, то вместо них возможно назначение недигидропиридинового БКК верапамила. Механизм его действия отчасти схож с таковым у β-адреноблокатов, поэтому этот препарат называют БКК, уменьшающим ЧСС.
Определенными нефропротективными свойства в этой группе ЛС обладает селективный β1 -адреноблокатор небиволол(препарат выводится из организма приблизительно в равной степени через кишечник и почки). Он, помимо прочего, имеет выраженное сосудорасширяющее действие, которое реализуется (что особенно важно с точки зрения патогенеза большинства нефропатий) за счет активной стимуляции выработки универсального эндотелий-зависимого фактора релаксации — оксида азота.
Среди β-адреноблокатов выраженными сосудорасширяющими и нефропротективными свойствами обладает также β1-, β2-и α1-адреноблокатор карведилол. Этот препарат вызывает вазодилятацию сосудов в организме в целом (что снижает их общее периферическое сопротивление), а так же почечных артериол в частности, и тем самым увеличивает почечный кровоток и СКФ. Правда, нужно отметить, что сосудорасширяющий и нефропротективный эффект карведилола связан больше с его α1-блокирующим действием [1, 41].
Так же карведилол не обладает внутренней симпатомиметической активностью и имеет свойства стабилизатора мембран клеток. Ему так же присущи антиаритмическое, антиангиальное и антиоксидантное действия.
Кроме того, в эксперименте было показано, что карведилол угнетает высвобождение фермента ренина клетками юкстагломерулярного комплекса клубочка (за счет блокады его β-адренорецепторов) и, следовательно, уменьшает как продукцию АТ II, так и гиперактивность всей РААС в целом. Он также снижает экспрессию некоторых профибринотических факторов, например таких как трансформирующий фактор роста-β, и тем самым в конечном счете тормозит процессы гломерулосклероза.
Ценность карведилола как препарата для лечения ПГ заключатся еще и в том, что этот препарат выводиться практически полностью из организма с желчью, через ЖКТ. Это позволяет его использовать на сем протяжении почечного континуума.
Таким образом, в ветеринарной нефрологии, равно как и в кардиологии МДЖ, использование β-адреноблокатов в основном ограничивается их антиаритмическими свойствами[10]. Хотя некоторые из них потенциально имеют перспективу в будущем найти место и в лечении ПГ, поскольку потенциально обладают рядом дополнительных нефропротективных свойств.
α-адроноблокаторы. Группа препаратов, обратимо блокирующих постсинаптические α-адренорецепторы и препятствующих, таким образом, контакту с ними таких нейромедиаторов, как норадреналин и адреналин. В итоге значительно снижается объем и скорость прохождения сосудосуживающих импульсов через адренергические синапсы и происходит снижение уровня как АД, так и интраренальной гипертензии в результате расширения артериол и прекапиляров (в т.ч. и в первичной микрокапиллярной сети почек).
Препарат из этой группы — празозин рекомендован к использованию в комплексной терапии ПГ (табл. 1-5). Очевидным достоинством этого препарата с точки зрения патогенеза ХБП является преимущественная его элиминация из организма с желчью, что позволяет не снижать его дозы даже у животных с тяжелыми степенями ХПН.
В целом сведений об использовании α-адроноблокаторов для лечения ПГ у собак и кошек крайне мало. Сегодня наиболее часто их рекомендуют для лечения идиопатической и кардиогенной АГ, а также при спазме уретры и доброкачественной гиперплазии предстательной железы.
Хотя, с другой стороны, экспериментальные данные, свидетельствующие о выраженных нефропротективных свойствах карведилола, реализуемых за счет его α1 -адреноблокирующих эффектов, делают перспективным дальнейшее изучение препаратов этой группы с целью использования их в ветеринарной нефрологии.
Мочегонные средства
Некоторые диуретики, по крайней мере с теоретической точки зрения, могут обладать гипотензивными свойствами, хотя в ветеринарной медицине доказательств этому пока не получено. Поэтому ценность препаратов этой группы в комплексном лечении ПГ может сводиться к:
- нефропротекции,
- снижению объема внеклеточной жидкости и
- контролю патологического перераспределения жидкости в организме, прежде всего гидроторокса и гидроперикарда, а значит, и к профилактике или снижению выраженности сердечной и дыхательной недостаточности.
В экспериментальных и клинических исследованиях, проведенных в медицине человека, доказано, что подавляющее число диуретиков не оказывают хоть сколько-нибудь значимого нефропротективного эффекта. А использование в монотерапии некоторых из них, например гидрохлоротиазида и триамтерена, вообще приводит к снижению почечного плазмотока и СКФ, а также к усилению протеинурии и повышению уровня азотемии.
Исключение составляют только сульфонамид индапамид и петлевой диуретик торасемид.
Ряд нефропротективных свойств индапамида обусловлен сосудорасширяющим и антиагрегантным действием в первичной микрокапиллярной сети почек. Эти особенности фармакодинамики индапамида связаны с блокадой кальциевых каналов (подобно БКК) и стимуляцией калиевых, а также индукцией синтеза таких вазодилатирующих агентов, как простагландин I2 (простациклин) и простагландин Е2 (динопрост). Кроме того, индапамид уменьшает чувствительность сосудистой стенки к норадреналину и ангиотензину II, снижает общее периферическое сопротивление сосудов (ОПСС) и обладает некоторым гипотензивным эффектом.
Мочегонное действие индапамида у животных с ХПН незначительное или полностью отсутствует. Индапамид используют у собак и кошек в дозе 0,1-0,15 мг/кг один-два раза в сутки. Нефропротективный эффект развивается спустя 2-4 недели после начала терапии и проявляется в замедлении процессов фатальной репарации в почечной паренхиме, в снижении уровня протеинурии и нормализации кровяного давления.
Но так как индапамид не обладает у собак и кошек со сниженной СКФ, и тем более ХБП, диуретическими эффектами, то выбор препаратов из этой группы на клиническом этапе заболевания сводится только к торасемиду. Ему, помимо выраженных мочегонных (сохраняющихся даже при снижении СКФ более чем на 97-98% от нормы), присущи еще и свойства калийсберегающего диуретика и определенные эффекты иАПФ. Некоторой альтернативой использования торасемида может являться сочетанная терапия фуросемидом и спиронолактоном.
Соль и ПГ
Пациенты с почечной гипертензией требуют сниженного содержания поваренной соли в пище. Владельцев следует проинформировать, что скармливание животным готовых «человеческих» продуктов, зачастую содержащих повышенное количество NaCl, обычно заканчивается усугублением тяжести гипертензии из-за активации натрий-объем-зависимых механизмов. С другой стороны, полное исключение соли из рациона приводит к еще большей активации РААС (прежде всего из-за увеличения уровня ренина и альдостерона), уже и без того гиперактивированной в результате целого ряда патологических изменений как в почечной паренхиме, так и в организме в целом [13, 35].
Комбинированная терапия ПГ
В медицине человека добиться нормализации уровня АД при различных нефропатиях удается в подавляющем числе случаев, лишь используя комбинированную антигипертензивную и нефропротективную терапию. К этому же прибегают тогда, когда необходимо нивелировать побочные эффекты одного гипертензивного/нефропротективного средства с помощью другого (например назначение спиронолактона для уменьшения гиперактивации альдостероновой системы вызываемой использованием фурасемида).
Связано это с тем, что ни один из классов гипотензивных препаратов не в состоянии в монотерапии в полном объеме контролировать все тесно взаимосвязанные звенья патогенеза, задействованные в развитии и поддержании ПГ, к которым относятся прежде всего гиперактивация ренин-ангиотензиновой и симпатоадреналовой систем, а также объем-зависимые механизмы.
С общепринятой на сегодняшний момент в медицине точки зрения считается, что индивидуально подобранное сочетание двух и более препаратов для лечения АГ более эффективно, чем увеличение дозы одного гипотензивного средства и что комбинированная терапия не только весомо повышает результативность лечения (в т.ч. снижает риск развития поражения органов-мишеней), но и предупреждает или значительно отдаляет развитие «эффекта ускользания» (или толерантности) у препаратов. Также снижение дозы каждого ЛС в комплексной терапии АГ позволяет снизить количество и значимость их побочных эффектов, что, кроме прочего, повышает уровень комплаенса[11] в лечении. Хотя нужно отметить, что с точки зрения ветеринарии кошек, например, дача даже одного препарата зачастую является, с технической точки зрения, далеко не простой и травмоопасной задачей и чревата развитием хронического стресса у пациента и его хозяев, не говоря уже о двух- и более компонентной терапии. Ситуация отчасти осложняется еще и тем, что подавляющее число гипотензивных и/или нефропротективных препаратов имеет только оральные формы выпуска. Поэтому одной из актуальных задач ветеринарной фармации является создание гипотензивных/нефропротективных полипилов, используемых по принципу: одно поликомпонентное ЛС — однократная поимка пациента (или извлечение его, например, из-за стиральной машины) — однократная (желательно в течение суток) дача.
В современной ветеринарной литературе не имеется достаточного числа рекомендаций по комбинированной терапии ПГ. Из имеющихся для лечения тяжелой ПГ наиболее рациональными сочетаниями на сегодняшний день считаются: иАПФ + амлодипин и иАПФ +амлодипин + прямые миолитики (гидралазин) [13].
Однако с теоретической точки зрения все группы гипотензивных препаратов, за исключением фенилалкиламиновых БКК (верапамил) и β-блокаторов, могут сочетаться с друг другом. Поэтому изучение действия двух и более компонентной терапии ПГ у собак и кошек на сегодня является важной задачей современной ветеринарной нефрологии.
Согласно рекомендациям ведущих мировых нефрологических ассоциаций и обществ, а также Комитета США по выявлению и лечению высокого АД и Европейского общества гипертензии, препаратами первого выбора для лечения ПГ являются иАПФ или БРА. Эти препараты рационально комбинировать с БКК и диуретиками.
Сочетанная блокада РААС при помощи иАПФ и БРА является более эффективной, чем монотерапия препаратами из этих групп по отдельности. Также с теоретической точки зрения как к иАПФ, так и к БРА или их сочетаниям может быть добавлен ПИР алисирен (Расилез). Однако переносимость таких комбинаций и дозы препаратов для использования у МДЖ требуют дальнейшего изучения.
Гипотензивный эффект препаратов, контролирующих активность РААС, при ПГ может быть значительно усилен использованием БКК верапамила[12] или лерканидипина[13], а также α- и β-блокатора карвединола. Такие сочетания, по крайней мере с теоретической точки зрения, могут оказаться весьма эффективным, потому что эти препараты, как уже было сказано, также обладают самостоятельными и напрямую не зависящими от снижения уровня гипертензии антипротеинурическими и нефропротективными свойствами.
Поскольку ни одна из групп диуретиков, за исключением петлевых, не способна увеличить мочеотделение на фоне снижения СКФ (что наблюдается при большинстве нефропатий), то целесообразно в комплексной терапии ПГ использовать именно эти мочегонные средства. Препаратом первого выбора как на доклиническом, так и особенно на клиническом этапах ХБП является петлевой диуретик со свойствами калийсберегающего и иАПФ — торасемид. Очень важно, что петлевые диуретики усиливают, особенно у пациентов с азотемией, антипротеинурическое действие препаратов, контролирующих активность РААС (иАПФ, БРА и прямых ингибиторов ренина). Связано это с тем, что под их влиянием ПГ становится ренин-зависимой и, следовательно, более чувствительной к действию препаратов данных групп.
Комбинированная терапия ПГ требует, во избежание развития тяжелой гипотонии, тщательного мониторинга АД и экскреторной функции почек. Это связано с тем, что даже непродолжительное снижение АД ниже уровня, контролируемого механизмами ауторегуляции почечного кровотока (систолическое давление < 70 мм рт. ст.), может привести к необратимым структурным изменениям в почечной паренхиме и значимо усугубить тяжесть течения как нефропатии, так и впоследствии ПГ.
Заключение
В заключение следует отметить, что поскольку все ЛС, назначаемые для контроля ПГ у собак и кошек, как и цели их применения, заимствованы из медицины человека, а дозы их использования для животных первоначально эмпирически подобраны тем или иным ветеринарным экспертом (врачом), то целесообразно не зацикливаться на уже имеющихся схемах лечения, а регулярно анализировать достижения нефрологии человека и свойства новых нефропротективных и гипотензивных препаратов, используемых в ней[14], с целью внедрения в ветеринарную практику (а такие, хоть и не многочисленные, примеры имеются, взять хотя бы БРА телмисатран). Поскольку только такой подход позволит достичь новых успехов в лечении такой сложной и многофакторной проблемы у собак и кошек, как ПГ.
Таблица 1. Оральные препараты для антигипертензивной терапии у собак и кошек (С — собаки, К — кошки) [42]
Класс препаратов |
лекарственный препарат (действующее вещество) |
стандартная оральная доза |
иАПФ/БРА: |
||
Ингибиторы ангиотензин превращающего фермента |
Беназеприл |
С: 0,5-2,0 мг/кг каждые 12 ч К: 0,5-2,0 мг/кг каждые 24 ч |
Эналаприл |
С: 0,5-2,0 мг/кг каждые 12 ч К: 0,5-2,0 мг/кг каждые 24 ч |
|
Рамиприл |
С / К: 0,25-1,0 мг/кг каждые 24 ч |
|
Имидаприл |
С / К: 0,25-1,0 мг/кг каждые 24 ч |
|
Блокаторы рецепторов ангиотензина |
Лозартан[15] |
С: 0,5-1,0 мг/кг каждые 24 ч |
Ирбесартан |
С: 1-5 мг/кг каждые 12-24 ч |
|
БКК: |
||
Блокаторы кальциевых каналов |
Амлодипин |
С / К: 0,1-0,75 мг/кг каждые 24 ч |
Другие препараты: |
||
β- блокаторы |
Атенолол |
С: 0,25-1,0 мг/кг каждые 12 ч К: 6,25-12,5 мг на кошку каждые 12 ч |
Блокаторы рецепторов альдостерона (калийсберегающие диуретики-Р.Л.) |
Спиронолактон |
С / К: 1,0-2,0 мг/кг каждые 12-24 ч |
α- блокаторы |
Празозин |
С: 0,5-2 мг/кг каждые 8-12 ч К: 0,25-0,5 мг на кошку каждые 24 ч |
Феноксибензамин |
С: 0,25 мг/кг каждые8-12 ч или 0,5 мг/кг каждые 24 ч К: 2,5 мг/кг каждые 8-12 ч или 5 мг на кошку каждые 24 ч |
|
Прямые миолитики |
Гидралазин |
С: 0,5-2 мг/кг каждые 12 ч (начиная с нижней дозы, постепенно увеличивая до верхней). К: 2,5 мг/кошку каждые 12-24 ч |
Ацепромазин (Ветранквил, Неуротранк) |
С /К: 0,5-2 мг/кг каждые 8 ч |
|
Диуретики: |
||
Тиазидные диуретики |
Гидрохлортиазид |
С /К: 2-4 мг/кг каждые12-24 ч |
Петлевые диуретики |
Фуросемид |
С /К: 1-4 мг/кг каждые 8-24 ч |
Таблица 2. Оральные препараты для повседневной антигипертензивной терапии [2]
Класс препаратов |
Препарат (действующее вещество и пример торгового названия) |
Обычная оральная доза |
Ингибиторы ангиотензин превращающего фермента |
Беназеприл (Lotensin, Fortekor) |
С: 0,5 мг/кг каждые 12-24 ч К: 0.5 мг/кг каждые 12 ч |
Эналаприл (Vasotec; Enacard) |
С: 0,5 мг/кг каждые 12-24 ч К: 0,5 мг/кг каждые 24 часа |
|
Блокаторы кальциевых каналов |
Амлодипин (Norvasc) |
С / К: 0,1-0,25 мг/кг каждые 24 часа (до 0,5 мг/кг у кошек) |
α1 - блокаторы |
Празозин (Minipress) |
С: 0,5-2,0 мг/кг каждые 8-12 ч К: 0,25-0,5 мг на кошку каждые 24 часа |
Феноксибензамин (Dibenzyline) |
С: 0,25 мг/кг каждые 8-12 ч или 0,5 мг/кг каждые 24 часа К: 2,5 мг на кошку каждые 8-12 ч или 0,5 мг на кошку каждые 24 часа |
|
Ацепромазин[16] (PromAce) |
С /:К 0,5-2,0 мг/кг каждые 8 ч |
|
Прямые миолитики |
Гидралазин (Apresoline) |
С: 0,5-2,0 мг/кг каждые 12 ч (начиная с нижней границы дозы) К: 2,5 мг на кошку каждые 12-24 ч |
Блокаторы рецепторов альдостерона (калийсберегающие диуретики) |
Спиронолактон (Aldactone) |
С /К: 1,0-2,0 мг/кг каждые 12 ч |
β- блокаторы |
Пропранолол (Inderal) |
С: 0,2-1,0 мг/кг каждые 8 ч (необходимо титровать эффект) К: 2,5-5 мг на кошку каждые 8 ч |
Атенолол (Tenormin) |
С: 0,25-1,0 мг/кг каждые 12 ч К: 6,25-12,5 мг на кошку каждые 12 ч |
|
Тиазидные диуретики |
Гидрохлортиазид (HydroDiuril) |
С /К: 2-4 мг/кг каждые 12-24ч |
Петлевые диуретики |
Фуросемид (Lasix) |
С /К: 1-4 мг/кг каждые 8-24 ч |
Таблица 3. Препараты, используемые для лечения гипертонических кризов (экстренная терапия (С — собаки, К — кошки)) [2]
Класс препаратов
|
Лекарственный препарат (и пример торгового названия) |
Обычная доза и способ введения |
иАПФ |
Эналаприлат (Вазотек в/в[17]) |
0,2 мг/кг в/в, повторять при необходимости каждые 1-2 часа (С/К) |
β-блокаторы |
Эсмолол (Бревиблок) |
50-75 мкг[18]/кг/минуту в/в с постоянной скоростью (С) (Действие препарата прекращается через 10-15 мин. после окончания инфузии Р.Л.) |
Блокаторы кальциевых каналов |
Амлодипин (Норваск) |
0,25-0,5 мг/кг орально каждые 24 часа (С/К)
|
Прямые миолитики |
Гидралазин (Апресолин) |
0,2 мг/кг в/в или в/м, повторяя каждые 2 часа при необходимости (С/К) |
Прямые вазодилататоры[19] |
Нитропруссид (Nipride, Nitropress) |
1 мкг /кг/минуту в/в с постоянным постепенным увеличением на 1 мкг/кг/минуту каждые 5 минут до достижения дозы 10 мкг/кг/минуту (С) |
Смешанные адреноблокаторы (преимущественно бета)
|
Лабеталол[20](Trandate) |
0,25мг/кг в/в каждые 2 минуты до достижения дозы 3,75 мг/кг в течение первого часа, затем введение продолжить капельно со скоростью 25 мкг/кг/минуту (С) |
Таблица 4. Оральные гипотензивные препараты, используемые в ветеринарной медицине [10]
Препарат |
Доза для кошек |
Доза для собак |
Эналаприл[21] |
0,25-0,5 мг/кг внутрь дважды в сутки |
Такая же |
Беназеприл[22] |
0,25-0,5 мг/кг внутрь один раз в сутки |
Такая же |
Рамиприл |
0,125 мг/кг внутрь один раз в сутки |
0,125-0,25 мг/кг один раз в сутки |
Амлодипин |
0,625-1,25 мг/кошку в день (0,13-0,3 мг/кг в один раз в сутки) |
0,05-0,4 мг/кг внутрь один раз в сутки |
Атенолол |
2 мг/кг внутрь один-два раз в сутки (6,25-12,5 мг/кошку внутрь два раза в сутки) |
0,25-1,0 мг/кг внутрь дважды в сутки |
Ацепромазин (вет.: Ветранквил, Неуротранк Р.Л.) |
0,05-0,1 мг/кг в/в, п/к |
Такая же |
Гидралазин |
2,5-5,0 мг/кошку внутрь дважды в сутки (приблизительно 0,5-0,8 мг/кг) |
0,5-3 мг/кг внутрь дважды в сутки |
Феноксибензамин |
0,25-0,5 мг/кг внутрь дважды в сутки |
0,25-1,5 мг/кг внутрь каждые 8-12 ч |
Празозин |
Не используется |
0,5-2 мг/собаку внутрь два-три раза в сутки |
Таблица 5. Лекарственные средства, обычно используемые для лечения гипертензии у собак и кошек[23] (С — собаки, К — кошки) [13]
Препарат |
Показания |
Механизм действия |
Дозы |
Комментарии |
Ацепромазин малеат |
Острая гипертензия |
Вазоконстрикция, обусловленная блокадой рецепторов симпатической нервной системы |
С/К: 0,02-0,05 мг/кг начиная с минимальной дозы постоянно отслеживая эффект |
С осторожность у пациентов тяжелыми нефропатиями и у возрастных животных |
Амлодипин |
Хроническая гипертензия |
Прямая вазодилятация (длительное действие) |
С/К: 0,05-0,2 мг/кг внутрь каждые 24 ч |
В монотерапии или в сочетано с другими антигипертензивными препаратами |
иАПФ: • Беназеприл • Эналаприл малеат |
Хроническая гипертензия Протеинурические заболевания почек |
Снижение образования AT-II: • Снижение вазоконстрикции обусловленной действием AT-ll • Снижение стимуляции симпатической нервной системы • Снижение образования альдостерона (снижение задержки соли и воды) |
Беназеприл: С/К: 0,25-0,5 мг/кг внутрь каждые 12-24 ч Эналаприл малеат: С: 0,5 мг/кг внутрь каждые 12-24 ч К: 0,25-0,5 мг/кг внутрь каждые 24 ч |
У кошек приводит к незначительному снижению уровня АГ |
β-адреноблокаторы: • Атенолол • Пропранолол |
Хроническая гипертензия |
Блокада выработки ренина, обусловленная активацией симпатической нервной системы (β- адренорецепторов юкстагломерулярного аппарата клубочка) Снижение частоты и силы сердечных сокращений Активация центральных гипотензивных механизмов |
Атенолол: С: 0,25-1,0 мг/кг внутрь каждые 12 ч (начиная с низкой дозы постепенно её повышая) К: 6,25-12,5 мг внутрь каждые 24 ч Пропраналол: С: 0,2-1,0 мг/кг внутрь каждые 8 ч К: 2,5-5,0 мг внутрь каждые 8-12 ч |
В качестве дополнения к другим гипотензивным препаратам |
Гидралазин гидрохлорид |
Острая гипертензия Хроническая гипертензия |
Прямая вазодилятация |
С/К: 0,5- мг/кг внутрь каждые 12 ч, начиная с низкой дозы, постоянно титруя эффект |
Тщательный мониторинг эффекта при использовании с другими препаратами |
Нитропруссид |
Острая гипертензия |
Прямая вазодилятация |
С/К: 0,5-5,0 пг/кг/мин непрерывная инфузия, начиная с низкой дозы, с последующим постепенным её повышением под постоянным контролем уровня АД |
Во время лечения препаратом требуется инвазивный контроль АД |
Литература
Abraham WT. Diabetes, Hypertension,and Renal Insufficiency in Post-Myocardial Infarction Cardiovascular Risk. Rev Cardiovasc Med 2003; 4 (suppl. 3):S30.
vbps-online.org.
Scott Brown, 2011; Bartges Joe, Polzin David J. Nephrology and Urology of Small Animals. WILEY- BLACKWELL/ A John Wiley & Sons, Ltd., Publication, 2011
Belew, A.M., T. Barlett, etal. (1999). Evaluation of the white-coat effect in cats. J Vet Intern Med 13: 134-142.
Bodey, A.R. and A.R. Michell (1996). Epidemiological study of blood pressure in domestic dogs. / Small Anim Pract 37: 116-125.
Brown, C.A., J.S. Munday, et al. (2005). Hypertensive encephalopathy in cats with reduced renal function. Vet Pathol 42: 642-649.
Brown, S., C. Atkins, et al. (2007). Guidelines for the identification, evaluation, and management of systemic hypertension in dogs and cats. J Vet Intern Med 21: 542—558.
Brown, S.A., D.R. Finco, et al. (2003). Evaluation of the effects of inhibition of angiotensin converting enzyme with enalapril in dogs with induced chronic renal insufficiency. Am J Vet Res 64: 321-327.
Buranakarl, C., S. Mathur, et al. (2004). Effects of dietary sodium chloride intake on renal function and blood pressure in cats with normal and reduced renal function. Am J Vet Res 65: 620-627.
Carr A.P., Duke T. Blood Pressure in Small Animals - Part I: Hypertension and hypotension and an update on technology; Part II: Hypertension - Target organ damage, Heart and Kidney; Part III: Hypertension - Target organ damage, eyes and the CNS - Diagnosis and treatment considerations. The European Journal of Companion Animal Practice (EJCAP) Volume 18, 19, 20-
Chetboul, V., H.R Lefebvre, et al. (2003). Spontaneous feline hypertension: clinical and echocardiographic abnormalities, and survival rate. J Vet Intern Med 17: 89-95.
Dagmara Hering et al. Renal Denervation in Moderate to Severe CKD. JASNMay 17, 2012
Elliott Jonathan, Gregory F. Grauer. BSAVA Manual of Canine and Feline Nephrology and Urology/ Second edition, 2013.
Elliott, J. and A.D.J. Watson (2009). Chronic kidney disease: staging and management. In: Current Veterinary Therapy XIV, edited by J.D. Bonagura and D.C. Twedt. St. Louis, MO: Elsevier Saunders, pp. 883-892.
Elliott, J., P.J. Barber, et al. (2001). Feline hypertension: clinical findings and response to antihypertensive treatment in 30 cases. J Small Anim Pract 42: 122-129.
Finco, D.R. (2004). Association of systemic hypertension with renal injury in dogs with induced renal failure. VetlntMed 18: 289-294.
Goy-Thollot, I., D. PeChereau, et al. (2002). Investigation of the role of aldosterone in hypertension associated with spontaneous pituitary- dependent hyperadrenocorticism in dogs. J Small Anim Pract 43: 489-492.
Grauer, G., D. Greco, et al. (2000). Effects of enalapril treatment versus placebo as a treatment for canine idiopathic glomerulonephritis. / Vet Intern Med 14: 526-533.
Greco, D.S., G.E. Lees, et al. (1994). Effects of dietary sodium intake on blood pressure measurements in partially nephrectomized dogs. Am J Vet Res 55: 160-165.
Hansen, B., S.P. DiBartola, et al. (1992). Clinical and metabolic findings in dogs with chronic renal failure fed two diets. Am J Vet Res 53: 326-334.
http://www.semintra.co.uk;
http://www.drugs.com/vet/semintra-oral-solution-4-mg-ml-can.html
Jacob, F., D.J. Polzin, et al. (2003). Association between initial systolic blood pressure and risk of developing a uremic crisis or of dying in dogs with chronic renal failure. J Am Vet Med Assoc 222: 322- 329.
Jepson, R.E., J. Elliott, et al. (2007). Effect of control of systolic blood pressure on survival in cats with systemic hypertension. J Vet Intern Med 21:402-409.
Jonathan N. King, Danielle A. Gunn-Moore, Séverine Tasker, Allison Gleadhill, and Günther Strehlau, and The BENRIC (BENazepril in Renal Insufficiency in Cats) Study Group. Tolerability and efficacy of benazepril in cats with chronic kidney disease). Journal of Veterinary Internal Medicine, pp. 1054–1064, Volume 20, Issue 5 (September 2006
King, J.N., D.A. Gunn-Moore, et al. (2006). Tolerability and efficacy of benazepril in cats with chronic kidney disease. J Vet Intern Med 20: 1054-1064.
Kirk, C.A., D.E. Jewell, et al. (2006). Effects of sodium chloride on selected parameters in cats. Vet Ther7: 333-346
Lesser, М., R. Fox, et al. (1992). Assessment of hypertension in 40 cats with left ventricular hypertrophy by Doppler-shift sphygmo- manometry. J Small Anim РгасЗЗ: 55-58.
Littman, M.P. (1994). Spontaneous systemic hypertension in 24 cats. J Vet Intern Med 8: 79-86.
Littman, M.P., J.L. Robertson, et al. (1988). Spontaneous systemic hypertension in dogs: five cases (1981-1983). / Am Vet Med Assoc 193: 486-494.
Maggio, F., T.C. DeFrancesco, et al. (2000). Ocular lesions associated with systemic hypertension in cats: 69 cases (1985-1998). J Am Vet Med Assoc 217: 695-702.
Mathur, S., H. Syme, et al. (2002). Effects of the calcium channel antagonist amlodipine in cats with surgically induced hypertensive renal insufficiency. Am J Vet Res 63: 833-839.
Ortega, T.M., E.C. Feldman, et al. (1996). Systemic arterial blood pressure and urine protein/creatinine ratio in dogs with hyperadrenocorticism. / Am Vet Med Assoc 209: 1724-1729.
Rosanne E. Jepson, Jonathan Elliott, David Brodbelt, and Harriet M. Syme. Effect of Control of Systolic Blood Pressure on Survival in Cats with Systemic Hypertension. Journal of Veterinary Internal Medicine, Article: pp. 402–409 | Abstract, Volume 21, Issue 3 (May 2007).
Scott A. Brown. Salt, hypertension and chronic kidney. Veterinary Focus. Vol 17 No 1, 2007
Bagley, R.S. (2003). The brain as a target organ. In: Essential Facts of Blood Pressure in Dogs and Cats, edited by B. Egner, A. Carr, and S. Brown. Babenhausen, Gefmany: Vet Verlag, pp. 129-139.
Snyder, P.S., D. Sadek, et al. (2001). Effect of amlodipine on echocardiographic variables in cats with systemic hypertension. J Vet Intern Med 15: 52-56.
Stiles, J., D.J. Polzin, et al. (1994). The prevalence of retinopathy in cats with systemic hypertension and chronic renal failure or hyperthyroidism. J Am Anim Hosp Assoc 30: 564-572.
Syme, H.M., P.J. Barer, et al. (2002). Prevalence of systolic hypertension in cats with chronic renal failure at initial evaluation. / Am Vet Med Assoc 220: 1799-1804.
Syme, H.M., P.J. Markwell, et al. (2006). Survival of cats with naturally occurring chronic renal failure is related to severity of proteinuria. J VetlntMed 20: 528-535.
Wong VY, Laping NJ, Nelson AH, et al. Renoprotective effects of carvedilol in hypertensive-stroke prone rats may involve inhibition of TGF beta expression. Br J Pharmacol 2001;134:977-84.
iris-kidney.com
[1] Более чем у 95% больных людей с АГ не удается выявить ее причину. Однако среди вторичных АГ нефрогенная АГ и у человека занимает первое место по частоте встречаемости.
[2] Сердечно-сосудистая система, центральная нервная система.
[3] Скрининг — стратегия в ветеринарной медицине, направленная на выявление патологий у клинически здоровых животных.
[4] Имеются в виду действующие вещества. Торговых названий ЛС, содержащих иАПФ, во много раз больше.
[5] А по современным представлениям именно канальцевой дисфункции принадлежит ведущая роль в прогрессировании ренальной недостаточности не только при первично тубуло-интерстициальных, но и при гломерулярных заболеваниях.
[6] http://iris-kidney.com
[7] В РФ препарат пока не зарегистрирован и отсутствует в свободной продаже.
[8] Это, однако, не означает, что образование АТ II в организме прекращается под воздействием ПИР, поскольку этот нейрогормон может синтезироваться из ангиотензиногена печени напрямую различными т.н. альтернативными путями.
[9] Следует учитывать, что возрастным животным амлодипин необходимо назначать в более низких дозах, учитывая снижение его метаболизма в печени.
[10] Имеющиеся на сегодняшний день данные о влиянии β-адреноблокатов на выживаемость МДЖ с хронической сердечной недостаточностью не позволяют рекомендовать их для терапии (тем более длительной) этой группы патологий. Связано это с тем, что основное место приложения их действия в медицине человека – терапия эссенциальной гипертензии и атеросклероза, которые не являются актуальными проблемами для медицины МДЖ.
[11] Комплаенс — это добровольное следование пациентом или его владельцем предписанному врачом режиму лечения.
[12] Однако следует учитывать, что фенилалкинамин верапамил не сочетаются с бета-блокаторами из-за взаимного усиления побочных эффектов.
[13] В медицине человека способность самостоятельно снижать альбуминурию наравне с иАПФ в настоящее время не доказана ни для каких дигидропиридиновых БКК, кроме лерканидипина.
[14] Тем более что все новинки фармакологии первоначально тестируются на различных животных.
[15] Лозартан это пролекарство. А по недавно полученным данным его использование у собак не рационально, поскольку у этого вида животных в организме не образуются активные метаболиты этого БРА.
[16] Не совсем понятно, почему авторы сайта www.iris-kidney.com и книги Nephrology and Urology of Small Animals относят ацепромазин к прямым миолитикам и к α1-блокаторам соответственно. Этот широко используемый для седации животных препарат из группы фенотиазинов скорее находится в промежутке между транквилизаторами и нейролептиками.
[17] В России инъекционная форма эналаприлата (вещество, метаболизирующееся в организме из эналаприла) выпускается под торговым названием Энап Р 1,25 мг/мл по 1 мл.
[18] 1 миллиграмм [мг] = 1000 микрограмм [мкг].
[19] В отечественной классификации и гидралазин и нитропруссид отнесены к прямым миолитикам, хотя механизм их вазодилатирующего действия различен.
[20] На территории РФ на данный момент не зарегистрирован. В качестве альтернативы можно использовать карведилол (α1 и β1 и β2 адреноблокатор). Последний, однако, не имеет инъекционной формы.
[21] Некоторые авторы предлагают более высокие дозы у собак – до 3,00 мг/кг два раза в день и, напротив, более низкую дозу для кошек.
[22] Некоторые авторы предлагают более высокую дозу для кошек – до 1,0 мг/кг.
[23] Авторы подчеркивают, что данные в таблице дозы препаратов приблизительны и могут быть скорректированы проводящим лечение клиницистом в зависимости от конкретных потребностей пациента.
Леонард Роман Александрович
Кальций-фосфорный дисбаланс и его последствия при ХБП у собак и кошек
Автор: к.в.н. Роман-А. Леонард, практикующий ветеринарный врач, руководитель Центра ветеринарной нефрологии и урологии, президент Российской Научно-практической Ассоциации Ветеринарных Нефрологов и Урологов (НАВНУ)
Введение
Хроническая болезнь почек (ХБП) является неизлечимым многофакторным заболеванием, неуклонно прогрессирующим параллельно необратимым процессам деструкции в почечной паренхиме и снижению числа их форменных элементов. А колоссальный компенсаторный резерв этого парного органа является причиной того, что внешние проявления неблагополучия возникают только тогда, когда из процессов мочеобразования, равно как и других разнообразных эндокринных, экзокринных и метаболических функций, оказываются исключенными более чем 3/4 нефронов (итогом этого является клинический этап почечного континуума[1]).
И как это ни прискорбно, но диагностика ХБП сегодня осуществляется ветеринарными врачами во всем мире чаще всего лишь в безапелляционной привязке к повышению уровня азотемии. В то время как такой ценнейший метод диагностики нефропатии (прежде всего ранней), как исследование мочи, не проводится вовсе, его результаты остаются без должного внимания или оказываются интерпретированы неверно[2].
Это тем более удивительно, притом что уже сегодня в практику ветеринарной медицины начинают внедряться методы, позволяющие диагностировать нефропатии на очень ранних стадиях, когда значимые патологические изменения отсутствуют даже в анализах мочи. Одним из таких методов является определение уровня цистатина С. Этот белок, продуцируемый ядерным аппаратом большинства клеток, выводится из организма исключительно почками, уровень его образования постоянен у каждого пациента во времени и не зависит от пола, массы тела, физической активности, рациона и наличия воспалительных реакций у животного (этой зависимостью очень сильно «грешит» креатинин). Наравне с инулином определение скорости клубочковой фильтрации (СКФ) по уровню цистатина С сегодня считается «золотым» стандартом в определении этого самого точного теста, оценивающего функциональное состояние почек.
Но, возвращаясь к азотемии, следует отметить, что на сегодняшний день такая отрасль науки, как фундаментальная нефрология (а она, что вполне естественно, не имеет четкого разграничения на ветеринарную и «человеческую», поскольку, с одной стороны, строение и функции почек у млекопитающих (за исключением, пожалуй, морских) практически на 100% идентичны[3], а с другой — исследования, проводимые в ее рамках, неразрывно связаны с лабораторными животными, в т.ч. и кошками[4]), не имеет однозначных свидетельств тому, что именно мочевина и креатинин действительно являются ведущими уремическими токсинами (признание этих веществ таковыми скорее всего обусловлено лишь данью моде, берущей свое начало чуть ли не с XIX века).
В качестве некоторых оснований для этого утверждения можно привести следующие факты:
— экзогенное введение мочевины и/или креатинина даже в течение длительного времени не приводит к появлению признаков почечной недостаточности у собак и кошек, это раз;
— верхним пределом нормы уровня креатинина для борзых и гончих собак, активно использующихся в работе, является 220 ммоль/л (а это третья степень почечной недостаточности, по классификации IRIS[5], отнесенная авторами к патологии, характеризующейся разнообразными клиническими проявлениями), это два;
— в практике большинства опытных ветеринарных терапевтов были и/или есть пациенты, у которых уровень креатинина в 4-5 и более раз превышает верхнюю границу нормы для вида, по классификации IRIS, что, однако, непропорционально мало сказывается на общем самочувствии животного, а сама «патология» обычно выявляется как случайная находка при обследованиях, проводимых по другим поводам, это три;
— и наконец, животное, прежде всего небольшого размера, может даже умереть от последствий тяжелой ренальной недостаточности (доказанной впоследствии гистоморфологически) с вполне нормальным прижизненным уровнем азотемии накануне смерти (уровень креатинина скорее всего и в этом случае повысился, например, в пять раз от исходного значения, что, однако, не помешало этому показателю оставаться в пределах формальной нормы по классификации IRIS: 20 ммоль/л*5=100 ммоль/л).
Некоторым оправданием может быть только то, что мочевина и креатинин могут в определенных случаях быть маркерами (но не факторами патогенеза) почечной дисфункции и их накопление в организме часто, хотя и не всегда, идет параллельно с увеличением количества и/или изменением силы рецепторных взаимодействий других, действительно значимых, уремических токсинов.
На клиническом этапе почечного континуума врачу приходится сталкиваться с целым рядом серьезных и практически неразрешимых проблем, связанных как с многообразием и разнонаправленностью клинических проявлений, так и с невозможностью использовать большинство лекарственных средств (в т.ч. многих нефропротективных) по причине изменения их фармакодинамики и фармакокинетики (а почки экскретируют и/или метаболизируют большинство препаратов). Кроме того, происходит неминуемое увеличение нефротоксичности даже у тех препаратов, которые способны проявлять определенные нефропротективные свойства у животных на доклиническом этапе ХБП (например, иАПФ, БКК и большинство БРА[6]). Следует констатировать, что лечение ХБП у собак и кошек на клиническом ее этапе, особенно в нынешней, сугубо азотемической, концепции ХБП, сводится сегодня только к симптоматической и заместительной терапии, эффективность которой высокой быть не может уже по своему определению, а прогноз заболевания стремительно переходит в разряд неблагоприятных. Мало того, поддержание высокого качества жизни пациентов (опять же в рамках азотемической модели) на клиническом этапе ХБП, даже несмотря на значительные затраты времени и материальных средств со стороны врачей и хозяев животных, становится практически неразрешимой задачей.
Некоторые незначительные успехи достигнуты современной ветеринарной нефрологией лишь в области борьбы с почечной гипертензией (хотя и тут все далеко не однозначно, поскольку большинство гипотензивных средств на клиническом этапе почечного континуума приобретают те или иные нефротоксичные свойства) и анемией (что случилось после внедрения в практику такого стимулятора гемопэза, как дардэпоэтин альфа, Аранесп[7]).
Также определенные положительные сдвиги возникли и в борьбе с гиперфосфатемией. Однако и фосфат-байндеры (например, Ренал Кандиоли, Ипакитине (содержащие карбонат кальция и хитозан), и временно снятый с производства Ренальцин[8] (содержит карбонат лантана), и специализированные диетические продукты, использующиеся для этого, назначаются обычно на клиническом этапе почечного континуума, т.е. ровно тогда, когда эффективность их применения начинает стремительно снижаться вместе с ухудшением почечной функции. В борьбе же с азотемией успехов за последние два десятилетия достигнуто не было (да и следует признать, что бороться с ветряными мельницами дело уже изначально неблагодарное).
Тем важнее становится анализ современных достижений фундаментальной нефрологии и клинической (прикладной) нефрологии человека, позволяющих переориентировать вектор диагностики на новые, куда более значимые проблемы в патогенезе ХБП, и прежде всего на такие, как минерально-костные нарушения. Причем не следует думать, что речь в данном случае идет только о патологических изменениях в скелете. Жертвой этих нарушений оказываются в той или иной степени все ткани и органы пациентов (включая ЦНС), и именно с минерально-костными нарушениями на сегодняшний день связывают большинство клинических проявлений заключительных этапов ХБП.
Минерально-костный синдром (МКС) при ХБП
Понятие МКС, как одного из значимых осложнений в течении ХБП у человека, было предложено и введено в широкую практику KDIGO (Kidney Disease Improving Global Outcomes[9]) в 2006 году.
Следующими выраженными в той или иной степени у каждого конкретного пациента, но, бесспорно, взаимосвязанными проявлениями этой патологии являются:
— изменение концентраций фосфора и кальция (и в меньшей степени магния) в крови, а также их нормального соотношения и локализации в клетках и тканях (это, помимо прочего, приводит у человека к таким тяжелейшим последствиям, как кальциноз сосудов и мягких тканей; однако выраженность и значимость этих процессов для собак и кошек с ХБП оценить пока довольно сложно, поскольку такие исходы этого процесса, как инсульты и инфаркты, у собак и кошек в принципе встречаются крайне редко);
— повышение уровня паратиреоидного гормона (ПТГ) (МКС, обычно характеризующийся тяжелым неконтролируемым вторичным и третичным (нодулярным[10]) гиперпаратиреозом) — это наиболее значимый и распространенный вариант течения этой патологии у кошек и собак);
— снижение синтеза активной формы витамина D3 (D-гормон, или кальцитриол, — гормон стероидной природы, по традиции относимый к жирорастворимым витаминам);
— тяжелое нарушение обменных процессов и минерализации костной ткани, приводящее к таким ренальным остеопатиям, как фиброзный остеит, адинамическая костная болезнь, остеомаляция с низким костным обменом, остеопороз, а также сочетание этих патологий; эти аномалии чреваты прежде всего не только множественными патологическими переломами костей, но и развитием тяжелого и плохо контролируемого костного болевого синдрома, неизбежно заканчивающегося хроническим стрессом, который, в свою очередь, особенно у кошек, может свести на нет все усилия врачей и владельцев и привести к быстрой гибели пациента.
Этиопатогенез МКС при ХБП
В норме в регуляции обмена кальция и фосфора в организме млекопитающих принимают участие почки, костная система и тонкий отдел кишечника. Хорошо известно, что эти органы являются мишенями для активного воздействия таких гормонов, как ПТГ, его функционального антагониста кальцитонина (КТ), а также кальцитриола.
Так, воздействуя на почки, ПТГ:
— стимулирует процессы 1α-гидроксилирования в эпителиоцитах проксимальных участков канальцев, что приводит к повышению синтеза кальцитриола (другие, так называемые неактивные формы витамина D, не имеют биологической активности), что в свою очередь ведет к увеличению всасывания кальция, и в меньшей степени фосфора, из пищи в кишечнике;
— снижает выведение кальция из организма с мочой за счет стимуляции его реабсорбции в канальцах;
— оказывает выраженный фосфатурический эффект.
Воздействие ПТГ на костную систему в норме обуславливает ее обновление, а при резком снижении уровня сывороточного кальция приводит к быстрому высвобождению этого катиона (а также фосфора и бикарбоната) в кровяное русло из остеобластов и остеоцитов и опосредованно через стимуляцию выработки некоторых цитокинов, остеокластов[11]. Также ПТГ стимулирует процессы всасывания кальция из кишечника — как прямо, так и опосредованно, через стимуляцию синтеза кальцитриола.
При ХБП изменениям подвергаются все участки фосфорно-кальциевого гомеостаза. Причем первые патологические изменения появляются задолго до клинического этапа ХБП.
Этиопатогенетическими механизмами развития МКС при ХБП считаются:
— снижение синтеза активной формы витамина D3;
— гипокальциемия (как относительная, связанная с патологическим интра- и экстрацеллюлярным перераспределением ионизированного кальция, так и абсолютная, обусловленная общим снижением связанного с белками плазмы, депонированного в костной ткани и ионизированного свободного кальция[12] в организме; даже транзиторная гипокальциемия практически мгновенно приводит к активации кальциевых рецепторов (CaR) на клетках паращитовидной железы, и продукция ПТГ резко возрастает[13]);
— снижение экскреции почками фосфора;
— неадекватно высокая реакция костной ткани на действие ПТГ на доклинических и ранних клинических этапах ХБП, приводящая к интенсивному высвобождению из костной ткани не только кальция, но и фосфора (на клиническом этапе, напротив, костная ткань неадекватно слабо реагирует на действие ПТГ, что весомо увеличивает синтез и силу рецепторных взаимодействий этого гормона, переводя его в разряд уремических токсинов (доза-зависимый эффект в этом случае выражен весьма значительно).
Однако ведущий механизм развития гиперфосфатемии при ХБП связан со значительным снижением СКФ у пациентов, тяжелым поражением канальцевого аппарата еще функционирующих нефронов (а канальцевые дисфункции всегда усугубляют гломерулярные и наоборот, поскольку нефрон-структура и физиологически, и отчасти даже анатомически замкнутая[14]) и неспособностью по этой причине почек выводить из организма фосфор в составе мочи в необходимом для поддержания гомеостаза объеме.
Перечисленные факторы являются ответственными за необратимые процессы гиперплазии паращитовидной железы и прогрессирующее увеличение уровня ПТГ в организме.
Определенным стимулирующим действием на продукцию ПТГ обладает и выраженное интрагломерулярное снижение уровня магния.
В отличие от креатинина, который при повышении его уровня в крови начинает интенсивно и в большом объеме элиминироваться из организма через желудочно-кишечный тракт (это является одной из многих причин, которая снижает ценность определения уровня почечной функции по его уровню), фосфаты могут покинуть организм только в составе мочи (речь, разумеется, не идет о фосфоре, транзитом проходящем через ЖКТ).
Уже при снижении СКФ более чем на 50% (а не следует забывать, что первые клинические проявления заболевания почек появляются, как правило, только тогда, когда этот показатель снижается более чем на 75%) периодически начинает повышаться сывороточная концентрация фосфора, формируется положительный баланс этого элемента в организме, и вступают в действие механизмы его ускоренной элиминации.
Первоначально, благодаря колоссальным компенсаторным возможностям почек (в данном случае, прежде всего, их канальцевого аппарата) и увеличению синтеза:
— фактора роста фибробластов 23 (FGF-23, fibroblast growth factor-23): это гормональный пептид, эффекты которого реализуются в результате связывания с трансмембранным протеином Клото, выполняющим в этом случае роль корецептора[15] и расположенным на мембранах эпителиоцитов проксимальных участков канальцев), а также
— ПТГ (специфические рецепторы этого гормона также расположены на клетках канальцев), объем фосфора в организме может оставаться длительное время в пределах физиологической нормы. Это состояние, продолжающееся иногда годами, определяется сегодня как компенсированная гиперфосфатемия.
Но поскольку многие очевидные внешние симптомы МКС при ХБП связаны прежде всего с увеличением количества ПТГ (этот гормон сегодня признан универсальным уремическим токсином, прямо или косвенно обуславливающим широчайший диапазон симптоматики клинического этапа почечного континуума — от уремического дерматита и гастрита до почечной гипертензии и реногенной гипертрофии левого желудочка) и FGF-23 (его относят к потенциально независимым уремическим токсинам, поскольку доказано, что он оказывает свое негативное действие на организм пациентов с ХБП даже в отсутствие гиперфосфатемии и гиперпаратиреоза), то многие из них начинают проявляться задолго до значимого повышения уровня фосфора в организме.
С клиническими симптомами МКС при ХБП (в первую очередь это касается кошек, распространенность нефропатий у которых в разы выше, чем у собак) практикующие ветеринарные врачи встречаются практически каждый день (ухудшение качества кожи и шерсти, очаговые аллопеции, снижение или даже полная потеря аппетита, патологический билатеральный мидриаз (является следствием почечной гипертензии и гиперпаратиреоза), интермиттирующая рвота, астения, снижение массы тела, реногенные кардиопатии и т.д.). Но, к несчастью, обычно интерпретируются эти отклонения как не связанные с ХБП. Хотя для ограничения круга патологий, возможных у пациента, и даже верификации диагноза, как правило, достаточно общеклинического анализа мочи и анализа научных данных (основанных прежде всего на гистоморфологических исследованиях почечной паренхимы) о распространенности тех или иных нефропатий в больших популяциях кошек и собак.
Точкой приложения действия синтезируемого в костных клетках гормонального пептида FGF-23 является прежде всего канальцевый аппарат нефрона, где он, во-первых, уменьшает реабсорбцию фосфора, увеличивая, таким образом, его количество в конечной моче, и, во-вторых, ингибирует активность фермента 1α-гидроксилазы, подавляя тем самым синтез кальцитриола. Последнее оправданно с точки зрения патогенеза МКС при ХБП, поскольку вместе с кальцием D-гормон стимулирует всасывание в кишечнике и фосфора, причем тем интенсивнее, чем тяжелее стадия ХБП. Сегодня доказано, что именно FGF-23 вкупе с белками Клото служат первым значимым рубежом защиты организма от нарастающей гиперфосфатемии. А количество и тех и других биологически активных молекул, как и сила их рецепторных взаимодействий, значительно возрастает уже на ранних доклинических стадиях ХБП. Поэтому увеличение уровней FGF-23 и/или белка Клото сейчас рассматривается как предвестник, свидетельствующий о наличии и прогрессировании МКС у пациентов на ранних доклинических стадиях ХБП. Вместе с тем клинический этап ХБП, напротив, обычно характеризуется снижением уровня трансмембранной формы белков Клото (но не FGF-23) из-за поражения проксимальных участков канальцев, где он образуется.
Еще одной мишенью для FGF-23 являются клетки самих паращитовидных желез. Воздействуя на них, FGF-23первоначально как стимулирует активную выработку ПТГ, так и инициирует и поддерживает процессы их пролиферации и гиперплазии. Это, в свою очередь, приводит к таким необратимым последствиям, как неконтролируемый вторичный и третичный гиперпаратиреоз. Впоследствии при усугублении тяжести ХБП высокие концентрации FGF-23 становятся причиной того, что чувствительность паращитовидных желез как к ионизированному кальцию, так и к самому ПТГ значительно снижается, что приводит к еще большей продукции этого универсального уремического токсина.
В последующем неминуемое прогрессирование процессов деструкции в почечной паренхиме приводит не только к значительному снижению СКФ, но и к формированию резистентности к действию FGF-23, связанному с выраженным дефицитом почечной выработки трансмембранной формы белка Клото (нет рецептора — нет действия сигнальной молекулы). Все эти процессы дополнительно усугубляют тяжесть декомпенсированной гиперфосфатемии и интоксикации, вызванной ПТГ на клиническом этапе ХБП.
Определенную роль в прогрессирующем увеличении уровня ПТГ в организме играет и снижение синтеза D-гормона в проксимальных участках канальцев (а тяжелое поражение, особенно проксимальных участков, канальцевого аппарата нефронов является неотъемлемой частью патогенеза ХБП вне зависимости от первичной формы нефропатии, к ней приведшей). ПТГ стимулирует процессы 1α-гидроксилирования неактивных форм витамина D2 в кальцитриол. С другой стороны, D-гормон, воздействуя на свои рецепторы на клетках паращитовидной железы, тормозит выработку ПТГ.
Также уменьшение уровня кальцитриола приводит к снижению всасывания кальция в кишечнике, развитию гипокальциемии и, соответственно, к дополнительной стимуляции выработки ПТГ.
Однако кальцитриол-зависимые пути стимуляции выработки ПТГ у собак и кошек, во всяком случае с теоретической точки зрения, не могут считаться ведущими, поскольку синтез этого стероида осуществляется у них не только в почках, но и в клетках лимфогемопоэтической системы, и в остеоцитах. А сосудистые гладкомышечные клетки продуцируют не только 1α-гидроксилазу, но и рецепторы к витамину D3, через которые и реализуется большинство его биологических эффектов. Причем значимость т.н. альтернативных путей образования кальцитриола, вероятно, возрастает с усугублением тяжести тубулоинтрестициальных поражений.
Также следует учитывать, что введение активных форм витамина D3 (к ним также относится такой синтетический аналог кальцитриола, как альфакальцидол) у животных с ХБП может привести к тяжелой D-гормон-интоксикации (а терапевтический индекс этих препаратов весьма узок) и дополнительному экзогенному усугублению тяжести гиперфосфатемии. Последнее явление связано прежде всего с тем, что активные формы витамина D3 при ХБП в равной степени стимулируют увеличение всасывания в кишечнике как кальция, так и фосфора, особенно если поступление его не ограничено диетически и/или с помощью фосфат-байндеров.
Еще одним возможным механизмом, приводящим к повышению уровня ПТГ при МКС, является снижение чувствительности клеток костной ткани к его кальциемическому действию, также возникающему на фоне гиперфосфатемии и гиперпаратиреоза (таким образом, замыкается порочный круг этиопатогенеза МКС при ХБП). Этот же процесс также может стимулировать накопление в организме различных токсических метаболитов и факторов воспаления и оксидативного стресса, свойственных клиническому этапу почечного континуума. Кроме того, скорость костной резорбции на клиническом этапе ХБП имеет определенные пределы, по достижении которых даже значительное повышение концентрации ПТГ не приведет к дополнительному увеличению высвобождения кальция в кровь. Возможно, что эти процессы будут иметь даже обратный эффект, суть которого заключается в подавлении функциональной (обменной) активности самих клеток костной ткани и снижении поступления ионизированного кальция в кровь.
Причем следует учитывать, что на фоне гиперпаратиреоза и гиперфосфатемии (даже компенсированной) активное экзогенное введение кальция не только не пойдет впрок костной ткани, но и может привести к необратимым процессам кальцификации мягких тканей. Также подобные действия не приведут к снижению уровня самого ПТГ, поскольку к клиническому этапу ХБП паращитовидные железы уже находятся в состоянии вторичной и третичной гиперпалазии и даже полная нормализация фосфор-кальциевого баланса не снизит интенсивность синтеза и экскреции запредельно высоких доз ПТГ. Вторичный и третичный гиперпаратиреоз — это необратимый процесс, и устранение проблемы возможно лишь хирургическим путем, что у кошек и собак сегодня не представляется возможным, во всяком случае, в широкой хирургической практике.
Заключение
Таким образом, параллельное нарастание тяжести гиперфосфатемии и гипокальциемии, снижение чувствительности клеток костной ткани к действию ПТГ, нарушения в рецепторных взаимодействиях самого ПТГ и рецепторов, расположенных на клетках паращитовидных желез и (до некоторой степени) снижение уровня кальцитриола являются факторами, ответственными за формирование неконтролируемого вторичного и третичного гиперпаратиреоза у собак и кошек при ХБП и развитие подавляющего числа клинических проявлений клинического этапа почечного континуума.
С высокой долей вероятности можно предположить, что именно задержка фосфора в организме, неизбежно заканчивающаяся компенсированной и декомпенсированной гиперфосфатемией, является одним из превалирующих факторов развития неконтролируемого вторичного и третичного гиперпаратиреоза и, следовательно, появления подавляющего числа клинических симптомов МКС при ХБП у собак и кошек. Это обстоятельство является веской причиной для начала «почечной», содержащей минимально возможное количество фосфора диетотерапии и использования фосфат-байндеров (карбонат кальция, севеламер, соли лантана[16]) на доклиническом этапе ХБП. А поскольку уровень протеинурии тесно коррелирует с тяжестью МКС, то стойкое повышение даже только этого показателя у пациента более 0,01 г/л (тем более в сочетании с редукцией плотности мочи и агранолуцитурией) является основанием для начала мероприятий по снижению поступления фосфора в организм.
На клиническом этапе почечного континуума, когда аппетит у животных по целому ряду причин отсутствует или извращен, подбор диетотерапии существенно усложняется (если возможен вообще), да и ее смысл в значительной степени нивелируется, поскольку даже полное исключение фосфора из рациона (что, разумеется, невозможно, особенно в случае такого облигатного хищника, как кошки) не приведет к снижению уровня интоксикации, вызванной неконтролируемым вторичным и третичным гиперпаратиреозом.
Определение уровня ПТГ в сыворотке крови у собак и кошек на сегодняшний день связано с определенными трудностями, поскольку лабораторные реактивы, используемые для верификации этого показателя у человека, для животных не комплементарны, а ветеринарные тест-системы пока не получили широкого распространения. Поэтому так важны хотя и косвенные, но легкодоступные тесты для оценки значимости МКС при ХБП. К ним, например, относится щелочная фосфотаза (ЩФ). Этот фермент принимает активное участие в процессах декальцификации костной ткани при МКС, и поэтому его уровень значительно повышается у пациентов, особенно на клиническом этапе ХБП.
Поскольку реабсорбция фосфора в канальцах напрямую сопряжена с реабсорбцией натрия по средствам Na/P -котранспортера, то значительное диетическое ограничение потребление поваренной соли может привести у пациентов с ХБП к усугублению тяжести гиперфосфатемии из-за значительного повышения числа и активности механизмов переноса элементов этой пары. Следует учитывать и то, что диетарный NaCl стимулирует всасывание кальция в кишечнике из пищи.
Кроме того, снижение уровня натрия в организме приводит к увеличению активности (и без того гиперактивированной вследствие нефропатии) ренин-ангиотензин-альдостероновой системы.
Литература
Block G.A., Raggi P., Bellasi A. et al. Mortality effect of coronary calcification and phosphate binder choice in incident hemodialysis patients. Kidney Int.2007; 71: 438–441.
Craver L., Marco M.P., Martinez I. et al. Mineral metabolism parameters throughout chronic kidney disease stages 1–5-achievement of K/DOQI target ranges. Nephrol. Dial. Transplant. 2007; 22: 1171–1176.
Denda M, Finch J, Slatopolsky E. Phosphorus accelerates the development of parathyroid hyperplasia and secondary hyperparathyroidism in rats with renal failure. Am J Kidney Dis 1996; 28 (4): 596-602
Fliser D, Kollerits B, Never U et al. Fibroblast growth factor 23 (FGF-23) predicts progression of chronic kidney disease: the Mild to Moderate Kidney Disease (MMKD) Study. J Am Soc Nephrol 2007; 18 (9): 2600-2608
Foley R.N., Parfrey P.S., Sarnak M.J. Clinical epidemiology of cardiovascular disease in chronic renal disease. Am. J. Kidney Dis. 1998; 32: S112–S119.
Fucumoto S. Physiological regulationand Disorders of Phosphate metabolism – Pivotal Role of Fibroblast Growth factor-23. Inter. Med. 2008; 47: 337–343.
Galitzer H, Ben-Dov IZ, Silver J et al. Parathyroid cell resistance to fibroblast growth factor 23 in secondary hyperparathyroidism of chronic kidney disease. Kidney Int 2010; 77 (3): 211-218
Horl, W.H. The clinical consequences of secondary hyperparathyroidism: focus on clinical outcomes. Nephrol Dial Transplant. – 2004. – Vol. 19 (Suppl 5). – V2-8.
Isakova T, Gutierrez O, Shah A et al. Postprandial mineral metabolism and secondary hyperparathyroidism in early CKD. J Am Soc Nephrol2008; 19 (3): 615-623
Isakova T, Wahl P, Vargas GS et al. Fibroblast growth factor 23 is elevated before parathyroid hormone and phosphate in chronic kidney disease. Kidney Int 2011; 79 (12): 1370-1378
Jean G. High levels of serum FGF-23 are associated with increased mortality in long haemodialysis patients. N.D.T. 2009 24(9); 2792–2796.
Makoto K. Klotho in chronic kidney disease – What’s new? Nephrol. Dial. Transplant. 2009; 24(6): 1705–1708.
Maschio G, Tessitore N, D’Angelo A et al. Early dietary phosphorus restriction and calcium supplementation in the prevention of renal osteodystrophy. Am J Clin Nutr 1980; 33 (7): 1546-1554
National kidney Foundation. K/DOQI Clinical Practice Guidelines for Bone Metabolism and Disease in Chronic Kidney Disease. Am. J. Kidney Dis. 2003 (suppl. 3); 42: S1–S202.
Razzaque M.S. Does FGF23 toxicity influence the outcome of chronic kidney disease? Nephrol. Dial. Transplant. 2009; 24(1): 4–7. 29. Gutierrez O.M. Fibroblast Growth Factor 23 and Left Ventricular Hypertrophy in Chronic Kidney Disease. Circulation. 2009; 119: 2545–2552.
Sitara D. Genetic ablation of vitamin D activation pathway reverses biochemical and skeletal anomalies in Fgf-23-null animals. Am. J. Pathol. 2006; 169:2161–2170.
Ермоленко В.М. Хроническая почечная недостаточность. Нефрология: национальное руководство. Под ред. Н.А. Мухина. М.: ГЕОТАР-Медиа. 2009; 579–629.
Рожинская Л. Я. Вторичный гиперпаратиреоз и почечные остеопатии при хронической почечной недостаточности. Журнал "Нефрология и диализ" Т. 2, 2000 г., №4
[1] Почечный континуум — это промежуток времени от появления первых гистоморфологических изменений в почечной паренхиме, диагностируемых обычно с помощью световой и/или электронной микроскопии до момента гибели пациента от последствий почечной недостаточности.
[2] Так, например, автору статьи постоянно приходится сталкиваться с мнением практикующих врачей, относящих неселективную нефротоксичную протеинурию к варианту нормы (хотя все точки над i в этом вопросе с легкостью можно расставить, опираясь на банальные физиологические знания о строении и функциональных особенностях фильтрационного барьера и канальцевого аппарата нефрона). Мало того, несколько раз даже пришлось убеждать коллег в том, что повышать уровень протеинурии у пациента до т.н. «нормы» хотя и вполне осуществимая (введение животному или человеку большинства нефротоксичных ядов, например этиленгликоля, может помочь в этом), но несколько избыточная, с точки зрения современной нефрологии, задача.
[3] Весомым подтверждением этого является и то, что все лекарственные препараты, предназначенные для лечения заболеваний почек у собак и кошек, как и цели их применения, заимствованы из медицины человека.
[4] Так, например, общепризнанно, что причины появления и характер течения такой нефропатии, как поликистоз почек, практически идентичны для человека и кошек, что позволяет расценивать (и использовать) этих животных как наиболее подходящий объект для проведения научных изысканий, направленных на предупреждение и контроль этой тяжелой патологии.
[5] http://iris-kidney.com
[6] Ингибиторы ангиотензин-превращающего фермента, блокаторы кальциевых каналов и блокаторы рецепторов ангиотензина).
[7] Введение «человеческих» эритропоэтинов кошкам и собакам стремительно приводит (как правило, уже после второй инъекции) к формированию в организме аутоантител, что не только практически полностью нивелирует их гемопоэтический эффект, но и заканчивается дополнительной гиперактивацией собственной иммунной системы (а избыточные аутоиммунные реакции являются одним из значимых факторов формирования и прогрессирования ХБП).
[8] У автора есть сведения, что компания «Байер» передала права на производство Ренальцина другой фармкомпании.
[9] Инициатива по улучшению глобальных исходов заболеваний почек. KDIGO является одной из самых авторитетных научно-практических ассоциаций, специализирующихся в области нефрологии человека.
[10] Узелковый.
[11] Остеокласты, строго говоря, не принадлежат к костным клеткам, а имеют моноцитарное происхождение и относятся к системе макрофагов. Это большие многоядерные клетки, участвующие в процессах дестукции костной ткани.
[12] Количество в крови ионизированного кальция (Ca2+) обуславливает полноту всех биологических эффектов этого катиона.
[13] Подобные кальциевые рецепторы расположены и на С-клетках щитовидной железы, продуцирующих антагониста ПТГ кальцитонин, а также на клетках головного мозга и почек.
[14] Одна из стенок дистального канальца в области т.н. плотного пятна сливается с юкстагломерулярными и экстрамезангиальными клетками (эти структуры в целом расположены между афферентной и эфферентной артериолами) собственной гломерулы. Такой тесный контакт различных участков нефрона необходим для постоянного обмена информацией о составе вторичной мочи, регуляции интрагломерулярного кровотока, изменения порозности слоев фильтрационного барьера и т.д.
[15] Корецептор — дополнительный рецептор, появляющийся на поверхности клетки в случае той или иной биологической необходимости. Связываясь с сигнальной молекулой (например, белок Клото связывается с молекулой FGF-23 на поверхности клетки высокого цилиндрического эпителия проксимальных канальцев), корецептор многократно усиливает уже имеющиеся эффекты (в данном случае это будет фосфатурический эффект и подавление синтеза D-гормона).
[16] Соли алюминия, рекомендуемые некоторыми авторами, использовать в качестве фосфат-байндеров недопустимо, поскольку они вызывают алюминиевую интоксикацию у пациентов, значительно усугубляют деструкцию костной ткани (алюминий начинает замещать кальций в остеобластах и остеокластах) и тем самым увеличивают тяжесть МКС при ХБП.
Леонард Роман Александрович
Гиперфосфатемия и гиперпаратиреоз при ХБП: диагностика, профилактика и возможности терапевтического контроля
Автор: к.в.н. Роман-А. Леонард, практикующий ветеринарный врач, руководитель Центра ветеринарной нефрологии и урологии, президент Российской Научно-практической Ассоциации Ветеринарных Нефрологов и Урологов (НАВНУ)
Основные положения
Гиперфосфатемия является одними из самых значимых осложнений хронической болезни почек (ХБП).
Нарушения в экскреции фосфора начинают возникать у пациентов с ХБП еще на ранних доклинических этапах почечного континуума, что первоначально приводит к компенсированной гиперфосфатемии. Затем при неизбежном усугублении почечной дисфункции этот процесс становится декомпенсированным.
Длительное поддержание почками уровня фосфора в организме в пределах нормы (компенсированная гиперфосфатемия) возможно благодаря повышению выработки и усилению рецепторных взаимодействий таких фосфатурических гормонов, как фактор роста фибробластов-23 (FGF-23), тиреокальцитонин (кальцитонин) и паратиреоидный гормон (ПТГ).
Хроническая гиперфосфатемия совместно с гипокальциемией и дефицитом активных форм витамина D (кальцитриол) приводит у больных с ХБП к развитию вторичного и третичного гиперпаратиреоза, в результате чего гиперпродукция ПТГ становится неконтролируемой.
FGF-23, и особенно ПТГ, являются значимыми, а в некоторых случаях и ведущими факторами уремической интоксикации у животных с ХБП и прямо коррелируют с тяжестью клинических проявлений и летальностью от этой патологии.
Даже полное прекращение поступления фосфора в организм на клиническом этапе ХБП не способно значимо повлиять на тяжесть вторичного/третичного гиперпаратиреоза. Поэтому контроль над балансом фосфора в организме необходимо начинать еще на ранних доклинических этапах ХБП. Для этой цели используются следующие терапевтические тактики: снижение потребления фосфора с пищей (специальные «почечные» диеты и фосфат-байндеры) и увеличение его элиминации почками (нефропротективная терапия, использование некоторых петлевых диуретиков).
Для контроля тяжести гиперпаратиреоза и его последствий у собак и кошек возможно применение антагониста ПТГ — кальцитонина и антипаратиреоидных лекарственных средств.
Введение
Клинический этап ХБП характеризуется неуклонно прогрессирующим накоплением в организме пациента значительного числа разнообразных уремических токсинов, в большей или меньшей степени негативно влияющих на те или иные его органы и функции. Элиминация части из этих веществ возможна только в составе мочи (например, фосфора[1]), либо в этом принимают участие и почки, и, например, ЖКТ. Так до 75% креатинина и мочевины (относимых сегодня к т.н. водорастворимым уремическим токсинам) при ХБП может покидать кровоток, диффундируя в просвет кишечника. Это, кроме прочего, значительно снижает ценность определения этих веществ в сыворотке крови и моче (как в абсолютных значениях, так и в качестве одной из переменных в расчетных индексах), по крайней мере, как маркеров тяжести почечной недостаточности[2].
Сегодня учеными и практикующими нефрологами ведется поиск новых, а также тщательно изучаются доселе мало изученные уремические токсины. Также продолжаются активные исследования различных механизмов патологического влияния на организм ранее открытых токсичных веществ и соединений, накопление которых происходит в организме пациентов как на клиническом, так и, что особенно важно, доклиническом этапах ХБП.
Особый интерес представляют механизмы развития и возможности коррекции у пациентов с ХБП минерально-костного синдрома (МКС) (ХБП-МКС) и неразрывно связанных с ним явлений компенсированной и декомпенсированной гиперфосфатемии и вторичного/третичного гиперпаратиреоза.
Следует обратить внимание на то, что большинство уремических токсинов имеют прямое кардио- и васкулотоксическое действие и поэтому диагностика и лечение сердечно-сосудистых заболеваний, особенно у такого подверженного заболеваниям почек вида животных, как кошки, не должно проводиться в полном отрыве от нефропатий, к ним обычно приводящим.
Механизмы развития ХБП-МКС
Неуклонное снижение скорости клубочковой фильтрации (СКФ) и частичная или полная утрата почками значительного числа выполняемых ими функций (в т.ч. участие в экскреции и метаболизме большинства лекарственных препаратов[3]) при прогрессировании ХБП неминуемо приводит к развитию у пациента еще и такого тяжелого и многофакторного осложнения, как МКС. Это осложнение ХБП характеризуется манифестацией следующих патологических изменений или их сочетанием:
– прогрессирующим увеличением уровня сывороточного фосфора и дисбалансом его распределения в костной ткани;
– снижением уровня сывороточного (прежде всего ионизированного) и, напротив, увеличением внутриклеточного кальция, а также нарушением обменных процессов в кости, приводящим к снижению прочности костной ткани, и кальцификацией (кристаллами кальция и фосфатами кальция) мягких тканей (часто встречается у людей с ХБП-МКС, распространенность у животных требует дальнейшего изучения);
– угнетением несколькими путями продукции активных форм витамина Д3 (1,25(OH)2D3, D-гормон, кальцитриол);
– значительным повышением уровня (сначала контролируемым компенсаторным, а затем непропорционально высоким патологическим[4]) таких ведущих регуляторов кальций-фосфорного обмена, как фактор роста фибробластов-23[5](FGF-23, фосфотонин) и паратиреоидный гормон (ПТГ), а также извращенной реакцией костной ткани на их действие;
– повышением уровня функционального антагониста ПТГ кальцитонина, производимого парафолликулярными клетками (C-клетками) щитовидной железы, который тормозит остеоцитный остеолиз, вызываемый ПТГ и D-гормоном, и обладает кальцийурическим (одна из причин развития и поддержания гипокальциемии при ХБП-МКС) и фосфатурическим действием.
Но нужно отметить, что этиологические факторы, приводящие к развитию МКС, и тяжесть последствий этой патологии могут существенно отличаться у разных пациентов, даже имеющих приблизительно идентичный уровень снижения СКФ.
Автор статьи предлагает начинать проводить мониторинг сывороточных уровней кальция, фосфора, щелочной фосфотазы и, при возможности, ПТГ и кальцитриола, начиная с I, неазотемической, стадии ХБП по классификацииIRIS (http://www.iris-kidney.com). Частота исследований определяется индивидуально для каждого пациента.
Наиболее значимыми для ветеринарной медицины последствиями МКС является развитие гиперфосфатемии (компенсированной и декомпенсированной) и, как прямое следствие, увеличение уровня и изменение качественной и количественной активности ПТГ. И именно в сторону гиперпродукции ПТГ, называемого сегодня универсальным уремическим токсином, и направлены все векторы патогенеза ХБП-МКС.
Так, в исследовании, в котором с 1992 по 1995 год приняло участие 80 кошек, было установлено, что 84% пациентов с ХБП страдают гиперпаратиреозом (Barber PJ, Elliott J., 1998).
Избыточная продукция ПТГ, в свою очередь, неразрывно связана с таким необратимым процессом, как вторичная, а затем и третичная (моноклонально-нодулярная) трансформация паращитовидной железы.
Причем нужно особо подчеркнуть, что гиперфосфатемия — это только финальный индикатор нарушения баланса фосфора и минерально-костных нарушений в организме больных с ХБП-МКС. Сначала происходит гиперплазия паращитовидной железы, увеличение выработки фосфатурических гормонов и снижается чувствительность канальцевого аппарата почек к фосфатурическому действию ПТГ, а только затем развивается декомпенсированная гиперфосфатемия и гипокальциемия, и регистрация положительного фосфорного и отрицательного кальциевого метаболизма становится технически возможной задачей.
Сегодня имеется достаточное число доказательств тому, что уровень ПТГ повышается не изолированно, а напрямую коррелирует с тяжестью гиперфосфатемии и гипокальциемии[6] и повышенная продукция ПТГ и FGF-23 в частности, и развитие МКС в целом является весомой причиной прогрессирующего усугубления степени тяжести ХБП и неразрывно связаны с развитием тяжелой симптоматики на клиническом этапе почечного континуума и сокращением продолжительности жизни пациентов.
Биологическая роль фосфора и последствия нарушения его метаболизма
В различных тканях организма фосфор присутствует в составе пиро- и ортофосфорной кислот и их метаболитов, важнейших органических соединений фосфорной кислоты: нуклеотидов, фосфолипидов, витаминов, большого числа коферментов и ферментов и т.д. Фосфорные соединения принимают активное участие в разнообразных физиологических процессах в организме, включая такие, как регуляция деятельности ферментов и рецепторных взаимодействий биологически активных веществ (БАВ), сохранение и трансляция генетической информации, передача метохондриальной энергии, а также поддержание жизнедеятельности нервной системы, минерального и костного обмена и кислотно-щелочного равновесия.
Гомеостаз фосфора (так же как и второго элемента этой пары — кальция) преимущественно поддерживается благодаря действию таких гормонов, как кальцитриол (D-гормон), кальцитонин (функциональный антагонист паратгормона), FGF-23 и ПТГ.
Уменьшение массы функционирующих форменных элементов почки, поражение гломерулярного и тубулярного аппарата еще функционирующих нефронов, и, как следствие, снижение СКФ (а значит, и снижение уровня ультрафильтрации) неминуемо приводит к задержке фосфора, поскольку его выведение из организма возможно только в составе мочи. Причем процессы, в конечном итоге приводящие к аккумуляции фосфора, начинают активизироваться еще на ранних доклинических стадиях ХБП, характеризующихся обычно лишь изменениями в анализах мочи (например, протеинурия, агранулоцитурия, гипостенурия).
Первой на рецидивирующее повышение уровня сывороточного фосфора реагирует костная ткань: остеоциты и остеокласты начинают вырабатывать FGF-23, который реализует свои фосфатурические эффекты благодаря взаимодействию с трансмембранным протеином Клото, выполняющим роль корецептора. Практически одномоментно с этим как под воздействием нарушения кальций-фосфорного баланса, так и напрямую самого FGF-23 начинает происходить увеличение выработки ПТГ[7] (хотя в некоторых случаях FGF-23, напротив, тормозит образование ПТГ, и причины то стимулирующего, то ингибирующего действия FGF-23 на синтез ПТГ пока остаются не до конца понятными).
Также большую роль в гиперпродукции ПТГ играет снижение эффективности взаимодействий кальция и кальцитриола со своими рецепторами, расположенными на мембранах главных клеток паращитовидной железы (прежде всего образованных в результате процессов гиперклеточности и гиперплазии).
Экспрессия секреции и усиление взаимодействий FGF-23 и ПТГ со своими рецепторами, расположенными в проксимальных участках канальцевого аппарата почек, приводит к тому, что значительно снижается тубулярная реабсорбция фосфора и весомо возрастает его экскреция с мочой (а реабсорбция кальция, наоборот, усиливается). Причем активная выработка фосфатурических гормонов и угнетение синтеза кальцитриола (стимулирующего всасывание в кишечнике не только кальция, но и фосфора) приводит к тому, что уровень фосфатемии может даже снизиться.
Супрессия образования кальцитриола происходит несколькими путями. FGF-23, во-первых, угнетает процессы 1α-гидроксилирования неактивных форм витамина D2 в D-гормон в эпителиоцитах проксимальных канальцев (он затем реабсорбируется из первичной мочи в кровь) и, во-вторых, напротив, стимулирует активность 24-гидроксилазы, увеличивающей метаболический клиренс кальцитриола. Это приводит к снижению интестинальной (кишечной) абсорбции и фосфора, и кальция. Как сам дефицит активных форм витамина D3, так и развивающаяся на этом фоне гипокальциемия (прежде всего дефицит ионизированного кальция) являются мощнейшими стимулами к гиперпродукции ПТГ (повышенное количество в сыворотке крови ПТГ на фоне пониженного уровня ионизированного кальция является наиболее точным лабораторным маркером почечного вторичного/третичного гиперпаратиреоза).
Также установлено, что и само по себе повышение сывороточного фосфора независимо от других факторов стимулирует гиперплазию паращитовидной железы и, следовательно, выработку ПТГ, хроническая гиперпродукция которого со временем становится плохо контролируемым процессом. В значительной мере этому способствует также и то, что при уремии на клетках паращитовидной железы значительно снижается количество и «качество» кальциевых и кальцитриол- (или витамин-D-) чувствительных рецепторов, воздействие на которые активно ингибирует выработку ПТГ. Причем обнаружено, что чем больше гиперплазирована паращитовидная железа при ХБП-МКС, тем менее чувствительной она становится к супрессивному воздействию ионизированного кальция и активных форм витамина D. Нодулярные образования, характерные для третичной гиперплазии паращитовидной железы, вообще практически не чувствительны к действию любых внешних факторов и непрерывно продуцируют избыточное количество ПТГ. Эти обстоятельства являются одной из причин того, почему экзогенное введение препаратов кальция и кальцитриола пациентам с ХБП-МКС в некоторых случаях не способно снизить выраженность уремической интоксикации.
Еще одним существенным обстоятельством, приводящим к неконтролируемому разрастанию паращитовидных желез, является накопление в организме свойственных клиническому этапу ХБП-МКС токсичных метаболитов, среди которых приснопамятные мочевина и креатинин играют далеко не ведущую роль.
Таким образом, промежуток почечного континуума, когда уровень фосфора формально остается в пределах нормы, но для поддержания статус-кво требуется все большее и большее увеличение выработки фосфатурических гормонов (они же являются и уремическими токсинами), характеризуется компенсированной гиперфосфатурией. Это состояние может продолжаться довольно длительное время (собственно говоря, как и сам доклинический этап ХБП), вплоть до снижения СКФ у пациента более чем на 75% от нормы. Однако затем прогрессирование гиперфосфатемии, во-первых, приобретает лавинообразный характер и, во-вторых, становится плохо контролируемым процессом, и даже запредельно высокие уровни выработки ПТГ и FGF-23 не способны больше сдерживать этот процесс. Положение может усугубляться еще и тем, что на этом этапе гиперфосфатурия может быть связана не только с кишечной абсорбцией фосфора, но и с его костной резорбцией.
По этой причине, а также потому, что и ПТГ и FGF-23 являются совершенно самостоятельными уремическими токсинами (в т.ч. и кардиотоксинами), контроль над поступлением фосфора в организм необходимо начинать у пациентов с ХБП-МКС как можно раньше, задолго до появления клинических признаков почечной недостаточности. На клиническом этапе ХБП возможности контроля декомпенсированной гиперфосфатемии и ее последствий становятся все более и более сложными и дорогостоящими задачами.
ПТГ как универсальный уремический токсин
ПТГ секретируется главными клетками паращитовидной железы. Основной его биологической функцией в норме является поддержание физиологического равновесия между кальцием и фосфором, реализуемой посредством повышения в сыворотке крови кальция (путем извлечения его из костных депо[8] и увеличения реабсорбции в канальцах), и снижение уровня фосфора (путем стимуляции экскреции с мочой). Регуляторами секреции ПТГ являются, прежде всего, ионизированный кальций, а также фосфор, магний и кальцитриол. Кроме того, мощнейшим стимулом для гиперпродукции ПТГ является ацидоз (в т.ч. почечный). Функциональным антагонистом ПТГ является кальцитонин.
Но сегодня рецепторы к ПТГ обнаружены не только на клетках костной ткани (они отнесены к первому типу, а воздействие на них избыточного количества комплиментарного гормона вызывает развитие МКС при ХБП), но и во многих других тканях и органах. Через кальций-зависимые механизмы (а кальциевые рецепторы имеются на большинстве клеток организма) ПТГ нарушает деятельность многих систем и органов и обуславливает полиорганную и полисистемную дисфункцию, характерную для клинического этапа ХБП (таблица 1). Причем одним из первых негативных эффектов гиперпродукции ПТГ является увеличение поступления ионизированного кальция в клетки[9] (в т.ч. и кардиомиоциты).
Причем уремическая интоксикация, связанная с хронической гиперсекрецией ПТГ, часто начинает проявляться задолго до развития у пациента гиперазотемии. В том числе и поэтому диагностирование нефропатий исключительно в канве повышения уровня креатинина и мочевыины может стать причиной выставления некорректных диагнозов, и пациенты с ХБП или ХБП-МКС не получат необходимое нефропротективное лечение.
Фундаментальная и клиническая нефрология относят сегодня гиперпродукцию ПТГ к универсальным факторам уремической интоксикации, а сам этот гормон (когда его количество значимо превышает физиологическую норму) ряд авторов называют «универсальным уремическим токсином».
Из этого следует, что гиперпродукция ПТГ при ХБП-МКС становится причиной целой лавины системных эффектов, приводящей у пациента к полиорганной недостаточности. Хотя при ХБП в организме, разумеется, складывается ситуация, при которой нарушения гомеостаза носят тяжелый и многофакторный характер и ответственность за развитие того или иного симптома или синдрома лежит в той или иной степени на двух и более уремических токсинах.
Тяжесть протеинурии, в т.ч. и на доклиническом этапе ХБП, напрямую коррелирует с выраженностью гиперфосфатемии (компенсированной или декомпенсированной), а значит, и уровнями таких значимых уремических токсинов, как FGF-23 и ПТГ. Протеинурия является также одной из причин увеличения метаболического клиренса активных форм витамина D.
Поэтому даже изолированная протеинурия является веским аргументом для рекомендации пациенту нефропротективной терапии, включающей меры, направленные на контроль поступления фосфора в организм («почечная» диетотерапия, фосфат-байндеры) и ускоряющие его экскрецию с мочой.
Таблица 1. Патологические изменения, вызываемые вторичным/третичным гиперпаратиреозом у собак и кошек с ХБП-МКС
Органы и системы |
Клинические проявления |
Кожа и шерсть |
Ухудшение качества кожи и шерсти Интенсивное выпадение шерсти (т.н. круглогодичная «линька») Хронические дерматиты (в т.ч. вызываемые сапрофитной флорой кожи) Алопеции |
Сердечно-сосудистая система |
Системная и итрагломерулярная гипертензия Уремический перикардит Гидроперикард Хроническая сердечная недостаточность |
Офтальмологические патологии |
Глаукома Патологические изменения на глазном дне (отслоение и кровоизлияния в сетчатку, микронекрозы сетчатки, изменение сосудистого рисунка и т.д.) |
Эндокринные и метаболические нарушения |
Повышение резистентности к инсулину и уровня глюкоземии (в т.ч. из-за усиления глюконеогенеза в печени) Повышение скорости липолиза в адипоцитах (одна из причин снижения веса или кахексии при ХБП-МКС) Патологическая кальцификация тканей и органов (в т.ч. почек и миокарда) |
Гематологические нарушения |
Анемия (часто в сочетании с дефицитом эритропоэтина) Панцитопения |
Неврологические нарушения |
Центральные и периферические нейропатии Хронический дистресс, астено-невротический синдром, психозы (в т.ч. повышенная агрессивность) Анорексия (в т.ч. по причине воздействия ПТГ на свои рецепторы второго типа в ЦНС) Парезы и параличи задних конечностей (в т.ч. сочетанно с тромбозом подвздошных артерий) Нарушение когнитивных функций и хронический стресс (в т.ч. связанный с хроническим болевым синдромом при ХБП-МКС) Рвота, рвотные позывы центрального происхождения |
Желудочно-кишечный тракт |
Уремический гастроэнтерит и связанные с ним рвота и рвотные позывы |
Опорно-двигательная система |
Ренальные остеопатии (остеопороз, адинамическая болезнь кости, фиброзный остеит, остеомаляция) Костные боли Патологические переломы Асептические миопатии Кальцификация мягких тканей |
Диагностика вторичного/ третичного гиперпаратиреоза
Определение уровня ПТГ у собак и кошек является трудноосуществимой задачей из-за высокой стоимости и малой доступности видоспецифичных диагностических систем.
Визуализация паращитовидных желез, по крайней мере, в широкой терапевтической практике и особенно у кошек, также представляет значительные трудности. Поэтому диагностику вторичного/третичного гиперпаратиреоза приходится проводить, в большинстве случаев опираясь на косвенные признаки.
Гиперфосфатемия, особенно в сочетании с гипокальциемией и любыми другими маркерами и/или факторами патогенеза ХБП, является веским основанием для выставления клинического диагноза вторичный гиперпаратиреоз.
Неуклонно прогрессирующее увеличение уровня щелочной фосфотазы (этот фермент, содержащийся примерно в равных долях в печени и костной ткани, принимает активное участие в остеоцитном остеолизе) также служит высоко достоверным критерием того, что ХБП у пациента уже сопровождается МКС в целом и вторичным гиперпаратиреозом в частности. Также изменение уровня щелочной фосфотазы можно использовать для оценки эффективности проводимого лечения, поскольку количество этого фермента до определенной степени коррелирует с тяжестью обменных нарушений в костной ткани и активностью ПТГ. Однако следует учитывать, что повышение уровня щелочной фосфотазы при ХБП-МКС носит изолированный от других «печеночных» показателей (билирубин, АЛТ, АСТ и т.д.) характер.
Широкая распространенность ХБП, особенно среди кошек, и трудности в лабораторной диагностике вторичного гиперпаратиреоза делают актуальными разработку и внедрение в широкую ветеринарную практику доступных методов определения уровня ПТГ у мелких домашних животных.
Таблица 2. Сравнительная характеристика фосфат-байндеров
Действующие начала и торговые названия препаратов, их содержащих |
Достоинства |
Недостатки |
Фосфат алюминия (Альмагель, Фосфалюгель и т.д.)
|
1. Эффективный контроль сывороточного фосфора.
|
1.Токсичны. При использовании у животных развивается отравление алюминием (его всасывание значительно усиливается при одновременном использовании препаратов витамина D), одним из проявлений которого является остеомаляция (размягчение) костей (из-за замещения алюминием кальция в клетках костной ткани) и возникновение участков в скелете с преобладанием некальцифицированных остеобластов. Отравление алюминием также приводит к энцефалопатиям, нейропатиям и анемии. 2. Химически несовместимы с препаратами калия. При необходимости препараты калия можно вводить только парентерально. 3. Диагностическая ценность определения уровня ПТГ при длительном использовании солей алюминия снижается, поскольку в этом случае выделение этого гормона является компенсаторной реакцией (алюминий значимо тормозит обменные процессы в костной ткани). |
Севеламер (Ренагель) |
1. Дорогостоящие. 2. Неудобно давать животным (очень крупные капсулы или жевательные таблетки). 3. Риск развития ацидоза (при использовании севеламера гидрохлорида). |
|
Соли лантана, содержащиеся в препаратах для человека[10] (Фосренол) |
||
Карбонат кальция и хитозан (вет. препарат Renal Candioli) |
1. Эффективны и просты в применении у собак и кошек вместе с едой. 2. Являются дополнительным источником кальция и обладают определенным антипаратиреоидным эффектом. |
1. Кроме фосфора хорошо связывают и железо, значительно уменьшая его всасываемость. Обязательно требуется парентеральное введение препаратов железа. 2. При некорректном использовании возможен риск развития гиперкальциемии (требуется регулярный контроль сывороточного кальция). |
Таблица 3. Степени гиперфосфатемии у собак и кошек (по IRIS) и предлагаемые автором варианты ее терапии
Степень гиперфосфатемии |
Уровень фосфора в крови |
Варианты терапии |
Компенсированная гиперфосфатемия (повышен уровень только ПТГ и FGF-23) |
||
I |
0,8-1,35 ммоль/л (собаки) 0,9-1,4 ммоль/л (кошки) |
Использование диетического корма со сниженным содержанием фосфора и препаратов, связывающих фосфор в кишечнике, или добавление к обычному рациону (кормление «со стола») препаратов, связывающих фосфор в кишечнике в повышенных количествах. |
Некомпенсированная гиперфосфатемия (повышен уровень фосфора, FGF-23 и ПТГ) |
||
II |
>1,45 ммоль/л |
Эффективный контроль последствий гиперфосфатемии (вторичная и третичная (нодулярная) гиперплазия и, как следствие, неконтролируемая гиперпродукция ПТГ) возможен только с помощью сочетанного использования диет со сниженным содержанием фосфора, фосфат-байндеров, препаратов кальцитонина (Миакальцик, Кальцитрин), являющегося функциональным антагонистом ПТГ, а также таких антипаратиреоидных средств, как: – Земплар (д.в. парикальцитол, фармподгруппа: активатор рецепторов витамина D) и – Мимпара (д.в. цинакальцет, фармподгруппа: кальцимиметики или активаторы кальций-чувствительных рецепторов паращитовидной железы). |
III |
> 1,61 ммоль/л |
|
IV |
>1,93 ммоль/л |
|
Лечение МКС при ХБП
Клинический этап ХБП налагает значительные ограничения на возможности лечения МКС (прежде всего вторичного/третичного гиперпаратиреоза), безусловно снижает (а то и сводит на нет) эффективность терапии, а также многократно увеличивает стоимость и затраты времени на ее проведение со стороны владельцев. Поэтому, как и в случае подавляющего числа нефропатий, начинать профилактику и лечение МКС при ХБП необходимо на возможно более ранних доклинических этапах почечного континуума.
Контроль поступления фосфора в организм при этом носит первостепенный характер, поскольку аккумуляция именно этого элемента в организме пациента чаще всего является ведущим механизмом развития и усугубления степени тяжести МКС в частности и ХБП в целом.
На клиническом этапе ХБП-МКС борьба с гиперфосфатемий также является необходимой мерой, но значимость ее во многом нивелируется, поскольку даже полное прекращение поступления фосфора в организм в этом случае мало отразится на степени тяжести вторичного/третичного гиперпаратиреоза и, следовательно, на уровне в организме пациентов такого универсального уремического токсина, как ПТГ.
Коррекция гипокальциемии и дефицита активных форм витамина D3 хотя и представляется важной задачей, но должна проводиться крайне осторожно, поскольку, во-первых, степень выраженности того и другого состояния у различных пациентов может сильно отличаться и, во-вторых, гиперкальциемия и гипервитаминоз D3 — это состояния, которые могут представлять для здоровья пациента иногда даже большую опасность, чем недостаток кальция и кальцитриола.
Для борьбы с последствиями вторичного/третичного гиперпаратиреоза на клиническом этапе ХБП-МКС у собак и кошек возможно использование (в т.ч. сочетанное) селективных активаторов рецепторов витамина D и кальцимиметиков.
Снижение поступления фосфора в организм можно осуществлять путем сочетанного использования следующих тактик: ограничение потребления с пищей, уменьшение абсорбции в кишечнике и увеличение элиминации в составе мочи.
Автор статьи предлагает поддерживать уровень фосфора у пациентов всеми возможными терапевтическими способами на доклиническом этапе ХБП ниже 0,8 ммоль/л для собак и ниже 0,9 ммоль/л для кошек. А на клиническом этапе почечного континуума уровень фосфора по возможности не должен превышать 1,35 ммоль/л для собак и 1,40 ммоль/л для кошек. Исключение и в том и в другом случае могут составлять животные, не достигшие годовалого возраста.
Сразу нужно оговориться, что поскольку основным источником фосфора является белок, то, особенно для такого облигатного хищника, как кошка, попытки ограничения его поступления с пищей весьма лимитированы на всех этапах почечного континуума. Снижение поступления белка до нефропротективных уровней чревата для этого вида животных дефицитом пластических и энергетических веществ и другими тяжелыми нарушениями обменных процессов, а также липидозом печени.
Тем не менее использование «почечных» диет необходимо рекомендовать пациентам, во-первых, на как можно более ранних этапах течения ХБП (даже изолированная, но стойкая протеинурия является веским для этого основанием, поскольку коррелирует с изменением метаболического профиля фосфора) и, во-вторых, на как можно более длительный срок (в идеале пожизненно), поскольку ХБП — это неизлечимое на сегодняшний день заболевание, одним из значимых и неизбежных исходов которого является МКС.
Поддержание оптимальной сывороточной концентрации фосфора с помощью диетотерапии (в составе комплекса мер, на это направленных) на доклиническом этапе ХБП-МКС не только имеет более высокую терапевтическую ценность, чем на клиническом, но и, что немаловажно, является вполне осуществимой задачей. Связано это прежде всего с тем, что аппетит у животных, как правило, сохранен в полном объеме и достичь комплаенса с владельцами в этом вопросе обычно достаточно просто.
На клиническом этапе эффективность диетотерапии не только значительно снижена, но и ее возможности во многом ограниченны, в том числе и потому, что у подавляющего числа пациентов аппетит по целому ряду объективных причин (в т.ч. и из-за гиперпаратиреоза) отсутствует, значительно снижен или извращен. Поэтому у владельцев зачастую быстро формируется отрицательное мнение о рекомендованном врачом корме. В последующем, памятуя о категорическом отказе питомца от дорогостоящего диетического питания или о вызванной его употреблением рвоте (хотя «виноват» в этом, разумеется, не высококачественный продукт, а, например, уремический гастрит), владельцы с большой неохотой приобретают аналогичные диеты и для других своих болеющих животных (а две и более кошек у одного хозяина — это в подавляющем большинстве случаев два и более пациентов с различными степенями ХБП). Причем такое положение дел обычно сохраняется даже несмотря на корректную терапию ХБП.
Еще одной необходимой мерой, способной значимо ограничить поступление фосфора в организм животных с ХБП-МКС, нормализовать кальций-фосфорный и костный обмен, а также снизить уровень активности паращитовидных желез (в т.ч. на посттранскрипционном уровне) и FGF-23, является использование фосфат-байндеров (таблица 2). Кальций-содержащие фосфат-байндеры (например, Ренал Кандиоли) также способны скорректировать уровень кальциемии[11], в т. ч. и при использовании кальцимиметиков (препараты из этой группы обладают гипокальциемическим действием), и дополнительно подавляют секрецию ПТГ, воздействуя на кальций-чувствительные рецепторы на паратиреоцитах.
Необходимость в начале терапии фосфат-байндерами возникает уже на доклиническом этапе ХБП, но ее интенсивность оценивается индивидуально для каждого пациента (клинический же этап ХБП является безапелляционным условием для назначения высоких доз препаратов из этой группы). Персистирующие или, тем более, неуклонно прогрессирующие патологические изменения в анализах мочи, например, является веским основанием для начала лечения даже в том случае, если у пациента сывороточные значения фосфора, кальция, мочевины и креатинина находятся в пределах нормы, а клинические проявления мало выражены.
Сочетанное использование диет со сниженным содержанием фосфора и фосфат-байндеров обычно является необходимым условием для поддержания уровня фосфатемии на нижней границе нормы или даже ниже ее. Только такая тактика может значимо отдалить время развития у пациента выраженного гиперпаратиреоза и клинического этапа ХБП-МКС. Целевые значения гиперфосфатемии по классификации IRIS и предлагаемые автором варианты их коррекции представлены в таблице 3.
Использование активных форм витамина D3 (кальцитриол или его синтетический аналог альфакальцидол[12]) для лечения МКС у собак и кошек как на доклиническом, так и клиническом этапах ХБП ограничивается прежде всего большими трудностями в оценке индивидуальной потребности в этом высокоактивном гормоне для каждого конкретного пациента и очень узким терапевтическим индексом[13] лекарственных средств, его содержащих.
С одной стороны, D-гормон необходим для большого числа важных физиологических процессов, включая в том числе нефропротекцию и подавление гиперактивности паращитовидной железы и РААС[14]. Но, с другой стороны, даже незначительный и транзиторный гипервитаминоз D3 приводит к увеличению абсорбции кальция и фосфора из кишечника, а также, что, возможно, даже более существенно, к резорбции этих элементов из костной ткани. В конечном счете это может не только усугубить тяжесть гиперфосфатемии, но и дополнительно к этому вызвать тяжелую гиперкальциемию[15] (последнее состояние является категорическим противопоказанием к использованию препаратов, содержащих активные формы витамина D3).
Кроме того, авторы одного исследования, в котором участвовали собаки с индуцированной ХБП, установили, что кальцитриол не способен постоянно подавлять гиперпродукцию ПТГ и что граница между супрессивной дозой и дозой, вызывающей гиперкальциемию, весьма незначительна (что подтверждает утверждение о том, что у препаратов активной формы витамина D3 узкий терапевтический индекс). По итогам эксперимента был сделан вывод, что потенциальный риск от использования кальцитриола у собак и кошек с ХБП превышает любую потенциальную пользу.
Поэтому использование активных форм витамина D3 для снижения скорости прогрессирования ХБП можно рекомендовать, и то с оговорками, только на доклинических этапах этой патологии и под постоянным контролем уровня фосфора и кальция в сыворотке крови.
По причине весьма разнонаправленного действия (как положительного, так и отрицательного) на различные ткани организма, кальцитриол и альфакальцидол относят сегодня к неселективным формам D-гормона.
Антипаратиреоидные средства
Одной из важных терапевтических тактик в лечении МКС является подавление гиперфункции паращитовидной железы. Для этого возможно использование таких антипаратиреоидных средств, как селективные ингибиторы D-рецепторов и кальцимиметики.
Большинства недостатков неизбирательных форм D-гормона лишены селективные активаторы витамин-D-рецепторов, присутствующих на мембранах главных клеток околощитовидных желез. Пока единственным доступным представителем этой группы ЛС является парикальцитол (Земплар). Этот препарат обладает выраженной селективной антипаратиреоидной активностью (значимо снижает выработку ПТГ при ХБП-МНС), но при этом не оказывает практически никакого влияния на всасывание кальция и фосфора из кишечника и резорбцию этих элементов из костной ткани. Гиперкальциемия при использовании парикальцитола развивается значительно реже, чем при введении кальцитриола или альфакальцидола (хотя также требует снижения дозы препарата от начальной или его полной отмены).
Еще одним антипаратиреоидным средством, доступным для использования, является цинакальцет (Мимпара). Этот препарат влияет на другой, более значимый кальций-зависимый, патогенетический механизм развития гиперпаратиреоза. Происходит это путем положительной аллостерической модуляции, возникающей под воздействием этого препарата, кальциевых рецепторов, также расположенных на поверхности клеток паращитовидной железы. В итоге многократно качественно и количественно увеличивается чувствительность этих рецепторов к плазматическому кальцию и выработка ПТГ и FGF-23 прогрессирующе снижается, а также нормализуются обменные процессы в костной ткани. Также под действием цинакальцета происходит снижение уровня фосфатемии и кальциемии. Это значительно облегчает подбор для пациентов дозы кальций-содержащих фосфат-байндеров (наиболее часто используемая сегодня в ветеринарной медицине подгруппа препаратов из этого класса), поскольку помимо прочего снижает вероятность развития у них тяжелой гиперкальциемии и кальцификации мягких тканей. Это же делает возможным сочетанное применение цинакальцета с неселективными формами D-гормона и, при необходимости, парикальцитолом.
Говоря в целом об этой группе препаратов, можно сделать вывод о том, что использование парикальцитола рационально прежде всего на доклинических этапах ХБП при нормальном (или ниже целевого значения) уровнях фосфора и кальция у пациентов. А показанием к назначению цинакальцета является клинический этап почечного континуума, сопровождающийся выраженным МКС. На этом же этапе ХБП может быть рекомендовано сочетанное использование этих двух антипаратиреоидных средств, имеющих взаимодополняющее действие. При совместном использовании доза каждого препарата может быть уменьшена в два раза относительно монотерапии, что потенциально, помимо увеличения эффективности, снижает вероятность развития значимых осложнений в процессе лечения.
Пожалуй, единственным существенным ограничением для применения и парикальцитола, и цинокальцета кошкам и собакам с ХБП-МКС является их высокая стоимость.
При терапии антипаратиреоидными препаратами, как и в иных случаях лечения ХБП на любом ее этапе, необходим регулярный мониторинг у пациентов сывороточных значений фосфора, кальция, магния[16], креатинина и щелочной фосфотазы, а также изменений в анализах мочи.
Дозы антипаратиреоидных препаратов, предлагаемых автором для использования у собак и кошек, приведены в таблице 4.
Использование в монотерапии при ХБП-МКС любых кальций-содержащих лекарственных средств (особенно инъекционных) для нормализации структуры костной ткани (исключая кальций-содержащие фосфат-байндеры, основная цель применения которых иная) при МКС нерационально, поскольку высокий уровень ПТГ не позволит даже избыточному количеству кальция аккумулироваться в костной ткани, а риск развития тяжелой гиперкальциемии и кальцификации мягких тканей будет повышен в несколько раз.
В тех случаях, когда при ХБП-МКС дополнительно к гиперфосфатемии у пациента развивается стойкая гиперкальциемия, то для ее контроля, а также для восстановления нормального уровня кальцификации костной ткани и снижения риска внекостной кальцификации автор предлагает использовать бифосфонаты, например алендроновую[17] или памидроновую кислоты.
Поскольку объем фосфора, экскретируемый почками, напрямую зависит от уровня ультрафильтрации (объема первичной мочи) и реабсорбции в канальцах, то использование нефропротективной и инфузионной терапии, а также мочегонных средств (прежде всего торасемида), подобранных индивидуально для каждого пациента, может существенно помочь в контроле развития и снижения тяжести гиперфосфатемии.
Что немаловажно, и парикальцитол, и цинакальцет имеют широкий терапевтический индекс, поскольку молекулы, не вступившие во взаимодействие с комлементарными рецепторами, имеют нейтральный метаболический профиль. А их использование в монотерапии или, что предпочтительнее, сочетанно может привести к эффективному контролю выработки ПТГ и даже к некоторой редукции гиперплазии паращитовидных желез.
Таблица 4. Антипаратиреоидные средства и дозы их применения при ХБП-МКС у собак и кошек
Препарат |
Механизм действия |
Этап почечного континуума |
Рекомендуемая доза |
Примечания |
|
Собаки |
Кошки |
||||
Парикальцитол (Земплар, капсулы 4 мкг; 2 мкг; 1 мкг; раствор для в/в введения 5 мкг/мл 2 мл; 5 мкг/мл 1 мл) |
Снижение уровня ПТГ путем блокады витамин-D-рецепторов на паратиреоцитах |
Доклинический и клинический |
Капсулы: внутрь 1-4 мкг на животное один раз в сутки, или через день, или через два дня на третий. Раствор: 0,05-5,0 мл на животное один раз в сутки, или через день, или через два дня на третий. |
Капсулы: внутрь 1 мкг на животное один раз в сутки, или через день, или через два дня на третий. Раствор: 0,05-0,2 мл на животное один раз в сутки, или через день, или через два дня на третий. |
В/в инъекции препарата болезненны. Требуется регулярный (не реже одного раза в неделю) контроль уровня кальция (в идеале ионизированного) и фосфора. Длительность использования препарата определяется индивидуально. |
Цинакальцет (Мимпара, табл. 30, 60 и 90 мг) |
Снижение уровня ПТГ путем блокады Са-чувствительных рецепторов на паратиреоцитах |
Клинический |
7,5-90 мг на животное 1 раз в сутки. |
3,75-7,5 мг (таблетки можно растворять в 0,9% растворе NaCl) на животное |
Возможно сочетанное использование с парикальцитолом. Требуется регулярный (не реже одного раза в неделю) контроль уровня кальция (в идеале ионизированного) и фосфора. Длительность использования препарата определяется индивидуально. |
Кальцитонин (Миакальцик, раствор для инъекций 100 МЕ/мл) |
Антагонизм с ПТГ |
Доклинический и клинический |
0,1-1 мл п/к 1-2 раза в сутки. Для мелких пород собак возможно интраназальное использование раствора для инъекций, как у кошек. |
0,1-0,2 мл п/к 1-2 раза в сутки или интраназально по 1 к. в носовые ходы 1-2 раза в сутки. |
То же, что и для цинакальцета. Особо показан для животных, у которых ХБП-МКС сопровождается гиперкальциемией. |
Заключение
Современные представления об этиопатогенезе ХБП требуют кардинального пересмотра в методах диагностики, профилактики и терапии этого широко распространенного среди собак и кошек заболевания. Прежде всего необходим отказ от сугубо азотемической модели в диагностике ХБП.
Также, учитывая то, что все старания врачей сегодня могут во многом оказаться обесценены, если не удается сохранить качество жизни пациента и возможность его полноценного общения с владельцами, необходимо прилагать максимум усилий для отдаления момента развития клинического этапа ХБП в целом и такого значимого ее осложнения, как МКС, в частности. Определенные возможности для этого существуют уже сейчас. Своевременное, в идеале на ранних доклинических этапах почечного континуума, использование для контроля гиперфосфатемии адекватной нефропротективной терапии, а также фосфат-байндеров и специальных диет, а для контроля вторичного/третичного гиперпаратиреоза антипаратиреоидных средств может во многом облегчить для врачей эту задачу.
Однако, учитывая индивидуальные особенности течения ХБП на всех ее этапах, требуется внедрение в широкую терапевтическую практику новых, высоко достоверных и информативных методов диагностики ХБП-МКС и уточнение имеющихся и разработка новых методов борьбы с этой патологией, которая среди кошек, в частности, в последнее время приобрела размах неинфекционной эпидемии.
Литература
Barber PJ,Elliott J .Feline chronic renal failure: calcium homeostasis in 80 cases diagnosed between 1992 and 1995. J Small Anim Pract. 1998 Mar;39(3):108-16.
Block G.A., Zeig S., Sugihara J. et al. Combined therapy with cinacalcet and low doses of vitamin D sterols in patients with moderate to severe secondary hyperparathyroidism. Nephrol. Dial. Transplant. 2008; 23: 2311-2318.
Cholstl JV., Steinberg SF., Tropper PJ. et al. The influence of hypermagnesemia on serum calcium and parathyroid hormone in human subjects. N Engl J Med 1984.
Combe CvAparicioM. Phosphorus andprotein restriction and parathyroid function in chronic renal failure. Kidney Int 1994; 46: 1381-1386.
Coyne D., Martin K. , Qiu P., Acharya M., Batlle D., Rosansky S., Abboud H., Fadem S., Levine L., Smolenski O., Kaplan M., Williams L., Sprague S. Paricalcitol (Zemplar) capsule controls secondary hyperparathyroidism (SHPT) in chronic kidney disease stages 3 and 4 patients [abstract] // J Am Soc Nephrol. 2004, 15: 733 A.
Demay MB., Kiernan MS., DeLuca HE., Kronenberg HM. Sequences in the human parathyroid hormone gene that bind the 1,25-dihydroxyvitamin D3 receptor and mediate transcriptional repression in response to 1,25-dihydroxyvitamin D3. Proc Natl Acad Sci USA 1992; 89:8097-8101.
Fishbane S., Shapiro W.B., Corry D.B. et al. Cinacalcet HCl and concurrent low-dose vitamin D improves treatment of secondary hyperparathyroidism in dialysis patients compared with vitamin D alone:the ACHIEVE study results. Clin. J. Am. Soc. Nephrol. 2008; 3: 1718-1725.
Goodman WG. Recent developments in the management of secondary hyperparathyroidism. Kidney Int 2001; 59: 1187-1201.
http://www.eclinpath.com/chemistry/minerals/overview
Jourde-Chiche N, Dou L, Cerini C, Dignat-George F, Vanholder R, Brunet P. Proteinbound toxins—update 2009. // Semin Dial. 2009. Vol. 22, N 4. P. 334-339.
KDIGO Clinical Practice Guideline for the Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD) // Kidney Int. 2009; 76 (suppl 113): S1–S130.
Komaba H., Goto S., Fukagawa M. Critical issues of PTH assays in CKD // Bone. 2009; 44: 666–670.
Kovesdy C.P., Kalantar-Zadeh K. Vitamin D receptor activation and survival in chronic kidney disease. Kidney Int 2008;73:1355-1363.
Levin A., Bakris G. , Molitch M. et al.Prevalence of abnormal serum vitamin D. PTH, calcium, and phosphorus in patients with chronic kidney disease: results of the study to evaluate early kidney disease // Kidney Int. 2007; 71: 31–38.
Lopex-Hilker S,Dusso AS.,Rapp NS. et al. Phosphorus restriction reverses secondary hyperparathyroidism independent of changes in Ca2+ and calcitriol. Am J Physiol 1990; 259: 432-437.
Miyamoto Y, Watanabe H, Otagiri M, Maruyama T. New insight into the redox properties of uremic solute indoxyl sulfate as a pro- and anti-oxidant. // Ther Apher Dial. 2011. Vol. 15, N 2. P. 129–131.
Miyazaki T, Ise M, Hirata M, Endo K, Ito Y, Seo H, Niwa T. Indoxyl sulfate stimulates renal synthesis of transforming growth factor-beta 1 and progression of renal failure. // Kidney Int Suppl. 1997. Vol. 63. P. 211–214.
Niwa T, Ise M. Indoxyl sulfate, a circulating uremic toxin, stimulates the progression of glomerular sclerosis. // J Lab Clin Med. 1994. Vol. 124, N 1. P. 96–104.
Noordzij M., Korevaar J.C., Boeschoten E.W., Dekker F.W., Bos W.J., Krediet R.T. The Kidney Disease Outcomes Quality Initiative (K/DOQI) Guideline for Bone Metabolism and Disease in CKD: association with mortality in dialysis patients. Am J Kidney Dis (2005) 46:925-932.
Slatopolsky E. Role of phosphorus in the pathogenesis of secondary hyperparathyroidism //Am J Kidney Dis. 2001; 37: 54–57.
Slatopolsky E., Finch J, DendaM. et al. Phosphorus restriction prevents parathyroid gland growth: high phosphorus directly stimulates PTH secretion in ww. J Clin Invest 1996; 97: 2534-2540.
Slatopolsky Е., Brown А., Dusso А. Pathogenesis of secondary hyperparathyroidism // Kidney Int. 2005; Vol. 56, Supplement 73: S14–S19.
Wang R., Karpinski E., Pang PK. Parathyroid hormone selectively inhibits L-type calcium channels in single vascular smooth muscle cells of the rat. J Physiol 1991; 441: 325-346.
Ветчинникова О.Н. Гиперпаратиреоз при хронической болезни почек. "Эффективная фармакотерапия. Урология и Нефрология" Спецвыпуск (44), 2013.
Волгина Г.В., Перепеченых Ю.В. Лечение вторичного гиперпаратиреоза у больных с хронической почечной недостаточностью (Практические рекомендации). «Нефрология и диализ», Т.2, №4, 2000.
Волгина Г. В. Вторичный гиперпаратиреоз при хронической почечной недостаточности. Лечение активными метаболитами витамина D. "Нефрология и диализ", Т. 6, 2004 г., №2.
Добронравов В.А. Cовременный взгляд на патофизиологию вторичного гиперпаратиреоза: роль фактора роста фибробластов 23 и Klotho. "Нефрология", 2011, том 15, №4, с. 11-20.
Ермоленко В. М., Волгина Г. В., Добронравов В. А. и др. Национальные рекомендации по минеральным и костным нарушениям при хронической болезни почек. Российское диализное общество. «Нефрология и диализ» Т. 13, № 1
Кирк Роберт. У., Бонагура Дж. Д. Современный курс ветеринарной медицины Кирка. Аквариум, 2014.
Милованова Л.Ю., Козловская Л.В., Милованов Ю. С. и др. Механизмы нарушения фосфорно-кальциевого гомеостаза в развитии сердечно-сосудистых осложнений у больных хронической болезнью почек. Роль фактора роста фибробластов-23 (FGF-23) и Тер. арх. 2010;6:66–72.
Милованова Л.Ю., Милованов Ю.С., Добросмыслов И.А. Вторичный гиперпаратиреоз у больных хронической болезнью почек. Роль фактора роста фибробластов-23 (FGF-23) и Klotho. «Клиническая нефрология» №1, 2013
Плотникова А.А., Милованова Л.Ю., Милованов Ю.С. Парикальцитол – новые возможности оптимизации нефропротективной стратегии и лечения вторичного гиперпаратиреоза. «Клиническая нефрология» №4, 2012.
Рожинская Л. Я. Вторичный гиперпаратиреоз и почечные остеопатии при хронической почечной недостаточности. "Нефрология и диализ" >> Т. 2, 2000 г., №4
[1] Возможности элиминации фосфора из организма человека затруднены даже при использовании самой современной диализной терапии. Связано это с тем, что при ХБП большое количество фосфора находится в межклеточных пространствах, из которых этот элемент легко перемещается в кровь.
[2] Факторами этиопатогенеза нефропатий мочевину и креатинин также можно назвать с очень большими оговорками.
[3] Именно поэтому клинический этап ХБП налагает существенные ограничения на использование многих лекарственных препаратов, включая нефропротективные.
[4] Причем момент этого перехода зафиксировать не удается даже в нефрологии человека.
[5] Этот гормон значительно более серьезный предиктор ускорения прогрессирования ХБП и увеличения летальности, чем сам фосфор. Также высокий уровень FGF-23 прямо коррелирует с тяжестью неконтролируемого вторичного/третичного гиперпаратиреоза.
[6] Возможен вариант развития МКС, при котором гиперфосфатемия сочетается с гиперкальциемией, что прогностически может быть даже более неблагоприятно.
[7] Дефицит кальцитриола, возникающий под воздействием FGF-23, также приводит к гиперпродукции ПТГ из-за нарушения геномных механизмов контроля синтеза этого гормона.
[8] Вместе с кальцием из костной ткани под действием ПТГ высвобождается также и фосфор. Но в норме фосфатурический эффект ПТГ с лихвой компенсирует развивающуюся на фоне этого процесса транзиторную гиперфосфатемию.
[9] Этот эффект ПТГ способен нивелировать кардио- и нефропротектор блокатор кальциевых каналов верапамил.
[10] Соли лантана, содержащиеся в препаратах для животных (лантаренол, Ренальцин). Ранее препарат выпускался компанией «Байер» и сейчас недоступен. Но у автора статьи имеются сведения, что препарат с аналогичным составом будет выпускаться в скором будущем другой фармацевтической компанией.
[11] МКС, сопровождающийся гиперкальциемией, является противопоказанием к использованию кальций-содержащих фосфат-байндеров.
[12] Рекомендация пациентам с ХБП препаратов, содержащих различные формы витамина D2 (тривит, тетравит и т.д.), не имеет под собой никакого основания, поскольку они содержат биологически неактивные, не прошедшие 1α-гидроксилирование в эпителиоцитах почечных канальцев формы этого БАВ.
[13] Широта терапевтического индекса лекарственных средств имеет особое значение для ветеринарной медицины, поскольку вес пациентов может различаться в 100 и более раз и прямой зависимости между «вес животного – доза препарата» часто не существует.
[14] Гиперактивация ренин-ангиотензин-альдостероновой системы (РААС) является неотъемлемой частью этиопатогенеза ХБП.
[15] При внутривенном введении активных форм витамина D3 эти эффекты выражены меньше.
[16] Тяжесть гипокальциемии при ХБП может быть связана с дефицитом магния, что требует введения препаратов, его содержащих.
[17] Для лечения кошек автор использовал в практике (из расчета на одно животное) алендроновую кислоту по 10 мг внутрь 1 раз в неделю (сочетанно с блокаторами протоновой помпы и маропитантом) и памидроновую кислоту в/в капельно медленно 6-9 мг 1 раз в неделю.
Леонард Роман Александрович
Рекомендации IRIS по лечению хронической болезни почек (ХБП) у кошек (2013)
Перевод с английского и комментарии: к.в.н. Леонард Р.А (vetnefro@mail.ru)
Алгоритм для определения стадии ХБП у кошек
Лечение ХБП должно подбираться для каждого отдельного пациента.
Нижеследующие рекомендации являются важными отправными точками для начала лечения большинства кошек находящихся на той или иной стадии ХБП (таблица 1).
В идеале необходим постоянный контроль за состоянием пациентов, а лечение должно корректироваться в зависимости от его эффективности.
Необходимо обратить внимание на то, что лечебные мероприятия начинают проводить после выставления диагноза ХБП. Однако повышение уровня только кретининемии выше референсных значений не является основанием для диагностики у пациента ХБП (при диагностике у пациента ХБП необходимо так же опираться на результаты других неинвазивных (анализы мочи, визуализирующие методы) и инвазивных (пункционная нефробиопсия) методов диагностики –Р.Л.). Часть препаратов, рекомендуемых нами для лечения кошек, не разрешена к использованию у этого вида животных (имеется в виду в Западной Европе и США – Р.Л.), поэтому указанные дозы являются имперически подобранными.
Это обстоятельство каждый раз ставит врача перед необходимостью оценивать как ожидаемый положительный эффект от использования препарата, так и степень риска ухудшения состояния пациента после начала его применения.
Стадия 1[1]
Прекратите, по возможности, использование всех потенциально нефротоксичных препаратов (если не имеется жизненно важных показаний к их применению - Р.Л.).
Диагностируйте и, при необходимости проведите адекватное лечение всех патологических состояний, способных вызвать пре- и постренальную почечную недостаточность (гиповолемия, гипотензия, острая задержка мочи т.д. – Р.Л.).
Исключите любые потенциально поддающиеся излечению заболевания, такие как пиелонефрит и/или инфекция мочевыделительного тракта, а так же визуализируемый при УЗИ и/или рентгенографии, ренальный уролитиаз.
У пациента должен быть определен уровень кровяного давления и соотношение белок/креатинин мочи (UP/C).
Лечение обезвоживания:
У пациентов на этой стадии способность к концентрации мочи может быть несколько сниженной, поэтому:
- скорректируйте, если нужно, клинически определенную дегидратацию/ гиповолемию при помощи изотонических полиионных жидкостей (например, раствора Рингер-Лактат);
- животные должны иметь постоянный доступ к свежей воде для питья.
Системная гипертония:
Уровень системной артериальной гипертензии (АГ) при котором может развиться поражение почек, не известен.
Наша цель состоит в том, чтобы снизить уровень систолического артериального давление (АД) до уровня
Если нет прямых доказательств повреждения целевых органов, но уровень систолического АД у животного постоянно превышает 160 мм. рт. ст., то лечение гипертензии все равно должно быть начато.
Стойкое повышение уровня АД должно быть зарегистрировано при многократных измерениях и соотнесено с промежутком временным в течении которого патология персистировала. В зависимости от этого выделяют:
- Умеренный риск (AP2): АД находилось в пределах 160-179 мм. рт. ст. в течение 1-2 месяцев;
- Серьезный риск (AP3): АД ≥ 180 мм. рт. ст. в течение 1-2 недель.
Если же у пациента диагностируется поражение какого-либо целевого органа (например, ярко выраженные изменения на глазном дне - Р.Л.), то его лечение должно быть начато даже если уровень АД находиться в пределах нормы.
Постепенная нормализация уровня кровяного давления является долгосрочной целью в лечении пациентов с ХБП, однако при этом терапия не должна приводить к внезапному и/или значительному снижению АД и развитию гипотонии.
Логический пошаговый подход к контролю АГ следующий:
Снижение потребления поваренной соли. Нет ни каких доказательств того, что уменьшение потребления Na+способствует снижению уровня АД. Поэтому диетотерапия с ограниченным содержанием соли должна сочетаться с медикаментозным лечением гипертензии.
2.Блокаторы кальциевых каналов (БКК), например, амлодипин.
Увеличьте дозу амлодипина до 0,5 мг/кг в день.
Сочетайте ингибиторы ангиотензин превращающего фермента (иАПФ) и БКК.
Позаботьтесь о том чтобы не начинать лечение БКК/иАПФ у нестабильных обезвоженных кошек, у которых уровень клубочковой фильтрации может стремительно упасть, если начать вводить эти препараты до того как пациент будет адекватно гидротирован.
Контроль ответа на антигипертензивную терапию:
Кошкам с гипертензией обычно показана пожизненная терапия, которая должна корректироваться в зависимости от потребностей пациента. Важно последовательное мониторирование. После стабилизации, контроль уровня АД должен происходить, по крайней мере, каждые 3 месяца.
АД
Уровень креатининемии. Снижение АД может привести к незначительному повышению концентрации уровня креатинина (<0,5 мг/дл или 45 мкмоль/л). Но более значительное увеличение уровня креатининемии, скорее всего, свидетельствует о неблагоприятном влиянии препарата и прогрессировании почечной дисфункции.
Протеинурия:
У кошек c первой (неазотемической- Р.Л.) стадией ХБП должно быть определено соотношение белок/ креатинин мочи (UP/C). Если это соотношение > 1,0 то животное должно быть обследовано с целью выявления патологий, приводящих к развитию протеинурии (см. пункты 1 и 2 ниже) и предприняты меры для её лечения (см. пункты 3 и 4 ниже).
Кошки с легкой протеинурией (UP/C от 0,4 до 1,0) требуют тщательного мониторинга состояния (см. пункт 1 ниже).
Постарайтесь выявить любой сопутствующий заболеванию патологический процесс, который можно вылечить или скорректировать.
Рассмотрите возможность проведения почечной биопсии (пункционной- Р.Л.) как варианта для идентификации нозологической формы нефропатии (проконсультируйтесь с экспертом, если не уверены в целесообразности её проведения).
иАПФ плюс диета со сниженным содержанием белка.
Контролируйте эффективность лечения/ прогрессирования заболевания:
- стабилизация концентрации креатинина и уменьшение индекса UP/C – положительный ответ (замедление темпов деструкции в почечной паренхиме – Р.Л.);
- прогрессирующее увеличение концентрации креатинина в крови и/или значения индекса UP/C – болезнь прогрессирует.
Обычно требуется пожизненная терапия, если основное заболевание не было устранено. При этом дозы (лекарственных средств – Р.Л.) могут быть сокращены, но при постоянном контроле индекса UP/C.
Примечания:
а. Использование иАПФ противопоказано животным, которые имеют клинические признаки обезвоживания и/или гиповолемии. Обязательно гидротируйте пациента перед использованием этих препаратов, иначе СКФ может значительно снизиться.
б. Кошки с протеинурией и гипоальбуминемией, вероятно, имеют риски развития тромбоэмболии, так же как и собаки. Однако использование аспирина у этого вида животных для достижения значимого антиагрегантного эффекта затруднено.
Предложено использование аспирина в дозе 1 мг/кг каждые 72 часа, в том случае, если уровень альбуминемии у пациента ниже 20 г/л (2 г/дл).
Начало корректировки уровня протеинурии (т.н. точка вмешательства) отличается в зависимости от стадии ХБП. У неазотемических животных (стадия I/ ранняя II[2] стадия) число нефронов, через которые может происходить потеря белка значимо. Поэтому причины появления даже пограничной или низкоуровневой протеинурия (UP/C <1,0) на начальных стадиях ХБП должны исследоваться более тщательно. В то время как на II-IV стадиях начинать лечение рекомендовано и при более низком соотношении UP/C.
Стадия 2
Все вышеупомянутые рекомендации и замечания для кошек, находящихся на I стадии ХБП, плюс нижеследующие дополнительные мероприятия.
Прекратите, по возможности, использование всех потенциально нефротоксичных препаратов (если не имеется жизненно важных показаний к их применению - Р.Л.).
Диагностируйте и, при необходимости проведите адекватное лечение всех патологических состояний, способных вызвать пре- и пост-ренальную почечную недостаточность (гиповолемия, гипотензия, острая задержка мочи т.д. – Р.Л.).
Исключите любые потенциально поддающиеся излечению заболевания, такие как пиелонефрит и/или инфекция мочевыделительного тракта, а так же визуализируемый при УЗИ и/или рентгенографии, ренальный уролитиаз.
У пациента должен быть определен уровень кровяного АД и соотношение UP/C.
Рассмотрите возможность для начала почечной диетотерапии, переход на которую на этой стадии ХБП осуществить значительно легче, прежде чем у пациента разовьется анорексия.
Лечение обезвоживания:
У этих пациентов снижена способность к концентрации мочи и поэтому:
- скорректируйте, если нужно, клинически определенную дегидратацию/гиповолемию при помощи изотонических полиионных жидкостей (например, раствора Рингер-Лактат);
- животные должны иметь постоянный доступ к свежей воде для питья.
Системная гипертония:
Уровень системной артериальной гипертензии (АГ) при котором может развиться поражение почек не известен.
Наша цель состоит в том, чтобы снизить систолическое АД до уровня
Если нет прямых доказательств повреждения целевых органов, но уровень систолического АД у животного постоянно превышает 160 мм. рт. ст., то лечение гипертензии все равно должно быть начато.
Стойкое повышение уровня АД должно быть зарегистрировано при многократных измерениях и соотнесено с промежутком временным в течение которого патология персистировала. В зависимости от этого выделяют:
- умеренный риск (AP2): АД находилось в пределах 160-179 мм. рт. ст. в течение 1-2 месяцев;
- серьезный риск (AP3): АД ≥ 180 мм. рт. ст. в течение 1-2 недель.
Если же у пациента диагностируется поражение какого-либо целевого органа (например, ярко выраженные изменения на глазном дне- Р.Л.), то его лечение должно быть начато даже если уровень АД находиться в пределах нормы.
Постепенная нормализация уровня кровяного давления является долгосрочной целью в лечении пациентов с ХБП, избегая при этом внезапного и/или значительного снижения АД и развития гипотонии.
Логический пошаговый подход к контролю АГ следующий:
Уменьшение потребления поваренной соли. Нет ни каких доказательств того, что уменьшение потребления Na+способствует снижению уровня АД. Поэтому диетотерапия со сниженным содержанием соли должна сочетаться с медикаментозным лечением гипертензии.
2.БКК, например, амлодипин.
Увеличьте дозу амлодипина до 0,5 мг/кг в день.
Сочетайте иАПФ и БКК.
Позаботьтесь о том чтобы не начинать лечение БКК/иАПФ у нестабильных обезвоженных кошек, у которых уровень клубочковой фильтрации может стремительно упасть, если начать вводить эти препараты до того как пациент будет адекватно гидротирован.
Контроль ответа на антигипертензивную терапию:
Кошкам с гипертензией обычно показана пожизненная терапия, которая должна корректироваться в зависимости от потребностей пациента. Важно последовательное мониторирование. После стабилизации, контроль уровня АД должен происходить, по крайней мере, каждые 3 месяца.
АД
Уровень креатининемии. Снижение АД может привести к незначительному повышению концентрации уровня креатинина (<0,5 мг/дл или 45 мкмоль/л). Но более значительное увеличение уровня креатининемии, скорее всего, свидетельствует о неблагоприятном влиянии препарата и прогресссировании почечной дисфункции.
Протеинурия:
Кошки на II стадии с UP/C >0,4 должны быть обследованы с целью выявления болезней, приведших к появлению протеинурии (см. пп. 1-2 ниже), а затем необходимо предпринять меры для её лечения (см. пункты 3 и 4 ниже).
Животные с пограничной протеинурией (UP/C от 0,2 до 0,4) требуют тщательного мониторинга (см. 1 ниже).
Постарайтесь выявить любой сопутствующий заболеванию патологический процесс, который можно вылечить или скорректировать.
Рассмотрите возможность проведения почечной биопсии (пункционной- Р.Л.) как варианта для идентификации нозологической формы нефропатии (проконсультируйтесь с экспертом, если не уверены в целесообразности её проведения).
иАПФ плюс почечная диетотерапия.
Контролируйте эффективность лечения/ прогрессирования заболевания:
- стабилизация концентрации креатинина и уменьшение индекса UP/C – положительный ответ (замедление темпов деструкции в почечной паренхиме – Р.Л.);
- прогрессирующее увеличение концентрации креатинина в крови и/или значения индекса UP/C – болезнь прогрессирует.
Обычно требуется пожизненная терапия, если основное заболевание не было устранено. При этом дозы (лекарственных средств – Р.Л.) могут быть сокращены, но при постоянном контроле индекса UP/C.
Примечания:
а. Использование иАПФ противопоказано животным, которые имеют клинические признаки обезвоживания и/или гиповолемии.
Обязательно гидротируйте пациента перед использованием этих препаратов, иначе СКФ может значительно снизиться.
б. Кошки с протеинурией и гипоальбуминемией, вероятно, имеют риски развития тромбоэмболии, так же как и собаки. Однако использование аспирина у этого вида животных для достижения значимого антиагрегантного эффекта затруднено.
Предложено использование аспирина в дозе 1 мг/кг каждые 72 часа, в том случае, если уровень альбуминемии у пациента ниже 20 г/л (2 г/дл).
Начало корректировки уровня протеинурии (т.н. точка вмешательства) отличается в зависимости от стадии ХБП. У неазотемических животных (стадия I/ ранняя II стадия) число нефронов, через которые может происходить потеря белка значимо. Поэтому причины появления даже пограничной или низкоуровневой протеинурия (UP/C <1,0) на начальных стадиях ХБП должны исследоваться более тщательно. В то время как на II-IVстадиях начинать лечение рекомендовано и при более низком соотношении UP/C.
Сокращение потребления фосфата:
У многих кошек на II-ой стадии сохраняются нормальные плазменные концентрации фосфата, но будет увеличен уровень паратиреоидного гормона. Данные свидетельствуют, что хроническое сокращение потребления фосфата, что бы поддержать его плазменную концентрацию ниже 1,5 ммоль/л (но не меньше чем 0,9 ммоль/л или 4.6 мг/дл, но не > 2,7 мг/дл), благоприятно для пациентов с ХБП.
Для достижения этого могут быть последовательно предприняты следующие меры:
Диетическое сокращение фосфата (почечная диетотерапия).
Если плазменная концентрация фосфата остается выше 1,5 ммоль/л (5 мг/дл) после его диетического ограничения, используйте кишечные фосфат-байндеры[3] (например, гидроокись или карбонат алюминия, карбонат кальция[4], ацетат кальция, карбонат лантана), эффективные дозы которых начинаются с 30-60 мг/кг/сут. Препараты следует давать вместе с едой, разделив суточную дозу на количество приемов пищи. Необходимая доза изменяется в зависимости от количества поступающего с пищей фосфата и стадии ХБП. Лечение фосфат-байндерами должно приводить к должному эффекту, обрисованному в общих чертах ранее. Верхняя доза, используемого препарата ограничивается развитием интоксикации у каждого конкретного пациента.
Мониторинг содержания кальция и фосфата в сыворотке крови необходимо проводить каждые 4-6 недель до стабилизации, а затем каждые 12 недель.
Микроцитоз и/или общая мышечная слабость являются свидетельством алюминиевой интоксикации, вызванной алюминий-содержащим фосфат- байндером и требует перехода на другой препарат из этой группы[5]. Гиперкальциемии, в некоторых случаях, можно избежать комбинируя алюминий- и кальций-содержащие фосфат-байндеры.
Метаболический ацидоз:
Если у пациента однажды диагностирован метаболический ацидоз (бикарбонат крови или общий CO2 2 в диапазоне от 16 до 24 ммолей/л.
Дополнительные рекомендации для пациентов на II стадии:
У гипокалиемических пациентов для достижения оптимального эффекта, следует использовать глюконат или цитрат калия (как правило, в дозе 1-2 ммоль/кг/день).
Стадия 3. Кошки
Все вышеупомянутые рекомендации и замечания для кошек, находящихся на I и II стадии ХБП, плюс нижеследующие дополнительные мероприятия.
Прекратите, по возможности, использование всех потенциально нефротоксичных препаратов (если не имеется жизненно важных показаний к их применению - Р.Л.).
Диагностируйте и, при необходимости проведите адекватное лечение всех патологических состояний, способных вызвать пре- и постренальную почечную недостаточность (гиповолемия, гипотензия, острая задержка мочи т.д. – Р.Л.).
Исключите любые потенциально поддающиеся излечению заболевания, такие как пиелонефрит и/или инфекция мочевыделительного тракта, а так же визуализируемый при УЗИ и/или рентгенографии, ренальный уролитиаз.
У пациента должен быть определен уровень кровяного давления и соотношение белок/креатинин мочи (UP/C).
Почечная диетотерапия.
Лечение обезвоживания:
У этих пациентов снижена способность к концентрации мочи и поэтому:
- скорректируйте, если нужно, клинически определенную дегидратацию/гиповолемию при помощи изотонических полиионных жидкостей (например, раствора Рингер-Лактат);
- животные должны иметь постоянный доступ к свежей воде для питья.
Системная гипертония:
Уровень системной артериальной гипертензии (АГ) при котором может развиться поражение почек не известен.
Наша цель состоит в том, чтобы снизить систолическое АД до уровня
Если нет прямых доказательств повреждения целевых органов, но уровень систолического АД у животного постоянно превышает 160 мм. рт. ст., то лечение гипертензии все равно должно быть начато.
Стойкое повышение уровня АД должно быть зарегистрировано при многократных измерениях и соотнесено с промежутком временным в течении которого патология персистировала. В зависимости от этого выделяют:
- умеренный риск (AP2): АД находилось в пределах 160-179 мм. рт. ст. в течение 1-2 месяцев;
- серьезный риск (AP3): АД ≥ 180 мм. рт. ст. в течение 1-2 недель.
Если же у пациента диагностируется поражение какого-либо целевого органа (например, ярко выраженные изменения на глазном дне- Р.Л.), то его лечение должно быть начато даже если уровень АД находиться в пределах нормы.
Постепенная нормализация уровня кровяного давления является долгосрочной целью в лечении пациентов с ХБП, избегая при этом внезапного и/или значительного снижению АД и развития гипотонии.
Если же у пациента диагностируется поражение какого-либо целевого органа (например, ярко выраженные изменения на глазном дне- Р.Л.), то его лечение должно быть начато даже если уровень АД находиться в пределах нормы.
Постепенная нормализация уровня кровяного давления является долгосрочной целью в лечении пациентов с ХБП, избегая при этом внезапного и/или значительного снижению АД и развития гипотонии.
Логический пошаговый подход к контролю АГ следующий:
Уменьшение потребления поваренной соли. Нет ни каких доказательств того, что уменьшение потребления Na+способствует снижению уровня АД. Поэтому диетотерапия со сниженным содержанием соли должна сочетаться с медикаментозным лечением гипертензии.
2. Блокаторы БКК, например, амлодипин.
Увеличьте дозу амлодипина до 0,5 мг/кг в день.
Сочетайте иАПФ и БКК.
Позаботьтесь о том чтобы не начинать лечение БКК/иАПФ у нестабильных обезвоженных кошек, у которых уровень клубочковой фильтрации может стремительно упасть, если начать вводить эти препараты до того как пациент будет адекватно гидротирован.
Контроль ответа на антигипертензивную терапию:
Кошкам с гипертензией обычно показана пожизненная терапия, которая должна корректироваться в зависимости от потребностей пациента. Важно последовательное мониторирование. После стабилизации, контроль уровня АД должен происходить, по крайней мере, каждые 3 месяца.
АД
Уровень креатининемии. Снижение АД может привести к незначительному повышению концентрации уровня креатинина (<0,5 мг/дл или 45 мкмоль/л). Но более значительное увеличение уровня креатининемии, скорее всего, свидетельствует о неблагоприятном влиянии препарата и прогресссировании почечной дисфункции.
Протеинурия:
Кошки на III стадии с UP/C >0,4 должны быть обследованы с целью выявления болезней, приведших к появлению протеинурии (см. пп. 1-2 ниже), а затем необходимо предпринять меры для её лечения (см. пункты 3 и 4 ниже).
Животные с пограничной протеинурией (UP/C от 0,2 до 0,4) требуют тщательного мониторинга (см. 1 ниже).
Постарайтесь выявить любой сопутствующий заболеванию патологический процесс, который можно вылечить или скорректировать.
Рассмотрите возможность проведения почечной биопсии (пункционной- Р.Л.) как варианта для идентификации нозологической формы нефропатии (проконсультируйтесь с экспертом, если не уверены в целесообразности её проведения).
иАПФ плюс почечная диетотерапия.
Контролируйте эффективность лечения/ прогрессирования заболевания:
- стабилизация концентрации креатинина и уменьшение индекса UP/C – положительный ответ (замедление темпов деструкции в почечной паренхиме – Р.Л.);
- прогрессирующее увеличение концентрации креатинина в крови и/или значения индекса UP/C – болезнь прогрессирует.
Обычно требуется пожизненная терапия, если основное заболевание не было устранено. При этом дозы (лекарственных средств – Р.Л.) могут быть сокращены, но при постоянном контроле индекса UP/C.
Примечания:
а. Использование иАПФ противопоказано животным, которые имеют клинические признаки обезвоживания и/или гиповолемии.
Обязательно гидротируйте пациента перед использованием этих препаратов, иначе СКФ может значительно снизиться.
б. Кошки с протеинурией и гипоальбуминемией, вероятно, имеют риски развития тромбоэмболии, так же как и собаки. Однако использование аспирина у этого вида животных для достижения значимого антиагрегантного эффекта затруднено.
Предложено использование аспирина в дозе 1 мг/кг каждые 72 часа, в том случае, если уровень альбуминемии у пациента ниже 20 г/л (2 г/дл).
Сокращение потребления фосфата:
Данные свидетельствуют, что хроническое сокращение потребления фосфата, что бы поддержать его плазменную концентрацию ниже 1,5 ммоль/л (но не меньше чем 0,9 ммоль/л или 4.6 мг/дл, но не > 2,7 мг/дл), благоприятно для пациентов с ХБП. Для кошек на III стадии ХБП более реалистичной является достижение плазменной концентрации фосфата < 1,6 ммоль/л (5,0 мг/дл).
Для достижения этого могут быть последовательно предприняты следующие меры:
Диетическое сокращение фосфата (почечная диетотерапия).
Если плазменная концентрация фосфата остается выше 1,6 ммоль/л (5 мг/дл) после его диетического ограничения, используйте кишечные фосфат-байндеры[6] (например, гидроокись или карбонат алюминия, карбонат кальция[7], ацетат кальция, карбонат лантана), эффективные дозы, которых начинаются с 30-60 мг/кг/сут. Препараты следует давать вместе с едой, разделив суточную дозу на количество приемов пищи. Необходимая доза изменяется в зависимости от количества поступающего с пищей фосфата и стадии ХБП по классификации IRIS. Лечение фосфат-байндерами должно приводить к должному эффекту, обрисованному в общих чертах ранее. Верхняя доза, используемого препарата ограничивается развитием интоксикации у каждого конкретного пациента.
Мониторинг содержания кальция и фосфата в сыворотке крови необходимо проводить каждые 4-6 недель до стабилизации и затем каждые 12 недель.
Микроцитоз и/или общая мышечная слабость являются свидетельством алюминиевой интоксикации, вызванной алюминий-содержащим фосфат- байндером и требует перехода на другой препарат из этой группы. Гиперкальциемии, в некоторых случаях, можно избежать комбинируя алюминий- и кальций-содержащие фосфат-байндеры.
Хотя имеются доказательства того, что разумное использование кальцитриола, оказывает положительное влияние на сроки выживания у собак на III стадии ХБП по классификации IRIS, свидетельств благоприятного воздействия ультранизких доз этой активная форма витамина Д3 на кошек пока не получено.
Метаболический ацидоз:
Если у пациента однажды диагностирован метаболический ацидоз (бикарбонат крови или общий CO2 2 в диапазоне от 16 до 24 ммолей/л.
Дополнительные рекомендации для пациентов на III стадии:
Если у пациента диагностирована гипокалиемия, то для коррекции состояния к терапии необходимо добавить глюконат или цитрат калия (как правило, 1-2 ммоль/кг/день).
Рассмотрите возможность лечения анемии, если это может оказать положительное влияние на качество жизни пациента. Необходимость этого, как правило, возникает, тогда, когда гематокрит[8]
Лечение рвоты/ сниженного аппетита/ тошноты производят с помощью ингибиторов протоновой помпы (например, омепрозол) и противорвотных препаратов (например, маропитант или ондансетрон). Однако необходимо проведение дальнейших исследований с целью установления рациональности использования этих препаратов у животных с нарушениями в желудочно –кишечном тракте при ХБП и уремии.
Проведите адекватное парентеральное введение жидкостей[9] в объеме, необходимом для гидратации пациента.
Лекарственные препараты, которые элиминируются из организма в основном через почки, должны использоваться с осторожностью у пациентов на III стадии ХБП. Это необходимо, что бы подобрать дозу этих препаратов (в зависимости от широты их терапевтического индекса), во избежание их накопления в организме.
Стадия 4. Кошки
Все вышеупомянутые рекомендации и замечания для кошек, находящихся на I, II и III стадии ХБП, плюс нижеследующие дополнительные мероприятия.
Прекратите, по возможности, использование всех потенциально нефротоксичных препаратов (если не имеется жизненно важных показаний к их применению - Р.Л.).
Диагностируйте и, при необходимости проведите адекватное лечение всех патологических состояний, способных вызвать пре- и постренальную почечную недостаточность (гиповолемия, гипотензия, острая задержка мочи т.д. – Р.Л.).
Исключите любые потенциально поддающиеся излечению заболевания, такие как пиелонефрит и/или инфекция мочевыделительного тракта, а так же визуализируемый при УЗИ и/или рентгенографии, ренальный уролитиаз.
У пациента должен быть определен уровень кровяного давления и соотношение белок/креатинин мочи (UP/C).
Почечная диетотерапия.
Лечение обезвоживания:
У этих пациентов снижена способность к концентрации мочи и поэтому:
- скорректируйте, если нужно, клинически определенную дегидратацию/гиповолемию при помощи изотонических полиионных жидкостей (например, раствора Рингер-Лактат);
- животные должны иметь постоянный доступ к свежей воде для питья.
Системная гипертония:
Уровень системной артериальной гипертензии (АГ) при котором может развиться поражение почек не известен.
Наша цель состоит в том, чтобы снизить систолическое АД до уровня
Если нет прямых доказательств повреждения целевых органов, но уровень систолического АД у животного постоянно превышает 160 мм. рт. ст., то лечение гипертензии все равно должно быть начато.
Стойкое повышение уровня АД должно быть зарегистрировано при многократных измерениях и соотнесено с промежутком временным в течении которого патология персистировала. В зависимости от этого выделяют:
- умеренный риск (AP2): АД находилось в пределах 160-179 мм. рт. ст. в течение 1-2 месяцев;
- серьезный риск (AP3): АД ≥ 180 мм. рт. ст. в течение 1-2 недель.
Если же у пациента диагностируется поражение какого-либо целевого органа (например, ярко выраженные изменения на глазном дне- Р.Л.), то его лечение должно быть начато даже если уровень АД находиться в пределах нормы.
Постепенная нормализация уровня кровяного давления является долгосрочной целью в лечении пациентов с ХБП, избегая при этом внезапного и/или значительного снижению АД и развития гипотонии.
Логический пошаговый подход к контролю АГ следующий:
Уменьшение потребления поваренной соли. Нет ни каких доказательств того, что уменьшение потребления Na+способствует снижению уровня АД. Поэтому диетотерапия со сниженным содержанием соли должна сочетаться с медикаментозным лечением гипертензии.
БКК, например, амлодипин.
Увеличьте дозу амлодипина до 0,5 мг/кг в день.
Сочетайте иАПФ и БКК.
Позаботьтесь о том чтобы не начинать лечение БКК/иАПФ у нестабильных обезвоженных кошек, у которых уровень клубочковой фильтрации может стремительно упасть, если начать вводить эти препараты до того как пациент будет адекватно гидротирован.
Контроль ответа на антигипертензивную терапию:
Кошкам с гипертензией обычно показана пожизненная терапия, которая должна корректироваться в зависимости от потребностей пациента. Важно последовательное мониторирование. После стабилизации, контроль уровня АД должен происходить, по крайней мере, каждые 3 месяца.
АД
Уровень креатининемии. Снижение АД может привести к незначительному повышению концентрации уровня креатинина (<0,5 мг/дл или 45 мкмоль/л). Но более значительное увеличение уровня креатининемии, скорее всего, свидетельствует о неблагоприятном влиянии препарата и прогрессировании почечной дисфункции (однако снижение уровня креатинина крови у пациентов на этой стадии очень часто происходит не из-за благоприятного влияния лекарственных препаратов, а по причине резкого сокращения мышечной массы -Р.Л.).
Протеинурия:
Кошки на IV стадии с UP/C >0,4 должны быть обследованы с целью выявления болезней, приведших к появлению протеинурии (см. пп. 1-2 ниже), а затем необходимо предпринять меры для её лечения (см. пункты 3 и 4 ниже).
Животные с пограничной протеинурией (UP/C от 0,2 до 0,4) требуют тщательного мониторинга (см. 1 ниже).
Постарайтесь выявить любой сопутствующий заболеванию патологический процесс, который можно вылечить или скорректировать.
Рассмотрите возможность проведения почечной биопсии (пункционной- Р.Л.) как варианта для идентификации нозологической формы нефропатии (проконсультируйтесь с экспертом, если не уверены в целесообразности её проведения).
иАПФ плюс почечная диетотерапия.
Контролируйте эффективность лечения/ прогрессирования заболевания:
- стабилизация концентрации креатинина и уменьшение индекса UP/C – положительный ответ (замедление темпов деструкции в почечной паренхиме – Р.Л.);
- прогрессирующее увеличение концентрации креатинина в крови и/или значения индекса UP/C – болезнь прогрессирует.
Обычно требуется пожизненная терапия, если основное заболевание не было устранено. При этом дозы (лекарственных средств – Р.Л.) могут быть сокращены, но при постоянном контроле индекса UP/C.
Примечания:
а. Использование иАПФ противопоказано животным, которые имеют клинические признаки обезвоживания и/или гиповолемии.
Обязательно гидротируйте пациента перед использованием этих препаратов, иначе СКФ может значительно снизиться.
б. Кошки с протеинурией и гипоальбуминемией, вероятно, имеют риски развития тромбоэмболии, так же как и собаки. Однако использование аспирина у этого вида животных для достижения значимого антиагрегантного эффекта затруднено.
Предложено использование аспирина в дозе 1 мг/кг каждые 72 часа, в том случае, если уровень альбуминемии у пациента ниже 20 г/л (2 г/дл).
Сокращение потребления фосфата:
Данные свидетельствуют, что хроническое сокращение потребления фосфата, что бы поддержать его плазменную концентрацию ниже 1,5 ммоль/л (но не меньше чем 0,9 ммоль/л или 4.6 мг/дл, но не > 2,7 мг/дл), благоприятно для пациентов с ХБП. Для кошек на IV стадии ХБП более реалистичной является достижение плазменной концентрации фосфата < 1,9 ммоль/л (6,0 мг/дл).
Для достижения этого могут быть последовательно предприняты следующие меры:
Диетическое сокращение фосфата (почечная диетотерапия).
Если плазменная концентрация фосфата остается выше 1,9 ммоль/л (6 мг/дл) после его диетического ограничения, используйте кишечные фосфат-байндеры (например, гидроокись или карбонат алюминия, карбонат кальция, ацетат кальция, карбонат лантана), эффективные дозы которых начинаются с 30-60 мг/кг/сут. Препараты следует давать вместе с едой, разделив суточную дозу на количество приемов пищи. Необходимая доза изменяется в зависимости от количества поступающего с пищей фосфата и стадии ХБП по классификации IRIS. Лечение фосфат-байндерами должно приводить к должному эффекту, обрисованному в общих чертах ранее. Верхняя доза, используемого препарата ограничивается развитием интоксикации у каждого конкретного пациента.
Мониторинг содержания кальция и фосфата в сыворотке крови необходимо проводить каждые 4-6 недель до стабилизации и затем каждые 12 недель.
Микроцитоз и/или общая мышечная слабость являются свидетельством алюминиевой интоксикации, вызванной алюминий-содержащим фосфат- байндером и требует перехода на другой препарат из этой группы. Гиперкальциемии, в некоторых случаях, можно избежать комбинируя алюминий- и кальций-содержащие фосфат-байндеры.
Хотя имеются доказательства того, что разумное использование кальцитриола, оказывает положительное влияние на сроки выживания у собак на IV стадии ХБП по классификации IRIS, свидетельств благоприятного воздействия ультранизких доз этой активная форма витамина Д3 на кошек пока не получено.
Метаболический ацидоз:
Если у пациента однажды диагностирован метаболический ацидоз (бикарбонат крови или общий CO2 2 в диапазоне от 16 до 24 ммолей/л.
Дополнительные рекомендации для пациентов на IV стадии:
Если у пациента диагностирована гипокалиемия, то для коррекции состояния к терапии необходимо добавить глюконат или цитрат калия (как правило, 1-2 ммоль/кг/день).
Рассмотрите возможность лечения анемии, если это может оказать положительное влияние на качество жизни пациента. Необходимость этого, как правило, возникает, тогда, когда гематокрит
Лечение рвоты/ сниженного аппетита/ тошноты производят с помощью ингибиторов протоновой помпы (например, омепрозол) и противорвотных препаратов (например, маропитант или ондансетрон). Однако необходимо проведение дальнейших исследований с целью установления рациональности использования этих препаратов у животных с нарушениями в желудочно –кишечном тракте при ХБП и уремии.
Проведите адекватное парентеральное введение жидкостей[10] в объеме, необходимом для гидратации пациента.
Приложите все возможные усилия для профилактики дефицита у пациента в организме белков/ калорий. Рассмотрите возможность принудительного кормления пациента через интервенционную трубку (например, через чрезкожную гастростому).
Приложите все возможные усилия для предотвращения развития у пациента обезвоживания. Пищеводные зонды для введения питательных смесей могут так же могут помочь в контроле уровня гидратации организма.
Рассмотрите возможность диализа и/или почечной трансплантации.
Лекарственные препараты, которые элиминируются из организма в той или иной степени через почки (или метаболизируются в них -Р.Л.), должны использоваться с осторожностью у пациентов на IV стадии ХБП. Возможно необходимо будет скорректировать дозу препаратов (как правило уменьшить её в два и более раза –Р.Л.), в зависимости от ширины терапевтического индекса лекарственного средства, во избежание его накопления (или его метаболитов –Р.Л.) в организме.
Приложение 1
Адаптированная подорганизация уровней кровяного давления
Признано, что некоторые породы, особенно собак, склонны иметь более высокий уровень кровяного давления, чем в популяции в целом.
Поэтому, имея дело с породами, для которых характерно более высокое кровяное давление, классификация рисков поражения органов – мишеней[11] может быть пересмотрена следующим образом:
Высокий риск: >40 мм. рт. ст. выше установленного справочного диапазона;
Умеренный риск: от 20 до 40 мм. рт. ст. выше установленного диапазона;
Низкий риск: от 10 до 20 мм. рт. ст. выше установленного диапазона;
Минимальный риск: менее 10 мм. рт. ст. выше установленного диапазона.
Приложение 2
Показания к проведению нефробиопсии (пункционной -Р.Л.)
Реномегалия
ХБП у молодого пациента
Стойкая и тяжелая протеинурия (UP/C >2,0) у не азотемического пациента
Усугубление тяжести протеинурии у пациента с ХБП
Острая почечная недостаточность, в том случае, когда биопсия может помочь в определении прогноза заболевания
Отказ от ответственности (дисклеймер[12])
Хотя были предприняты все усилия, чтобы гарантировать полноту и точность вышеизложенной информации для обеспечения здоровья животных ни совет IRIS ни Novartis Animal Health не принимает на себя ответственность за полноту и точность информации. Вся информация представлена без каких-либо гарантий выраженных или подразумеваемых.
Литература
http://www.iris-kidney.com
Таблица 1. Степени ХБП у собак и кошек по классификации IRIS
Степени ХБП |
Концентрация креатинина в плазме μmol/l mg/dl |
Комментарии |
|
Собаки |
Кошки |
||
Норма |
<125 <1.4 |
<140 <1.6 |
Группа риска по ХБП. Пациенты, попадающие в «группу риска», должны проходить регулярное обследование, и должны предприниматься меры для уменьшения факторов риска. |
1 |
<125 <1.4 |
<140 <1.6 |
Неазотемическая форма. Любая другая нефропатия, например неадекватная концентрирующая способность почек без явно выявляемой причины, связанной с нефропатией. Выявление отклонений при пальпации и/или при дополнительных инструментальных методах диагностики почек. Устойчивое повышение содержания белка в моче (почечного происхождения). Отклонения при биопсии почек. Прогрессирующее повышение содержания креатинина в сыворотке. |
2 |
125 - 180 1.4 - 2.0 |
140 - 250 1.6 - 2.8 |
Легкая ренальная азотемия. Нижний порог этого диапазона лежит в пределах границы диапазона нормы для многих лабораторий. Но нечувствительность к креатинину при проведении скрининг–теста означает, что животные с уровнем креатинина, близким к верхнему пределу нормы, часто имеют проблемы с выделительной системой. Клинические признаки легкой степени тяжести либо отсутствуют. |
3 |
181 - 440 2.1 - 5.0 |
251 - 440 2.9 – 5.0 |
Умеренная почечная азотемия. Могут присутствовать многие системные клинические признаки. |
4 |
>440 >5.0 |
>440 >5.0 |
Тяжелая ренальная азотемия. Присутствуют клинические признаки системных поражений. |
[1] Следует обратить внимание на то, что первая стадия ХБП по классификации IRIS не является гипер-азотемической.
[2] Ранняя вторая стадия была в некоторых публикациях определена как состояние, при котором уровень креатинина находился в пределах второй стадии ХБП по классификации IRIS, но при этом был ниже верхней границы справочного диапазона для этого показателя в конкретной лаборатории.
[3] Одно из значений англ. слова binder-это связывать (Р.Л.).
[4] Вместе с хитозаном входит в состав таких зарегистрированных в РФ ветеринарных фосфат-байндеров, как Ренал (Кандиоли) и Ипакетине (Р.Л.).
[5] В медицине человека алюминий-содержащие фосфат-байндеры (например, включающий в себя гидроксид алюминия (он же алгелдрат) препарат Алмагель) из-за их токсичности, значительно возрастающей при длительном использовании, практически не применяются. Кроме того, в эти препараты добавлены мятный или апельсиновый ароматизаторы, обычно вызывающие отвращение у кошек. Единственным преимуществом перед другими препаратами из этой группы является их низкая стоимость (Р.Л.).
[6] Одно из значений англ. слова binder-это связывать (Р.Л.).
[7] Вместе с хитозаном входит в состав таких зарегистрированных в РФ ветеринарных фосфат-байндеров, как Ренал (Кандиоли) и Ипакетине (Р.Л.).
[8] В оригинале употреблен такой идентичный гематокриту термин как PCV (packed cell volume), эквивалент которого редко встречается в русскоязычной литературе.
[9] Жидкости необходимые для гидратации организма должны содержать низкое количество натрия (30-40 ммоль/л). В идеале к ним следует добавить калий (около 13 ммоль/л), чтобы удовлетворить суточные потребности в жидкости и электролитах (например, Normosol-M или 5% декстроза с добавлением 0,18% NaCl плюс KCl)/
[10] Жидкости необходимые для гидратации организма должны содержать низкое количество натрия (30-40 ммоль/л). В идеале к ним следует добавить калий (около 13 ммоль/л), чтобы удовлетворить суточные потребности в жидкости и электролитах (например, Normosol-M или 5% декстроза с добавлением 0,18% NaCl плюс KCl).
[11] Современная классификация уровней кровяного давления предполагает разделение его не на легкую, среднюю или тяжелую степени, а иначе, в зависимости от риска поражения органов мишеней (ССС, ЦНС, глаза и т.д.) Р.Л.
[12] Дисклеймер (англ. Disclaimer) — письменный отказ от ответственности за возможные деликатные последствия того или иного поступка в результате действий заявившего данный отказ либо третьих лиц. Под деликтными понимаются любые виды ответственности заявителя.
Нефропатии собак и кошек и артериальная гипертензия
Автор: к.в.н. Роман-А. Леонард, практикующий ветеринарный врач, руководитель Центра ветеринарной нефрологии и урологии, президент Российской Научно-практической Ассоциации Ветеринарных Нефрологов и Урологов (НАВНУ)
Основные положения
В поддержании уровня артериального давления (АД) в организме участвует большое количество различных систем и органов. В норме почкам принадлежит важная (а в некоторых случаях и ведущая) роль в контроле АД.
Выделяют два тесно взаимосвязанных ренальных механизма регуляции и поддержания нормального уровня АД: краткосрочный (реализуемый через барорецепторы, расположенные в стенках сосудов, и контролируемый ЦНС) и долгосрочный (регулируемый ренин-ангиотензин-альдостероновой системой (РААС), продукцией почечной паренхимы различных вазоактивных веществ и натрий-объем-зависимыми механизмами гломерулотубулярной обратной связи).
На сегодняшний день считается доказанными большое число разнообразных механизмов возникновения и последующей хронизации артериальной гипертензии (АГ), в различной степени связанных с заболеваниями почек. Однако при изучении формирования почечной гипертензии (ПГ) исследователи постоянно сталкиваются с очевидными противоречиями, регулярно порождающими новые и новые вопросы.
Нарушения, прежде всего, в долгосрочной регуляции почками АД приводит к формированию стойкой АГ, к числу наиболее значимых последствий которой относится поражение (как правили необратимое) т.н. органов-мишеней (ЦНС, сердечно-сосудистая система (ССС), глаза, почки).
У каждого пациента к развитию АГ (не исключением является и ПГ) приводит сочетание различных как по характеру, так и по интенсивности нарушений в регуляции АД. Это требует от клинициста индивидуального подхода к каждому пациенту с гипертензией.
ПГ у собак и кошек обычно коррелирует с тяжестью протеинурии и, напротив, напрямую не зависит от уровня креатининемии, т.е. стадии хронической болезни почек (ХБП).
Заболевания почек и АГ всегда усугубляют течение друг друга, стремительно замыкая течение своих патогенезов в порочный круг. Поэтому вопрос о том, что явилось первопричиной развития патологии, нефропатия или гипертензия, обычно остается открытым.
Введение
В последние два десятилетия в ветеринарной медицине были кардинально пересмотрены представления о происхождении и течении АГ и ее участии в этиопатогенезе различных заболеваний. А развитие современных медицинских технологий, позволившее относительно точно измерять уровень кровного давления у мелких домашних животных, привело к тому, что контроль АГ все шире используется в клиниках по всему миру.
Нормальный уровень кровяного давления (а гипотония во многих случаях может представлять для пациента даже большую опасность, чем гипертония) жизненно необходим для нормального функционирования как каждого отдельного органа, так и организма в целом.
Так при систолическом давлении ниже 70-80 мм рт.ст. даже мощная система саморегуляции интрогломерулярного кровотока почек не способна сохранять необходимый для фильтрации уровень давления, и мочеобразование прекращается. В дальнейшем это может стремительно привести к спаданию и слипанию капиллярных петель клубочка с последующим исключением их из процессов перфузии. Неизбежным итогом этого является выраженная эндотелиальная дисфункция, инициирующая в последующем необратимые процессы фатальной репарации и гломеруло- и нефросклероза.
АГ же опасна прежде всего из-за значительного повышения вероятности поражения так называемых «органов-мишений»[1], дисфункция которых может иметь далеко идущие последствия для всего организма пациента, значимо снижать его качество жизни и даже привести к гибели.
АГ является не только существенным фактором усугубления течения большинства нефропатий, но и сама по себе (будучи первична) способна привести к тяжелому и необратимому поражению почечной паренхимы с исходом в тяжелые формы хронической почечной недостаточности (ХПН). Доказано, что АГ и нефропатии практически всегда усугубляют течение друг друга.
АД и его регуляция
Величина АД напрямую связана с уровнем сердечного выброса и общего периферического сопротивления всех сосудов организма. А сердечный выброс находится в зависимости от ударного объема (обусловливающегося, в свою очередь, венозным возвратом и сократимостью миокарда) и интенсивности частоты сердечных сокращений (ЧСС).
Уровень АД по принципу обратной связи регулируется через барорецепторы, находящиеся практически во всех сосудах организма. Они посылают сигналы в ЦНС, которая, в свою очередь, через вегетативную нервную систему передает импульсы к надпочечникам, сердечной мышце и сосудам. В ответ на изменение стимуляции и уровня катехоламинов (прежде всего адреналина и норадреналина) корректируется ЧСС и тонус сосудов.
Также велико влияние на АД различных вазоактивных веществ, в большом количестве секретируемых эндотелием сосудов (оксид азота, эндотелиин-1 и т.д.), РААС (АГII, альдостерон), предсердного натрий-уретического гормона(мощный вазодилятатор, образуемый кардиомиоцитами предсердий и снижающий уровень секреции ренина и альдостерона), калликреин-кининовой системы (прежде всего такого ее компонента, как сосудорасширяющий пептид брадикинин) и антидиуретического гормона ((АДГ); увеличивает реабсорбцию воды почками и, следовательно, повышает концентрацию мочи и объем циркулирующей крови, а также имеет ряд эффектов на кровеносные сосуды и головной мозг).
Одно из ключевых мест в поддержании нормального уровня АД (равно как и в развитии АГ) принадлежит почкам, работа которых во многом является автономной и не зависит от ЦНС.
Эндотелий сосудов почек — это очень важная и наиболее «проблемная» часть всего эндотелиального дерева организма (а в целом масса этой железы внутренней секреции, например, у взрослого человека составляет около 2 кг), прежде всего в силу чрезвычайно активного (и зачастую избыточного) ответа на повреждение, сопровождающегося интенсивным выбросом вазоконстрикторов, коагулянтов, факторов роста и агрегантов. Причем синтез этих БАВ-веществ имеет негативные последствия не только для интрагломерулярного кровотока и почечной паренхимы, но и для всего организма в целом и является одной из весомых причин формирования стойкой системной АГ.
Артериальная гипертензия
В настоящее время под АГ[2] понимают стойкое повышение артериального давления, которое превосходит его нормальные значения для конкретного пациента (поэтому нормы уровня АД, принятые для мелких домашних животных, имеющих выраженный внутривидовой полиморфизм размеров и массы тела, до некоторой степени могут считаться условными[3]).
Но так как скрининговое измерение[4] этого важного физиологического показателя у животных производится в клиниках довольно редко, то все-таки целесообразно в качестве референсных значений принять нормальный уровень кровяного давления для собак и кошек, установленный Veterinary Blood Pressure Society (www.vbps-online.org) и International Renal Interest Society[5] (www.iris-kidney.com) (таблица 1).
Системная артериальная гипертензия (АГ) представляет опасность прежде всего из-за того, что она способна привести к поражению различных органов-мишеней:
почки (из-за развивающейся гиперфильтрации, приводящей последовательно к повышению гидростатического давления в капиллярных петлях клубочка и к появлению функциональных, а затем и необратимых морфологических изменений в ренальной паренхиме),
глазных яблок (прежде всего сетчатки и сосудистой оболочки, приводящее к частичной или полной потере зрения),
головного мозга и ССС[6].
Поэтому степень тяжести АГ предложено разделять не на легкую, среднюю или тяжелую, а иначе — в зависимости от уровня риска поражения органов-мишеней, которое она потенциально может вызвать (таблица 1). Также общепризнано, что АГ — это не только симптом различных заболеваний, но и самостоятельная патология, способная даже в случае легкой степени тяжести привести, как указывают некоторые авторы, к очень тяжелым последствиям для здоровья пациента.
У собак и кошек может быть повышено как только систолическое, так и только диастолическое артериальное давление (т.н. изолированная систолическая и диастолическая гипертензия). Но каждый из этих видов гипертензии также может привести к значимым изменениям в органах-мишенях. Так, например, почечная гипертензия (ПГ) на начальных этапах ее развития у человека зачастую характеризуется лишь изолированным диастолическим компонентом. Поэтому клинический подход, основанный на измерении только систалического или только диастолического давления у пациента, должен быть признан неверным.
У человека наиболее часто (около 90% случаев) выявляется первичная (она же эссенциальная) системная гипертензия[7]. Диагностируется она тогда, когда причину развития данной патологии установить не удается. У животных подобный вид гипертензии встречается значительно реже и в литературе обычно называется идиопатической[8] АГ.
Собаки и кошки, напротив, чаще страдают от вторичной гипертензии, которая является прямым следствием:
какого-либо заболевания (нефро- и кардиопатии, акромегалии, анемии, гиперэстрогенизма, гипер- и гипотиреоза, ожирения, гиперадренокортицизма, сахарного диабета, острой уремии, гиперальдостеронизма, феохромацитомы и различных неврологических расстройств) или
длительного использования лекарственных средств, способных значимо увеличить объем циркулирующей крови или обладающих вазоконстрикционными или положительными инотропными эффектами.
Еще одной распространенной причиной повышения АД у животных (особенно у кошек) может быть названа так называемая гипертония «белого халата», обычно возникающая вследствие краткосрочной реакции на стресс или какую-либо напряженную ситуацию. Непосредственной причиной этого вида гипертензии, дифференцируемой, как это ни странно, и у человека, является гиперактивация симпато-адреналовой[9] и плазменного (быстрореагирующего) компонента ренин-ангиотензин-альдостероновой систем (РААС).
Гипертония «белого халата» может привести к необоснованному назначению антигипертензивных препаратов. Поэтому к процедуре определения уровня АД у собак и кошек предъявляется целый ряд особых требований, таких как: современный прибор для определения кровяного давления у мелких домашних животных (на сегодняшний день для этого наиболее широко используются аппараты, основанные на эффекте Доплера и конвенционной или высокочеткой осцилометрии), отдельная тихая комната для проведения процедуры, квалифицированный ветеринарный специалист, не менее чем пятикратное последовательное измерение (затем искомый показатель высчитывается как средняя величина) и т.д. Измерения АД проводят обычно на хвосте, предплечье или предплюсне.
Но с другой стороны, если у пациента выявляется поражение какого-либо органа-мишени (особенно глаз и/или ЦНС и ССС), то решение о начале терапии АГ должно быть принято как можно быстрее, даже в том случае если у врача остаются сомнения относительно точности проведенного измерения. Однако для контроля развития гипотонии у пациента необходимо динамическое наблюдение, включающее регулярное измерение АД.
Таблица 1. Дифференциальная диагностика АГ в зависимости от риска поражения органов-мишеней
Категория риска поражения органов-мишеней |
Систолическое кровяное давление |
Диастолическое кровяное давление |
Риск поражения органов-мишеней |
I |
<150 |
<95 |
Минимальный |
II |
150-159 |
95-99 |
Легкий |
III |
160-179 |
100-119 |
Умеренный |
IV |
>180 |
>120 |
Тяжелый |
Роль почек в поддержании и контроле АД
Одним из важнейших структурообразующих и функциональных элементов почек являются микрокапиллярные сосуды. Совокупность афферентных и эфферентных артериол и сосудистых петель клубочка образует первичную микрокапиллярную сеть почки, а артериоллы и венулы, оплетающие канальцы, — вторичную. От 15 до 25% крови от сердечного выброса непрерывно проходит через сосуды коркового слоя[10], этого относительно небольшого, составляющего не более 0,4-0,5% от массы тела парного органа.
Такое колоссальное кровообращение связано в почках не с большими энергетическими затратами и высокой потребностью в кислороде, а с непрерывно протекающими процессами мочеобразования, т.е. с регуляторной и выделительной функциями этого органа. Особое строение артериол клубочка (а проницаемость их стенки (фильтрационного барьера) для жидкой части крови в 400 раз превосходит таковую для других сосудов) позволяет им фильтровать первичную мочу. А афферентные и эфферентные артериолы, меняя диаметр своего просвета, способны эффективно поддерживать оптимальное для этого процесса внутриклубочковое давление в широком диапазоне системного (от 80 до 170 мм рт. ст.). Таким образом, скорость клубочковой фильтрации (СКФ) и процессы мочеобразования в норме не имеют прямой зависимости от объема кровоснабжения почек.
В дальнейшем, проходя по канальцам, первичная моча в результате процессов реабсорбции освобождается от необходимых для организма веществ. В это же время в канальцы из перитубулярной сети секретируются «лишние» для организма соединения, которые по различным причинам в необходимом объеме не попали в первичную мочу в процессе фильтрации. Так, например, при тяжелых степенях хронической болезни почек (ХБП) значительная часть креатинина попадает в мочу именно в результате процессов канальцевой секреции.
Выделяют два механизма регуляции интраренальной гемодинамики: краткосрочный, управляемый ЦНС через симпато-адреналовую систему (САС), и долговременный, прямо или косвенно связанный с почечной аутогуляцией.
Краткосрочная регуляция. ЦНС регулирует уровень внутрипочечного кровотока и внутриклубочкового кровяного давления в результате комплекса нейрогуморальных влияний на тонус приносящей (афферентной) и выносящей (эфферентной) артериол клубочка.
Управление как прессорными, вызывающими вазоконстрикцию, так и депрессорными, вызывающими вазодилатацию, реакциями инициируется бульбарными сосудодвигательными центрами, контролируемыми гипоталамическими, лимбикоретикулярными структурами и корой головного мозга. Информацию об изменении кровотока и/или давления в почечных сосудах ЦНС получает через симпатическую нервную систему от барорецепторов, расположенных в стенках ренальных артерий и первичной микрокапиллярной сети почек.
Однако роль ЦНС в регуляции СКФ (а значит, и процессов мочеобразования) через активацию САС и баррорецепторный механизм является кратковременной и значимой только при тяжелых острых нарушениях гомеостаза (например, массивная кровопотеря). При хронически протекающих процессах барорецепторы, расположенные в сосудах, быстро адаптируются к долговременному изменению АД и через какое-то время перестают «информировать» ЦНС о возникших нарушениях, расценивая их как норму[11]. В долгосрочной перспективе сбой в работе этой системы чреват развитием только лабильной (непостоянной) АГ, обычно не имеющей тяжелых последствий.
Долговременная регуляция почечного кровотока, нарушения в которой обычно и приводят к развитию стойкой АГ, осуществляется через миогенные механизмы, различные вазоактивные вещества, тканевую РААС и натрий-объем-зависимый механизм гломерулотубулярной обратной связи. А поскольку долговременная регуляция не зависит ни от ЦНС, ни от биологически активных веществ (БАВ), вырабатывающихся в других местах организма, то ее с полной уверенностью можно назвать автономной почечной ауторегуляцией.
И именно благодаря ей даже полностью денервированные почки (равно как и изолированные препараты этого органа) в полном объеме выполняют все свои метаболические и эндо- и экзогенные функции.
Также в условиях эксперимента доказано, что нарушения в почечной саморегуляции даже при незначительном повышении АД приводит к катастрофическим для организма последствиям, поскольку не только многократно повышается уровень СКФ и образования первичной мочи, но значительно замедляются процессы реабсорбции в канальцах. В итоге животное может потерять большую часть жидкой части крови и погибнуть от тяжелой гиповолемии[12].
Механизмы почечной ауторегуляции
Миогенный механизм ауторегуляции сопротивления почечных сосудов (эффект Бейлиса-Остроумова). Его основой является рефлекторное изменение просвета прегломерулярных сосудов (Aa. Interlobulares и афферентных артериол) в ответ на колебания АД (время реакции около 1 сек.). Так, например, повышенное давление растягивает стенки приносящих сосудов, вызывая в ответ вазоконстрикцию за счет сокращения их гладкомышечной стенки.
При незначительном подъеме АД в первую очередь возникает сужение сосудов, находящихся дальше всего от клубочков, и гипертензия легкой или даже средней тяжести не сказывается на тонусе афферентных артериол и СКФ. Если же давление крови начинает возрастать дальше, то в регуляцию вступают и приносящие артериолы, в стенке которых имеется мощный мышечный валик, значительно усиливающий эффект от их сокращения. И лишь при давлении крови, находящемся за верхними границами ауторегуляции, гипертензия начинает оказывать свое влияние на гломерулярные петли клубочков и выносящие артериолы. Итогом этого могут быть такие патологические состояния, как гиперфильтрация и эндотелиальная дисфункция первичной микрокапиллярной сети.
При гипотензивных состояниях, напротив, прегломерулярные сосуды расширяют свой просвет, увеличивая таким образом почечный кровоток.
Гломеруло-тубулярный механизм обратной связи (равновесия). Еще одним ключевым средством почечной саморегуляции является гломеруло-тубулярный механизм обратной связи. Обмен данными о количестве Na+, K+, Cl- и H2O во вторичной моче между клубочками и канальцами возможен благодаря тому, что важнейшие форменные элементы почечной паренхимы – интракортикальные нефроны (их около 75-85% от общего числа нефронов и именно им принадлежит центральная роль в процессе мочеобразования) имеют замкнутое строение как с анатомической, так и физиологической точек зрения. Дело в том, что на участке между афферентной и эфферентной артериолами, в области плотного пятна (macula densa[13]), дистальный каналец плотно сливается с экстрагломерулярными структурами своего же клубочка (рисунок 1). «Анализируя» через хеморецепторы плотного пятна информацию о составе вторичной мочи, поступающую от канальца, гломерула способна преобразовывать интенсивность своего кровотока путем изменения тонуса приносящей и/или выносящей артериол (время реакции около 10 сек.), подстраивая таким образом СКФ к текущим нуждам водно-солевого гомеостаза организма. Наиболее эффективен этот механизм ауторегуляции при нормальном уровне АД.
Особое место в поддержании процессов почечной саморегуляции принадлежит РААС. В норме эта система предотвращает снижение СКФ при давлении ниже 80-90 мм рт.ст.
РААС — это система ферментов и гормонов, принимающая участие в регулировании артериального (в т.ч. и внутриклубочкового) давления и водно-электролитного баланса у млекопитающих. Доказана значимая роль РААС в процессах клеточной (в т.ч. интрагломерулярной) пролиферации и гипертрофии, а также в воспалительных реакциях на местном и системном уровнях. Поэтому при патологии ее гиперактивация является одним из значимых факторов формирования стойкой АГ.
Одним из начальных звеньев РААС является синтезируемый гранулярными (юкстагломерулярными) клетками гломерул (рис. 1) фермент ренин (схема 1), с помощью которого происходит трансформация вырабатываемого в печени сывороточного глобулина ангиотензиногена в ангиотензин I (АГ I). Синтез ренина осуществляется гранулярными клетками в ответ на снижение давления и/или интенсивности кровотока в первичной микрокапиллярной сети почек. Регулируется образование и секреция ренина различными путями, в т.ч. в результате: 1) стимуляции симпатической нервной системой β-адренорецепторов, 2) действия АГ II и других ангиотензинов (по принципу отрицательной обратной связи), 3) работы гломерулотубулярного механизма обратной связи (при уменьшении поступления ионов натрия и хлора к плотному пятну нефрона), и 4) взаимодействия ЦНС с барорецепторами в стенках приносящей и выносящей артериол.
Затем АГ I, в легких и других органах, различными путями, в т.ч. по так называемому классическому, при взаимодействии с ангиотензин-превращающим ферментом (АПФ[14]), и/или по альтернативному, через химазу, тонин, тканевой активатор плазминоген, катепсин G, сериновые протеазы и т.д., превращается в мощный вазоконстриктор ангиотензин II (АГ II), стимулирующий в дальнейшем, кроме прочего, выработку альдостерона, АДГ и эндотелиина-1 (таблица 2, схема 1).
Также АТ II прямо, воздействуя на тубулярный эпителий, или косвенно, стимулируя секрецию альдостерона, способен эффективно регулировать избирательную реабсорбцию Na+, К+ и Н2О в канальцах, что обусловливает его антидиуретические свойства.
Существуют также внепочечные механизмы активации интраренальной РААС. Связаны они с увеличением выработки ренина юкстагломерулярным аппаратом клубочка под воздействием импульсов, поступающих через β-адренорецепторы от симпато-адреналовой системы. Происходит это также в ответ на снижение интрагломерулярного давления.

В противовес вазоконстрикционным БАВ в ренальной паренхиме также образуются и различные вазодилатирующие и диурез-стимулирующие агенты, такие как брадикинин, Pg I2 (простациклин), Pg E2 (динопростон) и оксид азота (один из сильнейших сосудорасширяющих агентов в организме).
Кроме того, экстрагломерулярные мезангиальные клетки (называемые еще юкставаскулярными, или клетками Гурмагтига), также расположенные между приносящей и выносящей артериолами клубочка (рис. 1), способны синтезировать фермент, разрушающий АГ II – ангиотензиназу и таким образом снижать активность РААС[15].
Из сказанного следует, что почки принимают непосредственное участие в регуляции водно-солевого баланса и важнейших прессорных и депрессорных систем в организме. Поэтому нарушения в их работе, связанные с различными нефропатиями, обычно приводят к развитию стойкой АГ.
Почечная гипертензия
Почечная гипертензия (ПГ) – это системная артериальная гипертензия этиопатогенетически связанная с каким-либо заболеванием почек. Подавляющее большинство из ныне известных хронических нефропатий, как инфекционного, так и неинфекционного характера (аутоиммунные, наследственные, обменные и т.д.), являются причиной ее появления. К развитию ПГ также может приводить одно- или двустороннее поражение почечных артерий и их основных ответвлений. Еще в 1934 году Гольдблатт создал реноваскулярную модель стойкой АГ у собак путем сужения почечной артерии одной из почек. А у человека ангиопластика пораженной почечной артерии или нефрэктомия на стороне стеноза приводит к нормализации кровяного давления.
Поэтому ПГ по происхождению делят на два типа: паренхиматозную и вазоренальную. Возможно и сочетание этих двух типов ПГ.
Ренальную гипертензию можно с уверенностью отнести (как в абсолютном, так и относительном выражении) к одной из лидирующих причин развития стойкой АГ у кошек (Rosanne E. Jepson, Jonathan Elliott, David Brodbelt, and Harriet M. Syme., 2007).
У собак ПГ в целом встречается не так часто, поскольку у этого вида животных значительно реже диагностируются и собственно сами нефропатии.
Сегодня ни у кого не вызывает сомнений, что между заболеваниями почек (причем процесс необязательно должен иметь билатеральный характер) и АГ существует самая тесная взаимосвязь. Еще один из родоначальников современного учения об АГ, Ричард Брайт, уже в XIX веке связал их «навеки вместе». В последующем было открыто множество факторов и механизмов возникновения и закрепления АГ, в большей или меньшей степени имеющих ренальную этиологию. Хотя чем больше данных получают врачи и ученые о взаимосвязи почек и гипертензии и наоборот, тем больше возникает вопросов и даже очевидных противоречий.
Прежде всего, несмотря на высокий уровень современных знаний и далеко шагнувших технологий, не до конца понятно, почему, например, при идентичных заболеваниях и прочих равных условиях у одних пациентов формируется тяжелая стойкая АГ, характеризующаяся поражением органов-мишеней, а у других ее выраженность значительно меньше или она отсутствует вовсе? Иными словами, до сих пор точно не установлена и «расшифрована» часть (возможно, весьма значительная) разнообразных механизмов формирования не только идиопатической, но и вторичной АГ, причина которой вроде бы лежит на поверхности. Особенно много неясного остается, как это ни странно, вокруг так называемой ренальной (почечной) АГ. Ситуация осложняется еще и тем, что практически всегда патогенез нефропатий и АГ замыкается в порочный круг. Поэтому зачастую неразрешенным остается вопрос, какая из патологий возникла раньше.
Хотя справедливости ради нужно отметить, что патогенез первичной и вторичной АГ имеет очень много общего и тактика ведения пациентов если и будет отличаться, то весьма незначительно.
С точки зрения патогенеза ПГ, наиболее значимым местом воздействия различных вазоактивных субстанций являются приносящая и выносящая артериолы клубочка. Именно они, меняя ширину своего просвета, поддерживают в норме достаточное для фильтрации интрагломерулярное давление, а при патологиях дисбаланс в их тонусе способствует развитию явлений гиперфильтрации, практически всегда приводящих к эндотелиальной дисфункции и в последующем к необратимым структурным изменениям в почечной паренхиме (гломеруло-, ангио- и нефросклероз).
Как уже говорилось, в норме, в основном эндотелием сосудов и в юкстагломерулярном аппарате клубочка, образуется большое количество БАВ, обладающих как вазоконстрикционными, так и вазодилятационными свойствами (таблица 2). Именно в раскоординации в образовании и уровне биологической активности, а также нарушениях в механизмах взаимодействия различных вазоактивных субстанций кроется одна из ведущих причин развития как интрагломерулярной, так и системной АГ. Также на почечную гемодинамику могут оказывать существенное влияние различные факторы роста (таблица 2), поскольку увеличение их количества и активности обусловливает процессы гиперклеточности и гипертрофии в гломерулах, что впоследствии приводит как минимум к механическому сдавливанию капиллярных петель клубочка и нарушению циркуляции крови в них.
Следует также отметить, что одни и те же БАВ могут обусловливать противоположные эффекты в почечной паренхиме в зависимости от их концентрации в тканях и/или вариантов воздействия на свои рецепторы различных типов. Так, например, АГ II, прикрепляясь к своим рецепторам первого типа, снижает уровень диуреза, вызывает вазоконстрикцию и пролиферацию клеток, а воздействуя на рецепторы второго типа[16] (их количество значительно возрастает в поврежденных тканях), напротив, обусловливает вазоделятацию, а также антиполиферативные и антигиперклеточные процессы в почечной паренхиме и стимулирует диурез (таблица 2, схема 1).
Таблица 2. Некоторые БАВ, участвующие в механизмах почечной ауторегуляции
БАВ |
Примечание |
Вазоконстрикторы |
|
Ангиотензин II (при воздействии на свои рецепторы первого типа) |
Основной эффекторный нейрогормон РААС. Обладает также выраженными пролиферативными и антидиуретическими свойствами. |
Катехоламины: адреналин, норадреналин |
С помощью катехоламинов тонус сосудов в организме поддерживает ЦНС. |
Эндотелин-1 (высокие концентрации на поверхности эндотелия сосудов) |
Синтезируется под воздействием АГ II, эндотелием сосудов; имеет в 10 раз более выраженные вазоконстрикционные свойства, чем сам АГII. Обладает также митогенной активностью по отношению к эндотелию и гладкомышечным клеткам сосудов. Вызывает экспрессию адгезивных молекул. |
Антидиуретический гормон |
Мощный вазоконстриктор, образующийся в гипофизе. Увеличивает реабсорбцию натрия и воды почками. Его уровень значительно повышается при обширной кровопотере, стрессе (в т.ч. хроническом) и черепно-мозговых травмах. |
Эндопероксиды, тромбоксан А2, простагландин Н2 |
Непосредственно воздействуют на гладкомышечные клетки сосудов, вызывая их сокращение. |
1,25 дигидроксивитамин D3(кальцитриол) |
Биотрансформация активных форм витамина D из неактивных в основном происходит в эпителиоцитах проксимальных извитых канальцев почек. При ХБП (неотъемлемой частью которой является выраженный тубулярный компонент) интенсивность этого процесса может многократно снижаться. Однако необоснованное и/или избыточное назначение активных форм витамина D3 при ХПН может явиться одной из причин усугубления и хронизации ПГ, а также привести к нарастанию гиперфосфатемии и гиперпаратиреоза). |
Вазодилататоры |
|
Ангиотензин II (при воздействии на рецепторы второго типа) |
Обладает также антидиуретическими и антипролиферативными свойствами. |
Эндотелин-1 (в физиологически низких концентрациях) |
Способствует высвобождению факторов релаксации сосудов. |
EDHF (эндотелий-зависимый фактор гиперполяризации)
|
Механизм сосудорасширяющего действия связан с открытием калиевых каналов в гладкомышечных клетках стенки сосудов. Его образование происходит под воздействием ацетилхолина, брадикинина, тромбина и гистамина. |
NO (универсальный эндотелий-зависимый фактор релаксации)
|
Сосудорасширяющее действие большинства вазодилатирующих БАВ связано именно со стимуляцией выработки оксида азота эндотелием сосудов. NO также угнетает адгезию и агрегацию тромбоцитов (т.е. обладает антикоагуляционными свойствами) и снижает активность макрофагов. |
Простагландин E2 (динопростон) |
Расслабляет гладкомышечные клетки кровеносных сосудов почки, тем самым уменьшая сосудосуживающие эффекты симпатической стимуляции и ангиотензина II. |
Простагландин I2 (простациклин) |
Является одним из конечных продуктов метаболизма арахидоновой кислоты, синтезируется в эндотелиалии, медии и адвентиции сосудов при нарушениях гемодинамики, а также под воздействием некоторых медиаторов, которые одномоментно увеличивают и образование NO. Также ингибирует процессы агрегации тромбоцитов. |
Калликреин-кининовая система:брадикинин, калликреин |
Кроме вазодилатации брадикинин выполняет в организме большое количество различных функций, в т.ч. регуляцию водно-электролитного баланса, сокращение гладкой мускулатуры и капиллярной проницаемости. Брадикинин разрушается тем же самым ферментом (ангиотензин-превращающим), с помощью которого происходит синтез АГ II (схема 1). |
Факторы роста[17] |
|
Ангиотензин II (при воздействии на рецепторы первого типа) |
Доказана роль АГII в процессах гломеруло- и нефросклероза. |
Альдостерон
|
Помимо антидиуретического действия, обладает, подобно АГ II, способностью вызывать пролиферацию и гипецеллюлярность резидентных клеток клубочка; так же участвует в процессах гломеруло- и нефросклероза. |
Инсулиноподобный фактор роста-1 (соматомедин C) |
Белок, по структуре и функциям похожий на инсулин. Одним из важнейших членов семейства инсулиноподобных факторов роста, осуществляющих в т.ч. регуляцию процессов (в т.ч. и патологических) роста, развития и дифференцировки клеток клубочка и тубулоинтерстиция. |
К основным причинам развития ПГ относится:
Снижение общей массы полноценно функционирующих нефронов и истощение компенсаторных резервов почек.
Снижение почечного кровотока (гипофильтрация) и, следовательно, СКФ, возникающее в ответ на очаговое и/или диффузное поражение клубочков (гиперклеточность, гипертрофия, гломерулосклероз и т.д.) и фиброз тубулоинтерстиция и почечных сосудов. Эти процессы приводят к увеличению реабсорбции ионов натрия и воды в канальцах (в т.ч. и из-за нарушения гломерулотубулярного баланса), что обусловливает рост объема экстрацеллюлярной жидкости и, как следствие, компенсаторную гиперволемию. Итогом этого является накопление избыточного количества натрия в стенках сосудов, их набухание и повышение чувствительности к вазоконстриктору ангиотензину II. Последний в свою очередь стимулирует образование и выброс корой надпочечников минералокортикостероида альдостерона, воздействие которого на свои рецепторы в почечной паренхиме приводит к еще большей задержке натрия и жидкости почками. Альдостерон также в большом количестве фиксируется на рецепторах в артериях и артериолах и удерживает в них жидкость. Исходом этого является, во-первых, отек стенок сосудов, сужение их просвета и нарастание сопротивления току крови и, во-вторых, повышение чувствительности к вазоконстрикционному действию катехоламинов (адреналин, норадреналин). Порочный круг патогенеза в итоге замыкается. Прогрессирующе увеличивается объем циркулирующей крови и межклеточной жидкости. Значимо нарушается регуляция почками водно-электролитного гомеостаза.
Гиперактивация РААС, неотъемлемой частью которой является избыточная продукция юкстагломерулярным аппаратом нефрона протеолитического фермента ренина. Этот процесс возникает вследствие ишемии почечной ткани, интрагломерулярной гипофильтрации и гиперактивации САС, а также нарушения гломерулотубулярного равновесия.
Лавинообразное увеличение продукции в почечной паренхиме АГ II различными альтернативными путями (т.е. минуя ангиотензин-превращающий фермент АПФ)), а также синтез этого нейрогормона канальцевым эпителием.
Угнетение депрессорных систем почек: снижение синтеза и активности таких вазодилатирующих простагландинов, как Pg I2, Pg E2 (их синтез практически полностью осуществляется в интерстиции мозгового слоя почек), кининов (брадикинина, калликреина) и образующегося под их воздействием оксида азота, происходящее в результате эндотелиальной дисфункции и процессов гломеруло- и нефросклероза. А нужно отметить, что в случае дефицита вазодилатирующих субстанций даже физиологически обусловленные (нормальные) концентрации ренина приведут к развитию АГ задолго до развития азотемии. Это является одной из причин развития стойкой АГ у пациентов с явлениями нефросклероза практически в 100% случаев. И именно поэтому антигипертензивное лечение животных с нефропатиями нужно начинать задолго до повышения уровня креатининемии, опираясь при этом на результаты измерения АД и/или другие, более значимые изменения в биологических жидкостях, например, на протеин- и гипостенурию.
Патологическое увеличение объема сердечного выброса, тахиаритмия и т.д., в итоге приводящие к развитию ренокардиального и кардиоренального синдромов.
Дисбаланс в выработке и биологической активности гормонов, регулирующих обмен кальция[18].
Клинические проявления ПГ
У животных ПГ, впрочем, как и практически любая другая АГ, длительное время может не сопровождаться какими-либо клиническими проявлениями (именно поэтому так важно измерение АД у клинически здоровых пациентов). Однако по многим, в первую очередь техническим, причинам[19], возможно это далеко не всегда. Некоторую роль в этом играют также отрицательные позиции пациента и/или его владельца к процедуре измерения АД. Поэтому приходится обращаться к другим, хотя и зачастую косвенным, но более доступным методам. И как в случае с большинством других нефропатий достаточно большой объем информации можно получить из обычного общего анализа мочи.
Протеинурия более 0,3 г/л (особенно прогрессирующая) является не только нефротоксичной и ухудшает прогноз заболевания почек, но и обычно коррелирует с уровнем ПГ (Syme, H.M., P.J. Markwell, et al., 2006). Также очень вероятно, что тяжесть ПГ напрямую зависит и от таких патогенетически значимых показателей, как уровень лейкоцитурии (в т.ч. при хронических гломерулонефритах и ХБП, когда она носит асептический агранулоцитарный характер) и плотности мочи (ее снижение говорит о нарушениях в работе тубулоинтерстициального аппарата почек, а также об истощении их депрессорных систем).
Вместе с тем концентрация креатинина крови напрямую не связана с уровнем ПГ и может присутствовать на любых стадиях ХБП. Так, например, ПГ может быть выраженной у пациента на I, не азотемической, стадии и отсутствовать у животного с IV, уремической (http://www.iris-kidney.com/education/hypertension.shtml).
Повреждение такого «органа-мишени», как глазные яблоки, является наиболее очевидным и вместе с тем широко распространенным, выявляемым практически в 100% случаев проявлением системной АГ у собак и кошек любого генеза (Littman et al. 1988; Stiles et al. 1994; Maggio et al. 2000; Elliott et al. 2001). Этот синдром первоначально можно легко дифференцировать по билатеральному патологическому мидриазу (расширение зрачков, нарушение адекватной реакции зрачка на свет), связанному с ретинопатиями и/или хориоидопатиями[20] различной степени.
В дальнейшем тяжелое поражение сетчатки глаза, характеризующееся выраженным изменением сосудистого рисунка, очаговыми кровоизлияниями, обширным экссудативным отслоением и т.д., может привести к частичной или даже полной (обычно внезапной) потере зрения. Эффективное лечение АГ в этом случае приводит к определенной нормализации структуры сетчатки, что, однако, лишь у немногих пациентов сопровождается адекватным восстановлением зрительной функции (Maggio и др. 2000).
В некоторых случаях возможно установить (или предположить с высокой долей вероятности) связь между АГ и нефропатией. Так, остропротекающие вирусные инфекции кошек в силу ряда причин очень часто осложняются быстропрогрессирующим (злокачественным) гломерулонефритом[21] с выходом в какую-либо хроническую форму этой нефропатии и развитию ПГ.
Подобная ситуация, но только с выходом в хронический тубулоинтерстициальный нефрит, может сложиться и у собак, переболевших (особенно несколько раз) бабезиозами и/или лептоспирозом. Связано это с тем, что гематурия, свойственная этим патологиям, имеет прямое повреждающее действие на канальцевый аппарат почек.
Также следует учитывать, что один из излюбленных методов диагностики нефропатий — УЗИ почек —обладает довольно низкой чувствительностью (из-за высокой субъективности оценки получаемых изображений) и выявляет только те патологии, которые характеризуются ярко выраженными структурными изменениями. Поэтому при подозрении на почечное происхождение АГ по возможности необходимо прибегнуть к анализам биологических жидкостей, другим визуализирующим методам диагностики (урография, КТ, МРТ почек) или рекомендовать пациенту для уточнения диагноза проведение пункционной нефробиопсии.
УЗИ может помочь в уточнении диагноза при одностороннем стенозе почечных артерий. Визуально на это указывает различная величина почек на фоне ярко выраженного снижения кровотока в меньшей из них. А ситуация, при которой одна почка находится в состоянии гипотензии, а другая — гипертензии, почти наверняка приведет к формированию стойкой ПГ из-за гиперактивации РААС.
Дополнительным основанием для выставления пациенту диагноза «реноваскулярная гипертензия» является АГ, резистентная к поликомпонентной антигипертензивной терапии.
Литература и интернет-источники
Bagley, R.S. (2003). The brain as a target organ. In: Essential Facts of Blood Pressure in Dogs and Cats, edited by B. Egner, A. Carr, and S. Brown. Babenhausen, Gefmany: Vet Verlag, pp. 129-139.
BartgesJoe, PolzinDavid J. Nephrology and Urology of Small Animals. WILEY- BLACKWELL/ A John Wiley & Sons, Ltd., Publication, 2011.
Belew, A.M.,T. Barlett, etal. (1999). Evaluation of the white-coat effect in cats. J Vet Intern Med 13: 134-142.
Bodey, A.R. and A.R. Michell (1996). Epidemiological study of blood pressure in domestic dogs. / Small Anim Pract 37: 116-125.
Brown, C.A., J.S. Munday, et al. (2005). Hypertensive encephalopathy in cats with reduced renal function. Vet Pathol 42: 642-649.
Brown, S., C. Atkins, et al. (2007). Guidelines for the identification, evaluation, and management of systemic hypertension in dogs and cats. J Vet Intern Med 21: 542—558.
Buranakarl, C., S. Mathur, et al. (2004). Effects of dietary sodium chloride intake on renal function and blood pressure in cats with normal and reduced renal function. Am J Vet Res 65: 620-627.
Carr A.P., Duke T. Blood Pressure in Small Animals - Part I: Hypertension and hypotension and an update on technology; Part II:Hypertension - Target organ damage, Heart and Kidney; Part III: Hypertension - Target organ damage, eyes and the CNS - Diagnosis and treatment considerations. The European Journal of Companion Animal Practice (EJCAP) Volume 18,19, 20 2008.
Chetboul, V., H.R Lefebvre, et al. (2003). Spontaneous feline hypertension: clinical and echocardiographic abnormalities, and survival rate. J Vet Intern Med 17: 89-95.
Dagmara Hering et al. Renal Denervation in Moderate to Severe CKD. JASNMay 17, 2012
Elliott Jonathan, Gregory F. Grauer. BSAVA Manual of Canine and Feline Nephrology and Urology/ Second edition, 2013.
Elliott, J. and A.D.J. Watson (2009). Chronic kidney disease: staging and management. In: Current Veterinary Therapy XIV, edited by J.D. Bonagura and D.C. Twedt. St. Louis, MO: Elsevier Saunders, pp. 883-892.
Elliott, J., P.J. Barber, et al. (2001). Feline hypertension: clinical findings and response to antihypertensive treatment in 30 cases. J Small Anim Pract 42: 122-129.
Finco, D.R. (2004). Association of systemic hypertension with renal injury in dogs with induced renal failure. VetlntMed 18: 289-294.
Goy-Thollot, I., D. PeChereau, et al. (2002). Investigation of the role of aldosterone in hypertension associated with spontaneous pituitary- dependent hyperadrenocorticism in dogs. J Small Anim Pract 43: 489-492.
Grauer, G., D. Greco, et al. (2000). Effects of enalapril treatment versus placebo as a treatment for canine idiopathic glomerulonephritis. / Vet Intern Med 14: 526-533.
Jacob, F., D.J. Polzin, et al. (2003). Association between initial systolic blood pressure and risk of developing a uremic crisis or of dying in dogs with chronic renal failure. J Am Vet Med Assoc 222: 322- 329.
Jepson, R.E., J. Elliott, et al. (2007). Effect of control of systolic blood pressure on survival in cats with systemic hypertension. J Vet Intern Med 21:402-409.
Lesser, М., R. Fox, et al. (1992). Assessment of hypertension in 40 cats with left ventricular hypertrophy by Doppler-shift sphygmo- manometry. J Small Anim РгасЗЗ: 55-58.
Littman, M.P. (1994). Spontaneous systemic hypertension in 24 cats. J Vet Intern Med 8: 79-86.
Littman, M.P., J.L. Robertson, et al. (1988). Spontaneous systemic hypertension in dogs: five cases (1981-1983). / Am Vet Med Assoc 193: 486-494.
Maggio, F., T.C. DeFrancesco, et al. (2000). Ocular lesions associated with systemic hypertension in cats: 69 cases (1985-1998). J Am Vet Med Assoc 217: 695-702.
Ortega, T.M., E.C. Feldman, et al. (1996). Systemic arterial blood pressure and urine protein/creatinine ratio in dogs with hyperadrenocorticism. / Am Vet Med Assoc 209: 1724-1729.
Rosanne E. Jepson, Jonathan Elliott, David Brodbelt, and Harriet M. Syme. Effect of Control of Systolic Blood Pressure on Survival in Cats with Systemic Hypertension. Journal of Veterinary Internal Medicine, Article: pp. 402–409 | Abstract, Volume 21, Issue 3 (May 2007).
Stiles, J., D.J. Polzin, et al. (1994). The prevalence of retinopathy in cats with systemic hypertension and chronic renal failure or hyperthyroidism. J Am Anim Hosp Assoc 30: 564-572.
Syme, H.M., P.J. Barer, et al. (2002). Prevalence of systolic hypertension in cats with chronic renal failure at initial evaluation. / Am Vet Med Assoc 220: 1799-1804.
Syme, H.M., P.J. Markwell, et al. (2006). Survival of cats with naturally occurring chronic renal failure is related to severity of proteinuria. J VetlntMed 20: 528-535.
iris-kidney.com
vbps-online.org
[1] Аналогичный этому термин – «target-organ damage» («повреждение целевого органа») в отечественной научной литературе употребляется значительно реже.
[2] С точки зрения биофизики, гипертензия – это стойкое повышение гидродинамического давления крови в артериальных сосудах, а также гидростатического давления биологических жидкостей в полых органах и полостях организма.
[3] Аналогичная ситуация складывается и в случае с креатинином. Так, для гончих и борзых собак, интенсивно использующих свою мышечную массу, его нормальный уровень, не причиняющий никакого вреда здоровью, может достигать 220 ммоль/л, что соответствует III степени почечной недостаточности по классификации IRIS.
[4] Скрининг — стратегия в ветеринарной медицине, направленная на выявление заболеваний у клинически бессимптомных животных в популяции.
[5] «Ветеринарное общество кровяного давления» и (дословно) «Международное общество интересующихся почками» (у собак и кошек).
[6] У человека АГ опасна прежде всего значительным увеличением вероятности инвалидизации или смерти в результате инфарктов и инсультов. Однако у собак и кошек эти патологии встречаются редко, даже у животных с тяжелой АГ.
[7] На сегодняшний день существует около 8 гипотез развития эссенциальной гипертензии (гипертонической болезни) у человека, включая синтетическую «мозаичную» теорию. Согласно ей, АГ – это следствие компенсации снижения перфузии тканей, возникающее как итог влияния восьми генов.
[8] Не путать с идиотопатической АГ, при которой установление её причины невозможно по причине недостаточно высокого уровня знаний врача, проводящего диагностику.
[9] Для симпато-адреналовой системы стресс - это такое же острое «повреждение» гомеостаза организма, как и, например, обильная кровопотеря. Поэтому ее реакция и в том и в другом случае будет приблизительно идентичной и приведет, в частности, к выраженной вазоконстрикции (и, следовательно, к повышению АД) как в почечной паренхиме, так и в организме в целом.
[10] Мозговой слой получает лишь около 2% от почечного кровотока.
[11] Возможно, поэтому у некоторых пациентов (речь идет о медицине человека) уровень нормального АД (иначе называемого рабочим) лежит за пределами принятых физиологических норм, а его изменение в меньшую сторону приводит к ухудшению общего состояния.
[12] Однако совсем минимизировать роль ЦНС в развитии ПГ не стоит. В этом случае трудно будет объяснить, почему при устойчивой, не поддающейся лечению даже четырех-пятикомпонентной антигипертензивной терапией (резистентной) ПГ симпатическая денервация почек у человека доказанно приводит к нормализации АД у пациентов с III-IV степенями ХБП, по крайней мере, в течение 12 месяцев[12] (Dagmara Hering et al., 2012).
[13] Темное пятно — плотноупакованная область ренин-образующих эпителиальных клеток дистального отдела канальца нефрона, расположенная в месте его слияния с собственной гломерулой, между приносящей и выносящей ее артериолами.
[14] Ангиотензин-превращающий фермент. Т.н. классическому пути образования АГ II в тканях даже в норме принадлежит лишь примерно пятая часть от общего количества.
[15] При некоторых экстремальных состояниях (например, при стрессе), а также при истощении запасов ренина в юкстагломерулярном аппарате клубочка, клетки Гурмагтига начинают, напротив, активировать РААС путем синтеза ренина. Это лишний раз доказывает, что многим регулирующим системам и клеткам почек присущ как минимум дуализм действия.
[16] На сегодняшний день открыто и в той или иной степени изучено более 12 видов рецепторов АГ II.
[17] Факторы роста – БАВ, способные стимулировать рост, пролиферацию и/или дифференцировку клеток (в т.ч. патологическую) в различных частях организма, в т.ч. и в гломерулах. Кроме перечисленных в таблице, к факторам роста могут быть отнесены также гормон роста, фактор некроза опухоли (TNF), катехоламины, цитокины и свободные радикалы.
[18] Паратиреоидный гормон, кальцитонин, кальцитриол (активная форма витамина D).
[19] Стоимость «приличного» тонометра для животных сегодня составляет около 1000 $.
[20] Хориоид — составная часть сложных слов, означающая «относящийся к сосудистой оболочке глаза».
[21]Выводы сделаны на основании ряда проведенных автором статьи гистоморфологических исследований почечной паренхимы кошек, погибших в результате различных остропротекающих вирусных инфекций.
Неотложные состояния в нефрологии. Этиленгликоль: клинико-морфологический обзор токсического воздействия

Автор: к.в.н. Роман-А. Леонард, практикующий ветеринарный врач, руководитель Центра ветеринарной нефрологии и урологии, президент Российской Научно-практической Ассоциации Ветеринарных Нефрологов и Урологов (НАВНУ)
Введение
Этиленгликоль (ЭГ) – двухатомный спирт (СН2ОН–СН2ОН), входящий в состав таких технических средств, как различные антифризы (используются для охлаждения двигателей внутреннего сгорания), а также тормозные, амортизаторные и гидравлические жидкости.
ЭГ считается протоплазматическим и сосудистым ядом, чье токсическое действие направлено прежде всего на поражение центральной нервной системы (ЦНС) и впоследствии почек[1].
Собаки и кошки, особенно имеющие свободный доступ на улицу, могут употреблять ЭГ при вытекании его из различных механизмов (прежде всего автомобилей), а также при его небрежном хранении. Он имеет сладковатый, нравящийся многим животным вкус и не замерзает тогда, когда на улице температура опускается ниже нуля градусов и количество других источников «жидкости» резко сокращается. Последнее обстоятельство приводит к тому, что число острых токсических состояний, вызванных ЭГ, учащается в холодное время года, а сами случаи отравления распространены в основном в холодных и умеренных широтах.
Все домашние животные восприимчивы к токсическому действию ЭГ. У собак отравление ЭГ происходит, как правило, при употреблении его внутрь. У кошек возможен также и трансдермальный путь токсического воздействия этого вещества. Поскольку пары ЭГ малолетучи (чистый ЭГ практически не имеет запаха), то при вдыхании его негативного воздействия на организм не происходит.
Патогенез токсического действия
Несмотря на то, что ЭГ относится к третьему классу токсичности, его минимальная летальная доза в пересчете на чистое вещество составляет около 1,5 мл/кг массы тела для кошек и 4,5 мл/кг массы тела для собак. Щенки и котята, а также животные, имеющие хронические заболевания почек и печени, более восприимчивы. В целом для ЭГ (как и для этилового спирта) характерно большое колебание индивидуальной чувствительности и разброс смертельно ядовитых доз.
ЭГ быстро и в неизмененном виде всасывается из ЖКТ. Его максимальное количество в крови наблюдается уже через несколько часов после употребления. Параллельно поступлению из пищеварительного тракта ЭГ начинает стремительно распространяться по всем тканям, достигая максимальной концентрации в головном мозге, и действует как нейроваскулярный яд, а также вызывает у животных состояния, подобные алкогольному опьянению (это первый период интоксикации ЭГ, или период неспецифического наркотического действия).
Длительность циркуляции ЭГ в организме может достигать нескольких суток. Примерно половина всего ЭГ в чистом виде экскретируется в течение 12-24 часов с мочой. Остальное его количество подвергается в почках и печени метаболизму (в т.ч. с участием алкогольдегидрогеназы), основными продуктами которого являются гликолевая, глиоксиловая и щавелевая кислоты.
Глиоксиловая кислота, основной токсический метаболит ЭТ, затем трансформируется в муравьиную кислоту, двуокись углерода, глицин и серин. С метаболитами ЭГ связан второй этап его токсического действия, называемый периодом морфологических деструктивных изменений паренхиматозных органов (гепаторенальная и панкреотическая фаза).
Все метаболиты этиленгликоля угнетают митохондриальный транспорт электролитов, синтез белков и разобщают процессы окисления и фосфорилирования в тканях. Эти негативные процессы дополнительно усиливаются метаболическим ацидозом, развивающимся по причине накопления в организме недоокисленных продуктов обмена веществ и таких нарушений в работе канальцевого аппарата почек, как снижение или даже полное прекращение экскреции им ионов водорода и синтеза бикарбонатов.
Образовавшаяся в результате метаболизма ЭГ щавелевая кислота стремительно связывается с ионами кальция, превращаясь в щавелевокислый кальций, затем откладывающийся в виде кристаллов оксалатов в основном в канальцах почек (фото 1). С этим явлением связано нарушение почечного кровотока и процессов фильтрации в гломерулах и реабсорбции в канальцах, возникающее как в результате чисто механических причин, так и вследствие рефлекторных реакций раздраженной почечной паренхимы.
Поэтому основной гистоморфологической характеристикой отравления ЭГ, связанной прежде всего с такими продуктами его метаболизма, как гликолевая кислота и оксолаты, является тяжелое поражение почечной паренхимы – дистрофия и атрофия канальцевого эпителия и/или острый тубулярный некроз, тубуло-интерстициальный отек, механическая закупорка канальцев солями щавелевокислого кальция и очаги (иногда обширные) гемморагического некроза в корковом слое (фото 1).
Кроме того, образование солей кальция может привести к развитию гипокальциемии и, как следствие, к угнетению сердечной деятельности и развитию гипотонии и тетании. Определенное количество оксалатов откладывается также в адвентиции стенок сосудов по всему организму.
Определенные гистоморфологические изменения также могут выявляться в тканях головного мозга (с чем связывают такие гиперкинетические проявления отравления ЭГ, как судороги и нистагм глазных яблок), а также в печени, перикарде и миокарде.
Клинические признаки
Клинические признаки отравления ЭГ зависят как от его дозы, попавшей в организм, так и от продолжительности токсического воздействия. Первоначальные проявления связаны с прямым воздействием самого ЭГ на головной мозг и могут напоминать наркотическое или алкогольное опьянение как с преобладанием гипокинетических (заторможенность, парез задних конечностей, сонливость, ступор и т.д.), так и гиперкинетических (судороги, атаксия, возбуждение, агрессивность и т.д.) явлений. У большинства животных отмечаются также рвотные позывы или рвота из-за раздражения ЭГ слизистой желудка, а также полидепсия и/или полиурия. Последние явления связаны с тем, что ЭГ стимулирует центр жажды и обладает свойствами осмотического диуретика, а также блокирует выделение антидиуретического гормона. Однако угнетение ЦНС может привести к тому, что употребление жидкости животными снижается, а осмотический диурез продолжает «иссушать» ткани и приводит к выраженной гиповолемии.
Действие токсичных метаболитов ЭГ определяет клинические признаки второго этапа отравления этим токсическим веществом. У некоторых животных между первым и вторым этапами интоксикации ЭГ может наблюдаться период временного улучшения общего состояния.
Олиго- или анурическая острая почечная недостаточность (ОПН) обычно развивается при отравлении ЭГ через 12-24 часа у кошек и 36-72 часа у собак. При этом наблюдаются следующие клинические признаки: летаргия, анорексия, гиповолемия, рвота и непродуктивные рвотные позывы, диарея, эрозивно-язвенное поражение ротовой полости, слюнотечение, тахипноэ и – позднее – судороги и кома. Почки на ощупь тестоватой консистенции и болезненные. На УЗИ отмечается снижение эхоплотности почечной паренхимы с участками разряжения (выраженной гипоэхогенности) и сглаживание границы между корковым и мозговым слоями.
Некоторые животные на этом этапе достаточно быстро впадают в кому или погибают.
Диагностика
Ключевым моментом в диагностике при отравлении ЭГ является сбор анамнеза (например, имеет ли животное доступ на улицу и/или к механизмам, в которых используются технические жидкости, содержащие ЭГ), поскольку клинические признаки, физикальные исследования и изменения в лабораторных показателях малоспецифичны и могут указывать как на изменения, характерные для различных заболеваний ЖКТ, поджелудочной железы, ЦНС и т.д., так и на мультисистемное поражение. Острая почечная недостаточность различного генеза, в т.ч. развивающаяся в результате воздействия других нефротоксинов, также может иметь идентичные клинические признаки.
В большинство современных этиленгликоль-содержащих антифризов добавлены флуоресцирующие вещества, имеющие яркий желтый, синий или зеленый цвет. Поэтому моча при отравлении ЭГ может иметь экзотическую окраску, хорошо различимую под лампой Вуда или в проходящем свете (мочу для исследования целесообразно взять у пациента сразу на приеме путем чрезбрюшинного уроцистоцентеза, а не дожидаться ее естественного пассажа). А содержание в различных антифризах фосфатных ингибиторов коррозии может приводить к тому, что у животных при отравлении ЭГ уже в первые часы наблюдается выраженная гиперазотемия, впоследствии усугубляющаяся острым почечным поражением.
Лечение
Развитие тяжелых необратимых осложнений или гибель животного при отравлении ЭГ напрямую зависит от того, насколько быстро было начато лечение. Прежде всего оно должно быть направлено на снижение интенсивности всасывания ЭГ в ЖКТ, на форсирование выделения его из организма в неизменном виде, на уменьшение темпов превращения ЭГ в токсичные метаболиты и на борьбу с ацидозом, который они провоцируют.
Важной частью лечения также является нефропротективная терапия и профилактика патологического перераспределения жидкости в организме (гидроторокс, гидроперикард) и связанной с ним сердечной и/или дыхательной недостаточности[2].
Если животное было доставлено в больницу в первый час поле поступления ЭГ в организм, целесообразным может быть промывание желудка и дача рвотных препаратов. По истечении 1-2 часов после отравления и при наступлении выраженных клинических признаков первой или тем более второй фазы эти мероприятия проводить нерационально. Использование энтеросорбентов также вряд ли даст положительный результат, поскольку ЭГ не только быстрее всасывается из ЖКТ, чем аккумулируется на их поверхности, но вступает с ними в весьма непрочную связь.
На следующем этапе лечения необходимо начать борьбу с гиповолемией и метаболическим ацидозом и одновременно с этим приступить к форсированию диуреза. Для этого возможно использование растворов кристаллоидов, содержащих в своем составе лактат или ацетат натрия (эти соли молочной и уксусной кислот, соответственно, метаболизируются в организме в гидрокарбонат натрия, который в свою очередь увеличивает резерв фосфатного буфера крови)[3] или сам гидрокарбонат натрия (раствор Натрия бикарбоната или Натрия гидрокарбоната 5 или 8,4 %). Для форсирования диуреза и ускорения элиминации из организма самого ЭГ и его высокотоксичных метаболитов вместе с инфузионными растворами внутривенно вводят петлевые диуретики (предпочтительнее торасемид, имеющий целый ряд преимуществ перед фуросемидом) в средних и высоких дозах. Использование остальных групп диуретиков, включая осмотические, нерационально[4].
Поскольку одним из факторов, лимитирующих образование продуктов метаболизма ЭГ (в частности, гликолиевого альдегида в высокотоксичную гликолиевую кислоту), является алкогольдегидрогеназа, то введение веществ, конкурентно связывающих этот фермент, является одним из важных лечебных мероприятий. Для этого могут использоваться 4-метилпиразол (4-MP, Fomepizole, Antizol-Vet) и этиловый спирт. Эффективность использования этих препаратов высока, если с момента поступления ЭГ в организм прошло не более 8 часов.
4-MP хорошо переносится собаками и имеет не много побочных эффектов. Рекомендуемые дозы для собак – 20 мг/кг внутривенно, затем 15 мг/кг через 12 и 24 часа и 5 мг/кг через 36 часов после введения начальной дозы. Если препараты 4-MP не доступны (в РФ в свободной продаже они отсутствуют), то возможно использование этанола в дозе 5,5 мл/кг 20%-ного раствора (в 5%-ной глюкозе) каждые четыре часа пять раз, затем каждые 6 часов четырехкратно.
У кошек дозировка 4-MP значительно превышает собачью и составляет 125 мг/кг первоначально и 31,3 мг/кг через 12, 24 и 36 часов после введения первоначальной дозы. Однако для этого вида животных рациональнее использование 20%-ного раствора этилового спирта в 5%-ной глюкозе в дозе 5 мл/кг внутривенно капельно. Процедуру проводят пятикратно каждые 6 часов, а затем четырех-шестикратно каждые 8 часов.
Ацидоз, развивающийся вследствие метаболизма ЭГ, корректируют введением бикарбоната натрия. Использование растворов, его содержащих, производят медленно внутривенно капельно (для предотвращения развития алколоза) и под постоянным (каждые 4-6 часов) контролем уровня бикарбонатов в сыворотке крови и уровня pH крови. Мониторинг этого показателя в моче также полезен и должен поддерживаться на уровне 7,0-7,5. Альтернативой введения растворов бикарбоната натрия может быть использование ректальных свечей, его содержащих.
Собакам и кошкам, у которых вследствие действия токсичных метаболитов ЭГ уже развилась азотемическая и/или олигоурическая форма острой почечной недостаточности, мероприятия по ингибированию алкогольдегидрогеназы малоэффективны. Поэтому владельцы должны быть проинформированы о том, что прогноз заболевания осторожный или даже неблагоприятный.
Лечение на этом этапе может включать лишь коррекцию водно-солевого состояния и кислотно-основного равновесия. Для этого возможно в/в введение растворов кристаллоидов (содержащих лактат, ацетат или бикарбонат натрия) в сочетании с петлевыми диуретиками (фуросемид или, предпочтительнее, торасемид) в средних или высоких дозах. Остальные методы лечения на этом этапе неэффективны.
Выжившим животным необходимо регулярно проводить обследование функции почек и печени. В качестве нефропротективной терапии и контроля патологического перераспределения жидкости в организме возможно использование низких доз торасемида внутрь (0,1-0,2 мг/кг ж. массы тела 1-2 раза в сутки) и блокаторов «медленных» кальциевых каналов из группы производных фенилалкиламина[5] (например, верапамил внутрь в дозе 1,0-2,5 мг/кг ж. массы тела 2 раза в сутки). Терапию этими препаратами проводят длительно (пожизненно).
Литература
Connally HE et al(2000) Inhibition of canine and feline alcohol dehydrogenase activity by fomepizole. Am J Vet Res 61(4):450-455
Dial SM et al(1994) Efficacy of 4-methylpyrazole for treatment of ethylene glycol intoxication in dogs. Am J Vet Res 55(12):1762-1770
Connally HE et al(1996) Safety and efficacy of 4-methylpyrazole for treatment of suspected or confirmed ethylene glycol intoxication in dogs: 107 cases (1983-1995). J Am Vet Med Assoc 209(11):1880-1883
Gregory F. Grauer. Overview of Ethylene Glycol Toxicity (источник: http://www.merckmanuals.com/vet/toxicology).
[1] Почки — это не только самый кровоснабжаемый орган, но они имеют и очень большое сосудистое дерево, являющееся их ключевым структурообразующим элементом.
[2] Следует отметить, что гидроторокс и гидроперикард могут развиваться даже на фоне выраженной гиповолемии.
[3] Например, Рингер-Лактат (ацетат), Лактасол, Нормофундин Г-5 или раствор Хартмана.
[4]Несмотря на то, что осмотические диуретики в некоторых случаях обладают даже более выраженными мочегонными свойствами, чем петлевые, при нарушении процессов микроциркуляции в гломерулах и снижении СКФ (что всегда наблюдается при отравлении ЭГ) их диуретические свойства резко снижаются. Кроме того, введение осмотических диуретиков может привести к тяжелой дегидратации межклеточного пространства, и без того развивающейся при отравлении ЭГ. Также необходимость использования больших объемов осмотических диуретиков на фоне угрозы развития олиго- или анурической острой почечной недостаточности может привести к патологическому перераспределению жидкости в организме и осложнениям в виде тяжелой дыхательной (связанной с гидротороксом) и сердечной (связанной с гидроперикардом) недостаточностью. Остальные группы диуретиков, тем более в краткосрочной перспективе, не способны вызвать у животных хоть сколько-нибудь значимого увеличения диуреза.
[5] Производные фенилалкиламина (верапамил) обладают при тубуло-интерстициальных патиях более выраженными нефропротективными свойствами, чем дигидропиридиновые представители группы блокаторов «медленных» кальциевых каналов (амлодипин, фелодипин).
Креатинин: коварный помощник. Так ли велико диагностическое и патогенетическое значение креатинина как это обычно постулируется?
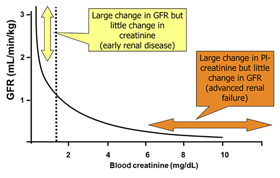
Автор: к.в.н. Роман-А. Леонард, практикующий ветеринарный врач, руководитель Центра ветеринарной нефрологии и урологии, президент Российской Научно-практической Ассоциации Ветеринарных Нефрологов и Урологов (НАВНУ)
Основные положения
СКФ является наиболее точным методом оценки уровня почечной функции у животных с различными нефропатиями, и в идеале именно на этом показателе должна быть основана классификация степеней тяжести не только ХПН и ХБП, но и большинства заболеваний почек в целом.
На сегодняшний день наиболее часто попытки расчета СКФ в рутинной ветеринарной практике производятся исходя из уровня азотемии. Однако ни уровень креатинина, ни тем более уровень мочевины сыворотки крови не являются сколько-нибудь точными показателями, с помощью которых можно оценить истинный уровень СКФ, особенно на начальных и заключительных этапах почечного континуума.
Нормальный уровень азотемии у животного ни в коей мере не говорит о том, что у пациента нет угрожающей жизни нефропатии. Связано это прежде всего с тем, что повышение уровня креатинина и мочевины крови как правило начинает происходить только после того, как СКФ оказывается снижена более чем на 75%.
Расчет уровня почечной функции только по креатинину очень часто приводит к завышенной оценке СКФ, следствием чего является, кроме прочего, то, что жизненно важная для пациента нефропротективная терапия назначается значительно позже, чем это необходимо, или не назначается вовсе.
Учитывая широкий диапазон нормального сывороточного уровня креатинина у животных, при обнаружении этого показателя на верхней границе нормы трудно бывает определить, особенно при первичном обследовании, является ли это значение обычным для пациента или оно возникло в результате прогрессирования какой-либо нефропатии.
Значительное снижение уровня креатинина, особенно при тяжелых степенях ХПН, необязательно говорит об улучшении почечной функции, а может быть следствием снижения мышечной массы и/или анорексии.
Гиперазотемия необязательно является следствием какой-либо нефропатии, а может иметь пре- или постренальный генез.
Значимость и последствия интоксикации, вызываемой повышением уровня креатинина и мочевины в крови, до сих пор значительно преувеличивается.
Введение
Сбор анамнеза и физикальные исследования на ранних стадиях течения большинства нефропатий у собак и кошек малоинформативны прежде всего из-за отсутствия каких-либо клинических проявлений, что является следствием колоссальных компенсаторных возможностей почек. Поэтому по возможности более ранняя лабораторная диагностика снижения почечной функции – это одна из приоритетных и вместе с тем наиболее трудноисполнимых задач современной ветеринарной нефрологии.
Самые достоверные сведения об экскреторных возможностях почек и, следовательно, о функциональном состоянии почечной паренхимы в целом дает определение скорости клубочковой фильтрации (СКФ) (29).
Неуклонно снижающаяся или низкая СКФ является наиболее точным маркером наличия у пациента угрожающей жизни нефропатии или хронической болезни почек (ХБП). Точно установлено, что СКФ неуклонно уменьшается у всех пациентов перед развитием ХБП. А сама по себе ХБП обязательно характеризуется снижением СКФ не менее чем на 75% от нормы.
Напрямую измерить СКФ невозможно. Наиболее точные сведения о ней дает определение клиренса вещества, которое не синтезируется в организме, физиологически нейтрально, свободно фильтруется в клубочках и не секретируется, не реабсорбируется и не метаболизируется в канальцах. Поскольку количество этого вещества, внутривенно введенного в организм и профильтрованного в неизменном виде в гломерулах, эквивалентно количеству, выведенному с мочой, то это позволяет точно определить СКФ для почек в целом. На сегодняшний день в качестве «золотого стандарта» для оценки СКФ используется клиренс полисахарида фруктозы инулина.
Однако определение СКФ по клиренсу инулина в ветеринарной медицине имеет целый ряд существенных ограничений, как связанных с техническими сложностями, так и по причине очень высокой стоимости проведения самого теста[1].
В настоящее время в рутинной практике попытка установления СКФ у пациента практически всегда предпринимается с помощью определение уровня креатинина в сыворотке крови. Также на его концентрации основана наиболее широко используемая в ветеринарии классификация степеней ХБП (IRIS). Но связано это не столько с диагностической ценностью креатинина как показателя уровня СКФ, сколько с относительной простотой, доступностью и невысокой стоимостью определения этого лабораторного показателя.
Установление уровня креатининемии – широко распространенный метод лабораторной диагностики (зачастую использующийся вообще как единственный тест для выявления ХБП, а то и вообще любой нефропатии у животных) – дает весьма приблизительное представление не только о СКФ, но и о стадии течения нефропатии в целом. Кроме того, определение уровня креатинина имеет ряд очень серьезных ограничений в верификации тяжести заболевания почек, особенно на ранних и поздних этапах почечного континуума. А нормальные его границы в сыворотке крови далеко не всегда обозначают, что у животного нет угрожающей жизни нефропатии. Именно поэтому 1-я степень ХБП, по классификации IRIS[2] (таблица 1), является неазотемической.
Таблица 1. Классификация степеней ХБП на основании концентрации креатинина в сыворотке крови собак и кошек, по данным сайта www.iris-kidney.com
Степени ХБП |
Концентрация креатинина в плазме μmol/l mg/dl |
Комментарии Comments |
|
Собаки |
Кошки |
||
- |
<125 <1.4 |
<140 <1.6 |
Группа риска по ХБП. Пациенты, попадающие в «группу риска», должны проходить регулярное обследование, и должны предприниматься меры для уменьшения факторов риска. At risk of CKD For patients identified as ‘at risk’ consider regular screening and taking steps to reduce risk factors. |
1 |
<125 <1.4 |
<140 <1.6 |
Неазотемическая форма. Любая другая нефропатия, например неадекватная концентрирующая способность почек без явно выявляемой причины, связанной с нефропатией. Выявление отклонений при пальпации и/или при дополнительных инструментальных методах диагностики почек. Устойчивое повышение содержания белка в моче (почечного происхождения). Отклонения при биопсии почек. Прогрессирующееповышениесодержаниякреатининавсыворотке. Non-azotemic Some other renal abnormality present e.g. inadequate concentrating ability without identifiable non-renal cause; abnormal renal palpation and/or abnormal renal imaging findings; persistent proteinuria of renal origin; abnormal renal biopsy results, progressively elevating creatinine levels. |
2 |
125 - 179 1.4 - 2.0 |
140 - 249 1.6 - 2.8 |
Легкая ренальная азотемия. Нижний порог этого диапазона лежит в пределах границы диапазона нормы для многих лабораторий. Но нечувствительность к креатинину при проведении скрининг–теста означает, что животные с уровнем креатинина, близким к верхнему пределу нормы, часто имеют проблемы с выделительной системой. Клиническиепризнакилегкойстепенитяжести либоотсутствуют. Mild renal azotemia [lower end of the range lies within the reference range for many labs but the insensitivity of creatinine as a screening test means that animals with creatinine values close to the upper limit of normality often have excretory failure] Clinical signs usually mild or absent. |
3 |
180 - 439 2.1 - 5.0 |
250 - 439 2.9 – 5.0 |
Умеренная почечная азотемия. Могут присутствовать многие системные клинические признаки. Moderate renal azotaemia Systemic clinical signs may be present. |
4 |
>440 >5.0 |
>440 >5.0 |
Тяжелая ренальная азотемия. Присутствуют клинические признаки системных поражений. Severe renal azotaemia. Systemic clinical signs are usually present. |
Также следует отметить, что свойства креатинина и мочевины как ведущих уремических токсинов, с которыми якобы связано большинство клинических проявлений ХБП, значительно преувеличены. В настоящее время и патофизиологи, и врачи-нефрологи сходятся в мысли о том, что повышение уровня азотемии хотя и может оказывать определенное неблагоприятное влияние на функциональное состояние организма, но все-таки не является ведущим фактором интоксикации, инициирующим целый ряд разнообразных клинических проявлений при ХБП.
Креатинин
Креатинин (как и мочевина) является одним из конечных продуктов азотистого обмена, в норме выделяемых в основном с мочой. Он образуется из белка креатина, служащего источником энергии для скелетной мускулатуры. В них креатин депонируется в виде соединения, носящего название креатинфосфат (креатинфосфорная кислота). При сокращении мышечных волокон креатинфосфат отдает свою энергию, а сам распадается до конечных продуктов – креатинина, воды и остатков фосфора.
Вновь образовавшийся креатинин беспрепятственно проходит через фильтрационный барьер гломерул, но, кроме этого, секретируется и в просвет проксимальных канальцев из перитубулярной микрокапиллярной сети. Поэтому количество креатинина, поступившего в мочу и выведенного из организма у здоровых животных, является суммой профильтрованного и секретированного.
Однако у собак и кошек с ХБП креатинин начинает интенсивно выделяться в просвет кишечника и затем, из-за обильного роста сапрофитной бактериальной флоры (что обычно для больных ХБП), там разрушается. Вследствие этого у пациентов с выраженным снижением функции почек элиминация креатинина из организма более чем на 2/3 может происходить через ЖКТ (что является одной из многих причин, осложняющих оценку уровня почечной функции, рассчитанной только по этому показателю).
Поскольку креатинин образуется в основном в результате биотрансформации креатина в скелетных мышцах, то объем его синтеза прямо пропорционален общей мышечной массе и интенсивности обменных процессов, происходящих в ней. Поэтому среднесуточный объем образования креатинина выше у молодых животных, чем у старых, равно как у ведущих активный образ жизни, чем у страдающих гиподинамией.
Сывороточное содержание креатинина может значительно отличаться у кошек и, особенно, у собак различных пород (нормальные значения этого показателя находятся в диапазоне, превышающем 100 ммоль/л). Кахексия любого генеза, как и низкобелковое питание или тем более анорексия, также может приводить к снижению уровня креатининемии. Высокое содержание в употребляемом животными корме мясных ингредиентов (прежде всего термически обработанных), напротив, может приводить к увеличению уровня азотемии, поскольку часть креатина в процессе приготовления кормов переходит в креатинин.
А уровень мочевины в крови вообще напрямую зависит от количества потребляемого белка и может неоднократно меняться в течение суток. Следовательно, у животных, находящихся на малобелковой диете, уровень азотемии, вероятнее всего, будет ниже, чем это можно было бы предполагать, исходя из данных других лабораторных и визуальных методов диагностики.
К ситуациям или состояниям, которые могут существенно снизить диагностическую ценность определения уровня креатинина, также можно отнести следующие:
крайние значения возраста и очень малая или, напротив, большая внутривидовая масса тела;
ожирение;
тяжелый дефицит пластических и/или энергетических веществ в организме;
низкобелковая диета;
стремительно, как например при острых гломеруло- или тубулоинтерстициальных нефритах, меняющаяся функция почек.
Поскольку уровень азотемии, находящийся в пределах нормы, далеко не всегда свидетельствует о том, что у пациента нет угрожающего жизни заболевания почек, то перед назначением нефротоксичных препаратов необходимо оценить функцию почек всеми другими доступными неинвазивными методами (анализ мочи часто может «рассказать» о функции почек гораздо больше, чем анализы крови), а также тщательно взвесить необходимость его проведения.
Из теоретических предпосылок, благодаря которым креатинин широко используется для диагностики почечной недостаточности, можно выделить только две: клиренс креатинина практически идентичен СКФ, рассчитанной по «золотому стандарту» для этого показателя, и скорость выведения креатинина у каждого конкретного животного примерно постоянна во времени. Но и здесь есть очень существенное «но». Фундаментальная физиология говорит о том, что верно это только для пациентов, у которых СКФ снижена не более чем на 25%, т.е. у практически здоровых животных или, во всяком случае, у тех, у которых напрочь отсутствуют какие-либо клинические признаки нефропатии (стоит напомнить и о том, что и животные, и человек могут прекрасно себя чувствовать с одной лишь здоровой почкой, а в этом случае СКФ, само собой разумеется, снижена, по крайней мере, на 50%) (37). Кроме того, скорость экскреции креатинина, относительно постоянная у людей, имеет выраженные внутривидовые различия у мелких домашних животных из-за большого количества разнообразных пород кошек и собак, чей вес может различаться более чем в 100 раз. Поэтому, как это ни странно, решающими факторами при выборе креатинина сыворотки крови в качестве маркера уровня почечной функции оказались следующие:
доступность его определения с экономической точки зрения (а также то, что сами измерения легко воспроизводимы почти в любой клинической лаборатории);
диагностика различных нефропатий у животных производится в основном на клинической стадии почечного континуума (т.е. на стадии ХБП), когда СКФ снижена более чем на 75% и уровень азотемии действительно стремительно начинает нарастать.
И только благодаря этому, несмотря на то что уровень креатина сыворотки крови дает очень отдаленное представление о СКФ (а чаще всего не дает вообще никакого) и, следовательно, о почечной функции в целом, именно он (а также мочевина, имеющая еще меньшее диагностическое значение) наиболее часто используется в рутинной практике для диагностики нефропатий и оценки степени их тяжести у мелких домашних животных.
Факторы, приводящие к ошибкам при расчете СКФ по уровню креатининемии
В гуманной медицине существует более 20 предсказывающих формул для вычисления СКФ по уровню креатинина у взрослых и детей, имеющих различные степени смещения и прецизионности[3] относительно результатов ее измерений методами, отнесенными к «золотому стандарту»[4]. Достоверность и, следовательно, клиническая ценность большинства этих предсказывающих формул оказались очень низкими (т.е. расчеты по ним систематически приводили к значительному завышению или занижению СКФ). Но даже те формулы, которые показали относительно высокую степень приближения к истинной СКФ (например,формула Кокрофта-Голта (Cockcroft-Gault), формулы из исследования MDRD[5] и, принадлежащее тем же авторам уравнение CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration equation)(41)), по целому ряду причин не могут быть напрямую инсталлированы на животных.
Продукция креатинина у кошек, и особенно у собак, очень сильно варьирует в зависимости от породы, пола, возраста и уровня физической активности. Так, например, нормальное значение уровня креатинина для гончих и борзых пород собак (до 220 ммоль/л) соответствует третьей, предпоследней, степени тяжести ХБП по классификации IRIS.
Практически все методы оценки СКФ, за исключением некоторых, основанных, например, на определении клиренса инулина (т.н. «золотой стандарт»), дают весьма смещенную оценку уровня почечной функции. Особенно выраженной она может быть при попытке измерить ее при помощи креатинина сыворотки крови. Подобное определения СКФ приводит к систематическому ее завышению, вследствие чего животные, требующие нефропртективной и мочегонной терапии, ее не получают.
Факторы, снижающие ценность определения уровня креатинина сыворотки крови в качестве индекса для оценки СКФ
К основным ограничениям использования концентрации креатинина в сыворотке крови в качестве лабораторного показателя, по которому можно оценить степень снижения почечной функции, можно отнести следующие.
Очень широкий диапазон нормальных концентраций в сыворотке крови у животных. Это обстоятельство зачастую позволяет повыситься его уровню у пациента более чем в 2-3 раза, прежде чем достигнет верхней границы нормы (т.е. нефропатия интенсивно прогрессирует, но из-за исходно низкого уровня креатиниемии диагностирована она может быть лишь другими методами).
Из-за большого функционального резерва почек концентрация креатинина может не выходить за пределы нормальных значений в случаях, когда большая часть их паренхимы находится в состоянии частичной и/или полной деструкции (схема 1 и 2). Что также верно и на ранних стадиях развития ренальной дисфункции в диапазоне между гиперфильтрацией и ранней стадией гипофильтрации, когда нет пропорциональной связи между уровнями креатинина и истинными значениями СКФ. Ситуацию усугубляет компенсаторная гиперфильтрация креатинина в мочу или в просвет кишечника, имеющая место при большинстве хронических нефропатий, особенно на доклиническом или, соответственно, клиническом этапах почечного континуума.
Крайне низкая чувствительность к изменению функции почек, особенно на ранних и поздних стадиях течения хронических нефропатий (относительное исключение, пожалуй, составляет только незначительный промежуток почечного континуума, который можно отнести к II-III степени ХБП по классификации IRIS (таблица 1). Кроме того, уровни креатинина весьма инерционны, и это не позволяет оперативно оценивать изменения СКФ при ухудшении или улучшении ренальных функций, возникающих в результате развития заболевания или нефропротективной терапии. Последнее особенно важно при острых нефропатиях, когда креатинин весьма неточно отражает реальную картину поражения почечной паренхимы до тех пор, пока не достигается некоторая стабилизация состояния пациента, что чаще всего происходит через 48-72 час. после дебюта заболевания (например, острого гломерулонефрита). В то время как оценить степень аутоиммунного поражения почечной паренхимы и, следовательно, определиться с тактикой (степенью агрессивности) гормонотерапии необходимо как можно быстрее после начала развития заболевания.
Зависимость от изменения мышечной (но не общей) массы тела пациента (что, например, при кахексии, обычно развивающейся у животных с ХБП, может создать иллюзию улучшения экскреторных функций почек). Синтез креатинина у животных с тяжелыми степенями ХБП снижается не только из-за уменьшения мышечной массы, но и, особенно у кошек, из-за дефицита пластических веществ (прежде всего аргинина, глицина и метионина), вызванного анорексией.
Изначально не очень высокая, находящаяся в нижней трети диапазона нормальных значений концентрация креатинина в сыворотке крови у пациентов с небольшой мышечной массой и гиподинамией и, напротив, исходно высокая у пациентов с большой массой и ведущих активный образ жизни. Таким образом, бывает очень сложно оценить, насколько значимым было повышение уровня креатинина у конкретного пациента, не только из-за широкого диапазона нормальных значений, но и из-за отсутствия сведений (что чаще всего бывает при первичном обращении) об отправной точке, с которой этот рост начался.
Увеличение тубулярной секреции (до 30% от общего объема) и генерации креатинина, а также его внепочечной экскреции при многих нефропатиях. Так, например, у пациентов с выраженным снижением функции почек до 2/3 общей суточной экскреции креатинина может происходить за счет его внепочечной элиминации (например, через ЖКТ, где креатинин разрушается сапрофитной микрофлорой и/или выводится наружу с каловыми массами).
Некоторые лекарственные препараты (например, циметидин, триметоприм) снижают тубулярную секрецию креатинина, способствуя увеличению концентрации креатинина в сыворотке крови (с другой стороны, введение этих лекарственных препаратов иногда используется для того, чтобы более точно установить истинный уровень креатининемии у пациента, сниженный в результате увеличения канальцевой секреции) (17, 30).
Ряд экзогенных химических веществ (например, цефалоспорины) могут определяться в сыворотке крови как креатинин при лабораторных исследованиях. Также у пациентов с кетоацидозом ацетоуксусная кислота может «маскироваться» под креатинин, создавая ложное впечатление об увеличении его содержания в крови.
Использование лабораториями различных методов определения креатинина (имеет место и недостаточное внимание к калибровке биохимических анализаторов). Это приводит к тому, что у одного и того же пациента и в одно и то же время его значения могут значительно различаться.
У щенков и котят дополнительной сложностью в определении уровня почечной функции по креатинину является интенсивный мышечный рост и созревание.
Измерение клиренса эндогенного креатинина как маркера почечной функции у пациента, с теоретической точки зрения, может дать более точные сведения. Но на практике расчет СКФ и по этому показателю далеко не всегда эквивалентен расчету по «золотому стандарту». Кроме того 24-часовое измерение клиренса креатинина является непростой задачей, поскольку, кроме прочего, требует сбора суточного объема мочи, что уже само по себе закладывает большой процент ошибки. Да и сам клиренс креатинина значимо варьируется день ото дня, приводя к серьезным разночтениям даже при корректном суточном сборе мочи. Следует помнить и о том, что чем тяжелее степень ХБП, тем больше креатинина элиминируется из организма не только с мочой, но и через ЖКТ.
В добавление к этому следует отметить, что отсутствуют данные о нормальном уровне креатинина у кошек старше 10-15 лет и у собак 7-9 летнего возраста. В то время как у пожилых пациентов в силу чисто физиологических процессов, как «старение почек» в частности, так и всего организма в целом, уровень креатининемии часто не коррелирует с данными других неинвазивных и инвазивных методов диагностики. Так, например, у животных с вторично сморщенной почкой, тяжелой гипертензией и выраженным нефритическим синдромом азотемия может находиться в пределах нормы или даже быть ниже ее.
Стадии течения хронических нефропатий и характерный для них уровень креатининемии приведены в таблице 2
Также нужно учитывать, что мочевина не используется в качестве переменных в предсказывающих формулах для определения СКФ и на ее уровне не построена ни одна из существующих классификаций степеней ХПН или ХБП ни у животных, ни у человека. Это говорит о еще меньшем диагностическом значении этого биохимического показателя, даже в сравнении с креатинином.
Креатинин и мочевина как уремические токсины
Длительное время считалось, что креатинин и мочевина являются не только маркерами почечной недостаточности, но и вызывают большинство ее клинических проявлений. Однако в настоящее время эти взгляды на патогенез ХПН и ХБП пересматриваются. Прежде всего небезынтересен тот факт, что у собак и кошек с повышенными уровнями креатинина и мочевины могут отсутствовать какие-либо клинические проявления. Да и длительное экзогенное введение больших доз этих веществ здоровым животным не приводит к появлению у них признаков ХБП.
Сегодня многие авторы склоняются к тому, что наиболее значимыми факторами т.н. уремической интоксикации (т.е. симптомокомплекса, возникающего на поздних стадиях почечного континуума) являются прежде всего нарушение кальций-фосфорного баланса в организме и развивающийся на его фоне гиперпаратиреоз. И именно паратиреоидному гормону, имеющему рецепторы не только первого типа на остеобластах, но и второго во многих других органах и тканях, отводится ключевое место в развитии целого ряда осложнений ХБП, во всяком случае, на ранних и средних этапах ее течения[6]. На заключительной стадии ХБП (уремическая, терминальная или IVпо классификации IRIS) состояние многократно усугубляется еще и нарушением кислотно-щелочного равновесия в организме (ацидозом, например). На этом фоне накопление конечных продуктов азотистого обмена веществ хотя, возможно, и имеет определенное токсическое влияние, но вряд ли является превалирующим.
Пре- и постренальная азотемия
В развитии азотемии далеко не всегда «виновными» оказываются непосредственно почки (хотя рано или поздно при отсутствии адекватных лечебных мероприятий этот парный орган оказывается втянут в патогенез любой патологии, характеризующейся гиперазотемией).
Преренальная азотемия (гиповолемического, гипотензивного и т.п. характера), как правило, имеет яркие клинические проявления или, во всяком случае, может быть теоретически предсказана (например, ее развитие можно предположить перед проведением длительной хирургической операции или после массивной кровопотери). С постренальной азотемией дела обстоят несколько сложнее. Разумеется, острая задержка мочи, возникшая в результате обструкции уретры, также не представляет сложности в диагностике. Но вот разрывы мочевого пузыря и, особенно, мочеточников могут остаться незамеченными и требуют, в частности, проведения визуализирующих методов диагностики. Тем более что первые клинические признаки ХПН при этом начинают появляться только тогда, когда уровень креатинина становится выше 440-600 ммоль/л. Последнее, между прочим, является дополнительным доказательством того, что значение азотемии в патогенезе т.н. уремической интоксикации и ХБП значительно преувеличены.
Заключение
Креатинин сыворотки крови сегодня очень широко используется для диагностики различных нефропатий, а также для классификации стадий ХБП у собак и кошек. Однако в подавляющем большинстве случаев этот показатель не является сколько-нибудь точным эквивалентом СКФ (ни сам по себе, даже в случае расчета его суточного клиренса, ни как переменная в предсказывающих формулах) и, следовательно, не может отражать истинный уровень почечной функции в целом. Поэтому для выявления нефропатий и оценки тяжести их течения необходимо прибегать к возможно более широкому спектру неинвазивных, а при необходимости и инвазивных, методов исследования (равно как и к статистической информации о распространенности тех или иных нефропатий в конкретном регионе, полученной в результате обработки данных гистоморфологических исследований аутопсийного материала) для того, чтобы диагностировать патологию на возможно более раннем этапе, т.е. тогда, когда еще возможно эффективное этиологическое и/или патогенетическое ее лечение и есть вероятность на годы отдалить появление первых клинических признаков ХБП.
К грубой врачебной ошибке можно отнести ситуацию, при которой нефропатии диагностируются только тогда, когда у пациента начинает увеличиваться уровень азотемии (тем более что рассчитанная по уровню креатинина и/или мочевины СКФ, а следовательно, и уровень почечной функции в целом систематически и значительно завышаются). Связано это с тем, что на азотемическом этапе почечного континуума большая часть форменных элементов и стромы почек уже находится в состоянии полной или частичной деструкции (склерозирование и т.д.). И такой подход позволяет начать лечение заболеваний почек только тогда, когда возможна лишь симптоматическая и/или заместительная терапия, а качество жизни и пациента, и его владельцев стремительно и неуклонно снижается не смотря на проводимые лечебные мероприятия.
Литература
Akizawa T., Fukagawa H., Koshikawa S., Kurosawa K. Recent progress in management secondary hyperparathyroidism of chronic renal failure. Curr Opin Hypertens 1993; 2; 558-565.
Alexiewicz J.M., Klinger M., Pitt S.M. et al. PTH inhibits B cell proliferation: implication in chronic renal failure. J Am Soc Nephrol 1990; 1: 236-244.
Amann K., Ritz E., Wiest G., Klaus G., Mall G. A role of parathyroid hormone for activation of cardiac fibroblast in uremia. J Amer Soc Nephrol 1994; 4(10): 1814-1819.
Bovee KC, Joyce T. Clinical evaluation of glomerular function: 24-hour creatinine clearance in dogs. Journal of the American Veterinary Medical Association. 1979;174:488–491.
Brown SA, Finco DR, Boudinot FD, Wright J, Taver SL, Cooper T. Evaluation of a single injection method, using iohexol, for estimating glomerular filtration rate in cats and dogs.American Journal of Veterinary Research. 1996a;57:105–110.
Brown SA, Haberman C, Finco DR. Use of plasma clearance of inulin for estimating glomerular filtration rate in cats. American Journal of Veterinary Research. 1996b;57:1702–1705.
Cholst I.N., Steinberg S.F., Tropper P.J. et al. The influence of hypermagnesemia on serum calcium and parathyroid hormone in human subjects. N Engl J Med 1984; 310: 1221-1225.
Coburn J.W., Slatopolsky E. Vitamin D, parathyroid hormone and the renal osteodystrophies in the kidney (4 th ed), edited by Brenner B.M., Rector F.C. Philadelphia, W.B. Saunders Company, 1991; 2036-2120.
Combe C., Aparicio M. Phosphorus and protein restriction and parathyroid function in chronic renal failure. Kidney Int 1994; 46: 1381-1386.
Feinfeld D.A., Sherwood L.M. Parathyroid hormone and 1,25 (OH)2 D3 in chronic renal failure. Kidney Int 1988; 33: 1048-1058.
Fensenfeld A.J., Llach F. Parathyroid gland function in chronic renal failure. KidneyInt 1993; 43: 771-789.
Finco DR, Braselton WE, Cooper TA. Relationship between plasma iohexol clearance and urinary exogenous creatinine clearance in dogs. Journal of Veterinary Internal Medicine.2001;15:368–373.
Finco DR, Brown SA, Vaden SL, Ferguson DC. Relationship between plasma creatinine concentration and glomerular filtration rate in dogs. Journal of Veterinary Pharmacology and Therapeutics. 1995;18:418–421.
Finco DR, Tabaru H, Brown SA, Barsanti JA. Endogenous creatinine clearance measurement of glomerular filtration rate in dogs. American Journal of Veterinary Research. 1993; 54: 1575–1578.
Finco DR. Measurement of glomerular filtration rate via urinary clearance of inulin and plasma clearance of technetium Tc 99m pentetate and exogenous creatinine in dogs. American Journal of Veterinary Research. 2005; 66: 1046–1055.
Goy-Thollot I, Chafotte C, Besse S, Garnier F, Barthez PY. Iohexol plasma clearance in healthy dogs and cats. Veterinary Radiology and Ultrasound. 2006b;47:168–173.
Hellerstein S, Berenbom M, Alon US, Warady BA: Creatinine clearance following cimetidine for estimation of glomerular filtration rate. Pediatr Nephrol 12:49-54, 1998.
Komaba H., Goto S., Fukagawa M. Critical issues of PTH assays in CKD // Bone. 2009; 44: 666–670.
Massry S.G. Is parathyroid hormone a uremic toxin? Nephron 1977; 19: 125-130.
Massry S.G. The toxic effect of parathyroid hormone in uremia. Semin Nephrol 1983; 3: 306-328.
Massry S.G., Smogorzewski M. Mechanism through which PTH mediates its deleterious effects on organ function in uremia. Semin Nephrol 1994; 14: 219-231.
Nicolle AP, Chetboul V, Allerheiligen T, Pouchelon J, Gouni V, Tessier-Vetzel D, Sampedrano CC, Lefebvre H. Azotemia and glomerular filtration rate in dogs with chronic valvular disease. Journal of Veterinary Internal Medicine. 2007;21:943–949.
Raine A.E.G., Bedford L., Simpson A.W.M. et al. Hyperparathyroidism, platelet intracellular free calcium and hypertension in CRF. Kidney Int 1993; 43: 700-705.
Silver J., Levi R. Regulation of PTH synthesis and secretion relevant to the management of secondary hyperparathyroidism in chronic kidney disease // Kidney Int. 2005; Vol. 67, Supplement 95, S8–S12.
Silver J., Moallem E., Kilav R. et al. New insights into the regulation of parathyroid hormone synthesis and secretion in chronic renal failure. Nephrol Dial Transplant 111 1996; (suppl 3), 2-5.
Slatopolsky E., Delmez J.A. Pathogenesis of secondary hyperparathyroidism. Am J Kidney Dis 1994; 23: 229-236.
Slatopolsky E., Delmez J.A. Pathogenesis of secondary hyperparathyroidism. Am J Kidney Dis 1994; 23: 229-236.
Slatopolsky Е., Brown А., Dusso А. Pathogenesis of secondary hyperparathyroidism // Kidney Int. 2005; Vol. 56, Supplement 73: S14–S19.
Von Hendy-Willson VE, Pressler BM. An overview of glomerular filtration rate testing in dogs and cats. Vet J. 2011 May;188(2):156-65.An overview of glomerular filtration rate testing in dogs and
Walser M: Assessing renal function from creatinine measurements in adults with chronic renal failure. Am J Kidney Dis 32:23-31, 1998.
Волгина Г. В. Вторичный гиперпаратиреоз при хронической почечной недостаточности. Лечение активными метаболитами витамина D. Журнал "Нефрология и диализ". Т. 6, 2004, № 2.
Волгина Г. В., Перепеченных Ю. В. Паратиреоидный гормон - универсальный уремический токсин. Журнал "Нефрологияидиализ" >> Т. 2, 2000, №1-2.
Волгина Г. В., Перепеченных Ю. В. Лечение вторичного гиперпаратиреоза у больных с хронической почечной недостаточностью. Журнал "Нефрология и диализ" >> Т. 2, 2000, № 4.
Волгина Г. В., Перепеченных Ю. В. Роль паратиреоидного гормона и витамина D в развитии кардиоваскулярных нарушений при хронической почечной недостаточности (Обзор литературы). Журнал "Нефрология и диализ" Т. 2, 2000, № 3.
Рожинская Л. Я. Вторичный гиперпаратиреоз и почечные остеопатии при хронической почечной недостаточности. Журнал "Нефрология и диализ" Т. 2, 2000, № 4.
Ромашина Н.Ю., Орлова Г.М., Хантакова Е.А., Хамнуева Л.Ю.Гиперпаратиреоз и анемия при хронической болезни почек: есть ли связь? ЭНИ Забайкальский мед. вестник. № 1.13.
Фундаментальнаяи клиническая физиология: Учебник для студ. высш. учеб. заведений / Под ред. А. Г. Камкина и А. А. Каменского. — М.: Издательский центр «Академия», 2004. — 1072 с.
Massry S.G. PTH and myocardiopathy. Contrib Nephrol 1984; 41: 231-239. Smogorzewski M. PTH, chronic renal failure and myocardium. Miner Electrol Metab 1995; 21: 55-62.
Melani R. Custódio, Marcia K. Koike et al. Parathyroid hormone and phosphorus overload in uremia: impact on cardiovascular system. Nephrology Dialysis Transplantation, Volume 27, Issue 4. №04. 2012.
http://www.kidney.org
Levey ASet al. A new equation to estimate glomerular filtration rate. Ann Intern Med. 2009 May 5;150(9):604-12. Erratum in Ann Intern Med. 2011 Sep 20;155(6):408.
Сноски
[1] Определения СКФ по клиренсу таких экзогенных радиоактивных меток, как 125I-иоталамат и 99mTc-DTPA, хотя также представляет собой высокоточные методы измерения этого показателя, но в настоящее время еще менее доступны, чем тест с инулином. А определение СКФ по плазменным клиренсам таких веществ, как iohexol и 51Cr-EDTA , кроме прочего требуют вычисления точной площади поверхности тела пациента, что далеко не всегда возможно в ветеринарной медицине.
[2] www.iris-kidney.com
[3] От англ. precision — точность.
[4] В различных клинических исследованиях в гуманной медицине проводилась сравнительная оценка уровня почечной функции по предсказывающей формуле, одной из переменных в которой был уровень креатинина сыворотки, а полученные результаты у тех же самых пациентов затем сравнивались со СКФ, определенной при помощи методов, соотнесенных к «золотому стандарту».
[5]Modification of Diet in Renal Disease Study (Levey AS исоавт., 1999).
[6] Паратиреоидному гормону сегодня также отводится ведущая роль в развитии такого осложнения ХБП, как миокардиопатии(38,39).
Роман-А. Леонард
Рекомендации НАВНУ: Хроническая Болезнь Почек у собак и кошек – основополагающие принципы диагностики и скрининга
Автор: к.в.н. Роман-А. Леонард, практикующий ветеринарный врач, руководитель Центра ветеринарной нефрологии и урологии, президент Российской Научно-практической Ассоциации Ветеринарных Нефрологов и Урологов (НАВНУ)
E-mail: vetnefro@mail.ru
Введение
Заболевания почек у мелких домашних животных, приводящие к развитию хронической болезни почек (ХБП), широко распространены во всем мире. Особенно подвержены нефропатиям кошки, у которых ХБП иногда считают чуть ли не нормальным состоянием для стареющих животных.
Сегодня можно констатировать тот факт, что ветеринарная медицина столкнулась с пандемией хронического заболевания неинфекционного характера (прежде всего у кошек), которое способно значительно ухудшить качество жизни как самих животных (в т.ч. и не достигших физиологической старости), так и их владельцев, а также привести последних к большим затратам времени и средств, необходимых для сохранения хотя бы жизни питомцев. Причем неверным будет считать, что ХБП подвержены в основном животные старших возрастных групп. Очень часто различные нозологические формы нефропатий (например, быстропрогрессирующий (подострый) гломерулонефрит (ГН) с полулуниями), неминуемо приводящие к развитию хронической почечной дисфункции, регистрируются даже у котят, не достигших 6-месячного возраста. Это в первую очередь касается животных, перенесших острые или подострые формы различных вирусных инфекций. Т.о., первые клинические признаки хронической почечной недостаточности могут регистрироваться у пациентов, не достигших годовалого возраста.
Кроме того, широко распространенная в медицине человека практика проведения пациентам на терминальной стадии ХБП машинного диализа («искусственная почка») в ветеринарной медицине по целому ряду обстоятельств пока не нашла широкого распространения.
Одной из ведущих причин такого положения дел является то обстоятельство, что диагностика ХБП (а иногда и любой нефропатии вообще) в большинстве случаев производится сегодня ветеринарными врачами только на основании развития у пациента азотемии. Помимо того, что такой подход не верен в принципе, он позволяет начать терапию заболевания только тогда, когда этиопатогенетическое лечение её невозможно, а симптоматическое высокозатратно (в силу того что почки выполняют большое число разнообразных экскреторных, эндокринных и метаболических функций), малоэффективно уже по своему определению и способно лишь до некоторой степени и на непродолжительное время поддержать гомеостаз организма. Кроме того, необходимость в проведении ежедневных лечебно-диагностических процедур (в т.ч. инвазивных) очень часто заканчивается развитием у пациента (особенно у кошек) хронического стресса, что еще больше снижает эффективность проводимых процедур, а то и вовсе сводит их на нет. Бесспорно, что подобный подход к диагностике заболеваний почек завел ветеринарную нефрологию, да и ветеринарию в целом, в тупик и весьма серьезно снижает авторитет профессии в целом.
Но развитие современной медицинской науки и фармакологии позволяет в корне изменить такое положение дел и дает все основания для разработки и внедрения новых безопасных, высокоэффективных и доступных в рутинной врачебной практике методов скрининга, диагностики и лечения различных нефропатий, включая ХБП. Эти инновационные методы позволяют значимо замедлить прогрессирование любых хронических нефропатий в частности и ХБП в целом, снизить затраты на лечение пациентов и риск развития у них осложнений, а значит, на годы отдалить появление клинического этапа почечного континуума, характеризующегося резким снижением качества жизни пациентов и их владельцев. Подобные подходы приемлемы для подавляющего числа животных, страдающих нефропатиями, независимо от причин их появления и/или нозологической формы самого заболевания. Кроме того, нефропротективная терапия на доклиническом этапе почечного континуума не только высокоэффективна в большинстве клинических случаев, но и не требует от владельцев больших затрат времени и средств.
Эти обстоятельства требуют от современной ветеринарной медицины кардинально новых подходов и стратегии в отношении дефиниции и разделения степеней тяжести различных хронических почечных патологий. Появилась насущная необходимость в формировании и внедрении в общеклиническую практику доступных для выполнения критериев и клинико-морфологической классификации, позволяющей выявлять и оценивать степень тяжести почечной дисфункции, ее прогноз и необходимые лечебные воздействия на том или ином этапе почечного континуума[3].
В медицине человека первая попытка решения этой задачи была предпринятаНациональным почечным фондом США (National Kidney Foundation – NKF). Современная концепция ХБП (chronic kidney disease (CKD) была дополнена и расширена экспертами Европейской почечной ассоциации – Европейской ассоциации диализа и трансплантации (ERA?EDTA) [European Best Practice, 2002] и KDIGO (Kidney Disease: Improving Global Outcomes) [LeveyAS и соавт., 2005; Levey AS и соавт., 2010] и к настоящему времени получила общемировое признание.
Учитывая тот факт, что макро- и микроструктурное строение почки у собак и кошек, а также физиологические аспекты ее работы практически на 100% идентичны с человеком (во всяком случае, в фундаментальных аспектах), основные положения современной концепции ХБП, разработанные NKF, ERA?EDTA и KDIGO, могут быть приняты за основу и в ветеринарной медицине.
Раздел I. Хбп – важная проблема ветеринарной медицины
Рекомендация 1.1
Внедрение новой концепции ХБП у мелких домашних животных (МДЖ) в общеклиническую практику ветеринарной медицины является важной задачей, имеющей своими целями следующее:
– снижение ранней смертности пациентов и увеличение продолжительности доклинического этапа почечного континуума;
– возможно более долгое сохранение активной и полноценной жизни животных, страдающих хроническими нефропатиями, и отдаление момента, когда начинают лавинообразно развиваться (в силу истощения компенсаторного резерва почек) клинические симптомы заболевания, качество жизни стремительно и неуклонно снижается, и возникает необходимость в постоянной симптоматической и заместительной терапии.
Комментарий
ХБП, являющаяся следствием различных гломеруло- и тубулоинтерстициальных патий, очень широко распространена среди кошек во всем мире, о чем свидетельствуют данные как клинических, так и, что куда более весомо, гистоморфологических исследований. И именно ХБП является не только наиболее частой причиной гибели или усыпления кошек, не достигших физиологической старости, но и одним из ведущих факторов ухудшения качества их жизни. Те или иные маркеры почечного поражения и/или снижения скорости клубочковой фильтрации (СКФ) могут быть выявлены практически у всех кошек вне зависимости от возрастной группы. А при гистоморфологическом исследовании почечной паренхимы изменения выявляются если не при световой, то, по крайней мере, при электронной микроскопии (например, слияние ножек подоцитов, накопление мембранного материала и мезангиального матрикса в гломерулах и т.д.).
Почему ХБП чаще болеют именно кошки? Факты и гипотезы
• Большое число видоспецифичных для кошачьих вирусных инфекций, имеющих хронические или латентные формы течения и инициирующих в организме каскад иммунных реакций, одним из итогов которых является более или менее постоянное образование циркулирующих иммунных комплексов (ЦИК, АГ+АТ+С3), вызывающих необратимые повреждения гломерулярного фильтрационного барьера. Ситуацию часто усугубляет содержание кошек большими группами, в которых происходит постоянный обмен вирусными агентами. Свою лепту в этот процесс вносит активная племенная и выставочная работа, в итоге которой представители дотоле относительно изолированной популяции кошек определенного региона встречаются с большим числом новых вирусных агентов, формирование иммунитета к которым если и не сопряжено с развитием острого инфекционного процесса, то, по крайней мере, чревато образованием большого числа ЦИК.
• Значительно более медленная элиминация иммунных комплексов через микрокапиллярную сеть гломерул в силу физиологических особенностей этого вида животных (сниженная скорость клубочковой фильтрации (СКФ) и высокая концентрационная способность тубулярного аппарата).
• Особенности белкового обмена у облигатных хищников, возможно имеющие негативное влияние на функцию почек (особенно на микрофильтрацию в гломерулах и патологические последствия протеинурии).
• Крайне ограниченный выбор эффективных противовирусных препаратов, обладающих вируцидным действием.
• Отсутствие широкого распространения во врачебной практике использования нефропротективных стратегий у кошек, болеющих или переболевших острыми (подострыми) формами вирусных инфекций, а также нефрологического обследования перенесших их животных.
У собак ХБП хотя и встречается значительно реже, чем у кошек, но также требует пристального внимания со стороны ветеринарных специалистов, тем более что такие причины ее развития, как сахарный диабет (диабетическая нефропатия) и трансмиссивные кровепаразитарные заболевания, вызывающие острый или подострый тубуло-интерстициальный нефрит, поражают все большее число особей в популяциях по всему миру.
Однако распространенность ХБП среди мелких домашних животных недооценивается многими ветеринарными специалистами. Непосредственной причиной гибели собак и кошек с ХБП может являться острая сердечная и/или дыхательная недостаточность, вызванная, например, патологическим перераспределением жидкости в организме (гидроторакс и гидроперикард), поражением миокарда и периферической и центральной нервной системы уремическими токсинами (прежде всего паратиреоидным гормоном (ПТГ)), а также тяжелое нарушение кислотно-щелочного гомеостаза организма (изменение рН крови даже на несколько десятых относительно нормы может стремительно привести к коме или смерти пациента) и т.д. И именно в силу отсутствия ярко выраженных патогномоничных признаков очень часто ветеринарными врачами случаи смерти пациентов с ХБП расцениваются как непочечные, тем более что уровень креатинина у таких пациентов, в силу различных причин, либо не определялся, либо был в пределах нормы, результаты исследования мочи были недооценены (если вообще делались), а посмертное гистоморфологическое исследование почечной паренхимы не проводилось.
Тем не менее по современным патофизиологическим представлениям ХБП сама по себе является, например, самостоятельной причиной ремоделирования миокарда из-за ряда метаболических и гемодинамических причин, таких как: гиперактивация ренин-ангиотензин-альдостероновой системы (РААС), оксидативный стресс, гиперпаратиреоз, анемия и дисбаланс пластических веществ в организме, прежде всего незаменимых аминокислот, возникающий в результате анорексии у пациентов.
Ввиду очень широкого распространения ХБП у мелких домашних животных её можно отнести не только к узкоспециальной нефрологической, но и к общеветеринарной и междисциплинарной категории. Для успешного ее решения требуется прежде всего систематический скрининг клинически здоровых пациентов, проведение которого должно осуществляться преимущественно врачами общей практики с последующим проведением, в случае необходимости, расширенного нефрологического обследования и назначением по его результатам пациенту этиопатогенетического и/или нефропротективного лечения.
В клинически сложных случаях животные должны направляться на консультацию к специалистам в области ветеринарной нефрологии или в специализированные ветеринарные центры.
Немаловажным является пропаганда знаний и умений в области профилактики возникновения и развития различных нефропатий, а также уменьшение числа ятрогений и необоснованного назначения нефротоксичных препаратов как на доклиническом, так и клиническом этапах почечного континуума.
