
6 курс / Гастроэнтерология / Российский_журнал_гастроэнтерологии,_гепатологии,_колопроктологии (60)
.pdf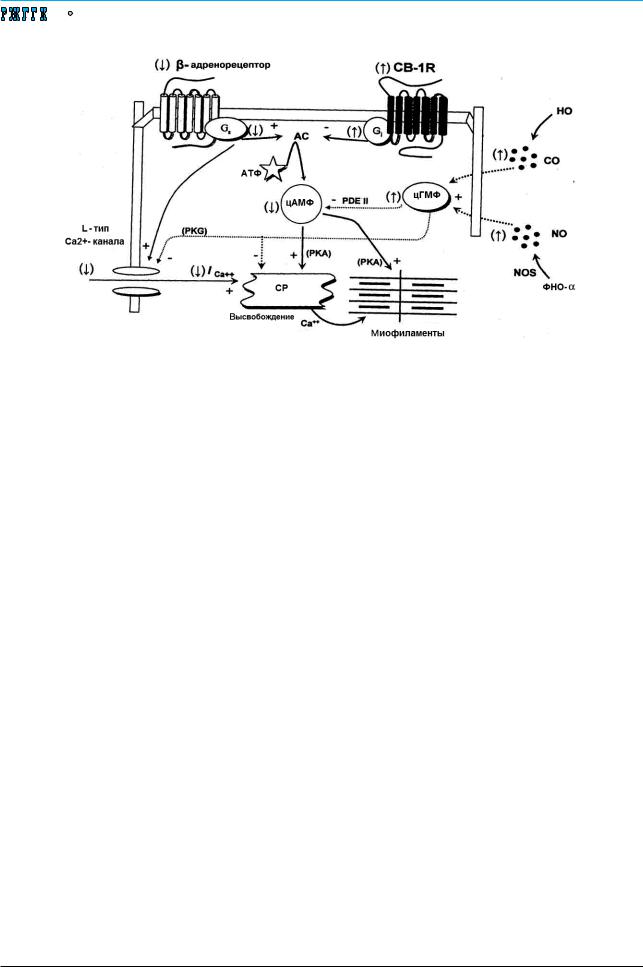
3, 2010 |
Лекции и обзоры |
|
|
|
|
|
|
Патогенетические механизмы формирования ЦКМ
особенности замедленной релаксации ЛЖ: |
существовали достаточно долго. Первые |
||||||||||
снижение показателя Е, повышение А, Е/А<1,0, |
доказательства.RUтого, что кардиомиопатия при |
||||||||||
повышение IRT и DT-E. Для рестриктивного типа |
ЦП может иметь и неакогольное происхождение |
||||||||||
характерны: повышение показателя Е, снижение |
представили С. Caramelo и соавт. в 1986 г. [15]. |
||||||||||
А, Е/А>2,2 снижение IRT и DT-E. |
|
|
Авторы обнаружили снижение СВ на 50% у крыс |
||||||||
Ранее |
предполагалось, |
что у |
пациентов |
с ЦП, индуцированным введением CL4. В 1989 г. |
|||||||
с циррозом печени |
(ЦП) |
значительно |
ниже |
.S. Lee предположил, что нарушение сердечного |
|||||||
|
|
|
|
|
|
-VESTI |
|
|
|
||
риск развития патологии сердца ввиду ряда |
ответа при ЦП обусловлено не столько действием |
||||||||||
патофизиологическихпроцессов,ассоциированных |
алкоголя, сколько самим заболеванием [40]. А в |
||||||||||
|
|
|
|
|
.M |
1996 г. Z. Ma |
и |
S.S. Lee предложили термин |
|||
с циррозом. В 50-е годы минувшего столетия было |
|||||||||||
продемонстрировано, что при ЦП наблюдаются |
«цирротическая кардиомиопатия» (ЦКМ): |
||||||||||
повышение СВ в покое и снижение общего |
нарушение |
сократительного ответа |
|||||||||
периферического |
сопротивления |
сосудов |
миокарда на стресс и/или диастолического |
||||||||
(ОПСС). Полученные данные были объединены |
расслабления |
с |
электрофизиологическими |
||||||||
в понятие «гипердинамического WWWкровообращения» |
изменениями при отсутствии каких-либо |
||||||||||
при циррозе [11, 37]. В конце 60-х годов T.J. Regan |
известных заболеваний сердца. |
|
|||||||||
и соавт. изучали сократимость миокарда при |
Исследования |
последних |
десятилетий |
||||||||
алкогольной болезни печени [63]. Было выявлено |
доказали, что нарушение ответа миокарда на |
||||||||||
значительноеповышениеконечно-диастолического |
стресс наблюдается при циррозе независимо от |
||||||||||
давления после введения ангиотензина. В норме в |
его происхождения [9, 45, 49]. |
|
|||||||||
ответ на повышение диастолического наполнения |
|
|
|
|
|||||||
отмечается существенное увеличение СВ, однако у |
Патогенетические механизмы ЦКМ |
||||||||||
наблюдавшихся пациентов этого не происходило, |
|||||||||||
|
|
|
|
||||||||
что свидетельствовало о тяжелом нарушении |
Сокращение |
миокардиоцитов осуществляет- |
|||||||||
сократительного ответа ЛЖ. В последующих |
ся, главным образом, посредством |
стимуляции |
|||||||||
исследованиях |
продемонстрировано |
также |
β-адренорецепторов. Исследования на крысах с |
||||||||
снижение |
сократительного |
ответа |
миокарда |
циррозом продемонстрировали многочисленные |
|||||||
на стресс (физическая нагрузка, прием пищи, |
нарушения в передаче β-адренергического сиг- |
||||||||||
стимуляция лекарственными препаратами и др.) у |
нала, в том числе: снижение плотности β-адре- |
||||||||||
пациентов с алкогольным ЦП, что ошибочно было |
норецепторов и уровня Gs-протеина, подавление |
||||||||||
расценено |
как |
проявление |
кардиотоксических |
аденилатциклазы |
и последующее |
образование |
|||||
эффектов алкоголя [27, 40, 44]. |
|
|
цАМФ [9, 45, 49, 51]. Кроме того, показано, что |
||||||||
Представления о том, что сердечная |
изменения структуры билипидного слоя мембра- |
||||||||||
недостаточность (СН) при ЦП обусловлена |
ны кардиомиоцитов приводят к так называемому |
||||||||||
явным или |
скрытым приемом |
алкоголя |
«снижению текучести мембран» [50]. Последнее, |
||||||||
РЖГГК он-лайн – www.gastro-j.ru |
21 |

Лекции и обзоры |
|
|
|
|
|
3, 2010 |
|
|
|||||
в свою очередь, приводит к нарушению функции |
Систолическая дисфункция миокарда |
|||||
мембранных рецепторов, в частности рецепторов |
|
|
|
|||
кальциевых каналов β-адренорецепторов [38]. |
Наиболее изученным фактором, способным |
|||||
Однако не только нарушения трансдукции |
проявить имеющееся нарушение сократительного |
|||||
сигнала с β-адренорецепторов приводят к наруше- |
ответа миокарда на физиологический стресс при |
|||||
ниям функции миокарда при циррозе. У пациен- |
ЦП, является физическая нагрузка. Первыми |
|||||
тов с ЦП было выявлено повышение активности |
недостаточность сократительной функции мио- |
|||||
эндоканнабиоидной системы (см. рисунок) [20]. |
карда в ответ на физическую нагрузку проде- |
|||||
Эндоканнабиоиды, взаимодействуя с 1-м подти- |
монстрировала группа ученых во главе с L. Gould |
|||||
пом миокардиальных каннабиоидных рецепто- |
[27]. Позже H. Kelbaek и соавт. показали, что |
|||||
ров (CB-1), способны оказывать отрицательное |
несмотря на то, что исходные значения ФВ у |
|||||
инотропное действие, что было установлено в экс- |
пациентов с алкогольным ЦП (n=20) без какой- |
|||||
периментальных и в клинических исследованиях |
либо доказанной сердечной патологии и у здоро- |
|||||
[13, 23]. Действие опосредовано Gi-протеином, |
вых лиц контрольной группы были сопоставимы, |
|||||
ингибирующим аденилатциклазу. S.A. Gaskari |
при физической нагрузке у пациентов с циррозом |
|||||
и соавт. в эксперименте на крысах с ЦП, инду- |
отмечался значительно меньший прирост этого |
|||||
цированным лигированием желчного протока, |
показателя по сравнению с контролем (повы- |
|||||
показали, что повышение локальной продукции |
шение медианы ФВ на 6 и 14% соответственно, |
|||||
эндоканнабиоидов при ЦП может приводить к |
p<0,05) [35]. |
|
|
|||
нарушению сократительного ответа на стимуля- |
R.D. Grose и соавт. изучали сократимость, |
|||||
цию β-адренорецепторов [25]. |
|
|
автоматизм сердца и влияние физической нагруз- |
|||
Кроме того, были получены данные, что при |
ки у 20 пациентов с алкогольным и неалкоголь- |
|||||
ЦП увеличивается продукция таких газов, как |
ным ЦП [28]. У большинства больных циррозом |
|||||
оксид азота (NO) и моноксид углерода (СO) |
(83%) были выявлены нарушение автоматизма |
|||||
вследствие повышения |
активности индуцибель- |
сердца и недостаточный хронотропный эффект – |
||||
|
|
|
-VESTI |
|
|
|
ной NO-синтетазы (iNOS) и гемоксигеназы-1 |
пиковая.частотаRU |
сердечных сокращений (ЧСС) |
||||
(см. рисунок) [13, 20, 23, 25, 39, 46, 50, 51, 73]. |
составила 120,5±6 ударов в минуту, не наблюда- |
|||||
Оба соединения приводят к повышению продук- |
лось повышения ФВ ЛЖ. Максимальная физи- |
|||||
ции цГМФ, который через протеинкиназу G или |
ческая нагрузка привела к повышению УО ЛЖ |
|||||
посредством других механизмов подавляет поток |
лишь на 96±14 и 97±11% у пациентов с алкоголь- |
|||||
свободного кальция внутрь клетки. |
.M |
ным и неалкогольным циррозом соответственно, |
||||
Особое значение в формировании ЦКМ имеют |
в то время как у здоровых лиц он повысился на |
|||||
нарушения в системе |
доставки кальция |
[74]. |
300%. |
|
|
|
В эксперименте было |
предположено, что |
это |
В последующем были проведены и другие |
|||
обусловлено главным образом значительным сни- |
исследования, в ходе которых выявлено нару- |
|||||
жением плотности рецепторов и электрофизио- |
шение адекватного ответа сердечно-сосудистой |
|||||
логической функции L-типа кальциевых каналов |
системы (ССС) на различные физиологические |
|||||
мембраны сарколеммы кардиомиоцитов. |
|
|
и фармакологические стимулы при циррозе [42]. |
|||
|
WWW |
|
F. Wong и соавт. продемонстрировали низкий |
|||
Клинические проявления ЦКМ |
|
|
прирост СВ при физической нагрузке у пациен- |
|||
|
|
тов с ЦП, а также отметили, что сниженная толе- |
||||
|
|
|
|
|||
По мнению многих ученых, снижение пост- |
рантность к физической нагрузке у них связана |
|||||
нагрузки на сердце вследствие периферической |
с увеличением толщины миокарда и снижением |
|||||
вазодилатации, наблюдающейся при ЦП, обеспе- |
растяжимости ЛЖ, которые приводят к диасто- |
|||||
чивает так называемое «самоизлечение» пациен- |
лической дисфункции, неадекватному инотропно- |
|||||
тов и защищает от развития тяжелой СН. Однако |
му и хронотропному ответу на стресс [75]. |
|||||
при воздействии значительного стресса у больных |
В некоторых исследованиях обнаружено нару- |
|||||
циррозом обнаруживаются проявления дисфунк |
шение сократительного ответа миокарда и на |
|||||
ции сердца, выраженность которых во многом |
фармакологические стрессоры при алкогольном и |
|||||
зависит от природы провоцирующего фактора. |
неалкогольном ЦП [44, 52, 62]. |
|||||
Клинические проявления ЦКМ условно разделе- |
Диастолическая дисфункция |
|||||
ны на следующие категории: |
|
|
||||
|
|
миокарда |
|
|
||
– систолическая дисфункция миокарда; |
|
|
|
|||
|
|
|
|
|||
– диастолическая дисфункция миокарда; |
|
Другим важным проявлением ЦКМ является |
||||
– электрофизиологические изменения; |
|
|
диастолическая дисфункция миокарда, в той или |
|||
– структурно-морфологические изменения; |
иной степени имеющаяся почти у всех пациентов |
|||||
– биохимические сдвиги. |
|
|
с циррозом. В исследовании G. Finucci было |
|||
|
|
|
|
обнаружено повышение КДО, объема ЛП, УО и |
||
|
|
|
|
показателя А ЛЖ у пациентов с ЦП по сравне- |
||
22 |
РЖГГК он-лайн – www.gastro-j.ru |

3, 2010 |
|
|
|
|
Лекции и обзоры |
|
|
|
|
|
|
|
|
нию с группой контроля [21]. Для оценки степе- |
данным ряда исследований, связано с тяжестью |
|||||
ни диастолической дисфункции использовалось |
цирроза, портальной гипертензией, портосистем- |
|||||
отношение E/А. При циррозе этот показатель |
ным шунтированием, уровнем натрийуретичес- |
|||||
снижался, отражая нарушение диастолического |
кого пептида мозга (BNP) и про-BNP, уровнем |
|||||
расслабления [24]. |
|
|
|
норадреналина, снижением выживаемости [12, |
||
Кроме того, в исследованиях было показано, |
16, 18, 22, 53]. В исследовании J.S. Bal и соавт. |
|||||
что у пациентов с напряженным асцитом степень |
удлинение QTc наблюдалось у 40% пациентов с |
|||||
диастолической дисфункции выше, чем у пациен- |
ЦП, которым не проводилась ортотопическая |
|||||
тов без него [59, 72]. Это объяснялось тем, что |
трансплантация печени (ОТП), и у 56% пациен- |
|||||
асцит может привести к давлению на диафрагму |
тов, которым она была выполнена; после проведе- |
|||||
и повышению внутригрудного давления, препят |
ния ОТП в 55% случаев длительность интервала |
|||||
ствуя диастолическому расслаблению миокарда. |
QTс снизилась до нормальных величин [10]. |
|||||
Электрофизиологические |
|
Однако высказано предположение, что ЦП явля- |
||||
|
ется не единственной причиной удлинения QT, и |
|||||
изменения |
|
|
|
|||
|
|
|
увеличение его длительности не было признано |
|||
|
|
|
|
|||
При ЦКМ наблюдаются три вида электрофи- |
независимым предиктором смерти у этой катего- |
|||||
зиологических нарушений: удлинение интервала |
рии пациентов. S. Hansen и соавт. показали, что |
|||||
QT, электромеханическая диссинхронизация и |
суточная дисперсия QTc у больных циррозом |
|||||
хронотропная недостаточность. |
|
оставалась нормальной [29]. |
|
|||
В клинической кардиологии удлинение интер- |
Другим электрофизиологическим нарушением |
|||||
вала QT принято рассматривать как предиктор |
при ЦП является электромеханическая диссин |
|||||
развития фатальных желудочковых аритмий и вне- |
хронизация – неодновременное начало меха- |
|||||
запной сердечной смерти. Длительность интервала |
нической (по QT-интервалу) и электрической |
|||||
QT зависит от ЧСС и пола пациента. Поэтому в |
систолы (время от начала нарастания систоличес- |
|||||
практике используют корригированную величину |
кого давления до закрытия аортального клапана). |
|||||
интервала QT–QTc, рассчитываемую по форму- |
Этот временной.RU интервал оказался значительно |
|||||
ле Базетта: QTc = RR×K, где RR – расстояние |
выше у пациентов с удлиненным QT [31]. |
|||||
между соседними зубцами R на ЭКГ в секундах; |
Третье электрофизиологическое |
проявление |
||||
K = 0,37 для мужчин и К = 0,40 для женщин [1]. |
ЦКМ – хронотропная недостаточность, означаю- |
|||||
Удлинение QT диагностируют в том случае, если |
щая неспособность миокарда отвечать на стимулы |
|||||
длительность QTc превышает 0,44. |
|
адекватным повышением ЧСС, что было проде- |
||||
Причины удлинения интервала QT |
-VESTI |
|
|
|||
условно |
монстрировано в исследованиях S.S. Lee и соавт. |
|||||
делят на две группы: врожденные и приобретен- |
[43]. Очевидным клиническим следствием этого |
|||||
|
|
|
.M |
явления может быть ограничение физической |
||
ные [3]. С конца 50-х–начала 60-х годов известны |
||||||
два варианта наследственного синдрома удлинен- |
активности. |
|
|
|||
ного интервала QT (СУИQT) – одной из причин |
Структурно-морфологические |
|
||||
смерти детей (смертность достигает 75%): синдром |
|
|||||
изменения |
|
|
||||
Gervell и Lange Nielsen (в сочетании с врожденной |
|
|
||||
|
|
|
||||
глухонемотой) и синдром RomanoWWWWard [3, 4]. |
У большинства пациентов с ЦП обнаружива- |
|||||
Кроме того, распространенной формой СУИQT у |
ются структурные или гистологические изменения |
|||||
молодых лиц является сочетание данного синдро- |
в сердце [34, 36, 76]. При эхокардиографическом |
|||||
ма с пролапсом митрального клапана [2]. |
|
исследовании у таких больных выявляют гипер- |
||||
Приобретенное удлинение QT может возник- |
трофию ЛЖ с утолщением межжелудочковой |
|||||
нуть при атеросклеротическом или постинфаркт |
перегородки, которая, по всей видимости, разви- |
|||||
ном кардиосклерозе, кардиомиопатиях, на фоне |
вается вследствие |
гемодинамической перегрузки |
||||
и после перенесенного миоили перикардита, |
и активации нейроэндокринной системы. В то же |
|||||
при аортальных пороках сердца, острой ишемии |
время размеры правого желудочка могут быть |
|||||
и инфаркте миокарда, при соблюдении малобел- |
увеличены, уменьшены или не изменены [7]. |
|||||
ковой диеты и многих других состояниях [1]. |
При ЦКМ наблюдаются и серьезные гистоло- |
|||||
Такие электролитные нарушения, как гипокали- |
гические изменения: субэндокардиальный и мио- |
|||||
емия, гипокальциемия и гипомагнезиемия также |
кардиальный отек, сегментарный фиброз, гипер- |
|||||
могут привести к удлинению интервала QT, как, |
трофия миокарда, экссудация, вакуолизация ядер |
|||||
впрочем, и применение диуретиков, особенно |
и пигментация [48, 56, 70]. Аутопсия сердечной |
|||||
петлевых, способных вызвать подобного рода |
ткани у больных ЦП показала гистологические |
|||||
электролитный дисбаланс. |
|
изменения в 32% случаев [48]. |
|
|||
Удлинение QT при |
ЦП является одним из |
Биохимические изменения |
|
|||
основных проявлений |
электрофизиологических |
|
||||
|
|
|
||||
нарушений при ЦКМ. Удлинение этого интерва- |
Повышенные |
уровни таких |
биохимичес- |
|||
ла наблюдается у 30–60% пациентов с ЦП и, по |
ких показателей, |
как тропонин I, |
предсердный |
|||
РЖГГК он-лайн – www.gastro-j.ru |
23 |

Лекции и обзоры |
3, 2010 |
натрийуретический пептид (ANP) и BNP в сыво- |
В 1999 г. в исследовании M. Huonker и соавт. |
|||
ротке крови больных ЦП в настоящее время рас- |
было обнаружено статистически значимое увели- |
|||
сматриваются в качестве сывороточных маркёров |
чение размеров ЛП, КДО, а также повышение |
|||
ЦКМ [58, 69, 77, 78]. |
|
|
|
давления заклинивания легочных капилляров, |
D. Pateron и соавт. продемонстрировали повы- |
среднего давления в легочной артерии и СВ через |
|||
шение уровня сывороточного тропонина I (0,06– |
9 ч после установления TIPS у 17 больных алко- |
|||
0,25 мкг/л) у 32% пациентов с ЦП [58]. Кроме |
гольным ЦП [33]. |
|||
того, его значения обратно коррелировали с УО |
В том же году E. Lotterer и соавт. опуб- |
|||
и массой ЛЖ. Уровень же BNP при циррозе, |
ликовали результаты исследования кратко- и |
|||
по данным R. Yildiz и соавт., коррелировал с |
долгосрочных воздействий TIPS на печеночную |
|||
количеством баллов по Чайлду–Пью (r=0,427, |
и системную гемодинамику [47]. Было продемон |
|||
p<0,012), толщиной |
стенки межжелудочковой |
стрировано снижение СВ в течение 3 мес после |
||
перегородки (r=0,497, p<0,001) и толщиной стен- |
TIPS, однако к концу первого года этот показа- |
|||
ки ЛЖ (r=0,526, p<0,001) [78]. |
|
|
тель возвращался к исходному уровню. |
|
У больных ЦП было выявлено и повышение |
P. Gines и соавт. показали, что у 12% пациен- |
|||
про-BNP (пропетида BNP) в сыворотке крови, а |
тов с напряженным асцитом, подвергшимся TIPS, |
|||
также обнаружена прямая корреляционная связь |
отмечалось развитие СН, в то время как в груп- |
|||
между этим показателем и тяжестью ЦП, CН, но |
пе пациентов, которым проводились повторные |
|||
не с гипердинамическим кровообращением [32]. |
парацентезы, таких случаев не наблюдалось [26]. |
|||
В исследовании A. Zambruni и соавт. у пациентов |
В двух крупных контролируемых исследованиях |
|||
с ЦП, в отличие от здоровых лиц, уровень С-нат |
не зарегистрировано ни одного случая развития |
|||
рийуретического пептида (CNP) коррелировал с |
СН после TIPS [67, 68]. |
|||
суточной экскрецией натрия и суточным объемом |
В 2007 г. M. Cazzangia и соавт. при обследо- |
|||
мочи (r=0,709, p=,022 и r=0,745, p=0,013 соот- |
вании 32 пациентов с ЦП выявили, что E/A≤1 |
|||
ветственно) [79] . |
|
|
|
через 4 нед после TIPS является единственным |
|
|
|
-VESTI |
|
Хотя все еще не известно, происходит ли при |
независимым.RUпредиктором смертности в течение |
|||
ЦП повышение вышеперечисленных сывороточ- |
1 года: за этот период умерли 6 из 10 боль- |
|||
ных маркёров вследствие сердечного дисстресса |
ных с E/A≤1, в то время как у пациентов с |
|||
или гипердинамического кровообращения, в бли- |
/A>1наблюдалась 100% выживаемость после |
|||
жайшем будущем возможно будут разработаны |
TIPS [17]. Предполагается, что установка TIPS |
|||
простые и недорогие биохимические тесты |
для |
является свого рода стрессом для сердца, кото- |
||
выявления пациентов с ЦКМ. |
.M |
рый позволяет выявить больных с выраженной |
||
|
|
|||
|
|
|
|
ЦКМ и соответственно повышает риск развития |
Влияние трансъюгулярного |
|
|
летального исхода. |
|
|
|
|
||
внутрипеченочного портосистемного |
|
|||
шунтирования на ЦКМ |
|
|
Влияние пересадки печени на ЦКМ |
|
Трансъюгулярное |
внутрипеченочное |
пор- |
Последствия ОТП при ЦКМ могут возникнуть |
|
тосистемное шунтирование (TIPS)WWWоказывает |
в интра- и постоперационный периоды. В связи |
|||
существенное влияние на течение ЦКМ. По дан- |
со снижением преднагрузки и сократительной |
|||
ным многих исследований, после установки TIPS |
способности во время операции значительно |
|||
отмечались значительное ухудшение гемодинами- |
снижается и СВ. Другие интраоперационные |
|||
ки, развитие нарушений ритма сердца, ишемии |
осложнения, такие как массивная кровопотеря |
|||
миокарда, острого отека легких, что объясняется |
или неадекватное возмещение жидкости, способ |
|||
острым повышением преднагрузки в связи с рез- |
ствуют дальнейшему снижению СВ. Кроме того, |
|||
ким переходом крови из воротной вены в систем- |
агрессивное возмещение жидкости и переливание |
|||
ный кровоток [8, 14, 41, 47, 61, 64]. |
|
|
крови могут привести к отеку легких, поскольку |
|
В частности, в исследовании D. Azoulay и |
желудочки не способны справиться с возросшей |
|||
соавт. измерялось давление в воротной вене и |
нагрузкой объемом. |
|||
проводилась катетеризация правых отделов сер- |
Другим фактором, который может усугубить |
|||
дца непосредственно после, а также через месяц |
послеоперационное течение, является постперфу- |
|||
после проведения TIPS 12 пациентам с ЦП [8]. |
зионный синдром, который проявляется умень- |
|||
Выявлено снижение портоатриального градиента |
шением ЧСС в сочетании со снижением среднего |
|||
давления от 15±3 до 7±3 мм рт. ст. через 30 мин |
артериального давления (АД) по меньшей мере |
|||
(p<0,0001) и до 8±3 мм рт. ст. через 1 мес после |
на 30% в минуту в течение первых 5 мин после |
|||
TIPS (p<0,001). СИ возрос от 4,5±1,3 до 5,7±1,5 |
реперфузии [54]. Указанный синдром развива- |
|||
л/мин•м2 (p<0,001) и до 7,4±1,4 л/мин•м2 |
ется примерно в 30% случаев после операции по |
|||
(p<0,001) через 30 мин и через 1 мес соответ |
пересадке печени и может привести к остановке |
|||
ственно. |
|
|
|
сердца. |
24 |
РЖГГК он-лайн – www.gastro-j.ru |

25

3, 2010
чались уменьшение размеров и толщины стенки ЛЖ, снижение КДО и ГДПВ [60]. Кроме того, несколько улучшилась и диастолическая функция миокарда.
Как уже упоминалось, ОТП, хотя и является своего рода стрессом для миокарда в интра- и ранний послеоперационный период, но приводит к значительному улучшению СФ в течение 6–12 мес после операции. Это дает основание рассматривать ЦКМ как одно из осложнений ЦП, проявления которого способны полностью исчезнуть после ОТП.
Список литературы |
|
|
|
|
|
|
|
|
|
intrahepatic portal-systemic shunting // Chest. – 1995. |
||||||||||||||||||||||||
1 |
Остроумова О.Д. Удлинение |
интервала |
QT. [Элек |
|
– Vol. 107. – P. 1467–1469. |
|
|
|
|
|
|
|
||||||||||||||||||||||
15. |
Caramelo C., Fernandez-Munoz D., Santos J.C. et |
al. |
||||||||||||||||||||||||||||||||
|
тронный ресурс]: Доступ – www.rmj.ru/search.htm. |
|||||||||||||||||||||||||||||||||
|
|
Effect of volume expansion on hemodynamics, capillary |
||||||||||||||||||||||||||||||||
2. |
Степура О.Б., Мельник О.О., Шехтер А.Б. и |
др. |
|
|||||||||||||||||||||||||||||||
|
permeability |
and renal function |
in conscious, |
cirrhotic |
||||||||||||||||||||||||||||||
|
Результаты применения магниевой соли оротовой кис- |
|
||||||||||||||||||||||||||||||||
|
|
rats // Hepatology. – 1986. – Vol. 6. – P. 129–134. |
||||||||||||||||||||||||||||||||
|
лоты «Магнерот» при лечении больных с идиопатичес- |
|
||||||||||||||||||||||||||||||||
|
16. |
Carey E.J., |
Douglas D.D. Effects of |
orthotopic |
liver |
|||||||||||||||||||||||||||||
|
ким пролапсом митрального клапана // Рос. мед. вести |
|||||||||||||||||||||||||||||||||
|
|
transplantation on the corrected QT interval in patients |
||||||||||||||||||||||||||||||||
|
– 1999. – № 2. – С. 74–76. |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
with end-stage liver disease // Dig. Dis. Sci. – 2005. |
|||||||||||||||||||||||||
3. |
Шилов |
А.М., Мельник |
М.В., Санодзе |
И.Д. Диа |
|
|||||||||||||||||||||||||||||
|
– Vol. 50. – P. 320–323. |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
гностика, профилактика и лечение синдрома удлинения |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
17. |
Cazzaniga M., Salerno F., Pagnozzi G. et al. Diastolic |
||||||||||||||||||||||||||||||||
|
QT-интервала: Метод. рек. – М., 2001. – 28 с. |
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
dysfunction is |
associated |
with |
poor survival in patients |
|||||||||||||||||||||||||||
4. |
Школьникова |
М.А., Чупрова |
С.Н. |
Клинический и |
|
with cirrhosis. with transjugular intrahepatic portosystemic |
||||||||||||||||||||||||||||
|
генетический |
полиморфизм наследственного |
синдрома |
|
|
|
RU |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
shunt // Gut. – 2007. – Vol. 56. – P. 869–875. |
|
|
||||||||||||||||||||||||||||||
|
удлиненного интервала QT, |
факторы |
риска синкопе |
|
|
|
||||||||||||||||||||||||||||
|
18. |
Day |
P.C., |
James |
F.W.O., |
Butler J.T. et |
al. |
Q–T |
||||||||||||||||||||||||||
|
и внезапной |
смерти. [Электронный ресурс]: Доступ |
||||||||||||||||||||||||||||||||
|
|
interval |
prolongation |
and |
sudden |
cardial death in |
pati |
|||||||||||||||||||||||||||
|
– www.incart.ru/atts/943/943shkol’nikova.pdf. |
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
ents |
with alcoholic |
|
liver |
disease |
// |
Lancet. – |
1993. |
|||||||||||||||||||||||
5. |
Acosta |
F., |
de |
la |
|
Morena G., Villegas |
M. |
et |
al. |
|
|
|||||||||||||||||||||||
|
|
– Vol. 341. – P. 1423–1428. |
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
Evaluation |
of |
cardiac function |
before |
and |
after liver |
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
19. |
Donovan C.L., Marcovitz P.A., Punch J.D. et al. Two- |
||||||||||||||||||||||||||||||||
|
transplantation // Transplant. Proc. – 1999. – Vol. 31. |
|||||||||||||||||||||||||||||||||
|
|
dimensional and dobutamine stress echocardiography in |
||||||||||||||||||||||||||||||||
|
– P. 2369–2370. |
|
|
|
|
|
|
|
|
|
|
-VESTI |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
the preoperative assessment of patients with |
end-stage |
||||||||||||||||||||
6. |
Al-Hamoudi W., Alqahtani S., Ma M., Lee S.S |
Hemo |
|
|||||||||||||||||||||||||||||||
|
liver disease prior to orthotopic liver transplantation // |
|||||||||||||||||||||||||||||||||
|
dynamics in the |
immediate postoperative |
period.Mafter |
|
||||||||||||||||||||||||||||||
|
|
Transplantation. – 1996. – Vol. 61. – P. 1180–1188. |
|
|||||||||||||||||||||||||||||||
|
liver transplantation in alcoholic and postviral cirrhosis |
|
|
|||||||||||||||||||||||||||||||
|
20. |
Fernandez-Rodriguez C.M., Romero J., Petros T.J. et |
||||||||||||||||||||||||||||||||
|
// |
Gastroenterology. – |
2007.– Vol. 21 |
(suppl. A). |
||||||||||||||||||||||||||||||
|
|
al. Circulating endogenous cannabinoid anandamide and |
||||||||||||||||||||||||||||||||
|
– P. 29. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
portal, systemic and renal hemodynamics in cirrhosis // |
|||||||||||||||||||
7. |
Alqahtani |
S.A., |
Foud |
T.R., |
Lee |
S.S. |
Cirrhotic |
|
||||||||||||||||||||||||||
|
Liver Int. – 2004. – Vol. 24. – P. 477–483. |
|
|
|
||||||||||||||||||||||||||||||
|
cardiomyopathy // Semin. Liver Dis. – Vol. 28, N 1. |
|
|
|
|
|||||||||||||||||||||||||||||
|
21. |
Finucci G., Desideri A., Sacerdoti D. et al. Left ventri |
||||||||||||||||||||||||||||||||
|
– P. 59–69. |
|
|
|
|
|
|
DennisonWWWA. et |
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
cular |
diastolic |
function in |
liver cirrhosis |
// Scand. J. |
|||||||||||||||||||||
8. |
Azoulay |
D., |
Castaing |
D., |
|
al. |
|
|||||||||||||||||||||||||||
|
|
Gastroenterol. – 1996. – Vol. 31. – P. 279–284. |
|
|
||||||||||||||||||||||||||||||
|
Transjugular intrahepatic portosystemic shunt |
worsens |
|
|
|
|||||||||||||||||||||||||||||
|
22. |
Finucci |
G., |
Lunardi F., |
Sacerdoti |
D. QT |
interval |
|||||||||||||||||||||||||||
|
the hyperdynamiccirculatory state of the cirrhotic patient: |
|||||||||||||||||||||||||||||||||
|
|
prolongation in liver cirrhosis: reversibility after orthotopic |
||||||||||||||||||||||||||||||||
|
preliminary report of a prospective study // Hepatology. |
|
||||||||||||||||||||||||||||||||
|
|
liver transplantation // Jpn. Heart J. – 1998. – Vol. 39. |
||||||||||||||||||||||||||||||||
|
– 1994. – Vol. 19, N 1. – P. 129–132. |
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
– P. 321–329. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
9. |
Baik S.K., |
Lee |
S.S. Cirrhotic |
cardiomyopathy: causes |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
23. |
Ford |
W.R., |
Honan |
S.A., |
White R. et |
al. Evidence |
||||||||||||||||||||||||||||
|
and consequences // J. Gastroenterol. Hepatol. – 2004. |
|||||||||||||||||||||||||||||||||
|
|
of a |
novel site mediating |
anandamide-induced |
negative |
|||||||||||||||||||||||||||||
|
– Vol. 19 (suppl. 1). – P. – P. 185–190. |
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
inotropic and |
coronary vasodilatator |
responses in |
rat |
|||||||||||||||||||||||||
10. |
Bal J.S., Thuluvath P.J. Prolongation of QTc interval: |
|
||||||||||||||||||||||||||||||||
|
isolated |
hearts |
// |
J. Pharmacol. – 2002. – |
Vol. 135. |
|||||||||||||||||||||||||||||
|
relationship |
with |
etiology and |
severity |
of liver |
disease, |
|
|||||||||||||||||||||||||||
|
|
–P. 191–1198. |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
mortality and liver transplantation // Liver Int. – 2003. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
24. |
Galderisi M., Dini F.L., Temporelli P.L. et al. Doppler |
||||||||||||||||||||||||||||||||
|
– Vol. 23. – P. 243–248. |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
echocardiography for |
the |
assessment of left ventricular |
||||||||||||||||||||||
11. |
Bayley |
T.J., |
Segcl |
N., |
Bishop |
J.M. The |
circulatory |
|
||||||||||||||||||||||||||
|
diastolic function: methodology, clinical and prognostic value |
|||||||||||||||||||||||||||||||||
|
changes |
in |
patients |
with |
cirrhosis of the |
liver |
at |
rest |
|
|||||||||||||||||||||||||
|
|
// Ital. Heart J. Suppl. – 2004. – Vol. 5. – P. 86–97. |
|
|||||||||||||||||||||||||||||||
|
and |
during |
exercise |
// |
Clin. Sci. – |
1964. |
–Vol. 26. |
|
|
|||||||||||||||||||||||||
|
25. |
Gaskari S.A., Liu H., Moezi L. et al. Role of endocan |
||||||||||||||||||||||||||||||||
|
– P. 227–235 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
nabinoids in the pathogenesis of cirrhotic cardiornyopathy |
||||||||||||||||||||
12. |
Bernaldi M., |
Calandra |
S., Colantoni |
A. et al. Q–T |
|
|||||||||||||||||||||||||||||
|
in bile duct-ligated rats // Br. J. Pharmacol. – 2005. |
|||||||||||||||||||||||||||||||||
|
interval prolongation in cirrhosis: prevalence, relationship |
|
||||||||||||||||||||||||||||||||
|
|
– Vol. 146. – P. 315–323. |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
with severity, |
and |
etiology of |
the disease |
and |
possible |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
26. |
Gines P., Uriz J., |
Calahorra B. et |
al. Transjugular |
||||||||||||||||||||||||||||||
|
pathogenetic factors // Hepatology. – 1998. – Vol. 27. |
|||||||||||||||||||||||||||||||||
|
|
intrahepatic |
portosystemic |
shunting versus paracentesis |
||||||||||||||||||||||||||||||
|
– P. 28–34. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
plus |
albumin |
for |
refractory |
ascites |
in |
cirrhosis |
// |
|||||||||||||
13. |
Bonz A., Laser |
M., Kullmer |
S. et al. Cannabinoids |
|
||||||||||||||||||||||||||||||
|
Gastroenterology. – 2002. – Vol. 123. – P. 1839–1847. |
|||||||||||||||||||||||||||||||||
|
acting on CBl receptors decrease contractile performance |
|
||||||||||||||||||||||||||||||||
|
27. |
Gould |
L., |
Shariff |
M., |
Zahir |
M. |
et |
al. |
Cardiac |
||||||||||||||||||||||||
|
in |
human |
atrial |
muscle |
// |
Cardiovasc. |
Pharmacol. |
|||||||||||||||||||||||||||
|
|
hemodynamics |
in alcoholic |
patients with |
chronic |
liver |
||||||||||||||||||||||||||||
|
– 2003. – Vol. 41. – P. 657–664. |
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
disease |
and |
a |
presystolic |
gallop |
// |
J. |
Clin. Invest. |
||||||||||||||||||||
14. |
Braverman A.C., Steiner M.A., Picus D. et al. High- |
|
||||||||||||||||||||||||||||||||
|
– 1969. – Vol. 48. – P. 860–868. |
|
|
|
|
|
||||||||||||||||||||||||||||
|
output congestive |
heart |
failure |
following |
transjugular |
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
26 |
РЖГГК он-лайн – www.gastro-j.ru |

|
|
3, 2010 |
|
|
|
|
|
|
|
|
|
|
|
Лекции и обзоры |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28. |
Grose R.D., Nolan J., Dillon J.F. et al. Exercise- |
|
intrahepatic portosystemic shunt: short-term and long- |
||||||||||||||
|
induced left ventricular dysfunction in alcoholic and |
|
term |
effectson |
hepatic and |
systemic |
hemodynamics |
||||||||||
|
non-alcoholic cirrhosis // J. Hepatol. – 1995. –Vol. 22. |
|
in patients with cirrhosis // Hepatology. – 1999. |
||||||||||||||
|
– P. 326–332. |
|
|
|
– Vol. 29, N 3. – P. 632–639. |
|
|
|
|||||||||
29. |
Hansen S., Moller S., Bendtsen F. et al. Diurnal |
48. |
Lunseth J.H., Olmstead E.G., Abboud F. A study of |
||||||||||||||
|
variation and dispersion in QT interval in cirrhosis: |
|
heart disease in one hundred eight hospitalized patients |
||||||||||||||
|
relation to haemodynamic changes [Электронный ресурс] |
|
dying with portal cirrhosis // AMA Arch. Intern. Med. |
||||||||||||||
|
// J. Hepatol. – 2007. – Vol. 47. – P. 373–380 (Epub |
|
– 1958. – Vol. 102. – P. 405–413. |
|
|
|
|||||||||||
|
ahead of print) – PMID: 17459513 [PubMed – indexed |
49. |
Ma Z., Lee S.S. Cirrhotic |
cardiomyopathy: getting |
|||||||||||||
|
for MEDLINE]. – Доступ: http://www.ncbi.nlm.nih. |
|
to the heart |
of |
the matter // Hepatology. – 1996. |
||||||||||||
|
gov/sites/ entrez. |
|
|
|
– Vol. 24. – P. 451–459. |
|
|
|
|
|
|||||||
30. |
Henriksen J.H., Bendtsen F., Hansen E.F. et al. Acute |
50. |
Ma Z., Meddings J.B., Lee S.S. Membrane physical |
||||||||||||||
|
nonselective beta-adrenergic blockade reduces prolonged |
|
properties determine cardiac beta-adrenergic receptor, |
||||||||||||||
|
frequency-adjusted QT interval (QTc) in patients with |
|
functionin cirrhotic rats // Am. J. Physiol. – 1994. |
||||||||||||||
|
cirrhosis // J. Hepatol. – 2004. – Vol. 40. – P. 239– |
|
– Vol. 267. – P. 87–93. |
|
|
|
|
|
|||||||||
|
246. |
|
|
|
|
51. |
Ma Z., Miyamoto A., Lee S.S. Role of altered beta- |
||||||||||
31. |
Henriksen J.H., Fuglsang Ј., Bendtsen F. et al. |
|
adrenoreceptor signal transduction in the pathogenesis of |
||||||||||||||
|
Dyssynchronous electrical and mechanical systole in |
|
cirrhotic cardiomyopathy in rats // Gastroenterology. |
||||||||||||||
|
patients with cirrhosis // J. Hepatol. – 2002. – Vol. 36. |
|
– 1996. – Vol. 110. – P. 1191–1198. |
|
|
|
|||||||||||
|
– P. 513–520. |
|
|
52. |
Mikulic E., Munoz C., Punfoni L.E. et al. Hemodynamic |
||||||||||||
32. |
Henriksen J.H., Gotze J.P., Fuglsang S. et al. Increased |
|
effects of dobutamine in patients with alcoholic cirrhosis |
||||||||||||||
|
circulating pro-brain natriuretic peptide (proBNP) and |
|
// Clin. Pharmacol. Ther. – 1983. – Vol. 34. –P. 56– |
||||||||||||||
|
brain natriuretic peptide (BNP) in patients with cirrhosis: |
|
59. |
|
|
|
|
|
|
|
|
|
|
||||
|
relation to cardiovascular dysfunction and severity of |
53. |
Mohamed R., Forsey P.R., Davics M.K. et al. Effect |
||||||||||||||
|
disease // Gut. – 2003. – Vol. 52. – P. 1511–1517. |
|
of liver transplantation on QT interval prolongation |
||||||||||||||
33. |
Huonker M., Schumacher Y.O., Ochs A. et al. Cardiac |
|
and autonomic dysfunction in end-stage liver disease // |
||||||||||||||
|
function and haemodynamic in alcoholic cirrhosis and |
|
Hepatology. – 1996. – Vol. 23. – P. 1128–1134. |
||||||||||||||
|
effects of the transjugular intrahepatic portosystemic |
54. |
Myers R.P., Lee S.S. Cirrhotic cardiomyopathy and |
||||||||||||||
|
stent shunt // Gut. – 1999. – Vol. 44. – P. 743–748. |
|
liver |
transplantation // Liver Transplant. – 2000. |
|||||||||||||
34. |
Inserte J., Perello A., Agullo L. et al. Left ventricular |
|
|
|
RU |
|
|
|
|
|
|
|
|||||
|
– Vol. 6. – P. 44–52. |
|
|
|
|
|
|||||||||||
|
hypertrophy in rats with biliary cirrhosis // Hepatology. |
55. |
Nasraway S.A., Klein R.D., Spanier T.B. et al. |
||||||||||||||
|
– 2003. – Vol. 38. – P. 589–598. |
|
|
|
|
. |
|
correlates |
of |
outcome |
in |
patients |
|||||
|
|
|
|
Hemodynamic |
|
||||||||||||
35. |
Kelbaek H., Eriksen J., Brynjolf I. |
-VESTI |
|
|
|
|
|
|
|
|
|
||||||
et al. Cardiac |
|
undergoing orthotopic liver transplantation: evidence |
|||||||||||||||
|
performance in patients with asymptomatic alcoholic |
|
for early postoperative myocardial depression // Chest. |
||||||||||||||
|
cirrhosis of the liver // Am. J. Cardiol. – 1984. |
|
– 1995. – Vol. 107. – P. 218–224. |
|
|
|
|||||||||||
|
–Vol. 54. – P. 852–855. |
|
|
56. |
Ocel J.J., Edwards W.D., Tazelaar H.D. et al. Heart |
||||||||||||
36. |
Keller H., Bezjak V., Stegaru B. et al. Ventricular |
|
and |
liver disease |
in 32 |
patients undergoing |
biopsy |
||||||||||
|
function in cirrhosis and portosystemic shunt: a two- |
|
of both organs, with implications for heart or liver |
||||||||||||||
|
dimensional |
echocardiographic study // Hepatology. |
|
transplantation // Mayo Clin. Proc. – 2004. – Vol. 79. |
|||||||||||||
|
– 1988. – Vol. 8. – P. 658–662. |
|
.M |
|
– P. 492–450. |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
37. |
Kowalski H.J., Abelmann W.H. The cardiac output at |
57. |
O’Connor C.M. The new heart failure guidelines; |
||||||||||||||
|
rest in Laennec’s cirrhosis // J. Clin. Invest. – 1953. |
|
strategies for implementation // Am. Heart J. – 2007. |
||||||||||||||
|
– Vol. 32. – P. 1025–1033. |
WWW |
|
– Vol. 153. – P. 2–5. |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||||||
38. |
Le Grimellec C., Fricdlander G., el Yandouzi E.H. |
58. |
Pateron D., Beyne P., Laperche T. et al. Elevated |
||||||||||||||
|
et al. Membrane fluidity and transport properties in |
|
circulating cardiac troponin I in patients with cirrhosis |
||||||||||||||
|
epithelia // Kidney Int. – 1992. – Vol. 42. – P. 825– |
|
// Hepatology. – 1999. – Vol. 29. – P. 640–643. |
||||||||||||||
|
830. |
|
|
|
|
59. |
Pozzi M., Carugo S., Boari G. et al. Evidence of |
||||||||||
39. |
Lee R.F., Glenn T.K., Lee S.S. Cardiac dysfunction |
|
functional and structural cardiac abnormalities in cirrhotic |
||||||||||||||
|
in cirrhosis // Best Pract. Res. Clin. Gastroenterol. |
|
patients |
with |
and |
without |
ascites // |
Hepatology. |
|||||||||
|
– 2007. – Vol. 21. – P. 125–140. |
|
|
|
– 1997. – Vol. 26. – P. 1131–1137. |
|
|
|
|||||||||
40. |
Lee S.S. Cardiac abnormalities in liver cirrhosis // |
60. |
Pozzi M., Grassi G., Ratti L. et al. Cardiac, |
||||||||||||||
|
West. J. Med. – 1989. – Vol. 151. – P. 530–535. |
|
neuroadrenergic, and portal hemodynamic effects of |
||||||||||||||
41. |
Lee S.S., Baik S.K. Cardiovascular consequences of |
|
prolonged aldosterone blockade in postviral Child A |
||||||||||||||
|
liver disease // Boxer’s hepatology: A textbook of liver |
|
cirrhosis // Am. J. Gastroenterol. – 2005. – Vol. 100. |
||||||||||||||
|
disease / Eds. T.D. Boyer, T. Wright, M.M. Zakim. |
|
– P. 1110–1116. |
|
|
|
|
|
|
||||||||
|
– 5th ed. – Philadelphia, PA: WB Saunders Co Ltd., |
61. |
Quiroga J., Sangro B., Nunez M. et al. Transjugular |
||||||||||||||
|
2006. – P. 453–475. |
|
|
|
intrahepatic portal-systemic shunt in the treatment of |
||||||||||||
42. |
Lee S.S., Hadengue A., Moreau R. et al. Postprandial |
|
refractory ascites: effect on clinical, renal, humoral, |
||||||||||||||
|
hemodynamic responses in patients with cirrhosis // |
|
and hemodynamic parameters // Hepatology. – 1995. |
||||||||||||||
|
Hepatology. – 1988. – Vol. 8. – P. 647–651. |
|
– Vol. 21. – P. 986–994. |
|
|
|
|
|
|||||||||
43. |
Lee S.S., Marty J., Mantz J. et al. Desensitization of |
62. |
Ramond |
M.J., |
Comoy |
E., |
Lebrec |
D. |
Alterations |
||||||||
|
myocardial beta-adrenergic receptors in cirrhotic rats // |
|
in isoprenaline sensitivity in patients with cirrhosis: |
||||||||||||||
|
Hepatology. – 1990. – Vol. 12. – P. 481–485. |
|
evidence of abnormality of the sympathetic nervous |
||||||||||||||
44. |
Limas C.J., Guiha N.H., Lekagul O. et al. Impaired |
|
activity // Br. J. Clin. Pharmacol. – 1986. – Vol. 21. |
||||||||||||||
|
left ventricular function in alcoholic cirrhosis with |
|
– P. 191–196. |
|
|
|
|
|
|
|
|||||||
|
ascites: ineffectiveness of ouabain // Circulation. – |
63. |
Regan T.J., Levinson G.E., Oldewurtel H.A. et al. |
||||||||||||||
|
1974. – Vol. 49. – P. 754–760. |
|
|
|
Ventricular functioninnon cardiacs with alcoholic fatty |
||||||||||||
45. |
Liu H., Lee S.S. Cardiopulmonary dysfunction in |
|
liver: role of ethanol in the production of cardiomyopathy |
||||||||||||||
|
cirrhosis // J. Gastroenterol. Hepatol. – 1999. – |
|
// J. Clin. Invest. – 1969. – Vol. 48. – P. 397–407. |
||||||||||||||
|
Vol. 14. – P. 600–608. |
|
|
64. |
Rodriguez-Laiz J.M., Banares R., Echenagusia A. et al. |
||||||||||||
46. |
Liu H., Song D., Lee S.S. Role of heme oxygenase- |
|
Effects of transjugular intrahepatic portasystemie shunt |
||||||||||||||
|
carbon monoxide pathway in pathogenesis of cirrhotic |
|
(TIPS) on splanchnic and systemic hemodynamics, and |
||||||||||||||
|
cardiomyopathy in the rat // Am. J. Physiol. Gastrointest. |
|
hepatic function in patients with portal hypertension: |
||||||||||||||
|
Liver Physiol. – 2001. – Vol. 280. – P. 68–74. |
|
preliminary results // Dig. Dis. Sci. – 1995. – Vol. 40. |
||||||||||||||
47. |
Lotterer E., |
Wengert A., Fleig W.E. Transjugular |
|
– P. 2121–2127. |
|
|
|
|
|
|
|||||||
РЖГГК он-лайн – www.gastro-j.ru |
27 |

Лекции и обзоры |
3, 2010 |
65. |
Ruiz-del-Arbol L., Monescillo A., Aroccna C. et al. |
73. |
Van Obbergh L., Valliercs Y., Blaise G. Cardiac |
|
Circulatory function and hepatorenal syndrome in cirrho- |
|
modifications occurring in the ascetic rat with biliary |
|
sis // Hepatology. – 2005. – Vol. 42. – P. 439–447. |
|
cirrhosis are nitric oxide related // J. Hepatol. – 1996. |
66. |
Ruiz-del-Arbol L., Urman J., Fernandez J. et al. |
|
– Vol. 24. – P. 747–752. |
|
Systemic, renal, and hepatic hemodynamic derangement |
74. |
Ward С.A., Liu H., Lee S.S. Altered cellular calcium |
|
in cirrhotic patients with spontaneous bacterial peritonitis |
|
regulatory systems in a rat model of cirrhotic cardio- |
|
// Hepatology. – 2003. – Vol. 38. – P. 1210–1218. |
|
myopathy // Gastroenterology. – 2001. – Vol. 121. |
67. |
Salerno F., Merli M., Riggio O. et al. Randomized con- |
|
– P. 209–1218. |
|
trolled study of TIPS versus paracentesis plus albumin |
75. |
Wong F., Girgrah N., Graba J. et al. The cardiac |
|
in cirrhosis with severe ascites // Hepatology. – 2004. |
|
response to exercise in cirrhosis // Gut. – 2001. – |
|
– Vol. 40. – P. 629–635. |
|
Vol. 49. – P. 268–275. |
68. |
Sanyal A.J., Genning C., Reddy K.R. et al. The North |
76. |
Wong F., Liu P., Lilly L. et al. Role of cardiac struc- |
|
American Study for the Treatment of Refractory Ascites |
|
tural and functional abnormalities in the pathogenesis of |
|
// Gastroenterology. – 2003. – Vol. 124. – P. 634– |
|
hyperdynamic circulation and renal sodium retention in |
|
641. |
|
cirrhosis // Clin. Sci. – 1999. – Vol. 97. – P. 259– |
69. |
Silver M.A., Maisel A., Yancy C.W. et al. BNP |
|
267. |
|
Consensus Panel 2004: a clinical approach for the diag- |
77. |
Wong F., Siu S., Liu P. et al. Brain natriuretic peptide: |
|
nostic, prognostic, screening, treatment monitoring, and |
|
is it a predictor of cardiomyopathy in cirrhosis // Clin. |
|
therapeutic roles of natriuretic peptides in cardiovascular |
|
Sci. (Lond). – 2001. – Vol. 101. – P. 621–628. |
|
diseases // Congest. Heart Fail. – 2004. – Vol. 10 |
78. |
Yildiz R., Yildirim B., Karincaoglu M. et al. Brain |
|
(suppl. 3). – P. 1–30. |
|
natriuretic peptide and severity of disease in non-alco- |
70. |
Spatt S.D., Rosenblatt P. The incidence of hyperten- |
|
holic cirrhotic patients // J. Gastroenterol. Hepatol. |
|
sion in portal cirrhosis: a study of 80 necropsied cases of |
|
– 2005. – Vol. 20. – P. 1115–1120. |
|
portal cirrhosis //Ann. Intern. Med. – 1949. – Vol. 31. |
79. |
Zambruni A., Trevisani F., Giilbero V. et al. Daily pro- |
|
– P. 479–483. |
|
file of circulating C-type natriuretic peptide in pre-ascitic |
71. |
Therapondos G., Flapan A.D., Dollinger M.M. et al. |
|
cirrhosis and in normal subjects: relationship with renal |
|
Cardiac function after orthotopic liver transplantation |
|
function // Scand. J. Gastroenterol. – 2007. – Vol. 42. |
|
and the effects of immunosuppression: a prospective |
|
– P. 642–647. |
|
randomized trial comparing cyclosporin (Neoral) and |
|
|
|
tacrolimus // Liver Transplant. – 2002. – Vol. 8. |
|
|
|
– P. 90–72. |
|
RU |
|
|
|
|
72. |
Torregrosa M., Aguade S., Dos L. et al. Cardiac altera- |
|
. |
tions in cirrhosis: reversibility after liver transplantation // J. Hepatol. – 2005. – Vol. 42. – P. 68–74.
-VESTI .M WWW
28 |
РЖГГК он-лайн – www.gastro-j.ru |

3, 2010 |
Лекции и обзоры |
|
|
УДК 616.36-003.826-085.244
Применение урсодезоксихолевой кислоты при неалкогольном и алкогольном стеатогепатите
Е.А. Федосьина, М.В. Маевская
Application of ursodeoxycholic acid at non-alcoholic and alcohol-induced steatohepatitis
Ye.A. Fedos’ina, M.V. Mayevskaya
Цель обзора. Привести литературные данные, |
|
|
RU |
|
The aim of review. To cite the literature data, con- |
||
подтверждающие эффективность применения урсо- |
|
. |
|
|
firming efficacy of ursodeoxycholic acid (UDCA) at alco- |
||
-VESTI |
|
||
дезоксихолевой кислоты (УДХК) при алкогольном и |
|
holic and non-alcoholic steatohepatitis (NASH). |
|
неалкогольном стеатогепатите (НАСГ). |
|
Original positions. Prevalence of liver steatosis as |
|
Основные положения. Распространенность |
|
pathomorphologic substrate of various liver diseases |
|
стеатоза печени как патоморфологического суб- |
|
is quite high, however the special attention is given to |
|
страта различных болезней этого органа довольно |
|
patients with signs of inflammation and fibrosis, i.e. with |
|
широка, однако особое внимание уделяется паци |
|
confirmed alcohol-induced and non-alcoholic steato- |
|
.M |
|
hepatitis. Article presents pathogenic mechanisms of |
|
ентам с признаками воспаления и фиброза, т. е. |
|
||
с подтвержденным алкогольным и неалкогольным |
|
the most important lesions of the liver – alcoholic and |
|
WWW |
|
non-alcoholic steatohepatitis in pathogenesis of which |
|
стеатогепатитом . В статье рассмотрены патогене- |
|
||
тические механизмы наиболее значимых пораже- |
|
the leading part belongs to accumulation of fat in cells |
|
ний печени – алкогольного и неалкогольного сте- |
|
of the organ and enhancement of lipid peroxidation pro- |
|
атогепатита, в патогенезе которых ведущая роль |
|
cesses with development of necrosis of hepatic cells. |
|
принадлежит накоплению жиров в клетках органа и |
|
At assessment of management approach of ste- |
|
усилению процессов перекисного окисления липи- |
|
atohepatitis patients main etiological factors and back- |
|
дов с развитием некроза печеночных клеток. |
|
ground diseases are taken into account. In the case of |
|
При определении тактики ведения пациентов со |
|
NASH itself, developed on a background of obesity, |
|
стеатогепатитом учитываются основные этиологи- |
|
diabetes mellitus, keeping a diet in a combination with |
|
ческие факторы и фоновые заболевания. В случае |
|
the adequate physical activity is effective, that results |
|
имеющегося собственно НАСГ, развившегося на |
|
in gradual normalization of body weight. If these means |
|
фоне ожирения, сахарного диабета, эффективно |
|
will give no required results, prescription of intestinal |
|
соблюдение диеты в комбинации с адекватными |
|
triglyceride-lipase inhibitors or anorexigenic agents is |
|
физическими нагрузками, приводящими к посте- |
|
rational. Disorders of carbohydrate metabolism (includ- |
|
пенной нормализации массы тела. При отсутствии |
|
ing insulin resistance) serve as the indication for pre- |
|
желаемых результатов от указанных мер целесо- |
|
scription of drugs, that sensitize peripheral tissues to |
|
образно назначение ингибиторов кишечной три |
|
insulin. At alcohol-induced steatohepatitis abstinence |
|
глицерид-липазы или анорексигенных препаратов. |
|
is categorical. |
|
Нарушения углеводного обмена (инсулинорезис- |
|
Corticosteroids are drugs of choice at treatment |
|
тентность в том числе) служат показанием к назна- |
|
of severe decompensated forms of alcoholic liver dis- |
|
чению средств, повышающих чувствительность к |
|
ease, that reduce level of circulating proinflammatory |
|
инсулину. При алкогольной этиологии стеатогепа- |
|
cytokines and promote histological improvement with |
|
тита безусловно соблюдение абстиненции. |
|
a short period. UDCA has antiapoptotic, cytoprotec- |
|
Федосьина Екатерина Александровна – кандидат медицинских наук, ассистент кафедры пропедевтики внутренних болезней ММА им. И.М. Сеченова Росздрава. Контактная информация для переписки: starKat@mail.ru; 11991, Москва, ул. Погодинская, д. 1, стр. 1, Клиника пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко ММА им. И.М. Сеченова Росздрава
РЖГГК он-лайн – www.gastro-j.ru |
29 |

Лекции и обзоры |
|
|
|
|
|
3, 2010 |
|
|
|
||||
Препаратами выбора при лечении тяжелых |
|
tive, immunomodulating, anti-oxidative effect, so it can |
||||
декомпенсированных форм алкогольной болезни |
|
be used as pathogenic therapy at alcohol-induced and |
||||
печени остаются кортикостероиды, уменьшающие |
|
non-alcoholic steatohepatitis. Potential of combination |
||||
уровень циркулирующих провоспалительных цито- |
|
of glucocorticoids with anti-oxidative agents, including |
||||
кинов и приводящие к гистологическому улучше- |
|
UDCA, that is especially promising for clinical practice, |
||||
нию за короткий период. Поскольку УДХК обладает |
|
continues to be studied as well. Prescription of UDCA is |
||||
антиапоптотическим, цитопротективным, иммуно- |
|
recommended at cholestatic variant of acute alcoholic |
||||
модулирующим, антиоксидантным действием, она |
|
hepatitis for essential decrease of pruritus and improve- |
||||
может использоваться в рамках патогенетической |
|
ment of biochemical scores. Cytoprotective effect of |
||||
терапии при алкогольном и неалкогольном стеато- |
|
UDCA allows to apply it at severe steatosis in absence |
||||
гепатите. Продолжает также изучаться возможность |
|
of inflammation, especially if the patient continues to |
||||
комбинирования глюкокортикоидов с препаратами, |
|
consume alcohol. |
||||
обладающими антиоксидантной активностью, в том |
|
Conclusion. Ursodeoxycholic acid has antiapop- |
||||
числе УДХК, что представляется особенно много- |
|
totic and anti-inflammatory effect and good safety |
||||
обещающим для клинической практики. Назначение |
|
profile. Application of UDCA can be recommended for |
||||
УДХК рекомендуется при холестатическом вариан- |
|
patients with steatohepatitis of various etiology. At alco- |
||||
те острого алкогольного гепатита для существен- |
|
holic lesion of the liver complete abstinence of alcohol |
||||
ного уменьшения зуда и улучшения биохимичес- |
|
intake is mandatory. Combination of corticosteroids |
||||
ких показателей. Цитопротективный эффект УДХК |
|
with anti-oxidative drugs, including UDCA that look most |
||||
позволяет применять ее при выраженном стеатозе |
|
perspective for clinical practice continues to be studied. |
||||
в отсутствие воспаления, особенно если пациент |
|
In the case of NASH itself on a background of obesity |
||||
продолжает употреблять алкоголь. |
|
|
UDCA can be prescribed as a drug with cytoprotective, |
|||
Заключение. Урсодезоксихолевая кислота |
|
antiapoptotic action, retarding fibrosis. |
||||
обладает антиапоптотическим и противовоспали- |
|
Key words: ursodeoxycholic acid, alcohol-induced, |
||||
тельным действием, а также хорошим профилем |
|
|
RU |
|||
|
non-alcoholic steatohepatitis. |
|||||
безопасности. Применение ее можно рекомендо- |
|
. |
|
|||
вать больным, страдающим стеатогепатитом раз- |
|
|
||||
|
|
|
|
|||
личной этиологии. При алкогольном поражении |
|
|
|
|
||
|
|
-VESTI |
|
|
||
печени необходимо полное воздержание от приема |
|
|
|
|||
алкоголя, также продолжает изучаться комбина- |
|
|
|
|||
ция кортикостероидов с препаратами, обладаю- |
|
|
|
|||
щими антиоксидантной активностью, в том числе |
|
|
|
|||
УДХК. В случае имеющегося собственно НАСГ на |
|
|
|
|||
|
|
.M |
|
|
|
|
фоне ожирения УДХК может назначаться в качестве |
|
|
|
|||
цитопротективного, антиапоптотического и замед- |
|
|
|
|||
ляющего фиброз препарата. |
WWW |
|
|
|
||
Ключевые слова: урсодезоксихолевая кислота, |
|
|
|
|||
алкогольный, неалкогольный стеатогепатит. |
|
|
|
|
|
|
Патогенез стеатогепатита |
|
|
ных кислот. Холестерин высокой плотности, |
|||
|
|
|
|
богатый аполипопротеином (A-I), синтезируется |
||
Распространенность стеатоза печени как пато- |
печенью или слизистой оболочкой тонкой кишки |
|||||
морфологического субстрата различных болезней |
и высвобождается в системный кровоток. Там он |
|||||
этого органа довольно широка, однако особое |
способствует переносу избытка свободного (неэс- |
|||||
внимание уделяется пациентам с признаками вос- |
терифицированного) холестерина от макрофагов |
|||||
паления и фиброза, т. е. с подтвержденным алко- |
к А-I путем взаимодействия с транспортной сис- |
|||||
гольным и неалкогольным стеатогепатитом |
темой макрофагов артериальной стенки. |
|||||
(НАСГ) [1]. Как известно, у здорового человека |
Плазменная лецитин-холестеринацилтранс- |
|||||
содержание жира в печени не превышает 1,5% от |
фераза конвертирует свободный холестерин в |
|||||
ее массы. Если количество липидов возрастает до |
α-липопротеины высокой плотности (ЛПВП), |
|||||
2–3%, мелкие капли жира в гепатоцитах выяв- |
далее они транспортируются в печень прямым |
|||||
ляются при световой микроскопии, что расцени- |
и непрямым путем. Прямой путь представляет |
|||||
вается как патологическое состояние – жировая |
собой селективный захват эстеров холестерина |
|||||
инфильтрация (стеатоз) печени. Основной состав |
гепатоцитами с участием рецепторов-скэвенед- |
|||||
жиров печени представлен триглицеридами (ТГ), |
жеров класса В типа 1 (SR-B1). Непрямой путь |
|||||
синтезирующимися из жирных кислот и глицеро- |
– холестерин высокой плотности меняется на |
|||||
фосфата. |
|
|
|
триглицериды в частицах, обогащенных аполи- |
||
Обмен липидов, в том числе холестерина, в |
попротеином-B, липопротеины низкой и очень |
|||||
организме человека тесно связан с участием желч |
низкой плотности (ЛПНП и ЛПОНП) через |
|||||
30 |
РЖГГК он-лайн – www.gastro-j.ru |
