
- •НАПРАВЛЕНИЯ ИСПОЛЬЗОВАНИЯ ФЕРМЕНТОВ
- •ФЕРМЕНТЫ КАК СПЕЦИФИЧЕСКИЕ РЕАГЕНТЫ
- •Глюкозооксидаза
- •Лактатоксидаза
- •Рекстриктазы бактерий
- •Иммуноферментный анализ
- •ФЕРМЕНТЫ КАК ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
- •Заместительная терапия
- •Комплексная терапия
- •Трудности энзимотерапии
- •Иммобилизированные ферменты
- •ФЕРМЕНТЫ КАК МАРКЁРЫ ЗАБОЛЕВАНИЙ
- •«Требования» к ферментам энзимодиагностики
- •Изоферменты
- •Основные ферменты энзимодиагностики
- •ИНГИБИТОРЫ ФЕРМЕНТОВ – ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
- •ЭНЗИМОПАТИИ

16
ФЕРМЕНТЫ КАК МАРКЁРЫ ЗАБОЛЕВАНИЙ
Энзимодиагностика – это раздел клинической энзимологии, который изучает возможность исследования активности ферментов в биологических жидкостях человека с целью диагностики тех или иных заболеваний.
Для диагностики заболеваний используют 3 группы ферментов
|
Секреторные |
|
|
Экскреторные |
Внутриклеточные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
• |
Псевдохолинэстераза |
|
• |
Щелочная фосфатаза |
|
|
• |
Ферменты |
|
|
печени |
|
|
|
свертывающей |
|
• |
Панкреатическая |
|
|
|
системы крови |
|
|
ɑ-амилаза и липаза |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Цитоплазматические
•Лактатдегидрогеназа (ЛДГ)
•Аланинаминотрнсфераза (АЛТ)
•Аспартатаминотрансфераза (АСТ)
•Креатинкиназа (КК)
Митохондриальные |
|
Лизосомные |
|
|
|
Аспартатаминотранс |
|
Кислая фосфатаза |
фераза (АСТ) |
|
(КФ) |
|
|
|

17
Секреторные ферменты:
•Место синтеза – гепатоциты печени
•Место работы – кровь (субстрат фермента локализуется в крови)
•Активность в крови - больше чем в тканях
•Являются показателями белоксинтезирующей функции печени – снижение их активности свидетельствует о патологии печени, при которой нарушается синтез белков плазмы крови.
Примеры секреторных ферментов:
•Псевдохолинэстераза (ПХЭ)
•Проферменты свертывающей системы крови (факторы свертывающей системы крови)
Экскреторные ферменты:
•Место синтеза – экзокринные железы
•Место работы – полости органов
•Активность в крови – незначительная и обусловлена диффузией фермента
•Являются показателями нормального отделения секрета из железы в полость органа – активность их в крови повышается при воспалении железы и, как следствие, затруднения оттока секрета железы в полость органа («эффект уклонения ферментов»).
Примеры экскреторных ферментов:
•Щелочная фосфатаза печени (ЩФ) – является маркёром синдрома холестаза, например, при желчнокаменной болезни
•Панкреатическая ɑ-амилаза и липаза – являются маркерами острого панкреатита

Внутриклеточные ферменты:
|
1. |
Цитоплазматические |
• |
Место синтеза – клетка |
|
|
|
• |
Лактатдегидрогеназа (ЛДГ) |
||
|
|
• |
Место работы – внутри клетки |
||
|
|
• |
Аланинаминотрансфераза (АЛТ) |
||
|
|
• |
Активность в крови – незначительная и является результатом |
||
|
|
• |
Аспартатаминотрансфераза (АСТ) |
||
|
|
|
нормально идущих процессов разрушения клеток, |
||
|
|
• |
Креатинкиназа (КК) |
|
|
|
|
|
повышенной проницаемости мембран в детском возрасте, |
||
|
2. |
Митохондриальные |
|
||
|
|
выполнения тяжелой физической работы |
|||
|
|
|
|
|
|
|
|
• |
Аспартатаминотрансфераза (АСТ) |
• |
Активность в ткани – высокая |
|
3. |
Лизосомные |
|||
|
|
|
|||
! |
|
• |
Кислая фосфатаза (КФ) |
|
|
При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе ферменты, высвобождаются в кровь. НО следует учитывать, что нормальные значения активности ферментов в крови детей и беременных женщин отличаются (выше) от показателей, характерных для взрослых людей, так как в их организме более активно идут процессы клеточной пролиферации и синтеза некоторых клеточных ферментов
Причины повышения активности внутриклеточных ферментов в крови:
1.Незначительное повышение активности цитоплазматических ферментов – воспалительный процесс
2.Значительное повышение активности цитоплазматических ферментов – цитолиз
3.Повышение активности в крови митохондриальных ферментов – некроз

19
«Требования» к ферментам энзимодиагностики
I.Органоспецифичность (тканеспецифичность) фермента или его изоформы – фермент или определенная изоформа фермента должны абсолютно или преимущественно быть локализованы в определенном органе или ткани
•Панкреатическая липаза – находится только в поджелудочной железе
•Печеночная гистидаза и аргиназа – только в гепатоцитах
•ЛДГ1 и ЛДГ2 – преимущественно в кардиомиоцитах
•АЛТ и АСТ – неспецифичны, присутствуют в клетках многих органов. Но основными источниками повышения их активности в крови являются гепатоциты печени и кардиомиоциты сердца.
II.Количество высвобождаемого в кровь фермента должно быть прямо пропорционально степени повреждения ткани
III. Количество высвобождаемого фермента должно быть достаточно для определения его активности IV. Активность ферментов должна быть стабильна в течение достаточно длительного времени (суток)
Изоферменты
Изоферменты (изоэнзимы) – это ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по
первичной структуре белка.
Причина появления изоферментов: различия в структуре генов, кодирующих синтез данных изоферментов.
Особенности изоферментов:
•Изоферменты отличаются по первичной структуре белковой молекулы (разная последовательность АК из-за различной структуры генов)
•Катализируют одну и ту же химическую реакцию
•Изоферменты в основном являются олигомерными белками, то есть имеют четвертичную структуру организации белковой молекулы, и состоят из разных по структуре субъединиц (протомеров)
•Причем та или иная ткань преимущественно синтезирует определенные виды протомеров
•В результате различных комбинаций протомеров образуются ферменты с различной структурой – изоферменты

20
Отличия изоферментов:
1.Физико-химические свойства (так как разная первичная структура молекулы, как следствие разная молекулярная масса, заряд молекулы, растворимость в воде и тд)
2.Органоспецифичность
3.Субстратная специфичность
4.Активность
5.Способы активации, чувствительность к ингибиторам и активаторам
Пример изофермента фермента – гексокиназа
Катализируемая реакция – перенос остатка фосфорной кислоты с АТФ на гексозы
|
|
|
|
Молекулярная |
|
|
|
|
|
|
|
|
Константа |
|
|
Активность |
|
|
Регуляция |
|
|
Изоформа |
|
|
|
|
Локализация |
|
|
Субстраты |
|
|
Михаэлиса |
|
|
(мкмоль/мин |
|
|
|
||
|
|
|
масса (кДа) |
|
|
|
|
|
|
|
|
|
|
активности |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
(ммоль/литр) |
|
|
на 1 г ткани) |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аллостерическая |
|
|
|
|
|
|
|
|
|
|
|
Все гексозы |
|
|
|
|
Мозг – 10 |
|
регуляция |
|||
|
Гексокиназа |
104 |
|
|
Разные органы |
|
(глюкоза, |
0,01 |
|
|
Сердце – 4.8 |
|
(продукт – |
|||||||
|
(I-III изоформы) |
|
|
|
фруктоза, |
|
|
Мышцы – 1.5 |
|
аллостерический |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
галактоза) |
|
|
|
|
Жир – 0.15 |
|
ингибитор |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фермента) |
|
|
Гексокиназа IV |
|
|
|
|
Печень и |
|
|
|
|
|
|
|
Печень – 0.4 |
|
Не |
||||
|
изоформа |
2000 |
|
|
поджелудочная |
|
Только глюкоза |
10-20 |
|
|
|
аллостерический |
||||||||
|
|
|
|
|
|
П.жел. – 2.1 |
|
|||||||||||||
|
(глюкокиназа) |
|
|
|
|
железа |
|
|
|
|
|
|
|
|
фермент |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||

21
Изоформы лактатдегидрогеназы
Катализируемая реакция – ЛДГ катализирует обратимую реакцию окисления лактата (молочной кислоты) с образованием пирувата (пировиноградной кислоты).
Локализация – внутриклеточный цитоплазматический фермент.
Состав – лактатдегидрогеназа состоит из 4-х субъединиц (тетрамер) 2-х типов:
•М-тип (от англ. muscle – мышца)
•Н-тип (от англ. heart – сердце)
Путем комбинации 2-х субъединиц формируются
5 изоформ ЛДГ: ЛДГ1 – ЛДГ5

22
ЛДГ1 и ЛДГ2 (Н-типы)
ЛДГ4 и ЛДГ5 (М-типы)
Появление в эволюции 5 изоформ ЛДГ обусловлено особенностями окислительного метаболизма тканей. Изоформы ЛДГ1 и ЛДГ2 (Н-типы) – наиболее эффективно работают в аэробных условиях и катализируют реакцию «лактат пируват». Данные изоформы ЛДГ локализуются преимущественно в кардиомиоцитах сердца и почках. При поступлении молочной кислоты их крови в кардиомиоциты Н-типы ЛДГ катализируют реакцию окисления лактата в пируват, таким образом, лактат используется кардиомиоцитами как источник энергии (АТФ образуется при дальнейшем катаболизме образованного пирувата).
Изоформы ЛДГ4 и ЛДГ5 (М-типы) преимущественно локализуются в скелетных мышцах и печени. Они наиболее эффективно работают в анаэробных условиях и преимущественно катализируют реакцию «пируват лактат».
Аэробные условия |
«лактат пируват» |
Анаэробные условия |
«пируват лактат» |
Определение активности ЛДГ используется для диагностики заболеваний:
•Инфаркт миокарда (ЛДГ1, ЛДГ2) – через 2-3 суток после болевого приступа, а также в динамике восстановления (чем быстрее нормализуется активность фермента в плазме, тем благоприятнее прогноз)
•Гепатит и цирроз печени (ЛДГ4, ЛДГ5)
•Поражения почек (ЛДГ1, ЛДГ2)
•Повреждение, дистрофия и атрофия мышц (ЛДГ4, ЛДГ5)

23
Метод определения активности изоформ ЛДГ – путем электрофореза (разные изоформы ЛДГ отличаются разной электрофоретический подвижностью)
В норме суммарная активность ЛДГ составляет – 170-520 ЕД/л
24
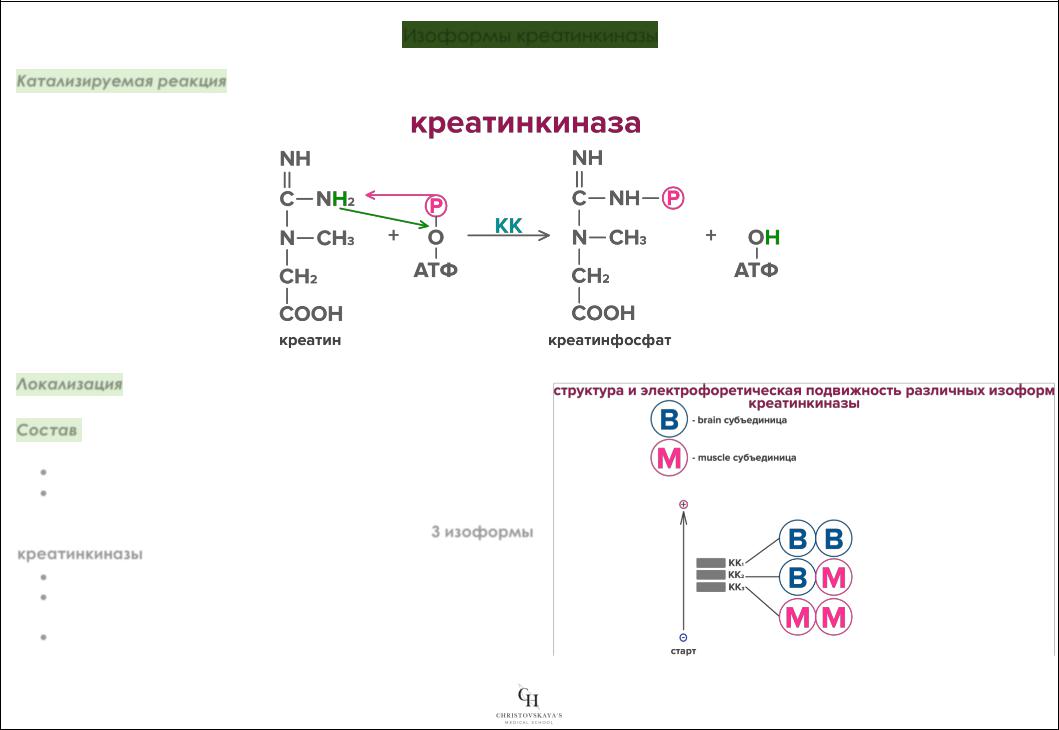
Изоформы креатинкиназы
Катализируемая реакция – КК катализирует реакцию переноса остатка фосфорной кислоты с АТФ на креатин с образованием креатинфосфата и АДФ.
Локализация – внутриклеточный цитоплазматический фермент.
Состав – креатинкиназа состоит из 2-х субъединиц (димер) 2-х типов:
•М-тип (от англ. muscle – мышца)
•В-тип (от англ. brain – мозг)
Путем комбинации 2-х субъединиц формируются 3 изоформы
креатинкиназы:
•ВВ – преимущественно локализуется в головном мозге
•ММ – преимущественно локализуется в скелетных
мышцах
•МВ – преимущественно локализуется в кардиомиоцитах

25
Метод определения активности изоформ КК – путем электрофореза (разные изоформы КК отличаются разной электрофоретический подвижностью).
В норме суммарная активность КК не должна превышать – 90 МЕ/л.
Определение активности КК используется для диагностики заболеваний:
•Инфаркт миокарда – происходит повышение активности МВ изоформы КК в плазме крови
•Травмы и повреждения скелетных мышц – происходит повышение активности ММ изоформы КК в плазме крови
Изоформа BB никакого диагностического значения не имеет, так как не может проникнуть в кровь через гематоэнцефалический барьер даже при инсульте.
Почему важно определять именно изоформентный состав, а не просто суммарную активность фермента?
Суммарная активность фермента не предоставляет информации о локализации патологического процесса. Так, например, суммарная активность ЛДГ может быть повышена при повреждениях различных органов (сердца, скелетных мышц, почек, печени). А в некоторых случаях суммарная активность фермента вообще не предоставляет информации даже о наличии патологического процесса.
Например: болезнь Тея-Сакса (ганглиозидоз)
Причина – мутация в гене HEXA, который кодирует ɑ-субъединицу фермента гексоаминидазы А снижение активности гексоаминидазы А
•Изоформа А (2ɑ2ß)
•Изоформа В (4ß)
Суммарная активность фермента при данной патологии оказывается нормальной, так как нарушается синтез только
лишь ɑ-субъединиц, а синтез ß-субъединиц компенсаторно увеличивается и, как следствие, увеличивается концентрация изоформы гексоаминидазы В и суммарная активность остается в пределах нормы.
