

Зависимость скорости реакции от концентрации S в присутствии и отсутствии обратимого конкурентного ингибитора:
! При обратимом конкурентном ингибировании возрастает KM, но, как правило, не меняется максимальная скорость р-ции.
KM возрастает, т.к. как бы снижается сродство E к S, поскольку присоединению S к АЦ фермента мешает ингибитор.
Vmax, как правило, не меняется, т.к. при большом избытке S происходит вытеснение I из
АЦ фермента и может быть достигнута максимально возможная скорость реакции.

Обратимые неконкурентные ингибиторы
Присоединяются к ферменту в участке, расположенном вне области активного центра
меняется конформация E меняется структура активного центра E уменьшается активность E.
! При обратимом неконкурентном ингибировании уменьшается Vmax, но, как правило, не меняется
KM.
Vmax уменьшается, т.к. кол-во активных молекул E, т.к. часть из них, связанных с I, на время полностью исключаются из катализа.
У тех молекул E, которые не связаны с ингибитором, сродство к S остается прежним. Поэтому, KM, как правило, меняться не будет.
Хотя, в ряде случаев, KM может возрастать.

Необратимые ингибиторы – присоединяются
к ферменту, образуя прочную ковалентную связь с его функциональными группами. Или вызывают необратимую денатурацию фермента.
Необратимые специфические ингибиторы – присоединяются к строго определённой группе в области активного центра E, образуя с ней прочные ковалентные связи.
Пример: Ацетилхолинэстераза ингибируется фосфорорганическими соединениями.
Например: диизопропилфторфосфат (ДФФ), зарин и др.

Необратимые неспецифические ингибиторы.
Существует 2 разновидности:
1)ингибиторы, образующие прочную ковалентную связь с группами, расположенными в любом участке фермента (довольно часто: вне области активного центра).
Они не специфичны к определенным ферментам.
Пример:
n-Хлормеркурибензоат присоединяется к свободным SH-группам любых ферментов. Его действие неспецифично.
2)ингибиторы, которые присоединяются к молекуле фермента вне области активного центра и образуют с ней плохо растворимые комплексы (H2S, соли тяжелых металлов).
В больших дозах вызывают необратимую денатурацию фермента.
Пример:
Ацетат свинца (свинцовая примочка) – вызывает необратимую денатурацию многих ферментов (и других белков).

Регуляция действия ферментов
Метаболический путь – это цепь
взаимосвязанных реакций, в ходе которой исходный субстрат S превращается в конечный продукт P за несколько стадий.
|
|
Метаболический путь бывает: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
Линейный: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
E1 |
|
|
|
|
|
|
|
|
E2 |
|
|
|
|
|
|
E3 |
|
|
|
....... |
|
|
|
En |
|
|
|
|
|
|
|
|||||||||||||||||
|
|
S |
|
|
|
|
|
|
|
|
A |
|
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
P |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
Разветвленный: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
|
|
|
|
|
|
|
|
En |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E3 |
C |
|
4 |
|
|
|
D ....... |
|
|
|
|
|
|
|
|
|
|
P1 |
|
|
|
|
|
|
|
||||||||||
S |
|
E1 |
A |
|
|
|
|
E2 |
B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
E5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
E6 |
L |
|
|
E7 |
|
|
M ....... |
|
|
|
Em |
P2 |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
Регуляция скорости реакций метаболического пути осуществляется путем регуляции действия определенных ферментов, которые называются
регуляторными.
Признаки регуляторных реакций:
1)самая медленная реакция пути;
2)необратимая или практически необратимая реакция;
3)реакции на разветвлении метаболического пути

Очень часто ингибитором регуляторного фермента является конечный продукт метаболического пути.
|
|
|
E1 |
|
|
|
|
E2 |
|
|
|
E3 |
|
....... |
|
En |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
A |
|
|
|
B |
|
|
|
|
C |
|
|
|
|
|
P |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Отрицательная обратная связь
Регуляторные ферменты метаболического пути, как правило, являются аллостерическими.
Существует 2 основных способа регуляции действия ферментов:
1)путем изменения количества фермента;
2)путем изменения активности фермента при неизменном количестве.
2 способ гораздо более быстрый.

Способы регуляции активности ферментов.
1.Частичный протеолиз:
Это регуляция на уровне первичной структуры белка.
2.Фосфорилирование и дефосфорилирование:
|
|
|
|
|
|
|
|
в |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
з |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
од |
аим |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
оот |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
нои |
|
|
|
тал |
к |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
м |
е |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
н |
|
|
|
и |
в |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ны |
х з |
|
ани |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ар |
|
е |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
яд |
|
|
|
|
OH...-OOC |
|
|
|
|
OPO2- |
|
|
|
|
|
|
|
|
|
ов |
|
||
|
|
|
|
|
|
|
-O |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
АТФ |
АДФ |
3 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
I. |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
II. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Протеин |
|
H3PO4 |
H O |
Фосфопротеин |
|
|
|
|
||||||||||||
|
|
2 |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I.фосфорилирование – катализируют
ферменты: протеинкиназы (A, C, G и др.);
II.дефосфорилирование – катализируют
ферменты: протеинфосфатазы.
Это регуляция на уровне третичной структуры белка.
Одни ферменты в ходе фосфорилирования активируются, другие, напротив, становятся неактивными.
Примеры:
Липаза – OH + АТФ Липаза – OPO3H2
(протеин) |
(фосфопротеин) |
неактивная |
активная |
Гликогенсинтаза –OH + АТФ Гликогенсинтаза –OPO3H2
(протеин) |
(фосфопротеин) |
активная |
неактивная |
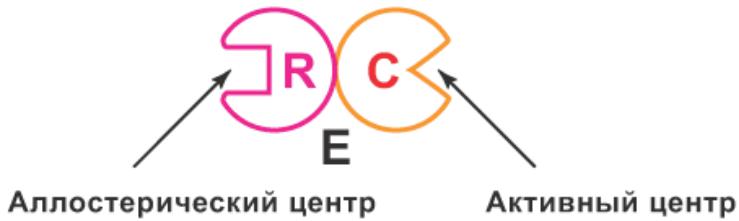
3.Аллостерическая регуляция:
Аллостерические ферменты:
1)Олигомерные белки, состоящие из 2-х или более субъединиц – регуляторной (R) и каталитической (C).
2)Имеют 2 пространственно разделенных центра: активный центр, расположенный в C субъединице и аллостерический центр, расположенный в R субъединице.
3)К АЦ присоединяется S фермента.
Каллостерическому – лиганд-эффектор.
4)Эффекторы делятся на: активаторы (A) и ингибиторы (I).
Эффекторы влияют на сродство АЦ фермента к S.
A – увеличивают сродство; I – уменьшают.
