
- •1. Предмет и значение аналитической химии. Связь с другими науками.
- •1.1. Определение.
- •1.2. Предмет и значение.
- •1.3. Теоретическая основа. Связь с другими науками.
- •2. Методы аналитической химии. Прикладные виды химического анализа.
- •3. Классификация качественного и количественного анализа.
- •3.1. Классификация качественного анализа.
- •4.2. Взятие навески.
- •4.3. Пробоподготовка.
- •5. Разложение (вскрытие) пробы: растворение, сплавление, спекание, специальные методы.
- •5.1. Растворение в жидкостях.
- •5.2. Сплавление.
- •5.3. Примеры практического применения сплавления.
- •5.4. Спекание.
- •5.5. Специальные методы. Термическое разложение.
- •5.6. Пирогидролиз.
- •11.2. Способы осуществления.
- •21. Общая характеристика титриметрического анализа (та). Понятие, терминология. Требования к реакциям, применяемым в та.
- •21.1. Общая характеристика.
- •21.2. Требования к реакциям, применяемым в та.
- •22. Основные приёмы титрования. Прямое, обратное, косвенное титрование. Примеры.
- •22.1. Прямое титрование.
- •22.2. Обратное титрование (титрование по остатку).
- •31.2. Термодинамическая и концентрационная константы равновесия реакции.
- •60.2. Условное произведение растворимости.
- •61. Растворение малорастворимого соединения: под действием кислот, комплексонообразователей, окислительно-восстановительных реакций.
- •61.1. Растворение малорастворимого соединения.
- •61.2. Растворение осадков под действием кислот.
- •61.3. Растворение осадков вследствие комплексообразования.
- •61.4. Растворение в результате овр.
- •69.2. Преимущества га.
- •69.3. Недостатки га.
21.2. Требования к реакциям, применяемым в та.
Реакции, применяемые в титриметрическом анализе, должны удовлетворять следующим требованиям:
1. Реакция должна протекать количественно, т.е. с большим выходом продукта реакции.
2. Реакция должна протекать с большой скоростью.
3. Реакция не должна осложняться протеканием побочных реакций, т.е. в процессе титрования должно сохраняться определённое соотношение между титрантом и титруемым веществом.
4. Должен существовать способ определения конца реакции.
Если реакция не удовлетворяет хотя бы одному из этих требований, она не может использоваться в титриметрическом анализе.
22. Основные приёмы титрования. Прямое, обратное, косвенное титрование. Примеры.
22.1. Прямое титрование.
Определяемое вещество непосредственно взаимодействует с титрантом. Для проведения анализа достаточно одного рабочего раствора. Пример: титруем щёлочь кислотой.
22.2. Обратное титрование (титрование по остатку).
Используют 2 рабочих раствора: основной и вспомогательный. Например, титрование Cl- в кислом растворе. К анализируемому раствору сначала добавляют заведомо избыток основного рабочего раствора AgNO3. При этом происходит реакция образования малорастворимого соединения AgCl. Затем избыток AgNO3, не вступивший в реакцию с Cl-, оттитровывают вспомогательным рабочим раствором роданида аммония:
Ag++Cl- AgCl
Ag++SCN- AgSCN
Индикатор – соль Fe3+.
22.3. Косвенное титрование (титрование по замещению).
В этом способе к определяемому веществу добавляют в избыток специальный реагент, вступающий с ним в реакцию. Один из продуктов реакции затем оттитровывают рабочим раствором. Пример: иодометрическое определение Cu2+:
2Cu2++4I- 2CuI+I2
К анализируемому раствору добавляют избыток KI, выделившийся I2 оттитровывают тиоцианатом натрия (роданидом натрия) в присутствии краххмала.
23. Расчёты в ТА. Принцип эквивалентности. Понятие об эквиваленте. Молярная масса эквивалента.
24. Расчёты в ТА. Расчёт результатов прямого титрования.
25. Расчёты в ТА. Расчёт результатов обратного титрования.
26. Общая характеристика реакций в растворах. Классификация растворителей (по величине диэлектрической проницаемости ε, электрическому моменту диполя μ).
27. Общая характеристика реакций в растворах. Классификация растворителей по характеру взаимодействия с ионами вещества.
28. Механизм растворения химических веществ. Сольватные комплексы. Ионные ассоциаты, ионные пары.
29. Скорость химических реакций в растворе. Кинетические уравнения. Правило Аррениуса. Катализаторы, ингибиторы, промоторы, каталитические яды.
30. Равновесие химических реакций в растворе. Закон действующих масс. Константа равновесия реакций.
31. Значение закона действующих масс. Термодинамическая и концентрационная константы равновесия реакции.
31.1. Закон действующих масс.
В математической форме установлен Гульдбергом и Вааге в 1867 г.:
aA+bB cC+dD
v прямой реакции = K1*CaA*CbB
v обратной реакции = K2*CcC*CdD
Из уравнений равенства v прямой и обратной реакции в момент химического равновесия:
K1*[A]a*[B]b=K2*[R]r*[S]s
([A]a и [B]b – концентрация в момент химического равновесия!)
 =
=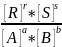 =Kc
=Kc
Константа равновесия (Kc) реакции не зависит от концентрации компонентов.
Основное значение закона действующих масс состоит в том, чтобы устанавливать связь между равновесными концентрациями всех компонентов реакции.
