
- •1. Предмет и значение аналитической химии. Связь с другими науками.
- •1.1. Определение.
- •1.2. Предмет и значение.
- •1.3. Теоретическая основа. Связь с другими науками.
- •2. Методы аналитической химии. Прикладные виды химического анализа.
- •3. Классификация качественного и количественного анализа.
- •3.1. Классификация качественного анализа.
- •4.2. Взятие навески.
- •4.3. Пробоподготовка.
- •5. Разложение (вскрытие) пробы: растворение, сплавление, спекание, специальные методы.
- •5.1. Растворение в жидкостях.
- •5.2. Сплавление.
- •5.3. Примеры практического применения сплавления.
- •5.4. Спекание.
- •5.5. Специальные методы. Термическое разложение.
- •5.6. Пирогидролиз.
- •11.2. Способы осуществления.
- •21. Общая характеристика титриметрического анализа (та). Понятие, терминология. Требования к реакциям, применяемым в та.
- •21.1. Общая характеристика.
- •21.2. Требования к реакциям, применяемым в та.
- •22. Основные приёмы титрования. Прямое, обратное, косвенное титрование. Примеры.
- •22.1. Прямое титрование.
- •22.2. Обратное титрование (титрование по остатку).
- •31.2. Термодинамическая и концентрационная константы равновесия реакции.
- •60.2. Условное произведение растворимости.
- •61. Растворение малорастворимого соединения: под действием кислот, комплексонообразователей, окислительно-восстановительных реакций.
- •61.1. Растворение малорастворимого соединения.
- •61.2. Растворение осадков под действием кислот.
- •61.3. Растворение осадков вследствие комплексообразования.
- •61.4. Растворение в результате овр.
- •69.2. Преимущества га.
- •69.3. Недостатки га.
11.2. Способы осуществления.
1. Периодическая экстракция – измельчение вещества из одной и той же фазы свежими порциями экстрагента. Существует в однократном и многократном варианте.
2. Непрерывная экстракция – экстракция с непрерывной подачей реагента в экстрактор.
3. Непрерывная противоточная экстракция – экстракция, при которой осуществляется встреча водной и органической фазы.
4. Экстракционнная хроматография.
Для однократной экстракции:
Степень
измельчения =
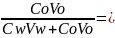

12. Классификация экстракционных процессов по природе. Преимущества экстракции и области её применения.
13. Собственно химический анализ. Расчёт и обработка результатов анализа.
14. Метрологические характеристики аналитического определения: сходимость, воспроизводимость, чувствительность (предел обнаружения, открываемый минимум, предельное разбавление).
15. Аналитические характеристики определения: экспрессность, надёжность, специфичность, избирательность, способы повышения селективности.
16. Источники ошибок. Закон накопления ошибок. Классификация потерь.
17. Общая характеристика качественного анализа. Классификация по технике проведения процесса.
18. Общая характеристика качественного анализа. Классификация по аналитическому эффекту: метод растирания, метод капельных реакций.
19. Общая характеристика качественного анализа. Кристаллоскопические реакции. Дробный, систематический анализ.
20. Общая характеристика качественного анализа. Сульфидная классификация катионов.
20.1. Сульфидная классификация катионов.
Это наиболее распространённая классификация, по которой все катионы делятся на 5 групп. Основными групповыми реагентами являются (NH4)2S в нейтральной и щелочной среде; H2S в кислой среде.
№ |
Ионы |
Групповой реагент |
Состав осадка |
1 |
Li+, Na+, K+, NH4+ |
нет |
нет |
2 |
Ca2+, Mg2+, Ba2+, Sr2+ |
(NH4)2CO3 |
MeCO3 |
3 |
Al3+, Cr3+ (A) Fe3+, Mn2+, Co2+, Ni2+, Fe2+ (B) |
(NH4)2S в нейтральной и щелочной среде |
Me(OH)3, MeS, Me2S3 |
4 |
Hg2+, Cu2+, Bi3+, Zn2+ (A) Sn (II, III), Sb (III, V), As (III, V) (B) |
H2S в кислой среде |
Сульфиды: A – не растворимые в (NH4)2S B – растворимые в (NH4)2S |
5 |
Ag+, Pb2+, Hg22+ |
HCl (2M) |
MeCl, MeCl2 |
Недостатком является токсичность H2S, поэтому анализ следует проводить в лаборатории с хорошей вытяжкой.
Альтернатива H2S – использование серосодержащих органических соединений. В процессе гидролиза данных соединений выделяется сульфид-ион. Минус в том, что может выделиться сера вместо сульфида.
21. Общая характеристика титриметрического анализа (та). Понятие, терминология. Требования к реакциям, применяемым в та.
21.1. Общая характеристика.
Титриметрический анализ основан на точном измерении количества реагента, израсходованного на реакцию с определяемым веществом (раннее название – объёмный анализ).
Слово «титр» обозначает «надпись», в аналитической химии – один из способов выражения концентрации вещества. Титр показывает количество вещества в граммах, растворённого в 1 см3 раствора.
Титрованный (стандартный) раствор – раствор, концентрация которого известна с высокой точностью. Стандартный раствор часто называют рабочим раствором или титрантом.
В момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества, называется точкой эквивалентности.
