
4 курс / Акушерство и гинекология / Эндометриоз_Клинические_и_теоретические_аспекты,_А_Н_Стрижаков,-1
.pdf
Эндометриоз. Клинические итеоретическиеаспекты
к инсулину, глюкагону, кортикостероидам и катехоламинам;
7)обмен веществ - усиление синтеза гликогена, увеличение или снижение концентрации свободных жирных кислот;
8)систему кроветворения - влияние на агрегацию эритроцитов и тромбоцитов.
В настоящее время достоверно установлено, что эн-
догенные ПГ оказывают влияние практически на все звенья репродуктивной функции, в том числе, на подвижность сперматозоидов в шеечной слизи, процессы стероидогенеза в яичниках, овуляцию, имплантацию бластоцисты, а также на течение беременности и родов.
Влияниепростагландиновнаовуляциюи функциюжелтоготела
Результаты экспериментальных работ свидетельствуют об активном участии ПГ в процессе овуляции (по данным многочисленных исследований '40'', ингибитор биосинтеза ПГ индометацин блокирует овуляцию у большинства видов млекопитающих). Основу механизма регуляции ПГ процессов овуляции составляют следующие факторы:
1)на ранних стадиях развития фолликула простагландины (ПГЕ2) маскируют действие фолликулостимулирующего гормона на клетки зернистой (гранулезной) мембраны и лютеинизирующего гормона - на клетки внутренней оболочки (theca interna);
2)ПГ играют роль внутрияичниковых медиаторов, стимулирующих овуляторный эффект лютеинизирующего гормона (разрыв большого зрелого фолликула); выделение лютропина обусловлено влиянием ПГКа на центральную нервную систему; так, в эк-
169

А.Н. Стрижаков иА. И. Давыдов
спериментах на овцах установлено, что после внутримышечного введения nXF2a концентрация лютеинизирующего гормона в крови возрастает в 10 раз . Таким образом, ПГ могут конкурировать с гормонами аденогипофиза или, напротив, дополнять и усиливать их действие в зависимости от стадии развития фолликула. В связи с этим, не следует рассматривать эффект влияния ПГ на овуляцию как противовоспалительный, способствующий нарушению целостности стенки доминантного фолликула и выходу яйцеклетки в брюшную полость13. В то же время, различные типы ПГ по разному влияют на процессы овуляции: nrF2a вызывает сокращение, ПГЕ2 - расслабление изолированных полосок стенки фолликула (ПГГуг принимает непосредственное участие в овуляторном разрыве фолликула, а ПГЕ2 - более ответственен за процессы лютеинизации); антагонизм этих простагландинов проявляется и во влиянии на кровеносные сосуды в яичнике: ПГЕ2 в условиях непрерывной инфузии в яичник ингибирует вазоконстрикцию, обусловленную воздействием
Акц ентируя внимание на стимуляции простагландинами синтеза лютеинизирующего гормона необходимо отметить, что между ними существует и обратная связь: при изучении трансформации арахидоновой кислоты в гомогенатах яичников крыс К. Satoh et al.67 обнаружили, что ведущая роль в конверсии полиненасыщенной жирной кислоты отводится системе биосинтеза ПГ в зрелых фолликулах, в активировании которой основное значение принадлежит лютеинизирующему гормону (при этом половые стероиды выполняют функцию посредников взаимодействий в системе простаг-ландины-лютропин- простагландины).
Несмотря на неоспоримость факта об ингибирую-
170

Эндометриоз. Клинические и теоретические аспекты
щем влиянии антагонистов ПГ-синтетаз на овуляцию, остается неуточненным механизм блокады этими веществами биосинтеза простагландинов. Возможно, ингибиторы ПГ препятствуют образованию декапептидов, необходимых для секреции гонадотропинов; что, в свою очередь, приводит к нарушениям в системе ПГ-лютро- пин-ПГ (последние проявляются в разрушении фермента циклооксигеназы, ответственного за трансформацию арахидоновой кислоты).
В опытах, проведенных на препаратах желтого тела, полученных у беременных женщин, установлено, что ПГ обладают стимулирующим эффектом на синтез прогестерона, оказывая влияние, сходное по действию с лютеинизирующим гормоном. Кроме этого, ПГ регулируют тропность лютеиновых клеток человека к лютеинизирующему гормону (в противовес эстрогенам, которые отвечают за лютеолитическую регуляцию) .
Действие простагландинов на маточные трубы
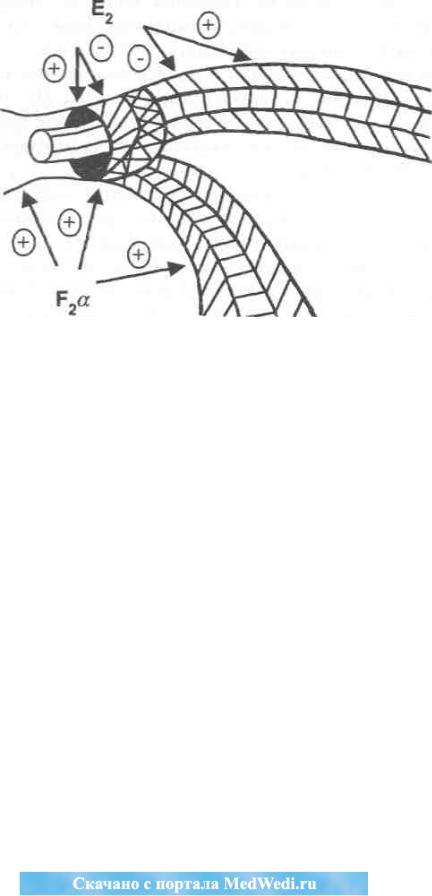
Основу механизма действия простагландинов на маточные тубы составляют процессы сокращения и расслабления мышечных волокон яйцеводов, регулирующие транспорт оплодотворенной яйцеклетки, а также объем ретроградной менструальной крови. Как известно14, мышечная оболочка маточных труб образована двумя слоями гладких мышц - внутренним циркуляторным и наружным продольным; выраженность мышечного пласта усиливается от воронки (где мышечная оболочка как самостоятельная структура отсутствует) к перешейку, в котором внутренние слои достигают максимального развития, формируя мощную круговую мышцу. В преовуляторной фазе менструального цикла ПГТ^ и ПГЕ9 стимулируют констрикцию продольных воло-
171
А.Н. Стрижаков и А.И.Давыдов
Рис. 5.9. Влияние простагландинов на маточные трубы (схема)
кон, в фолликулиновой и лютеиновой стадиях - вызывают расслабление циркулярного слоя; nFF2a сокращает оба типа мышц, а ПП~ - оказывает на них слабое стимулирующее действие ,13. Таким образом, пассаж яйцеклетки по трубе происходит под влиянием ПГЕ и IirF2a: в преовуляторной фазе менструального цикла увеличение синтеза IirF2a приводит к сокращению интерстициального отдела маточной трубы; в лютеиновой фазе - преобладание ПГЕ обеспечивает беспрепятственный транспорт яйцеклетки в полость матки, а под влиянием ПГР2а создаются условия для передвижения яйцеклетки по трубе (рис. 5.9). Следовательно, физиологическая регуляция транспортной функции трубы определяется соотношением ПГЕ/ПГР9а.
172

Эндометриоз. Клинические итеоретическиеаспекты
Простагландини и матка
В настоящем разделе следует осветить три аспекта взаимодействия ПГ и матки вне беременности:
1)ПГ и менструация;
2)ПГ и сократительная активность миометрия;
3)влияние ПГ на архитектонику мышечных волокон матки.
Впроцессе десквамации простагландины играют немаловажную роль: во-первых, клеточные гормоны, стимулируя контрактильную активность миометрия, принимают опосредованное участие в отторжении функционального слоя эндометрия; во-вторых, ПГ оказывают непосредственное влияние на эндометрий - в экспериментальных исследованиях установлено, что трансформация клеток эндометрия в клетки отпадающей оболочки в условиях как in vivo, так и in vitro обусловлена
повышенной продукцией ПГ серий F и Е с преобладанием последних1. Кроме этого, в эксперименте на крысах было доказано, что ткань отпадающей оболочки обладает способностью секретировать простациклин (ПГІ,) с накоплением его метаболитов, в частности, б-кето-nrF.a . Учитывая, что клетки отпадающей оболочки
локализуются вокруг спиральных артерий в субэпителиальной строме, продукция этими клетками ПГ оказывает прямое влияние на сосудистый тонус и кровообращение в эндометрии (в связи с чем, маточным ПГ отво-
дится достаточно определенное значение в генезе меноррагий13).
Среди важнейших аспектов проблемы «простагландины и репродуктивная система женщин» особую актуальность приобретают вопросы взаимодействия ПГ и миометрия. В настоящее время является неоспоримым факт, что ПГЕ и ПГКа принимают непосредственное
173

А.Н. Стрижаков иА.И.Давыдов
участие в активации сократительной функции миометрия. При этом действие ПГ опосредуется через специфические рецепторы, расположенные в плазме мембран «ткани-мишени» . Сила и интенсивность сокращений миометрия определяется продукцией ПГ: в норме образование клеточных гормонов способствует физиологическому сокращению матки, отторжению функционального слоя эндометрия и своевременной остановке менструального кровотечения за счет тромбообразования; повышенная (патологическая) секреция ПГГ^а приводит к судорожным сокращениям миометрия и артериол и является причиной ишемических болей спастического характера (клинически это проявляется выраженной альгодисменорей).
Усиленное образование (или замедленная деградация) простагландинов обуславливает нарушения архитектоники мышечных волокон матки: в месте их переплетения образуются щели и лакуны, препятствующие тесному соприкосновению мышечных элементов. В результате вышеизложенного повреждается синхронность сократительной деятельности миометрия, что вызывает усиление спастических сокращений и, следовательно, повышает интенсивность болевого синдрома20.
Содержание ПГ¥2 ав очагах наружного генітального эндометриоза
Нами изучено содержание простагландинов Fy* в очагах наружного генитального эндометриоза у больных с различным клиническим течением патологического процесса. Следует отметить, что серийные исследования плазмы крови и тканей гетеротопий не выявили достоверной вероятности различий в концентрации ПГ у этих больных. В связи с чем, в качестве нормативных
174

Эндометриоз. Клинические итеоретическиеаспекты
Таблица 5.7
СОДЕРЖАНИЕ ПГР2а В ПЛАЗМЕ КРОВИ ЗДОРОВЫХ ЖЕНЩИН ПО ВОЗРАСТНЫМ ГРУППАМ (Абрамченко В.В., Богдашкин Н.Г.1)
|
Возраст |
Число |
Содержание ПГ |
Вероятность |
||
женщин (лет) |
наблюдений |
(нг/мл) |
различий (Р) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
>0.05 |
<0.05 |
|
|
|
|
|
|
|
1 |
|
20.3±0.8 |
11 |
0.077±0.011 |
2:3,4 |
1:2,3,4 |
|
|
|
|
|
3:4 |
|
|
|
|
|
|
|
|
2 |
|
32.1И.2 |
11 |
0.153±0.014 |
|
|
|
|
|
|
|
|
|
3 |
|
43.6±1.3 |
11 |
0.148±0.017 |
|
|
|
|
|
|
|
|
|
4 |
|
Общая |
33 |
0.126±0.009 |
|
|
|
|
группа |
|
|
|
|
|
|
|
|
|
|
|
показателей нами использованы результаты, получен-
ные В. В. Абрамченко и Н.Г. Богдашкиным1 при исследова-
нии плазмы крови у здоровых небеременных женщин
(табл. 5.7).
Естественно, что в концентрация ПГ в плазме здоровых женщин репродуктивного возраста варьирует в зависимости от фазы менструального цикла. По данным авторов1, диапазон индивидуальных колебаний уровня
175

А.Н. Стрижаков иА.И.Давыдов
HTF-a в плазме крови здоровых небеременных женщин репродуктивного возраста находится в пределах 0.07-0.2 нг/мл.
Результаты исследований, проведенных нами, свидетельствуют, что содержание nTF2a в очагах наружного генитального эндометриоза, локализованного в малом тазу (перитонеальный эндометриоз) варьирует в широких пределах в зависимости от тяжести клинической симптоматики заболевания. У пациенток с «бессимптомным» течением эндометриоза концентрация IirF2a как в сыворотке крови, так и в патологических имплантатах достоверно не отличалась от нормативных параметров; напротив, в группе больных с «классическим» течением эндометриоза, клинически классифицированным как тяжелая форма заболевания (принципы классификации изложены ниже) уровень nTF2a в крови и тканях достоверно превышал соответствующие показатели, полученные при обследовании здоровых небеременньгх женщин или больных «бессимптомным» эндометриозом
(табл. 5.8, рис. 5.10).
Как представлено в таблице 5.8, средний уровень содержания IirF2a в имплантатах «бессимптомного» эндометриоза составил 0.157±0.091 нг/г; диапазон индивидуальных колебаний находился в пределах 0.086-0.182 нг/г и определялся, главным образом, фазой менструального цикла (максимальные значения зарегистрированы в преовуляторном периоде). У пациенток с тяжелой формой эндометриоза индивидуальные показатели концентрации IirF2a варьировали от 0.493 до 0.895 нг/г; какой-либо зависимости в вариации уровня ПГ на протяжении менструального цикла не обнаружено.
Таким образом, вышеизложенное убеждает, что в патогенезе эндометриоза ПГ отводится немаловажная роль: во-первых, повышение концентрации ПГ в орга-
176

Эндометриоз. Клинические и теоретические аспекты
Таблица 5.8
СОДЕРЖАНИЕ nrF2a В ПЛАЗМЕ КРОВИ ЗДОРОВЫХ НЕБЕРЕМЕННЫХ ЖЕНЩИН И ОЧАГАХ ЭНДОМЕТРИОЗА У
ПАЦИЕНТОК С РАЗЛИЧНЫМ КЛИНИЧЕСКИМ ТЕЧЕНИЕМ ЗАБОЛЕВАНИЯ
|
1 "руппа обследованных |
Содержание ПГ |
Вероятность |
||
|
|
|
(нг/мл; нг/г) |
различий (Р) |
|
|
|
|
|
|
|
|
|
|
|
>0.05 |
<0.05 |
|
|
|
|
|
|
1 |
|
Контрольная группа* |
0.126±0.009 |
1:2 |
1,2:3 |
|
|
|
|
|
|
2 |
|
Пациентки с |
0.157±0.091 |
|
|
|
|
"бессимптомным" |
|
|
|
|
|
эндометриозом |
|
|
|
|
|
|
|
|
|
3 |
|
Пациентки с |
0.673±0.011 |
|
|
|
|
"классическим" |
|
|
|
|
|
эндометриозом |
|
|
|
|
|
|
|
|
|
|
|
* - Абрамченко В.В., Богдашкин Н.Г [1] |
|
||
|
|
|
|
|
|
низме женщины представляет предрасполагающий (этиологический) фактор развития эндометриоза; во-вто- рых, ПГ, по-видимому, стимулируют развитие эндометриоза; и, наконец, ПГ «отвечают» за основные клинические симптомы эндометриоза - боль, дисменорею, бесплодие. Анализируя сведения литературы по данному вопросу, необходимо констатировать, что результаты исследований, посвященных изучению роли ПГ при эндометриозе, существенно противоречивы: одни авторы33, полагают, что уровень ПГ в организме больных эндометриозом не изменяется, другие, напротив, приводят данные о высокой концентрации ПГ
177

А.Н.СтрижаковиА.И.Давыдов
нг/мл(нг/г)
0,6
0,5
0,4
0,3
0,2
0,1
■ "бессимптомное" течение □"классическое" течение
Рис. 5.10. Содержание nrF.a в плазме крови и очагах эндометриозау пациенток сразличнымклиническим течением заболевания
как в крови и перитонеальной жидкости, так и в эндометриоидных гетеротопиях. Возможное объяснение наличию диаметрально противоположных мнений по этой проблеме - отсутствие коррелятивных связей между биохимическим и клиническим исследованиями. Справедливо отметить, что в работе M.W. Vernon9,1 установлена взаимосвязь между морфологическими (макроскопическими) признаками эндометриоидных гетеротопий и концентрацией в них nTF2a (рис. 5.11). Однако, в собственных исследованиях мы не получили данных, подтверждающих результаты исследований M.W. Vernon, так как, согласно П1Т2а
