
metodichka_po_sterilnym
.pdf
Краткий информационный материал к блоку стерильные и асептически изготавливаемые лекарственные формы
Растворы для инъекций и инфузий – жидкая стерильная лекарственная форма, получаемая путем растворения одного или нескольких лекарственных веществ и предназначенная для парентерального инъекционного применения. Инъекционные растворы объемом 100 мл и более называют инфузионными.
Общие требования к инъекционным и инфузионным растворам
№ |
Требование |
|
|
Способ достижения |
|
|
|
||||
1. |
Изотоничность |
|
Растворы изотонируют, добавляя вспомогательные вещества, |
||||||||
|
Физиологической |
норме |
разрешенные ГФ, с учетом совместимости компонентов. Наиболее |
||||||||
|
соответствует |
|
часто для этих целей используется натрия хлорид. |
|
|
||||||
|
0,9% раствор NaCl. |
|
В |
отдельных |
случаях |
допускается |
применение |
||||
|
Пределы |
физиологической |
гипертонических или гипотонических растворов (в/м, п/к), о чем |
||||||||
|
нормы 0,9% ± 0,2 % |
|
должно быть указано в НД |
|
|
|
|
|
|
||
2. |
Стабильность |
|
Стабилизаторы: |
|
|
Лекарственные вещества: |
|||||
|
|
|
|
1.Ингибиторы гидролиза: |
|
|
1.Соли слабых оснований и |
||||
|
|
|
|
буферные растворители (pH<7); |
|
сильных |
кислот |
(соли |
|||
|
|
|
|
кислота хлористоводородная |
|
алкалоидов |
и |
синтетических |
|||
|
|
|
|
|
|
|
|
азотистых оснований) |
|
||
|
|
|
|
2. Ингибиторы гидролиза: |
|
|
|
|
|
|
|
|
|
|
|
буферные растворители (pH |
|
2.Соли сильных оснований и |
|||||
|
|
|
|
>7); |
|
|
|
слабых |
кислот |
(натрий |
|
|
|
|
|
NaOH; |
|
|
|
сульфацил, натрий нитрит, |
|||
|
|
|
|
NaHCO3; |
|
|
натрий тиосульфат). |
|
|||
|
|
|
|
|
|
3.Легкоокисляющиеся |
|
||||
|
|
|
|
3.Антиоксиданты |
|
|
|
||||
|
|
|
|
|
|
вещества |
|
|
(кислота |
||
|
|
|
|
Na2 SO3; |
|
|
|
|
|
||
|
|
|
|
|
|
|
аскорбиновая, |
|
натрий |
||
|
|
|
|
Na -метабисульфит; |
|
|
|
||||
|
|
|
|
|
|
сульфацил) |
|
|
|
||
|
|
|
|
Na2S4O6; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Трилон Б |
|
|
|
|
|
|
|
3. |
Отсутствие |
механических |
подготовка посуды и вспомогательного материала; |
|
|
||||||
|
включений |
|
|
соблюдение условий асептики; |
|
|
|
|
|||
|
|
|
|
тщательное фильтрование; |
|
|
|
|
|||
|
|
|
|
качественная упаковка и укупорка. |
|
|
|
|
|||
4. |
Стерильность |
|
1. Изготовление в асептических условиях; |
|
|
|
|||||
|
|
|
|
2. Стерилизация: |
|
|
|
|
|
|
|
|
|
|
|
термическая (насыщенным паром под давлением 120+2˚С, |
|||||||
|
|
|
|
текучим паром 100˚ С); |
|
|
|
|
|
|
|
|
|
|
|
мембранная фильтрация (полимерные мембраны с диаметром пор |
|||||||
|
|
|
|
0,2-0,5 мкм); |
|
|
|
|
|
|
|
|
|
|
|
3. Введение антисептиков-консервантов (производные фенола и др); |
|||||||
|
|
|
|
4. Герметичная упаковка и укупорка под обкатку |
|
|
|
||||
|
|
|
|
||||||||
5. |
Комфортность |
|
Оптимальное значение рН обеспечивается добавлением буферных |
||||||||
|
|
|
|
растворов, NaHCO3 (р-ры кислот аскорбиновой, никотиновой) |
|||||||
|
|
|
|
Изотоничность обеспечивается добавлением изотонирующих |
|||||||
|
|
|
|
компонентов (NaCL, C6H12O6 и др.); |
|
|
|
|
|||
|
|
|
|
Отсутствие механических включений |
|
|
|
||||
Дополнительные требования к инфузионным растворам в зависимости от их функционального назначения
№ |
Требование |
Способ достижения |
|
|
Комментарии |
||||||
1. |
Способность |
|
раствора |
Добавляют |
соли, |
ионный |
состав |
По |
физиологическим |
||
|
регулировать |
осмотическое |
которых |
соответствует |
ионному |
показаниям (отек |
легких, |
||||
|
давление в плазме крови |
мозга и |
|
||||||||
|
|
|
|
|
|
|
|||||
|
(изотоничность |
|
|
составу |
плазмы |
крови, |
в |
др.) |
могут |
быть |
|
|
(изоосмолярность) |
или |
концентрации, обеспечивающей |
|
использованы растворы с |
||||||
|
соответствие |
осмотического |
|
более |
|
высокой |
|||||
|
|
|
|
|
|
|
|||||
|
давления |
|
раствора |
необходимое осмотическое давление |
осмотической |
|
|||||
|
физиологическому |
состоянию |
|
|
|
|
|
активностью. |
|
||
1

|
плазмы крови). |
|
|
и вспомогательные |
|
|
|
|
|
|
|
вещества, разрешенные ГФ, с учетом |
|
||
|
|
|
|
совместимости |
компонентов. |
|
|
|
|
|
|
Наиболее часто для этих целей |
|
||
|
|
|
|
используется натрий хлорид (NaCL) |
|
||
|
|
|
|
|
|
|
|
2. |
Апирогенность |
|
|
|
|
|
Для растворов, вводимых |
|
|
|
|
1. Соблюдение условий асептики; |
в объеме более 10 мл, не |
||
|
|
|
|
|
|
|
допускается введение |
|
|
|
|
2. Проверка исходных веществ на |
растворов, содержащих |
||
|
|
|
|
апирогенность (вода для |
пирогенные вещества. |
||
|
|
|
|
инъекций, глюкоза и др.); |
|
||
|
|
|
|
|
|||
3. |
Способность |
регулировать |
Добавлением буферных растворов, |
Для приведения крови к |
|||
|
кислотно-щелочное |
|
веществ, регулирующих рН. |
физиологической норме: |
|||
|
равновесие в плазме крови |
|
|
|
при ацидозе |
||
|
(изогидричность |
или |
|
|
|
могут быть введены р-ры |
|
|
соответствие |
рН |
раствора |
|
|
|
с рН >7,4 ; |
|
физиологическому |
состоянию |
|
|
|
при алкалозе могут |
|
|
плазмы крови). |
|
|
|
|
|
быть введены р-ры с рН < |
|
|
|
|
|
|
|
7,4 |
4. |
Изоионичность |
|
|
Вводят в состав р-ров соли, ионный |
|
||
|
|
|
|
состав |
которых |
соответствует |
|
|
|
|
|
ионному составу плазмы крови, |
|
||
|
|
|
|
например: Na+, Cl-; SO42-; HPO42-; K+ |
|
||
|
|
|
|
и др. |
|
|
|
5. |
Соответствие вязкости |
Добавление веществ, повышающих |
|
||||
|
раствора вязкости |
|
вязкость р-ра (высокомолекулярных |
|
|||
|
(реологическим свойствам) |
веществ: поливинол и др.) |
|
||||
|
плазмы |
|
|
|
|
|
|
6. |
Пролонгирование |
|
Добавление веществ, повышающих |
|
|||
|
фармакологического действия |
вязкость р-ра (высокомолекулярных |
|
||||
|
|
|
|
веществ (ВМВ) |
|
|
|
|
Практически для всех растворов для инъекций и инфузий, изготовляемых в аптеке регламентированы |
||||||
НД: |
|
|
|
|
|
|
|
состав;
способы обеспечения их стабильности;
способы обеспечения стерильности.
Обязательным является умение выполнять официальные требования к организации технологического процесса и контролю качества. «Правила правильного (надлежащего) производства» («Good manufactaring practice», GMP).
Правила включают:
требования к современной технологии производства;
контроль качества лекарственных средств, дисперсионных сред вспомогательных веществ и лекарственных препаратов;
общие требования к помещениям, оборудованию, персоналу.
Для обеспечения минимальной контаминации микроорганизмами растворы готовят в асептических условиях. Стерильные растворы изготавливают в специально спланированных и отдельных помещениях, так называемых «чистых помещениях». Они должны иметь многоступенчатую систему приточно-вытяжной вентиляции с преобладанием притока. Воздух данных помещений так же должен соответствовать национальным стандартам по степени чистоты (класс чистоты). Наиболее ответственные технологические операции должны быть защищены установками ламинарного потока воздуха.
Объем инъекционных растворов во флаконах всегда должен быть больше номинального. В сосудах вместимостью до 50 мл наполнение проверяют калиброванным шприцем; в сосудах вместимостью 50 мл и более - калиброванным цилиндром (при температуре 20 + 2°С). Объем раствора, выбранного из сосуда шприцем после вытеснения воздуха и заполнения иглы или после выливания в цилиндр, не должен быть меньше номинального.
Объем инъекционных растворов в сосудах
Номинальный |
Объем заполнения (мл) |
Число сосудов для контроля |
2
объем (мл) |
Невязкие растворы |
Вязкие растворы |
заполнения (шт) |
1 |
1,10 |
1,15 |
20 |
2 |
2,15 |
2,25 |
20 |
5 |
5,30 |
5,50 |
20 |
10 |
10,50 |
10,70 |
10 |
20 |
20,60 |
20,90 |
10 |
50 |
51 |
51,50 |
5 |
Более 50 |
на 2% более |
на 3% более |
|
|
номинального |
номинального |
|
При изготовлении растворов для инъекций и инфузий рассчитывают:
массы лекарственных веществ;
количества стабилизатора;
объем растворителя с учетом номинального объема фасовки.
Задание 1. Изготовление растворов для инъекций – соли слабого основания и сильной кислоты
Рецепт № 1 |
Фармацевтическая экспертиза рецепта |
Rp.: Sol. Dibazoli 2% - 100 ml |
Форма рецептурного бланка (приказ № 110 от 12.02.07г.) – N 107/у |
Sterilisetur! |
Проверка фармацевтической (физико-химической, химической и |
D.S. Для в/м введения по 2 мл 3 раза |
фармакологической) совместимости ингредиентов прописи |
в день. |
Вывод. ЛВ совместимы, т.к. пропись нормирована. |
Пропись нормирована |
Проверка доз веществ список А и Б, НЕО учетных в-в |
№ 214 от 16.07.97, |
РД – 2,0 - 100 мл |
прилож. 2, раздел 1.1, пропись 11 – |
Х - 2 мл |
Р-р дибазола 0,5%, 1%, 2%. |
Х = (2х2):100 = 0,04 < ВРД |
Состав прописи: |
СД – 0,04 х 3 = 0,12 < ВСД |
Дибазола 5,0; 10,0; 20,0 |
Вывод. Дозы не завышены. |
Раствор кислоты хлороводородной |
Учетных ЛВ нет. |
0,1 М 10 мл |
Вывод. Препарат изготавливать можно. |
Воды для инъекций до 1 л. |
Оформление основной этикетки «Стерильно» и предупредительных |
Режим стерилизации: 120С – 8 мин |
надписей «Хранить в прохладном месте», «Беречь от детей» для |
(объем до 100 мл). |
стадии оформления (маркировки) – МУ от 4.07.97. |
Срок годности: 60 дней – для 0,5% и |
|
1% растворов; |
|
30 дней – для 2% раствора. |
|
Физико-химические свойства лекарственных и вспомогательных веществ
Dibazolum (дибазол) - белый или белый со слегка сероватым или желтоватым оттенком кристаллический порошок горько-соленого вкуса. Трудно растворим в воде при комнатной температуре (1:50), легко растворим в кипящей воде. Гигроскопичен. Хранение. Список Б. В хорошо укупоренной таре. ВРД = 0,05, ВСД = 0,15 Спазмолитическое, гипотензивное средство. Раствор дибазола имеет кислую реакцию среду. Повышение значения рН в растворе приводит к образованию осадка слабого основания, дальнейшей деструкции с образованием токсических веществ.
Повышение рН может быть обусловлено некоторой щелочностью стекла, влияние которой усиливается при повышении температуры (термическая стерилизация). Для нейтрализации щелочи, выделяемой из стекла при термической стерилизации растворы стабилизируют 0,1М раствором хлористоводородной кислоты.
Solutio Acidi hydrochlorici 0,1 M (р-р кислоты хлористоводородной 0,1 M). Используют для регуляции значения pH раствора, изготавливают по мере необходимости (хранению не подлежит). Состав: кислота хлористоводородная разведенная (плотность 1,038-1,039) – 4,4 мл, вода для инъекций до 1 л
Aqua pro injectionibus (вода для инъекций) – вода очищенная повышенной чистоты, полученная дистилляцией или методом обратного осмоса. Вода для инъекций должна отвечать требованиям, предъявляемым к воде очищенной, но, дополнительно, должна быть апирогенной. Во избежание контаминации микроорганизмами, полученную апирогенную воду используют для изготовления инъекционных лекарственных форм сразу же после перегонки или в течение 24 часов, сохраняя при определенной температуре в закрытых емкостях, исключающих загрязнение воды инородными частицами и микроорганизмами. На пирогенность вода проверяется ежеквартально, бактериологический анализ осуществляется не реже двух раз в квартал.
3
Расчеты проводятся до изготовления р-ра. |
Лицевая сторона ППК выписывается после |
|
Оборотная сторона ППК |
изготовления раствора. |
|
Номинальный объем раствора = 100 мл |
|
Лицевая сторона ППК |
Объем заполнения 102 мл |
Дата |
ППК к рецепту № 1 |
Все расчеты проводят в соответствии с прописью, |
Aquae pro injectionibus ad 102 ml (101 ml) |
|
учитывая объем заполнения |
Dibazoli 2,04 |
|
Дибазол |
Solutionis Acidi hydrochlorici 0,1 М – 1 ml |
|
20,0 – 1000 мл |
(gtt XXХX) |
|
Х – 102 мл Х = 2,04 |
Номинальный объем 100 ml |
|
Раствор кислоты хлороводородной 0,1 М |
Объем раствора во флаконе 102 ml |
|
10 мл – 1000 мл |
Изготовленный объем |
|
Х – 102 мл Х = 1,02 мл≈1 мл |
Подписи: |
|
0,1 мл - 4 кап |
Изготовил _________ |
|
1 мл - Х кап |
Проверил __________ |
|
Х = (1 х 4) : 0,1 = 40 кап |
|
|
V H2O = 102 мл – 1 мл = 101 мл |
|
|
|
|
|
Технология изготовления (с указанием названия стадий)
1. Растворение В стерильной подставке растворяют 2,04 дибазола в 3/4 объема горячей воды для инъекций, после охлаждения
добавляют 0,1 М кислоту хлороводородную 40 капель (1 мл), перемешивают и доводят водой для инъекций до нужного объема.
2. Фильтрование После полного химического контроля раствор фильтруют через стерильный комбинированный фильтр (складчатый
бумажный фильтр с подложенным тампоном длинноволокнистой стерильной ваты), промытый стерильной водой для инъекций или через стеклянный фильтр № 3 или 4.
3. Упаковка с укупоркой Флакон с раствором укупоривают резиновой пробкой и проверяют на отсутствие механических включений. В случае
отсутствия мех. включений обкатывают металлическим колпачком. 4. Подготовка к стерилизации
Укупоренный флакон обвязывают смоченной пергаментной бумагой, на “язычке” которой указывают № рецепта, состав прописи, режим стерилизации, подпись изготовившего, дату.
5. Стерилизация (не позднее 3 часов с момента изготовления раствора)
Насыщенным паром под давлением (120 0С) – 8 мин (объем до 100 мл). Проверяют на отсутствие механических включений.
6. Оформление (маркировка)
Основная этикетка «Стерильно» с указанием № аптеки, № рецепта, Ф.И.О. пациента, состава прописи, № анализа, способа применения, даты, цены. Предупредительные надписи «Хранить в прохладном месте», «Беречь от детей», отдельный рецептурный номер.
Теоретическая основа технологического процесса и обоснование его стадий
1.Растворы для инъекций лекарственных средств, относящихся к группе солей слабых оснований и сильных кислот готовят, используя в качестве стабилизатора кислоту хлороводородную – 0,1 М. Механизм стабилизации – сдвиг значения рН раствора в сторону образования недиссоциированного продукта. Это создает условия, препятствующие гидролизу, омылению сложных эфиров, окислению фенольных и альдегидных групп.
2.Инъекционный раствор дибазола готовят в асептических условиях, чтобы максимально сократить попадание в раствор микроорганизмов и предупредить его пирогенные свойства.
Контроль на стадиях изготовления
Фиксируют в «Журнале регистрации контроля отдельных стадий изготовления растворов для инъекций и инфузий» –
приказ № 214 от 16.07.97, приложение Д.
1 – ЛВ растворены полностью. Проводят полный химический контроль дибазола и кислоты хлористоводородной (пр. № 214 от 16.07.97, пункт 8.5.1).
2 – контроль на отсутствие механических включений на УК-2.
3 – флакон укупорен герметично (жидкость не подтекает, колпачок не прокручивается вокруг горлышка).
4 – обвязка из пергамента плотно прилегает к колпачку, фиксирована нитками. Надпись на «язычке» выполнена карандашом (водостойкая) и содержит номер рецепта, состав прописи, режим стерилизации, дату, подпись изготовившего.
5 – время и температуру фиксируют в «Журнале регистрации режима стерилизации исходных лекарственных веществ, изготовленных лекарственных средств, вспомогательных материалов, посуды и прочее» - приказ № 214 от 16.07.97, прилож. Е.
Вторичный контроль на механические включения. При серийном изготовлении препаратов – полный химический контроль (только на действующие вещества).
4
6 – основная этикетка и предупредительные надписи соответствуют НД.
Контроль изготовленного препарата
1. Анализ документации Фармацевтическая экспертиза рецепта проведена правильно. Номера препарата, рецепта и ППК соответствуют,
расчеты сделаны правильно, ППК выписан верно. 2. Оформление
Наклеена этикетка «Стерильно» с указанием № аптеки, № рецепта, ФИО пациента, состава прописи, способа применения, даты (число, месяц, год), № анализа, цены. Имеется отдельный рецептурный номер, предупредительные надписи «Хранить в прохладном месте», «Беречь от детей» 3. Упаковка с укупоркой
Укупорка герметична: металлический колпачок не прокручивается и при переворачивании флакона жидкость не подтекает.
4.Органолептический контроль. Раствор прозрачный, механических включений нет.
5.Физический контроль
Объем заполнения флакона соответствует ГФ XI, вып. 2, С. 141, табл. 6. Вывод. Препарат изготовлен удовлетворительно.
Контроль при отпуске
Ф.И.О. пациента и № рецепта на этикетке, рецепте и квитанции соответствуют. Имеется указание о способе приема и предупредительные надписи «Хранить в прохладном месте», «Беречь от детей», отдельный рецептурный номер. Вывод. Препарат может быть отпущен пациенту.
Задание 2. Изготовление раствора для инъекций – соли сильного основания и слабой кислоты
Рецепт № 2 |
|
|
Фармацевтическая экспертиза рецепта |
|
|||||
Rp.: Solutionis Coffeini Natrii benzoatis |
Форма рецептурного бланка приказ № 110 от 12.02.07г.) – N |
|
|||||||
10% 10 ml |
107/у |
|
|
|
|
|
|
||
Sterilisetur! |
Проверка фармацевтической (физико-химической, химической |
||||||||
Da tales doses numero 5. |
и фармакологической) совместимости ингредиентов прописи |
|
|||||||
Signa.По 1 мл под кожу 2 раза в день |
Вывод. ЛВ совместимы, т.к. пропись нормирована Проверка доз |
||||||||
Пропись нормирована – |
списка А и Б, НЕО учетных веществ |
|
|
||||||
пр. № 214 от 16.07.97, прилож. 2, раздел |
Раствор кофеина бензоата натрия 10% |
|
|
||||||
1.1, пропись 28 – |
10,0 |
- |
100 мл |
|
|
|
|
||
Раствор кофеина бензоата натрия 10%, |
Х |
- |
1 мл |
|
Х=0,1 |
|
|
|
|
20%. |
РД = 0,1 мл |
ВРД = 0,4 мл |
|
|
|
||||
Состав прописи: |
СД = 0,1 х 2 = 0,2 |
ВСД = 1,0 |
|
|
|
||||
Кофеина бензоата натрия 100,0; 200,0 |
Вывод. Дозы не завышены. |
|
|
|
|||||
Р-р натрия гидроксида 0,1 М 4 мл |
Учетных веществ нет. |
|
|
|
|||||
Воды для инъекций до 1 л. |
Вывод. Препарат изготавливать можно. |
|
|
||||||
Режим стерилизации: 120 С – 8 мин |
Оформление |
|
основной |
этикетки |
«Стерильно» |
и |
|||
предупредительных надписей |
«Хранить |
в прохладном |
и |
||||||
(объем до 100 мл). |
|||||||||
защищенном от света месте», |
«Беречь от детей» для стадии |
||||||||
Срок годности: 30 суток. |
|||||||||
оформления (маркировки) – МУ от 4.07.97. |
|
|
|||||||
|
|
|
|||||||
Физико-химические свойства лекарственных и вспомогательных веществ
Coffeinum-natrii benzoas (кофеин бензоат натрия) - белый порошок без запаха, слабогорького вкуса. Легко растворим в воде (1:2). Хранение. Список Б. ВРД = 0,4 (под кожу) ВСД = 1,0 (под кожу). Стимулятор центральной нервной системы, кардиотоническое средство. Дополнительные требования, которые предъявляются к чистоте вещества квалификации «годен для инъекций» или «Для стерильных лекарственных форм» это - отсутствие органических примесей. Раствор лекарственного вещества не должен мутнеть или выделять осадок при нагревании в течение 30 мин.
В кислой среде в процессе стерилизации выпадает в осадок слабодиссоциирующая кислота бензойная. Для получения стабильного раствора добавляют 0,1 М раствор натрия гидрооксида.
Solutio Natrii hydroxydi 0,1 M (раствор натрия гидроксида 0,1 М). Используют для регуляции значения рН раствора, изготавливают по мере необходимости (хранению не подлежит). Изготовление раствора см. в ГФ, статья "Реактивы" Aqua pro injectionibus (Вода для инъекций) – см. пример №1
5
Расчеты проводятся до изготовления раствора. |
|
Лицевая сторона ППК выписывается после |
|
Оборотная сторона ППК |
|
изготовления раствора. |
|
Номинальный объем одной дозы препарата 10 мл, |
|
Лицевая сторона ППК |
|
Vраствора в сосуде = 10,5 мл, следовательно, объем |
|
Дата |
|
пяти доз составит – 52,5 мл |
|
ППК к рецепту № 2 |
|
m кофеина натрия бензоата на все дозы = 5,0 |
|
Aquae pro injectionibus 33,3 ml |
|
m кофеина натрия бензоата для объема 52,5 мл = 5,25 |
|
Coffeini Natrii benzoatis (pro inject) 5,0 |
|
Vраствора натрия гидроксида на все дозы (по прописи и |
|
Aquae pro injectionibus 16 ml |
|
практически) - 0,1 моль/л 0,2 мл |
|
Solutionis Natrii hydroxydi 0,1 mol/l 0,2 ml (gtt |
|
V воды для инъекций с учетом прироста объема (КУО= |
|
XXXVI) |
|
0,65 мл/г) и объема стабилизатора = 49 мл |
|
Номинальный объем 10 ml N.5 |
|
52,5 - (0,65 х 5,25 - 0,2) = 49,3 мл (~ 49 мл) |
|
Объем раствора во флаконе 10,5 ml N.5 |
|
0,1 мл (0,1 М NaOH) – 18 капель |
|
Изготовленный объем 52,5 ml |
|
0,2 мл – Х |
|
|
|
Х= 36 капель |
|
Подписи: |
|
|
|
Изготовил _________ |
|
|
|
Расфасовал: по 10,5 мл числом 5 |
|
|
|
Проверил __________ |
|
|
|
Отпустил: _________ |
|
Технология изготовления (с указанием названия стадий)
1. Растворение
В стерильной подставке в 33,3 мл воды для инъекций растворяют 5,0 кофеина-бензоата натрия. Добавляют 36 капель 0,1 М раствора натрия гидроксида.
2. Фильтрование
После полного химического контроля раствор фильтруют через стерильный комбинированный фильтр (складчатый
бумажный фильтр с подложенным тампоном длинноволокнистой стерильной ваты), промытые стерильной водой для
инъекций или через стеклянный фильтр № 3 или 4.
3. Упаковка с укупоркой
Флаконы с раствором укупоривают резиновой пробкой и проверяют на отсутствие механических включений. В случае отсутствия мех. включений обкатывают металлическим колпачком.
4. Подготовка к стерилизации
Укупоренные флаконы обвязывают смоченной пергаментной бумагой, на «язычке» которой указывают: № рецепта,
состав прописи, режим стерилизации, дату изготовления, подпись изготовившего.
5.Стерилизация (не позднее 3 часов с момента изготовления раствора) насыщенным паром под давлением (120 0С) –
8минут (объем до 100 мл). Проверяют на отсутствие механических включений.
6.Оформление (маркировка)
Основная этикетка «Стерильно» с указанием № аптеки, № рецепта, Ф.И.О. пациента, состава прописи, № анализа, способа применения, даты, цены. Предупредительные надписи «Хранить в прохладном и защищенном от света месте», «Беречь от детей», отдельный рецептурный номер.
Теоретическая основа технологического процесса и обоснование его стадий
1.В водных растворах соли сильных оснований и слабых кислот легко гидролизуются, образуя слабощелочную реакцию среды. Это приводит к образованию труднорастворимых соединений, дающих в растворах муть или осадок, что недопустимо в растворах для инъекций. В данном случае, выпадает в осадок слабо диссоциирующая кислота бензойная.
2.Гидролитические процессы усиливаются в кислой среде (рН воды для инъекций 5,0-7,0). Для подавления реакции гидролиза необходимо добавление 0,1 М раствора натрия гидроксида или натрия гидрокарбоната (согласно прописи). В данном случае, добавляют раствор натрия гидроксида (0,1 М).
Контроль на стадиях изготовления
Фиксируют в «Журнале регистрации контроля отдельных стадий изготовления растворов для инъекций и инфузий» –
приказ № 214 от 16.07.97, приложение Д.
1 – ЛВ растворены полностью. Проводят полный химический контроль кофеина-бензоата натрия и натрия гидроксида (пр. № 214 от 16.07.97, пункт 8.5.1).
2 – контроль на отсутствие механических включений на УК-2.
3 – флакон укупорен герметично (жидкость не подтекает, колпачок не прокручивается вокруг горлышка).
4 – обвязка из пергамента плотно прилегает к колпачку, фиксирована нитками. Надпись на «язычке» выполнена карандашом (водостойкая) и содержит номер рецепта, состав прописи, режим стерилизации, дату, подпись изготовившего.
5 – время и температуру фиксируют в «Журнале регистрации режима стерилизации исходных лекарственных веществ, изготовленных лекарственных средств, вспомогательных материалов, посуды и прочее» - приказ № 214 от
6
16.07.97, прилож. Е.
Вторичный контроль на механические включения. При серийном изготовлении препаратов – полный химический контроль (только на действующие вещества).
6 – основная этикетка и предупредительные надписи соответствуют НД.
Контроль изготовленного препарата
1. Анализ документации.
Фармацевтическая экспертиза рецепта проведена правильно. Номера препарата, рецепта и ППК соответствуют, расчеты сделаны правильно, ППК выписан верно.
2. Оформление.
Наклеена этикетка «Стерильно» с указанием № аптеки, № рецепта, ФИО пациента, состава прописи, способа применения, даты (число, месяц, год), № анализа, цены. Имеется отдельный рецептурный номер, предупредительные надписи «Хранить в прохладном и защищенном от света месте», «Беречь от детей».
3.Упаковка с укупоркой. Укупорка герметична: металлический колпачок не прокручивается и при переворачивании флакона жидкость не подтекает.
4.Органолептический контроль. Раствор прозрачный, механических включений нет.
5.Физический контроль. Объем заполнения флакона соответствует ГФ XI, вып. 2, С. 141, табл. 6. Вывод. Препарат изготовлен удовлетворительно.
Контроль при отпуске
Ф.И.О. пациента и № рецепта на этикетке, рецепте и квитанции соответствуют. Имеется указание о способе приема и предупредительные надписи «Хранить в прохладном и защищенном от света месте», «Беречь от детей», отдельный рецептурный номер.
Вывод. Препарат может быть отпущен пациенту.
Задание 3. Изготовление раствора для инъекций легкоокисляющихся лекарственных веществ
Рецепт № 3 |
|
Фармацевтическая экспертиза рецепта |
|
||
Rp.:Solutionis Glucosi 5% - 10 ml |
Форма рецептурного бланка приказ № 110 от 12.02.07г.) – N 107/у |
|
|||
Sterilisetur! |
Проверка фармацевтической (физико-химической, химической и |
|
|||
Da tales doses numero 20 |
фармакологической) совместимости ингредиентов прописи. |
|
|||
Signa. Для внутривенного введения |
Вывод. ЛВ совместимы, т.к. пропись нормирована. |
|
|||
Пропись нормирована – |
Проверка доз лекарственных веществ списка А и Б, НЕО учетных |
|
|||
пр. № 214 от 16.07.97, прил. 2, раздел |
веществ |
|
|
|
|
1.1, пропись 7 – |
Не проводим, т.к. нет веществ, приравненных к ним |
|
|||
Раствор глюкозы 5%, 10%, 20%, 25% |
Вывод: ЛП готовить можно. |
|
|
|
|
Состав прописи: |
Вывод. Лекарственный препарат изготавливать можно. |
|
|||
Глюкоза (в пересчете на безводную) |
Оформление |
основной |
этикетки |
«Стерильно» |
и |
50,0; 10,0; 200,0; 250,0 |
предупредительных надписей «Хранить в прохладном и |
||||
Р-р кислоты хлороводородной |
защищенном от света месте», «Беречь от детей» для стадии |
||||
0,1 М до pH 3,0-4,1 |
маркировки – МУ от 4.07.97. |
|
|
|
|
Натрия хлорида 0,26 |
|
|
|
|
|
Воды для инъекций до 1 л. |
|
|
|
|
|
Режим стерилизации: 120ºС – |
|
|
|
|
|
8 мин (объем до 100 мл). |
|
|
|
|
|
Срок годности: 30 суток. |
|
|
|
|
|
Физико-химические свойства лекарственных и вспомогательных веществ
Glucosum (глюкоза) - бесцветные кристаллы или белый мелкокристаллический порошок без запаха, сладковатого вкуса. Растворим в воде (1:1,5). Дополнительное требование к лекарственному веществу "Глюкоза для инъекций" - апирогенность. Определенная навеска каждой партии синтезируемой глюкозы в виде 5% раствора должна выдерживать испытание на пирогенность, тест-доза 10 мл на 1 кг массы животного статья ГФ "Испытание на пирогенность". Хранят глюкозу в стерильной, хорошо укупоренной таре. В защищенном от света месте.
Для медицинских целей применяют: изотонический раствор (5%) и гипертонические растворы (10 – 40 %) растворы глюкозы. Изотонический раствор применяют для пополнения организма жидкостью и в качестве источника энергии для осуществления необходимых функций организма (раствор для парэнтерального питания).
При изготовлении раствора глюкозы на стадии термической стерилизации происходит деструкция лекарственного вещества, первым этапом которого считают раскрытие цикла и образование ациклической молекулы. Далее – дегидратация, окисление, изомеризация. Раствор глюкозы приобретает желтую или даже бурую окраску. В процессе термодеструкции в растворе накапливаются оксикислоты (молочная, гликолевая, уксусная) и альдегид 5- оксиметилфурфурол (5-ОМФ). Содержание данной примеси нормируется величиной оптической плотности раствора не более 0,250 в УФ области спектра при длине волны 284 нм.
Натрия хлорид стабилизатора Вейбеля способствует циклизации глюкозы, блокирует альдегидную группу в ациклической активной форме и препятствует окислению глюкозы.
7

В кислой среде, поддерживаемой хлористоводородной кислотой, замедляются процессы окисления глюкозы. Установлено, что при значении рН раствора глюкозы 3,0-4,1 количество 5-ОМФ минимально. Важно также уменьшить содержание кислорода в растворителе, заранее прокипятив воду для инъекций.
Растворы глюкозы имеют очень кислую реакцию среды (рН 3,0-4,0), поэтому 5 % растворы глюкозы, применяемые в гинекологии для внутриматочных введений, изготовляют без стабилизатора.
Solutio Acidi hydrochlorici 0,1 М (раствор кислоты хлороводородной 0,1 М) Изготовляют из кислоты хлористоводородной разведенной. Используют для регуляции рН раствора. Изготавливают по мере необходимости, т.к. хранению не подлежит.
Natrii chloridum (натрия хлорид) - белые кубические кристаллы или белый кристаллический порошок соленого вкуса, без запаха. Растворим в воде (1:3). Значение рН 0,9 % раствора 5,0-7,0. Дополнительное требование к лекарственному веществу "Натрия хлорид для инъекций" – апирогенность. Предварительная депирогенизация для разрушения пирогенных веществ - порошок нагревают в открытых стеклянных или фарфоровых емкостях в воздушных стерилизаторах при 180 °С 2 часа при толщине слоя порошка не более 6 - 7 см, стерильный порошок используют в течение 24 часов.
Solutio Wejbeli (раствор Вейбеля). Cостав: натрия хлорида - 5,2, кислоты хлористоводородной разведенной - 4,4 мл, воды для инъекций до 1 л. Хранению не подлежит.
Aqua pro injectionibus (вода для инъекций) – см. пример №1
Расчеты проводятся до изготовления раствора. |
|
Лицевая сторона ППК выписывается после |
|
|||||||||||
|
|
Оборотная сторона ППК |
|
|
изготовления раствора. |
|
||||||||
Номинальный объем одной дозы = 10 мл; 20 доз – |
|
|
Лицевая сторона ППК |
|
||||||||||
200 мл; |
|
|
|
Дата |
|
|||||||||
Vраствора во флаконе = 10,5 мл, т.е. объем 20 доз составит |
|
ППК к рецепту № 3 (А) |
|
|||||||||||
210 мл |
|
|
|
|
Aquae pro injectionibus 134 ml |
|
||||||||
Глюкоза безводная |
|
|
|
Glucosi hydrici (10%) 11,66 |
|
|||||||||
50,0 |
- |
1000 мл |
|
|
|
Natrii chloridi 0,05 |
|
|||||||
Х |
- |
210 мл |
|
|
|
Solutionis Acidi hydrochlorici |
|
|||||||
Х1 безводная глюкоза на все дозы = 10,5 |
|
|
0,1 моль/л 1 ml |
|
||||||||||
Глюкоза, содержащая 10% кристаллизационной |
|
Aquae pro injectionibus 67 ml |
|
|||||||||||
воды (Х2). |
|
|
|
Номинальный объем (Vн) одной дозы 10 ml |
|
|||||||||
Х2 = (а х 100)/(100-b) |
|
|
|
Общий номинальный объем 200 ml |
|
|||||||||
Х2 = (10,5 х 100)/(100-10) = 11,66 г |
|
|
Изготовлено 210 мл |
|
||||||||||
С max (глюкозы) = N/КУО = 1/0,69 = 1,45% < 5%. |
|
Расфасовал по 10,5 мл числом 20: |
|
|||||||||||
Прирост объема при растворении глюкозы водной - |
|
Проверил: |
|
|||||||||||
8 мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆V = 11,66 х 0,69 = 8,04 мл ≈ 8 мл |
|
|
Дата |
|
||||||||||
Объем воды для инъекций |
|
|
|
ППК № к рецепту № 3 (Б) |
|
|||||||||
Vводы для инъекций = 100 – (5+3,84) = 91,2мл |
|
|
Aquae pro injectionibus 128 ml |
|
||||||||||
Количество стабилизатора для 200 мл (210 мл) |
|
Glucosi hydrici (10%) 11,66 |
|
|||||||||||
раствора: m NaCl = 0,05, Vр-ра кислоты хлористоводородной 0,1 |
|
Solutionis Vejbeli 10,5 ml |
|
|||||||||||
моль/л = 1 мл |
|
|
|
Aquae pro injectionibus 63,5 ml |
|
|||||||||
Можно |
взять заранее |
изготовленный |
раствор |
|
|
|
|
|
|
|
|
|
|
|
Номинальный объем (Vн) одной дозы 10 ml |
|
|||||||||||||
Вейбеля. Его берут 5%, от объема раствора, т.е.10 |
|
|
||||||||||||
|
Общий номинальный объем 200 ml |
|
||||||||||||
мл |
для объема 200 |
мл или 10,5 |
мл для |
|
|
|||||||||
|
Изготовлено 210 мл |
|
||||||||||||
изготавливаемого объема 210 мл. |
|
|
|
|||||||||||
|
|
Изготовил: |
|
|
|
|
|
|
||||||
Vводы для инъекций = 201 мл или 191,5 мл |
|
|
|
|
|
|
|
|
||||||
|
|
Расфасовал по 10,5 мл числом 20: |
|
|||||||||||
210 мл - (1+8) = 201 мл |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
Проверил: |
|
||||||||||
210 мл - (10,5 + 8) = 191,5 мл |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Технология по стадиям 1. Растворение
В стерильной подставке в 128 мл воды для инъекций растворяют 11,66 глюкозы (влажность 10%), добавляют 10,5 мл асептически изготовленного стабилизатора Вейбеля.
2. Фильтрование
После полного химического контроля раствор фильтруют через стерильный комбинированный фильтр (складчатый
бумажный фильтр с подложенным тампоном длинноволокнистой стерильной ваты), промытый стерильной водой для
инъекций или через стеклянный фильтр № 3 или 4.
3. Упаковка с укупоркой
Флаконы с раствором укупоривают резиновой пробкой, проверяют на отсутствие механических включений. В случае отсутствия мех. включений обкатывают металлическим колпачком.
4. Подготовка к стерилизации
Укупоренные флаконы обвязывают смоченной пергаментной бумагой, на «язычке» которой указывают: № рецепта,
8
состав прописи, режим стерилизации, дату изготовления, подпись изготовившего.
5.Стерилизация (не позднее 3 часов с момента изготовления раствора) насыщенным паром под давлением (120 0С) –
8минут (объем до 100 мл).
6.Оформление (маркировка)
Основная этикетка «Стерильно» с указанием № аптеки, № рецепта, Ф.И.О. пациента, состава прописи, № анализа, способа применения, даты, цены. Предупредительные надписи «Хранить в прохладном и защищенном от света месте», «Беречь от детей», отдельный рецептурный номер.
Теоретическая основа технологического процесса и обоснование его стадий
1.Глюкоза неустойчива как в щелочной (образуются оксикислоты, оксиметилфурфурол), так и кислой (появляются D-глюконовая кислота, ее лактоны и продукты их окисления) среде.
2.Минимальная деструкция глюкозы наблюдается при рН 3,0-4,0, которые создают добавлением 0,1М раствора кислоты хлористоводородной (около 5 мл на 1 л раствора). Натрия хлорид в сочетании с кислотой
хлористоводородной создает необходимую буферную систему 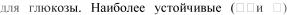 пиранозные формы глюкозы.
пиранозные формы глюкозы.
3.При экстемпоральном изготовлении растворов глюкозы (до 1 л) используют стабилизатор – раствор Вейбеля в количестве 5% от объема независимо от концентрации раствора.
4.Глюкоза должна быть апирогенной, т.к. ее депирогенизация невозможна (в отличие от натрия хлорида).
5.Пожелтение раствора глюкозы связаны с образованием 5-оксиметилфурфурола (обладает нефрогепатотоксическим действием).
6.Для предотвращения деструкции глюкозы разгрузку стерилизатора проводят не дожидаясь полного охлаждения флаконов.
Контроль на стадиях изготовления
Фиксируют в «Журнале регистрации контроля отдельных стадий изготовления растворов для инъекций и инфузий» –
приказ № 214 от 16.07.97, приложение Д.
1 – ЛВ растворены полностью. Проводят полный химический контроль глюкозы, натрия хлорида и кислоты хлористоводородной (пр. № 214 от 16.07.97, пункт 8.5.1).
2 – контроль на отсутствие механических включений на УК-2.
3 – флакон укупорен герметично (жидкость не подтекает, колпачок не прокручивается вокруг горлышка).
4 – обвязка из пергамента плотно прилегает к колпачку, фиксирована нитками. Надпись на «язычке» выполнена карандашом (водостойкая) и содержит номер рецепта, состав прописи, режим стерилизации, дату, подпись изготовившего.
5 – время и температуру фиксируют в «Журнале регистрации режима стерилизации исходных лекарственных веществ, изготовленных лекарственных средств, вспомогательных материалов, посуды и прочее» - приказ № 214 от 16.07.97, прилож. Е.
Вторичный контроль на механические включения.
При серийном изготовлении препаратов – полный химический контроль (только на действующие вещества). 6 – основная этикетка и предупредительные надписи соответствуют НД.
Контроль изготовленного препарата
1. Анализ документации.
Фармацевтическая экспертиза рецепта проведена правильно. Номера препарата, рецепта и ППК соответствуют, расчеты сделаны правильно, ППК выписан верно.
2. Оформление.
Наклеена этикетка «Стерильно» с указанием № аптеки, № рецепта, ФИО пациента, состава прописи, способа применения, даты (число, месяц, год), № анализа, цены. Имеется отдельный рецептурный номер, предупредительные надписи «Хранить в прохладном и защищенном от света месте», «Беречь от детей».
3. Упаковка с укупоркой.
Укупорка герметична: металлический колпачок не прокручивается и при переворачивании флакона жидкость не подтекает.
4.Органолептический контроль. Раствор прозрачный, механических включений нет.
5.Физический контроль. Объем заполнения флакона соответствует ГФ XI, вып. 2, С. 141, табл. 6. Вывод. Препарат изготовлен удовлетворительно.
Контроль при отпуске
Ф.И.О. пациента и № рецепта на этикетке, рецепте и квитанции соответствуют. Имеется указание о способе приема и предупредительные надписи «Хранить в прохладном и защищенном от света месте», «Беречь от детей», отдельный рецептурный номер.
Вывод. Препарат может быть отпущен пациенту.
Задание 4. Изготовление раствора для инъекций «Хлосоль»
9
Рецепт № 4 |
Фармацевтическая экспертиза рецепта |
|
|||||
Rp.: Solutionis «Chlosolum» 500 ml |
Форма рецептурного бланка приказ № 110 от 12.02.07г.) – N |
||||||
Sterilisetur! |
107/у |
|
|
|
|
|
|
Da. Signa. Для в/в введения |
Проверка |
фармацевтической |
(физико-химической, |
||||
|
химической |
и |
фармакологической) |
совместимости |
|||
Пропись нормирована – |
ингредиентов прописи. |
|
|
|
|
||
пр. № 214 от 16.07.97, прил. 2, раздел 1.1, |
Вывод. ЛВ совместимы, т.к. пропись нормирована. |
|
|||||
пропись 55 – |
Проверка доз лекарственных веществ списка А и Б, НЕО |
||||||
Раствор «Хлосоль» |
учетных веществ |
|
|
|
|
|
|
|
Не проводим, т.к. нет веществ, приравненных к ним |
|
|||||
Состав прописи: |
Вывод: ЛП готовить можно. |
|
|
|
|
||
Калия хлорида 1,5 |
Вывод. ЛП изготавливать можно. |
|
|
|
|||
Натрия хлорида 4,75 |
Оформление |
основной |
этикетки |
|
«Стерильно» |
и |
|
Натрия ацетата 3,5 |
предупредительных надписей «Хранить в прохладном месте», |
||||||
Воды для инъекций до 1 л. |
«Беречь от детей» для стадии маркировки – МУ от 4.07.97. |
|
|||||
Режим стерилизации 1200С – 8 мин (объем |
|
|
|
|
|
|
|
до 100 мл). |
|
|
|
|
|
|
|
Физико-химические свойства лекарственных и вспомогательных веществ
Kalii chloridum (калия хлорид) - бесцветные кристаллы или белый кристаллический порошок без запаха, соленого вкуса. Растворим в воде (1:3).Хранение. В сухом месте. Средство, регулирующее метаболические процессы. Используют сорт «х.ч.»
Natrii acetas (натрия ацетат) - бесцветный кристаллический порошок без запаха или со слабым запахом уксусной кислоты, солоноватого вкуса. Очень легко растворим в воде (2,5:1). Хранение. В хорошо укупоренной таре, предохраняющей от действия света. Используют сорт «ч.д.а.»
Natrii chloridum (натрия хлорид) – см. пример №3
Aqua pro injectionibus (вода для инъекций) – см. пример №1
Расчеты проводятся до изготовления раствора. |
Лицевая сторона ППК выписывается после |
||
Оборотная сторона ППК |
изготовления раствора. |
||
Оборотная сторона ППК |
Лицевая сторона ППК |
||
Калия хлорид |
|
Дата |
|
1,5 1000 мл |
|
ППК к рецепту № 4 |
|
Х 500 мл |
Х = 0,75 |
Aquae pro injectionibus 500 ml |
|
Натрия хлорид |
|
Kalii chloridi 0,75 |
|
4,75 1000 мл |
Natrii chloridi 2,37 |
||
Х 500 мл |
Х = 2,37 |
Natrii acetates 1,75 |
|
Натрия ацетат |
|
Vобщ. = 500 ml |
|
|
Изготовленный объем = |
||
3,5 1000 мл |
|
||
|
Подписи: |
||
Х 500 мл |
Х = 1,75 |
||
Изготовил _________ |
|||
% твердых веществ |
|||
Проверил __________ |
|||
500 мл 4,87 |
|
||
|
|
||
100 мл Х |
|
|
|
Х = 0,97% < 3%. |
|
||
Vводы для инъекций |
= 500 мл |
|
|
Технология по стадиям 1. Растворение
В стерильной подставке в 500 мл воды для инъекций растворяют 0,75 калия хлорида, 2,37 натрия хлорида и 1,75 натрия ацетата.
2. Фильтрование
После полного химического контроля раствор фильтруют через промытый комбинированный фильтр (складчатый бумажный фильтр с подложенным тампоном длинноволокнистой стерильной ваты) или через стеклянный фильтр № 3 или 4 в стерильный флакон на 500 мл.
3. Упаковка с укупоркой
Флакон с раствором укупоривают резиновой пробкой и проверяют на отсутствие механических включений, обкатывают металлическим колпачком.
4. Подготовка к стерилизации
Укупоренный флакон обвязывают смоченной пергаментной бумагой, на «язычке» которой указывают: № рецепта,
состав прописи, режим стерилизации, дату изготовления, подпись изготовившего.
5.Стерилизация (не позднее 3 часов с момента изготовления раствора). Насыщенным паром под давлением (120 0С)
– 12 минут (объем от 100 до 500 мл).
6.Оформление (маркировка)
Основная этикетка «Стерильно» с указанием № аптеки, № рецепта, Ф.И.О. пациента, состава прописи, № анализа,
10
