
30 Билет
Гетерогенное равновесие в растворах электролитов. Константа растворимости, растворимость. Условия выпадения и растворения осадков. Закон Гесса. Следствие из закона Гесса. Соединения азота с водородом: аммиак, гидразин, гидроксиламин, азотоводородная кислота. Их получение, строение, свойства.
(1) В насыщенном р-ре сильного малорастворимого электролита устанавливается равновесие между осадком(тв.форма) и ионами электролита. СаСО3 = Са2+(р)+ СО32-(р).
Кр (константа равновесия) =(а(Са2+(р))*а( СО32-(р))/а(СаСО3(т)). Где а(Са2+(р)) и а( СО32-(р) – активные концентрации ионов Са2+ и СО32-.т.к. а(СаСО3(т)) – постоянна, т.е. произведение Кр* а(СаСО3(т)) при данной температуре, величина постоянная. Ksр = а(Са2+(р))*а( СО32-(р)). Произведение растворимости –постоянная величина при постоянной температуре, характеризующая растворимость труднорастворимого электролита.
Для труднорастворимого электролита АmBn. Ksр(АmBn) = [A]m *[B]n . [A]в степени m *[B] в степени n.
Если в растворе произведение реальных концентраций ионов[A]m и [B]n (больше чем произведение растворимости при данной температуре то выпадет осадок). Чтобы растворить осадок нужно:1) уменьшить в его насыщенном р-ре концентрации соответствующих ионов, за счет вовлечения их в разные комплекс, либо путем изменения кислотности среды.
2)более полное связывание ионов. 3)за счет связывания ионов в слабый электролит. 4)за счет связывания ионов в малорастворимый комплекс.
(2)Закон Гесса —Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. Cледствия: Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции Тепловой эффект химической реакции равен разности сумм теплот образованияпродуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты Если начальное и конечное состояния химической реакции (реакций) совпадают, то ее (их) тепловой эффект равен нулю. Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Для экзотермических реакций эта формула даёт отрицательное значение для ΔH, так как большее значение вычитается из меньшего значения. например: 2H2 + O2 → 2 H2O Эндотерми́ческие реа́кциихимические реакции, сопровождающиеся поглощением теплоты. К эндотермическим реакциям относятся: реакции восстановления металлов из оксидов, электролиза (поглощается электрическая энергия), электролитической диссоциации (например, растворение солей в воде), ионизации, фотосинтеза.
(3) Промышленный синтез аммиака — каталитический процесс, протекающий при высоких давлениях (от 300 до 1000 атм) и температурах (~500°С) в присутствии катализатора (98 % Fe304 + 2% KAIO2): В лаборатории аммиак получают, действуя на соли аммония растворами щелочей: NH4C1 + КОН = NH3 + КС1 + Н20 Молекула аммиака — тригональная пирамида (искаженный тетраэдр) с валентным углом 107,3°, что соответствует л/;3 - г и б р и д и з а ц и и атома азота. Молекула полярна и проявляет электронодонорные свойства. Водородная связь между молекулами аммиака слабее, чем в воде, поэтому вязкость аммиака меньше, а температура плавления ниже, чем воды и аммиак легко сжижается. Жидкий аммиак применяется как неводный нивелирующий растворитель. Цианид водорода и хлорная кислоты в жидком аммиаке являются одинаковыми по силе электролитами. При обычных условиях аммиак — газ с резким запахом, хорошо растворимый в воде. При 20 °С в одном литре воды растворяется до 700 л газообразного аммиака. Химические свойства аммиака характеризуют:NH3+HCl=NH4Cl(присоединение) 2Na+2NH3=2NaNH2(амид)+H2(замещение) В окислительно-восстановительных реакциях амиды, имиды и нитриды проявляют восстановительные свойства, окисляясь до азота. В ОВР аммиак - восстановитель: 2NH3 + 2КМп04 = N2 + 2Мп02 + 2КОН + 2Н20 Соли аммония термически неустойчивы и разлагаются при нагревании. Гидразин, N2H4, получают окислением водного раствора аммиака гипохлоритом натрия в присутствии желатина:2NH3 + NaCIO = N2H4 + NaCl + H20 Гидразин — бесцветная, дымящая на воздухе жидкость. Гидразин— слабое двухкислотное основание , с кислотами образует соли гидразиния, например, N2H4 H2S04— сульфат гидразиния, с водой — гидразин-гидрат N2H4 Н20. Гидразин— слабое двухкислотное основание , с кислотами образует соли гидразиния, например, N2H4 H2S04— сульфат гидразиния, с водой — гидразин-гидрат N2H4 Н20. Степень окисления азота в гидразине -II. В ОВР гидразин — сильный восстановитель: 2CuS04+N2H4 H2S04=2Cu+N2+3H2S04 В реакциях с сильными восстановителями гидразин может проявлять окислительные свойства:N2H4+Н2=2NH3 Гидроксиламин, NH2OH, получают электролитическим восстановлением азотной кислоты на свинцовом катоде:HN03+6«Н»=NH2OH+2Н20 Гидроксиламин — кристаллическое вещество, т. пл. 33 °С. Гидроксиламин — слабое основание. Степень окисления азота в гидроксиламине -I. В щелочной среде гидроксиламин хороший восстановитель:2NH2OH+I2+2КОН = N2+2KI + 4Н20, а в кислой может быть и окислителем:4FeS04 + 2NH2OH + 3H2S04 = 2Fe2(S04)3 + (NH4)2S04 + 2Н20 Азид водорода получают окислением гидразина азотистой кислотой: N2H4 + HN02 = HN3 + 2Н20 HN3 — бесцветная жидкость с резким запахом, т. кип. 37 °С, токсичен, распадается со взрывом. Линейное строение азид-иона N3 по методу валентных связей объясняется следующим образом. Центральный атом азота (N ) имеет 4 неспаренных электрона. Две его sр-гибридные орбитали образуют g-связи, а две р-орбитали — П-связи с атомами азота. В водном растворе азид водорода — слабая кислота. В водном растворе медленно разлагается: HN3 + Н20 = N2 + NH2OH В ОВР проявляет окислительные свойства подобно азотной кислоте: HN3 + 2HI = I2 + NH3 + N2 При взаимодействии HN3 с металлами образуются соли — азиды, азот и аммиак: 3HN3 + Mg = Mg(N3)2 + N2 + NH3 Азиды тяжелых металлов (РЬ и др.), как и сама кислота, — взрывчатые вещества.
(4) C(H+)=sqrt(Ka*Cm)=10-5 pH=-lgC[H+]=4
31 билет
Квантово-механическая модель строения атомов. Основные правила и принципы, определяющие порядок заполнения электронных орбиталей. Отношение неметаллов к растворам кислот и щелочей. Железо. Строение атомов, степени окисления. Оксиды, гидроксиды, соли, комплексные соединения. Биологическая роль железа
|
Тип орбитали |
1S |
2s |
2p |
3S |
3p |
3d |
4S |
4p |
|
n+l |
1 |
2 |
3 |
3 |
4 |
5 |
4 |
5 |
|
n |
1 |
2 |
2 |
3 |
3 |
3 |
4 |
4 |
|
l |
0 |
0 |
1 |
0 |
1 |
2 |
0 |
1 |
1S › 2S › 2p › 3S › 3p › 4S › 3d › 4p
Принцип Паули:
В атоме не
может быть двух e,
обл.одинаковым набором всех 4-ех квантовых
чисел.(Это означает след., что если есть
два e
с одинаковым квантовым числом, то хоть
чем то они отличаются) Правило
Хунда:
Суммарный спинe
должен быть максимальным при распределении
e
в электронной оболочке. + ½ +½ +½
Некоторые отклонения в эл. конф.
элементов, связаны с правилом e
или с электронной ямой. Такие провалы
имеют место у
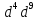 элементов и
элементов и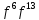 элементов.Cu
элементов.Cu
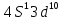 Au
6
Au
6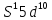 Cr
Cr
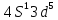 Современное деление элементов наs,p,d,f
осуществляется на основе критерия:
какой уровень заполняется последним.
S-
эл.: IA,IIA
подргуппы ,H,He
P-эл.:
IIIA-VIIIA
групп D-эл.:IB-VIIIB
гр.,нач. С 4 периода. f-эл.:
лантоноиды, актиноиды, кот. вынесены
за пределы табл.
Современное деление элементов наs,p,d,f
осуществляется на основе критерия:
какой уровень заполняется последним.
S-
эл.: IA,IIA
подргуппы ,H,He
P-эл.:
IIIA-VIIIA
групп D-эл.:IB-VIIIB
гр.,нач. С 4 периода. f-эл.:
лантоноиды, актиноиды, кот. вынесены
за пределы табл.
(2) Бор – B+HNO3->H3BO3+3NO2 К растворам щелочей бор устойчив, но в присутствии окислителей реагирует с образованием метаборатов: 2B+2KOH+3NaClO->2KBO2+3NaCl+H2O Кремний В конц растворах щелочей растворяется с образованием силикатов Si+2NaOH+H2O->Na2SiO3+2H2 Медленно растворяется в HF Si+6HF->H2SiF6+2H2; 3Si+18HF+4HNO3->3H2[SiF6]+4NO+8H2O Фосфор – образование фосфина 8P+3Ba(OH)2+6H2O->3Ba(H2PO2)2+2PH3 С водой сера не реагирует, в растворах щелочей диспропорционирует: 3S + 6NaOH = 2Na2S + Na2S03 + 3H20 Концентрированной азотной кислотой сера окисляется до степени окисления VI: S + 6HNO3 = H2S04 + 6N02 + 2Н20 По химическим свойствам селен и теллур являются аналогами серы. Они устойчивы на воздухе, легко взаимодействуют с галогенами, при нагревании образуют с кислородом диоксиды, Э02, со многими металлами — селениды и теллуриды. С водородом, как и сера, реагирует только селен. В отличие от серы селен и теллур окисляются концентрированной азотной кислотой только до степени окисления IV: 3Se + 4HN03 + Н20 = 3H2Se03 + 4NO ЗТе + 4HN03 = ЗТе02 + 4NO + 2Н20 Галоген I2 3I2+10HNO3 >6HIO3+10NO+2H2O
(3) Железо металл средней активности. Во влажном воздухе подвергается коррозии: 4Fe + 2Н20 + 302 = 2Fe203 Н20(FeO(OH))2 Образующаяся ржавчина не защищает железо от дальнейшего разрушения. В очень мелкораздробленном состоянии железо обладает пирофорными свойствами, то есть воспламеняются на воздухе при обычной температуре. Железо, вытесняет водород из разбавленных кислот: Э + НС1 = ЭС12 + н2, но не реагируют с растворами щелочей. В обычных условиях концентрированные серная и азотная кислоты пассивируют железо, а при нагревании окисляют до солей железа(Ш): Fe + 6HNO3 = Fe(N03)3 + 3N02 + 3H20. Очень разбавленная HNO3 (w < 5%) окисляет железо до степени окисления II: 4Fe + IOHNO3 = 4Fe(N03)2 +NH4NO3 + 3H20 При взаимодействии железа с кислородом при комнатной температуре образуется красно-бурый Fe203, при нагревании до 400 °С — черный Feз04, а выше575 °С —черный FeO. Гидроксиды железа— белый Fe(OH)2 и бурый Fe(OH)3— получают действием щелочей на соответствующие соли. Гидроксид железа(П) очень легко окисляется кислородом воздуха: 4Fe(OH)2 + 02 + 2Н20 = 4Fe(OH)3, Поэтому Fe(OH)2, загрязненный продуктами окисления, имеет грязно-зеленый цвет. Чистый Fe(OH)2 может быть получен в отсутствие окислителей (кислорода воздуха и др.). Оксид и гидроксид железа(П) проявляют основные свойства. Оксид и гидроксид железа(Ш) амфотерны с преобладанием основных свойств. Fe(OH)3 и Fe203 растворяются в кислотах с образованием солей катионного типа. Анионные соли (ферриты) получаются только при сплавлении этих соединений со щелочами или содой: Fe203 + Na2C03 = 2NaFe02 + С02 , Гидроксид железа(П) окисляется кислородом воздуха в момент получения, Fe(OH)3 + ЗНС1 = FeCl3 + 3H20 Следует отметить, что соли катионного типа для Fe(III) устойчивы. В степени окисления VI железо образует соли неизвестной в свободном состоянии железной кислоты — ферраты, которые можно получить окислением соединений железа(Ш) в сильнощелочной среде: 2Fe(OH)3 + ЮКОН + 3Br2 = 2K2Fe04 + 6КВг + 8Н20 или при сплавлении с окислителями оксидов: Fe203 + ЗВа02 = 2BaFe04 + ВаО. Ферраты — сильные окислители в нейтральной и особенно в кислой средах: Ферраты окисляют аммиак до свободного азота 2K2Fe04 + 2NH3 + 2Н20 = 4КОН +N2 + 2Fe(OH)3, а при pH <10 окисляют воду с выделением кислорода: 4K2Fe04 + 10Н20 = 8КОН + 4Fe(OH)3 + 302 Для железа известно большое число комплексных соединений. С анионами слабых кислот железо образует устойчивые комплексные соединения, например гексацианидоферрат(П) калия K4[Fe(CN)6], называемый «желтой кровяной солью», гексацианидоферрат(Ш) калия K3[Fe(CN)e] («красная кровяная соль»), K3[FeF6] и другие. Ион [Fe(CN)e]4 диамагнитен, прочен, устойчив по отношению к воздуху, растворам кислот и щелочей. «Желтая кровяная соль» образует с ионами железа(Ш) осадок интенсивного синего цвета («берлинская лазурь»): FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]^ + ЗКС1. Ион [Fe(CN)e]3 парамагнитен, устойчив токсичен. «Красная кровяная соль» — сильный окислитель, особенно в щелочной среде: W + 6K3[Fe(CN)6] + 8КОН = 6K4[Fe(CN)6] + K2W04 + 4Н20. С солями железа(П) K3[Fe(CN)e] образует осадок синего цвета («турнбулева синь»): FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6]^ + 2КС1 Реакции образования «берлинской лазури» и «турнбулевой сини» используются в аналитической практике как качественные реакции на ионы железа(Ш) и (II). Железо образует комплексные соединения, например соль Мора (NH4)2Fe(S04)2 6Н20, квасцы общей формулы MeFe(S04)2 12Н20, которые в растворе полностью ионизированы.
(4) 2HIO3 + 10HI = 6I2 + 6H2O 2IO3- + 12H+ + 10e = I2 + 6H2O 2I- - 2e = I2
C(HI) = p*1000*w/M= 0,663 n(HI)=C*V= 0,0265 n1/z(HI)=n(HI)*z=0,0265*1=0,0265 т.к на HI идет 1I
n1/z (HIO3) = 0,0265 n(HIO3)=n1/z(HIO3)/z = 0,0053
C(HIO3) = р*1000*w/M= 0,29 V(HIO3)=n/C= 18,276 мл
