
ЛИКБЕЗ ДЛЯ ЗАОЧНИКОВ
.doc-
Каково строение атома водорода? Какие частицы образуются: а) при отрыве одного электрона от атома водорода; б) при присоединении одного электрона к атому водорода? Какая из образующихся частиц имеет вакантную орбиталь, а какая – неподеленную электронную пару?
Ответ:
Любой атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, окружающих ядро. Положительный заряд ядра обусловлен наличием в нем протонов, заряд каждого протона +1. Атом в целом электронейтрален, поскольку положительный заряд ядра компенсирован отрицательным зарядом электронов (заряд каждого электрона равен ‑1).
Порядковый номер атома в Таблице Менделеева численно равен количеству протонов в ядре атома и количеству электронов, окружающих ядро атома. Это и обуславливает электронейтральность атома.
К примеру, водород – первый элемент таблицы Менделеева. Его ядро содержит один протон, а вокруг ядра движется один электрон. В атоме углерода (элемент № 6) заряд ядра равен +6 (т.к. содержит шесть протонов), причем каждый атом углерода содержит шесть электронов, компенсирующих положительный заряд ядра.
Электроны в атомах располагаются на орбиталях. Так, единственный электрон атома водорода располагается на так называемой 1s-орбитали. Поскольку электрон на орбитале один, то говорят, что атом водорода содержит неспаренный электрон. Электронная конфигурация атома водорода 1s1 (указывается орбиталь и количество электронов на ней).
Если от атома водорода оторвать отрицательно заряженный электрон, то останется положительно заряженная частица – ион водорода H+ или, как ее чаще называют, протон (так как мы оторвали единственный электрон, который был в атоме водорода и после этого от атома водорода осталось только его ядро, представляющее собой один протон). Протон имеет вакантную (пустую) 1s-орбиталь, на которой раньше (в атоме водорода) располагался электрон.
На одной орбитали может разместиться не более двух электронов. Поэтому, если электронейтральный атом водорода присоединяет отрицательно заряженный электрон, то образуется отрицательно заряженная частица (заряд ‑1) – так называемый гидрид‑анион, обозначаемый Н‑. Эта частица имеет отрицательный заряд, так как содержит один протон (ядро атома водорода) и два отрицательно заряженных электрона. Эти электроны располагаются на 1s-орбитали и электронная конфигурация гидрид-аниона 1s2. Поскольку два электрона располагаются на одной орбитали, то говорят, что гидрид-анион содержит неподеленную электронную пару.

2. Напишите формулу электронной конфигурации атома углерода в основном и возбуждённом состоянии. Какова валентность углерода в органических соединениях? Приведите структурные формулы следующих соединений:
-метан, этан; этилен (этен), пропилен (пропен);
-ацетилен (этин), пропин; бензол;
-метанол, этанол; формальдегид (метаналь), уксусный альдегид (этаналь);
-уксусная (этановая) кислота; этилацетат (этиловый эфир уксусной кислоты);
-метиламин, диметиламин; аминоуксусная кислота;
Ответ:
Атом углерода в основном, невозбуждённом состоянии, имеет формулу электронной оболочки 1s22s22p2. Для нас наиболее важны электроны внешнего (в данном случае второго) уровня, так называемые «валентные» электроны, потому что именно они участвуют в химических реакциях; в невозбуждённом состоянии это электроны 2s22p2. При переходе в возбуждённое состояние электронная конфигурация углерода становится 1s22s12p3 , конфинурация внешнего, валентного уровня, как видно из формулы и рисунка, 2s12p3. Всего на валентном, внешнем уровне получается 4 неспаренных электрона, которые учавствуют в образовании связей в органических соединениях. Поэтому валентность углерода в органических соединениях всегда 4.

В соответствии с вышеизложенным принципом валентности углерода, равной 4, можно изобразить структурные формулы упомянутых веществ следующим образом:





3. Что такое обменный и донорно-акцепторный механизм образования ковалентной связи? Что такое гомолитический и гетеролитический разрывы ковалентной связи? Какие частицы (как они называются) образуются при: а) гомолитическом разрыве связи Н-Н в молекуле водорода Н2; б) гомолитическом разрыве связи С-Н в молекуле этана; в) гетеролитическом разрыве связи H-Cl в молекуле HCl; г) гетеролитическом разрыве связи С-Н в молекуле этана?
Ответ:
В процессе изучения органической химии Вы регулярно встречаетесь с разнообразными химическими реакциями. При их протекании одни вещества (исходные вещества или реагенты) превращаются в другие (продукты реакции). Химические реакции протекают за счет разрыва одних химических связей и образования других связей. Именно поэтому так важно знать способы образования и разрыва химической связи.
Ковалентная связь всегда образуется за счет двух электронов. При изображении структурных формул органических соединений ковалентную связь изображают в виде черточки (‑) или же в виде пары электронов (:).
Ошибка! Объект не может быть создан из кодов полей редактирования.
Существует лишь два механизма образования ковалентной связи: обменный и донорно-акцепторный. При обменном механизме ковалентная связь между двумя атомами образуется за счет двух электронов – по одному неспаренному электрону от каждого из атомов, образующих связь. Примером может служить образование молекулы водорода Н2 из двух атомов водорода. Атомы водорода являются свободными радикалами, поскольку по определению радикал – это частица с одним или несколькими неспаренными электронами.
ЗАПОМНИТЬ!!!
Процесс, обратный образованию ковалентной связи по обменному механизму, в результате которого образуются два свободных радикала, называется гомолитическим разрывом связи.

При донорно-акцепторном механизме ковалентная связь между двумя атомами образуется также за счет двух электронов – неподеленной электронной пары атома-донора и пустой орбитали атома-акцептора. В органической химии частицу с неподеленной электронной парой называют нуклеофилом, а частицу с пустой орбиталью – электрофилом. Таким образом, нуклеофил может взаимодействовать с электрофилом с образованием связи по донорно‑акцепторному механизму. Две нуклеофильные частицы, равно как и две электрофильные частицы не взаимодействуют друг с другом.
ЗАПОМНИТЬ!!!
Процесс обратный образованию связи по донорно-акцепторному механизму называется гетеролитическим разрывом сввязи. При этом часто (но не всегда!!!) образуются заряженные частицы ‑ ионы.
ЗАПОМНИТЬ!!!!
Частица с неподеленной электронной парой называется нуклеофил, а частица с пустой орбиталью – электрофил.

4. Приведите все структурные формулы и названия изомерных соединений следующего состава:
-алканы C5H12;
-алкены C4H8;
-спирты C3H8O.
Ответ:
алканы состава С5Н12:

Алкены состава С4Н8:
Спирты состава С3Н8О:

5. Являются ли пары изображенных ниже веществ одним и тем же или разными веществами:

Ответ:
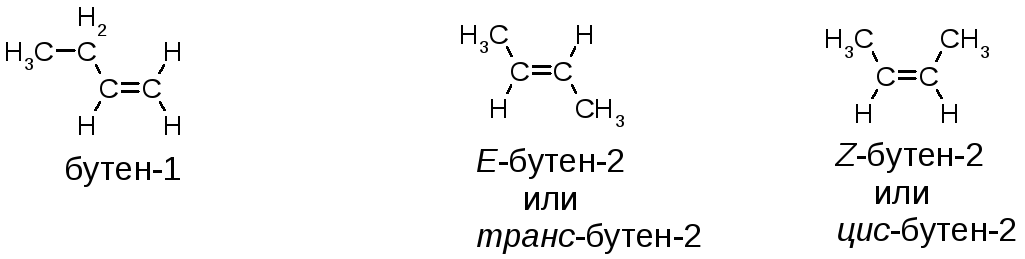
В случае (а) изображена одна и та же молекула – н-бутана. Дело в том, что относительно любой одинарной связи возможно относительно свободное вращение. Такое вращение может происходить и относительно центральной связи углерод‑углерод, как изображено ниже. Это приводит к тому, что молекулы бутана существуют в виде бесчисленного множества форм – так называемых конформаций, которые легко переходят друг в друга при комнатной (и пониженной) температуре.

В случае (б) речь идет о разных веществах – цис-бутене-2 и транс-бутене-2. Дело в том, что центральные атомы углерода связаны двойной связью, относительно которой уже невозможно свободное вращение. Поэтому цис-изомер не может свободно проходить в транс-изомер. Существуют два совершенно различных вещества – цис-бутен-2 и транс-бутен-2.

6. Какой тип реакций (замещения или присоединения) характерен для алканов, алкенов, алкинов, ароматических углеводородов? Напишите реакции, характерные для этих классов соединений, а также для спиртов, альдегидов, карбоновых кислот, аминов и аминокислот.
Ответ (знать все приведенные ниже реакции):
Алканы. Для алканов характерны реакции замещения (чаще всего при действии галогенов, хлора и брома), при этом могут замещаться один (уравнения 1, 3) или несколько (уравнение 2) атомов водорода.
Рассмотрим уравнение 1 более подробно. Строение продукта реакции – хлорметана – очень похоже на строение исходного соединения – метана. В процессе реакции один атом водорода в молекуле метана заменяется (замещается) на атом хлора, поэтому говорят, что происходит реакция замещения.
Сходным образом протекают также и реакции 2 и 3: чтобы правильно изобразить продукт необходимо перерисовать структурную формулу исходного соединения, заменив при этом атом водорода на соответствующий заместитель.

Алкены. Алкены вступают в реакции присоединения по двойной связи (реакции 4-9). Присоединение воды часто называют реакцией гидратации (8).
Суть этих реакций заключается в том, что в двойной связи С=С происходит разрыв более слабой π-связи, и к каждому из атомов углерода присоединяется одновалентный атом (типа H, Cl, Br) или одновалентный остаток (типа ОН). Все остальные связи, которые были в исходном алкене остаются незатронутыми и сохраняются в продукте реакции. Ниже изображена упрощенная схема, иллюстрирующая протекание реакций присоединения по двойной углерод-углеродной связи алкенов.


Для реакций алкенов (с несимметрично замещённойдвойной связью) с водой и галогеноводородами (реакции 10, 11) необходимо решить: к котрому из атомов C присоединится H, а к которому - OH или галоген? Чаще всего можно воспользоваться правилом Марковникова и присоединить атом H к тому атому углерода двойной связи, который связан с большим количеством атомов водорода (наиболее «гидрогенизированный»)

Алкины. Алкины вступают в реакции присоединения по тройной связи(13-17), при этом могут присоединять один (уравнения 13, 15) или два (14, 16) эквивалента реагентов. В отличие от алкенов, гидратация алкинов (т.н. реакция Кучерова) (17) приводит не к спиртам (8), а к карбонильным соединениям.
Более подробно
поясним реакцию 13.
В молекуле ацетилена содержится три
связи углерод‑углерод, или как говорят
одна тройная связь
![]() .
Из этих трех связей рвется только одна
связь, а две остаются, поэтому продукт
реакции содержит фрагмент
.
Из этих трех связей рвется только одна
связь, а две остаются, поэтому продукт
реакции содержит фрагмент
![]() .
При этом, к каждому атому углерода
присоединяется по одному атому водорода,
что обеспечивает четырехвалентность
углерода в продукте реакции.
.
При этом, к каждому атому углерода
присоединяется по одному атому водорода,
что обеспечивает четырехвалентность
углерода в продукте реакции.
Все остальные связи, которые содержались в исходной молекуле ацетилена не затрагиваются и остаются в продукте реакции.
Аналогично проекает реакция 15. В реакции 16 сначала происходит рзрыв двух связей углерод-углерод, а к каждому из атомов углерода присоединяется по два атома хлора.

Ароматические углеводороды (арены). Вступают в реакции замещения атомов водорода (бромирование 18, нитрование 19):

Кислород содержащие
соединения.
Спирты
в реакции с активными металлами, подобно
кислотам, выделяют водород (20).
При нагревании с серной кислотой
происходит реакция дегидратации (21).
Реакция 21
по сути обратна реакции 8:
от соседних атомов углерода отщепляются
одновалентные атомы или группы, при
этом между двумя соседними атомами
углерода формируется еще одна связь
углерод-углерод, так что в продукте
реакции имеется двойная связь
![]() .
.

Альдегиды вступают в реакции восстановления (22) и окисления (23). Рекция 23 носит название «реакция сребряного зеркала», так как выделяющееся в ходе нее серебро дает на стенке зеркальный налет.

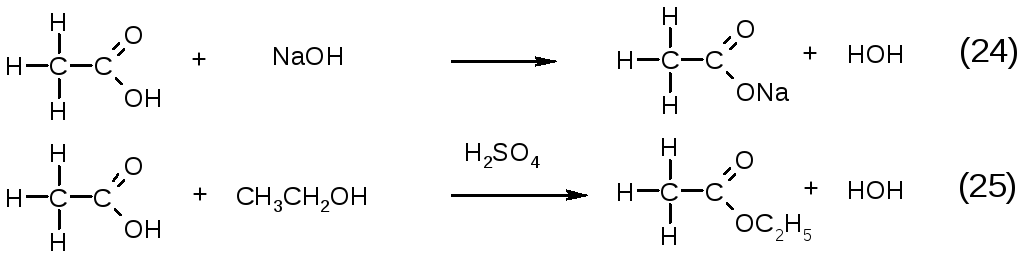
Карбоновые кислоты взаимодействуют с гидроксидами с образованием солей (24), а со спиртами (в присутствии сильных кислот в качестве катализатора) – с образованием сложных эфиров (25).
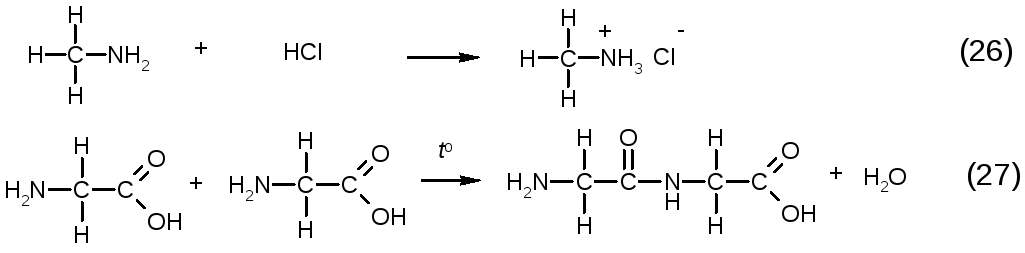
Азот содержащие соединения. Амины реагируют с сильными кислотами с образованием солей аммония (26). Для аминокислот, кроме этого, важна реакция образования пептидов при повышенной температуре (27):
7. Приведите механизм образования хлорэтана при взаимодействии этилена с хлороводородом.
Ответ: С точки зрения механизма реакции алкенам характерны реакции электрофильного присоединения. Механизм этого превращения изображен ниже. На первой стадии происходит диссоциация хлороводорода на протон и хлорид-анион (гетеролитический разрыв связи H-Cl, смотри вопрос 3). При этом образуется протон Н+, содержащий вакантную орбиталь, а также хлоид-анион Сl-, обладающий неподеленной электронной парой. Частицы с вакантной обиталью (типа протона Н+) называют электрофильными, а с неподеленной электронной парой – нуклеофилами.
Первым с молекулой
этилена взаимодействует электрофильная
частица – протон Н+
(поэтому и говорят, что алкенам характерны
реакции электрофильного присоединения).
На этой стадии происходит присоединение
протона с одновременным гетеролитическим
разрывом π-связи в молекуле этилена
(если гетеролитический разрыв π‑связи
происходил бы сам по себе, то образовывалась
бы частица  ).
Присоединение протона происходит за
счет образования новой связи С-Н по
донорно-акцепторному механизму (т.е. Н+
присоединяется к тому атому углерода
).
Присоединение протона происходит за
счет образования новой связи С-Н по
донорно-акцепторному механизму (т.е. Н+
присоединяется к тому атому углерода
 ,
на котором находится отрицательный
заряд, т.е. неподеленная электронная
пара). Присоединение протона ведет к
образованию этильного катиона –
выполняется закон сохранения заряда,
который в данном случае заключается в
следующем: взаимодействует электронейтральная
молекула этилена и положительно-заряженный
ион Н+,
суммарный заряд реагентов равен +1,
поэтому и суммарный заряд продуктов
должен быть равен +1, что и выполняется:
образуется этильный катион С2Н5+.
,
на котором находится отрицательный
заряд, т.е. неподеленная электронная
пара). Присоединение протона ведет к
образованию этильного катиона –
выполняется закон сохранения заряда,
который в данном случае заключается в
следующем: взаимодействует электронейтральная
молекула этилена и положительно-заряженный
ион Н+,
суммарный заряд реагентов равен +1,
поэтому и суммарный заряд продуктов
должен быть равен +1, что и выполняется:
образуется этильный катион С2Н5+.
На последней стадии электрофильная частица – этильный катон взаимодействует с нуклеофильной – хлорид-анионом с образованием новой связи C—Cl по донорно-акцепторному механизму.

