
- •1. ИНФОРМАЦИЯ О ДИСЦИПЛИНЕ
- •1.1. ПРЕДИСЛОВИЕ
- •1.2. СОДЕРЖАНИЕ ДИСЦИПЛИНЫ И ВИДЫ УЧЕБНОЙ РАБОТЫ
- •2.3. СТРУКТУРНО-ЛОГИЧЕСКАЯ СХЕМА ДИСЦИПЛИНЫ
- •2.5. ПРАКТИЧЕСКИЙ БЛОК
- •2.6. БАЛЛЬНО-РЕЙТИНГОВАЯ СИСТЕМА ОЦЕНКИ ЗНАНИЙ
- •3.1. БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •3.2. ОПОРНЫЙ КОНСПЕКТ ЛЕКЦИЙ
- •Введение
- •В 2. Топливо и энергетика
- •Заключение
- •3.3. Глоссарий
- •3.4. Методические указания к выполнению лабораторных работ
- •Работа 1. ОПРЕДЕЛЕНИЕ ВЛАЖНОСТИ ТОПЛИВА
- •Работа 2. ОПРЕДЕЛЕНИЕ ЗОЛЬНОСТИ ТОПЛИВА
- •Работа 3. ОПРЕДЕЛЕНИЕ ВЫХОДА ЛЕТУЧИХ ИЗ ТОПЛИВА
- •Работа 4. ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ СГОРАНИЯ ТОПЛИВА
- •Работа 6. АНАЛИЗ ДЫМОВЫХ ГАЗОВ
- •4. БЛОК КОНТРОЛЯ ОСВОЕНИЯ ДИСЦИПЛИНЫ
- •4.2. Текущий контроль
- •4.3. Итоговый контроль
- •Содержание
3.2. ОПОРНЫЙ КОНСПЕКТ ЛЕКЦИЙ
Введение
В1. Состояние и перспективы развития топливно-энергетического комплекса Российской Федерации
Россия располагает значительными разрабатываемыми и разведанными запасами первичных энергетических ресурсов и мощным топливноэнергетическим комплексом (ТЭК), который является основой стабильного состояния и дальнейшего развития народного хозяйства, а также одним из инструментов проведения внутренней и внешней политики.
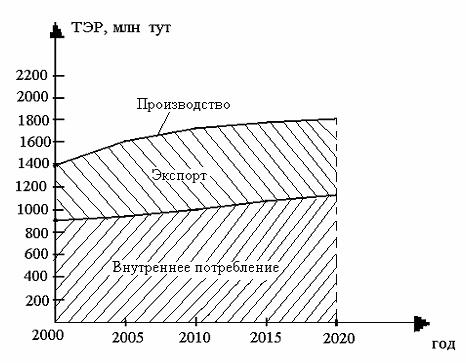
В период 1990…2000 гг., несмотря на снижение добычи первичных энергетических ресурсов (угля, нефти, газа), российский ТЭК в основном обеспечивал потребности страны в топливе и энергии, сохранив тем самым энергетическую независимость России. В настоящее время преодолена тенденция спада и начался рост добычи газа, нефти и угля, производства электроэнергии, объема и глубины переработки нефти. В ближайшей перспективе ожидается увеличение внутреннего потребления и экспорта первичных топливно-энергетических ресурсов, а также увеличение их производства (рис. 2).
Динамика производства ТЭР обусловлена необходимыми объемами и стоимостью работ по приросту их разведанных запасов, ценой каждого вида топлива на внутреннем и внешнем рынках, а главное – зависимостью стоимости их производства от масштабов развития основных топливных баз.
Рис. 2. Производство и потребление топливно-энергетических ресурсов
17

Основой внутреннего спроса на топливно-энергетические ресурсы при всех вариантах останется природный газ. При этом его доля в расходной части баланса первичных энергоресурсов снизится с 50 % в настоящее время до 45 − 46 % в 2020 году.
На жидкое топливо (нефть и нефтепродукты) будет приходиться в течение рассматриваемой перспективы 20 – 22 %, а на твердое топливо - 19 – 20 %. Достаточно стабильным будет внутренний спрос и на нетопливные энергоресурсы (электроэнергию и теплоту гидро- и атомных электростанций и возобновляемых источников энергии).
В предстоящий период наиболее динамично будет расти потребление моторного топлива - на 15 - 26 % к 2010 году и на 33 - 55 % к 2020 году. При этом в качестве моторного топлива в предстоящий период будут также использоваться сжиженный и сжатый природный газ. Прогнозируется также, что в мобильной энергетике к 2020 году начнется распространение электрических и водородных двигателей, а также применение топливных элементов.
Оптимизация топливно-энергетического баланса страны определила следующие задачи в области энергообеспечения народного хозяйства России и развития отраслей ТЭК:
- увеличение производства первичных энергоресурсов с 1418 млн тут в 2000 году (1515 млн тут в 2002 году) до 1700 - 1820 млн тут в 2010 году и до
1810 - 2030 млн тут в 2020 году; - рост выработки электроэнергии с 878 млрд кВт·ч в 2000 году (892 млрд
кВт·ч в 2002 году) до 1015 - 1070 млрд кВт·ч в 2010 году и до 1215 - 1365 млрд кВт·ч в 2020 году;
- увеличение добычи нефти с 324 млн т в 2000 году (379 млн т в 2002 году) до 445 - 490 млн т в 2010 году и до 450 - 520 млн т в 2020 году;
- рост производства моторных топлив с 83 млн т в 2000 году (88 млн т в
2002 году) до 100 - 110 млн т в 2010 году и до 115 - 135 млн т в 2020 году; - увеличение добычи газа с 584 млрд м3 в 2000 году (595 млрд м3 в 2002
году) до 635 - 665 млрд м3 в 2010 году и до 680 - 730 млрд м3 в 2020 году; - рост добычи угля с 258 млн т в 2000 году (253 млн т в 2002 году) до 310 -
330 млн т в 2010 году и до 375 - 430 млн т в 2020 году; - увеличение централизованного отпуска теплоты с 1452 млн Гкал в 2000
году (1437 млн Гкал в 2002 году) до 1570 - 1625 млн Гкал в 2010 году и до 1720 - 1820 млн Гкал в 2020 году.
В 2. Топливо и энергетика
В настоящее время за счет сжигания органического топлива на Земле по-
кДж лучают теплоты более чем 13·1016 год . Эта тепловая энергия используется в
быту, промышленности, на транспорте и других отраслях народного хозяйства в специальных сооружениях, которые объединяют общим термином – тепловые устройства.
18
Наиболее распространенные промышленные тепловые устройства можно разделить на четыре характерные группы:
1)тепловые генераторы;
2)теплообменники;
3)тепловые аппараты;
4)тепловые машины.
Во всех тепловых устройствах за исключением теплообменников (№ 2) главным тепловым процессом, определяющим тепловую работу устройства, является получение теплоты в результате превращения химической, электрической, солнечной, атомной и других видов энергии.
Превращение химической энергии в тепловую при сжигании органического топлива производится:
-в теплогенераторах – в топках;
-в тепловых аппаратах – в отпускных печах, в паровых и водогрейных котлах; в плавильных и нагревательных печах;
-в тепловых машинах – в двигателях внутреннего сгорания, реактивных двигателях, газовых турбинах.
В этих тепловых установках используется около 70 % всего расходуемого на внутреннее потребление органического топлива. В ближайшей перспективе (до 2020 года) валовое потребление топлива на нужды промышленности будет возрастать, однако потребление его будет неравномерно, в зависимости от вида топлива. Так, доля сжигаемого газа с 50 % (в настоящее время) уменьшается до 49 % в 2010 г. и 46 % в 2020 г. потребление жидкого топлива изменится с 20 до 22% ; потребление угля возрастает с 19 до 20 процентов.
Одно из важнейших направлений политики любого государства – обеспечение собственной энергетической безопасности. В настоящее время и на ближайшую перспективу наша страна полностью обеспечивает собственные нужды в органическом топливе и имеет возможность экспортировать его (см. рис. 2).
Однако, несмотря на самодостаточность в обеспечении энергетической безопасности, в нашей стране большое внимание уделяется всемерной экономии энергетических ресурсов, дальнейшему совершенствованию энергопотребления, проведению активной энергосберегающей политики.
Важным направлением в экономии топлива является использование вторичных энергетических ресурсов (ВЭР). Расчеты показывают, что капитальные затраты на внедрение в производство устройств по утилизации ВЭР в 3,5 раза меньше капитальных затрат на добычу, обогащение и транспортировку органического топлива (в расчете на 1 т).
Повышение экономичности, надежности и экологической безопасности в практике сжигания топлив базируется на теоретических исследованиях, проводимых учеными всех (промышленно развитых) стран мира.
Исследованиям общих вопросов теории горения (химический и физический этапы) посвящены работы зарубежных (Льюис Б., Эльбе Г., Пиз Р.Н., Иост В., Эванс М. и др.) и отечественных ученых. Еще в 1890 годах русский ученый В.А. Михельсон опубликовал результаты своих фундаментальных работ по
19
теории горения газов. Известны основополагающие работы Д.И. Менделеева по химизму различных топлив. Широкое развитие теория горения получила в работах советских ученых (Н.Н. Семенов, Г.Ф. Кнорре, Д.А. Франк-Каменецкий, Я.Б. Зельдович, Л.Н. Хитрин, В.В. Померанцев, В.И. Блинов и др.).
Вопросам теории горения частиц (капель) топлив посвящены работы зарубежных авторов (Вуд Б.Д., Россер В.А., Уайз Х., Гольдсмит М., Пеннер С. и др.) и отечественных ученых (Г.А. Варшавский, И.И. Палеев, М.А. Гуревич, Д.Б. Сполдинг, В.И. Блинов, А.С. Предводителев, С.В. Бухман и др.).
Большое значение в организации горения имеет аэродинамика топочных струй. Теоретическим разработкам в области аэродинамики факела, плотного и кипящего слоев посвященных работы Л. Прандтля, Г.Н. Абрамовича, Л.А. Вулиса, Ю.В. Иванова, Л.Г. Лойцянского, С.Л. Шагаловой и др.
Очень большое количество научно-исследовательских, конструкторских и опытно-промышленных работ приходится на прикладное направление подготовки топлива и его сжигания различными способами. В этом направлении известны работы таких ученых, как Гаусорн В., Уиделл Д., Хотел Г., Воль К., Геслей К., Кутателадзе С.С., Померанцев В.В., Баскаков А.П., Арефьев К.М. и многих других.
Горение – один из первых сложных технических процессов, освоенный человечеством. В истории развития техники этот процесс занимал и продолжает занимать очень важное место, является основой современной энергетики, многих технологических производств, транспорта и быта.
Курс «Топливо и теория горения» в значительной степени синтезирует сведения основных физико-химических и теплотехнических дисциплин.
Знание этого курса во всем предлагаемом в данной работе объеме необходимо при изучении дисциплины «Котельные установки и парогенераторы», отдельные разделы используется при изучении дисциплин: «Технологические энергоносители предприятий», «Нетрадиционные и возобновляемые источники энергии», «Тепловые и атомные электростанции», «Режимы работы и эксплуатация ТЭС», «Тепломеханическое и вспомогательное оборудование электростанций».
3.2.1.Топливо: виды, состав, характеристики
Впроцессе работы с данным разделом Вам предстоит:
-изучить три темы;
-выполнить блок лабораторных работ, включающих работы 1…5;
-выполнить блок практических занятий, включающих два задания (задачи
1…4);
-ответить на вопрсы для самопроверки;
-ответить на вопросы тренировочного теста № 1;
-выполнить часть контрольной работы.
20
3.2.1.1. Виды и свойства органических топлив
Горючие вещества, основной составной частью которых является углерод, применяемые с целью получения при их сжигании тепловой энергии, называются топливом (органическим топливом). Основные виды органического топлива: угли, нефть, природный газ, сланцы, торф. Из природных топлив путем их переработки могут быть получены искусственные виды топлив: из твердых топлив получают кокс, брикеты угля, древесный уголь, сланцевое масло и газы путем газификации каменных углей; из нефти – бензин, мазут, керосин, соляровое масло и др.; при использовании природного газа – доменный газ.
Торф. Торф характеризуется высоким содержанием влаги, достигающим в мокрой залежи 95 % и в сухой 80-85 %. Зольность торфа в зависимости от условий образования залежи колеблется от 3 до 17 % в пересчете на сухую массу
(табл. 4).
Таблица 4
Средний состав и теплота сгорания кускового и фрезерного торфа
Сорт |
|
Состав рабочей силы, % |
|
|
Теплота |
Выход |
||||
|
СP |
HP |
OP |
SP |
NP |
|
AP |
WP |
сгорания |
летучих |
|
|
|
|
|
|
|
|
|
QHP , |
веществ |
|
|
|
|
|
|
|
|
|
кДж/кг |
Vг ,% |
Кусковой |
30,9 |
3,2 |
17,8 |
0,2 |
1,3 |
|
6,6 |
40 |
10070 |
70 |
Фрезерный |
25,7 |
2,7 |
14,9 |
0,1 |
1,1 |
|
5,5 |
50 |
8500 |
70 |
Запасы торфа в РФ составляют, по оценкам экспертов, 200-220 млрд т. Залежи торфа встречаются как в европейской части нашей страны так и на Урале, в Сибири и на Дальнем Востоке. Особенно богата торфом Сибирь (более 50 % запасов страны).
Мощность торфяников, измеряемая глубиной залежи, достигает 10 -15 м. Слой в 1 м толщины образуется в среднем за 30-50 лет.
Внастоящее время торф рассматривается в первую очередь как весьма ценное сельскохозяйственное удобрение. Однако запасы его велики, к тому же он относится к категории возобновляемых горючих ископаемых (при правильном регулировании жизни торфяных болот, где идет непрерывное накопление торфа), поэтому торф и в дальнейшем может рассматриваться как энергетическое топливо, особенно при переходе к комплексному его использованию.
Внастоящее время торф сжигается на нескольких десятках небольших электростанций нашей страны в количестве до 4 млн т в год. К 2020 г. энергетическое потребление торфа прогнозируется примерно на таком же уровне.
Бурые угли. Этот вид горючих ископаемых является результатом сложной трансформации торфяника, погребенного под мощным слоем наносных отложений, горной породы, предотвративших контакт органического вещества с кислородом воздуха. Повышение температуры (до 200 °С, а возможно, и выше) и
21

давления (до 300 МПа) при этих условиях приводит к углефикации органических остатков, сопровождающейся обогащением их углеродом и потерей кислорода.
По внешнему виду различают землистые бурые угли, лигниты и блестящие бурые угли. Землистые бурые угли представляют бесструктурную мелкозернистую бурую массу, легко крошащуюся и содержащую в естественном состоянии до 50 % воды. При обработке растворителями они почти не дают твердого горючего осадка. Лигниты, в отличие от других видов бурых углей, хорошо сохранили микроструктуру дерева. В большинстве случаев они имеют бурый цвет и волокнистый излом. Блестящие бурые угли по внешнему виду очень похожи на каменные из-за черного цвета, характерного блеска и представляют плотную однородную массу с раковистым изломом.
Бурые угли имеют высокий выход летучих (более 40%), большую влажность (до 40% и более), теплота сгорания рабочей массы беззольного угля является относительно высокой: Qвр = 24 МДж/кг (5700 ккал/кг). Однако ввиду большой зольности и влажности этих углей их низшая теплота сгорания оказы-
вается невысокой: Qнр = (10,5…15,9) МДж/кг (2500…3800 ккал/кг).
Характеристики бурых углей некоторых месторождений приведены в табл. 5.
Таблица 5
Характеристика бурых углей
|
|
Месторождение угля |
||
Показатели, % |
Южно- |
Ирша-Бо- |
Подмос- |
Бикинс- |
|
Ураль- |
родин- |
ков- |
кое |
|
ское |
ское |
ное |
|
|
35,0 |
|||
Зольность Ар |
16,0 |
6,3 |
30,6 |
|
Влажность Wр |
10,0 |
8,2 |
32,1 |
10,5 |
Выход летучих Vг |
63,6 |
47,0 |
48,0 |
50,4 |
Состав горючей мас- |
|
|
|
|
сы С |
69,5 |
70,7 |
67,6 |
65,4 |
Н |
6,6 |
5,7 |
5,17 |
5,5 |
О |
21,8 |
22,9 |
26,0 |
26,5 |
N |
0,6 |
0,7 |
1,22 |
1,8 |
Содержание серы |
|
|
|
|
S |
2,92 |
0,3 |
4,34 |
0,44 |
В том числе: |
|
|
|
|
пиритной |
1,23 |
0,01 |
2,49 |
0,07 |
сульфатной |
0,13 |
0,02 |
0,65 |
0,03 |
органической |
1,46 |
0,27 |
1,2 |
0,34 |
Содержание гумино- |
|
|
|
|
вых кислот в горю- |
68,0 |
37,7 |
17,0 |
22,0 |
чей массе |
|
|
|
|
Челябинское
24,4
9,1
39,0
71,0
4,4
23,0
1,4
1,97
0,1
0,29
1,58
2,3
22
Промышленная классификация бурых углей предусматривает разделение их на группы по влажности и зольности и на сорта по крупности кусков. По содержанию влаги в рабочем топливе (Wр) бурые угли делятся на три группы: Б1, Б2 и Б3 при Wр>40, Wр=30…40 и Wр<30 % соответственно. По зольности сухой массы (Ас) бурые угли в зависимости от бассейна делятся на ряд групп (от трех до пяти). По размерам кусков бурые угли разделяются на сорта: БК (бурые крупные – с размерами кусков от 50 до 100 мм); БО (бурый орех – куски от 25 до 50 мм); БМ (бурые мелкие – куски от 13 до 25 мм); БР (бурый рядовой – куски до 200 мм для шахт и до 300 мм для карьеров).
Месторождение бурых углей в нашей стране имеются повсеместно, и запасы их весьма велики. Только в Канско-Ачинском бассейне геологические запасы бурых углей оцениваются в 600 млрд т, из которых 140 млрд т можно добывать открытым способом.
Еще более крупные запасы углей сосредоточены в Тунгусском бассейне (несколько триллионов тонн). Крупные залежи бурых углей имеются в Казахстане, Украине, в центральной зоне Российской Федерации, в Средней Азии и на Дальнем Востоке.
Из-за высокого содержания балласта и малой механической прочности бурые угли нетранспортабельны на большие расстояния и относятся, как и торф, к категории местных топлив. Однако разработанные различные технологии их подготовки позволяют превращать бурые угли в транспортабельное топливо, что в сочетании с новыми способами сжигания (например в кипящем слое) существенно расширит возможности их перевозки и сделает более эффективным их сжигание на электростанциях.
Перспективно энерготехнологическое или энергохимическое использование бурых углей, при котором на их основе можно получать синтетическое жидкое топливо, химическое сырье, различную товарную продукцию.
Каменные угли. Изменение органического вещества горючих ископаемых на каменноугольной стадии протекает под действием ряда геологических факторов в зонах повышенной тектонической активности. Главным фактором, по-видимому, является температура (предполагают, что формирование каменных углей происходило при температурах 250-350 °С). Установлено, что некоторые горные породы и минеральные включения в угольной массе (например оксиды железа, алюминия и др.) могут играть роль катализаторов ряда реакций в веществе угля. В результате этого происходит дальнейшее обогащение органического материала углеродом с потерей им кислород- и водородсодержащих соединений, образующих оксид и диоксид углерода, воду, метан. Содержавшиеся в буром угле гуминовые кислоты на каменноугольной стадии превращаются в нерастворимые нейтральные гумины.
Каменные угли весьма разнообразны по химической зрелости, в связи с чем их классифицируют по ряду признаков: выходу летучих веществ, отнесенному к горючей массе топлива, Vг, спекаемости твердого остатка, определяемой при нагреве топлива без доступа воздуха до температуры 850 °С в стандартных
условиях, и теплоте сгорания по бомбе на горючую массу Qгб . В принятой
23
классификации каменные угли подразделяются на следующие марки (с обозначением марок): длиннопламенный (Д), газовый (Г), газовый жирный (ГЖ), жирный (Ж), коксовый (К), коксовый жирный (КЖ), коксовый второй (К2), отощенный спекающийся (ОС), слабоспекающийся (СС), тощий (Т). Число марок углей и их характеристика определяются ГОСТ для каждого бассейна.
Запасы каменных углей в РФ также весьма велики, при этом большая их часть подобно бурым углям сосредоточена в Сибири. Среди крупнейших каменноуголных бассейнов страны сегодня разрабытваются Кузнецкий, Печорский, Южно-Якутский, Кизеловский.
Каменные угли обладают относительно меньшим содержанием золы и влаги, чем бурые угли: Ар = (5…15) %; Wр =(5…10) %. Вследствие этого их теплота сгорания оказывается большей:
Qнр = (23…27,3) МДж/кг (5500…6500 ккал/кг).
Антрацит. Антрацит является конечным итогом преобразования углей. Это разновидность угля характеризуется весьма высокой степенью углефикации (содержание углерода в горючей массе достигает 94 – 96 %), высокой твердостью и плотностью, низкой влажностью и четко выраженной мелкокристаллической структурой природного графита. Из-за повышенной хрупкости добыча антрацита сопровождается образованием большего количества мелочи (с размерами кусков менее 6 мм) – так называемого штыба. Антрацитовый штыб (АШ) является относительно низкосортным энергетическим топливом, сжигание которого было впервые в мире в широких масштабах организовано на электростанциях СССР еще в довоенный период.
У этих углей малый выход летучих (Vг = 2…9 %).
Теплота сгорания таких углей достаточно высокая: Qнр = 34,5 МДж/кг (8300 ккал/кг). Угли, по своим характеристикам находящиеся между каменными углями и антрацитами, называют полуантрацитами. Выход летучих у таких углей составляет Vг = (5…10) %, а теплота сгорания несколько больше, чем антрацитов (Qнр = 35 МДж/кг). Полуантрациты и антрациты разделяются по объемному выходу летучих веществ в условной горючей массе Vгоб: полуантрациты – (220…300) см3/г, антрациты – менее 220 см3/г. Теплота сгорания летучих веществ для антрацитов – 43,1 МДж/кг, полуантрацитов – 48,2 МДж/кг.
Горючие сланцы. Горючие сланцы относятся к классу сапропелитов, сильно забалластированных осадочными породами (песком, глиной), содержание которых достигает 70 %. При содержании балласта свыше 70 % сжигание сапропелита в обычных топочных устройствах (слоевых или камерных) становится невозможным, однако в топках с кипящим слоем можно сжигать горючие сланцы, содержащие менее 30 % горючего органического вещества.
Будучи типичным низкосортным топливом, сланцы вместе с тем являются ценным сырьем для производства синтетического жидкого топлива и горючего газа, в частности при их комплексном использовании. Определенную ценность представляет также сланцевая зола как строительный материал и продукт для раскисления почв в сельском хозяйстве.
24
Наша страна располагает большими запасами сланцев. Месторождения сланцевого топлива имеются в областях Куйбышевской, Саратовской, Ульяновской, Ленинградской и др.
Зольность сланцев очень большая и доходит до Ар =(50…60) %. Вследствие большого балласта их теплота сгорания низкая Qнр = (5,87…10) МДж/кг (1400…2000 ккал/кг). В горючей массе содержание водорода оказывается высоким Нр = (7,5…9,5) %, что обусловливает большой выход летучих, достигающий (80…90) %, и их легкую воспламеняемость.
Древесное топливо и городской мусор. К этой категории топлива кроме собственно дров относят также различного рода растительные отходы, образующиеся как при рубке леса, так и при его дальнейшей переработке (пни, сучья, ветви, вершинные части деревьев, обрезки, щепа, стружка, опилки, так называемые отпады: хвоя, листва, валежник, корье), отходы растениеводства: солома, костра, лузга, стебли некоторых растений и т. п.
Органическая часть древесины и других растительных образований состоит в основном из углеводов и в меньшей мере из белков, жиров, восков и смол, входящих в состав растительных клеток или заполняющих межклеточное пространство растительной ткани. Основными компонентами углеводов является целлюлоза (С6Н24О5)х, из которой построены стенки клеток, гемицеллюлоза, представляющая собой гидролизирующуюся часть целлюлозы, и особое инкрустирующее вещество, заполняющее межклеточные промежутки – лигнин (С9Н24О10). Содержание целлюлозы в органической части многоклеточных растений достигает 60 %, содержание лигнина колеблется в пределах 20…30 %, в зависимости от породы и возраста древесины. Содержание минеральных солей в основной древесине составляет 0,21 %, в березовой − 0,29…0,38 %, в дубовой − 0,37 %, в еловой − 0,22…0,37 %. Однако в коре, листьях, а также в стеблях однолетних растений содержание минеральных солей значительно больше и составляет: в еловой коре − 5,77 %, в буковой − 8,84 %, в соломе – от 3,3 до 7,2 %, в лузге − 2,31 %, камыше − 7,4 %. Элементный состав и характеристика древесного топлива различных видов приведены в табл. 6.
25
Таблица 6
Элементный состав и характеристики древесного топлива
Топливо |
Состав органиче- |
Характеристики рабочего |
||||||
|
ской массы, % |
|
топлива |
|
|
|||
|
С0 |
Н0 |
О0+N0 |
Wp, % |
Ар, % |
P |
кДж |
|
|
|
|
|
|
|
QH , |
|
|
|
|
|
|
|
|
кг |
||
|
|
|
|
|
|
|
||
Древесина: |
|
|
|
|
|
|
|
|
Сосна |
50,2 |
6,0 |
43,8 |
57,4 |
1,4 |
7120 |
|
|
Береза |
49,3 |
6,1 |
44,6 |
50,4 |
2,1 |
8140 |
|
|
Ольха |
49,0 |
6,3 |
44,8 |
51,0 |
1,4 |
7780 |
|
|
Осина |
48,8 |
6,1 |
45,1 |
44,0 |
1,1 |
9150 |
|
|
Солома |
44,9 |
5,4 |
49,7 |
8 |
5,0 |
13120 |
|
|
Лузга подсолнечная |
51,7 |
6,3 |
42,0 |
15 |
2,0 |
15500 |
|
|
Камыш |
- |
- |
- |
16 |
7,4 |
14400 |
|
|
Крупномасштабное использование растительного топлива на электростанциях сегодня рассматривается как один из альтернативных вариантов развития энергетики на базе потребления биомассы. Расчеты показывают, что для работы ТЭС мощностью 100 МВт необходима плантация с конвейерной ротацией биомассы (растительного топлива) площадью 100 км2 при обычной скорости прироста древесной массы 40 т/га в год; ежегодная вырубка при этом должна проводиться с площади 8…10 км2. Площадь посадки может быть существенно уменьшена, если использовать быстрорастущие древесные породы. Достижения селекции позволяют рассчитывать на определенные успехи в этом направлении.
Городской мусор становится все более заметной частью так называемых антропогенных отходов. При накоплении его в количестве до 2 кг в сутки на одного городского жителя город с миллионным населением продуцирует до 750 тыс. т в год влажного мусора. По составу городской мусор состоит на 40…50 % горючих материалов и на 20…40 % из металла, стекла, керамики. Влажность его находится в пределах 15…30 %. При содержании горючих компонентов в мусоре до 50% его теплоценность достигает 7…8 тыс кДж/кг, что ставит его по калорийности выше горючих сланцев, но ниже бурых углей Кан- ско-Ачинского бассейна. Сжигание городского мусора в специальных мусоросжигательных котлах позволяет эффективно использовать его как низкосортное энергетическое топливо.
Все виды твердых топлив содержат в своем составе наряду с горючими компонентами значительное количество негорючего материала – балласта (рис. 3). В состав горючей части топлива входят сложные органические соединения, а также в небольшом количестве некоторые минеральные вещества, способные участвовать в горении, например дисульфид железа FeS2.
26
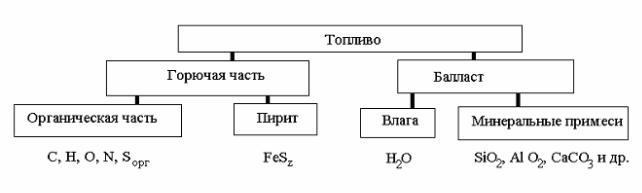
Рис. 3. Составные части твердого топлива
Балласт твердого топлива состоит из влаги W и негорючей минеральной части А, образующей при горении топлива золу и шлак.
Мазут. В энергетике основным жидким топливом является мазут, который в соответствии с ГОСТ 10583-75 подразделяется для стационарных котельных на марки 40, 100, 40В, 100В. Марка мазута определяется предельной вязкостью.
По содержанию серы различают малосернистый мазут (Sр = 0,5 %), сернистый (Sр = 2,0 %) и высокосернистый (Sр ≈ 3,5 %). Некоторые характеристики мазута приведены в табл. 7.
Мазут имеет высокую теплоту сгорания рабочей массы Qнр = (39,4…40,2) МДж/кг.
Вязкость нефти и мазута обычно выражают в единицах условной вязкости (ВУ). Согласно ГОСТ 6258-85, условной вязкостью называют отношение времени истечения из вискозиметра 200 мл испытуемого нефтепродукта при температуре испытания ко времени истечения 200 мл дистиллированной воды при 20 °С. Это отношение выражается числом условных градусов.
В зависимости от вязкости мазут бывает нескольких марок, различающихся температурой застывания. Для мазутов температура застывания 25 °С и ниже, поэтому необходим предварительный подогрев мазута при перекачке до
(60…70) °С, а при сжигании − до (100…140) °С.
|
|
|
|
|
|
|
|
|
|
Таблица 7 |
|
|
Характеристики мазута |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
Наименование |
|
|
Состав рабочей массы, % |
|
|
Теплота |
||||
р |
|
p |
|
p |
p |
p |
p |
p |
сгорания, |
|
|
W |
|
A |
S |
|
C |
H |
N |
+O |
МДж/кг |
Малосернистый |
3,0 |
|
0,05 |
0,3 |
84,65 |
11,7 |
0,3 |
40,3 |
||
Сернистый |
3,0 |
|
0,10 |
1,4 |
83,80 |
11,2 |
0,5 |
39,8 |
||
Высокосернистый |
3,0 |
|
0,10 |
2,8 |
83,0 |
10,4 |
0,7 |
38,8 |
||
27
Газообразное топливо. Газообразное топливо делится на природное и искусственное и представляет собой смесь горючих и негорючих газов, содержащую некоторое количество водяных паров, а иногда пыли и смолы. Количество газообразного топлива выражают в кубических метрах при нормальных условиях (1,02·105 Па и 0 °С), а состав – в процентах по объему. Под составом газообразного топлива понимают состав его сухой газообразной части.
Наиболее распространенное газообразное топливо – это природный газ, обладающий высокой теплотой сгорания.
Теплота сгорания 1 м3 природного сухого газа для большинства отечественных месторождений составляет (33,3…35,9) МДж/м3.
Перед подачей потребителям природный газ осушается, обеспыливается и из него удаляют сероводород. Все природные газы чисто газовых месторождений легче воздуха.
Нефтепромысловый (попутный) газ содержится в растворенном виде в нефти. В зависимости от месторождения в 1 т нефти растворено от 50 до 660 м3 газа при давлении в десятки МПа. В отличие от природного газа, попутный газ содержит меньше метана и больше тяжелых углеводородов, что увеличивает его теплоту сгорания.
Попутный газ отделяется в сепараторах от нефти, а затем из него выделяют ценные химические продукты и смесь сжижаемых углеводородов, в основном пропана и бутана.
При атмосферных условиях сжиженные газы переходят в газообразное состояние.
К искусственным газам относятся коксовый, сланцевый, генераторный и доменный.
3.2.1.2. Элементарный состав топлива
Состав твердого и жидкого топлив характеризуется содержанием о нем отдельных химических элементов, а также золы и влаги. Рабочей массой топлива называется состав топлива, с которым оно поступает к потребителю (этому составу придан индекс «р»), %:
Cp + Hp + Sp + Np + Op + Ap + Wp = 100, |
(1) |
где, соответственно, содержание углерода (С), водорода (Н), серы (S), азота (N), кислорода (О), золы (А) и влаги (W).
Кроме рабочей, состав топлива оценивается по сухой массе, безводной и беззольной массе, органической массе.
Состав топлива может быть пересчитан с одного на другой. Например, зависимость для пересчета содержания углерода с известной рабочей массой
топлива на сухую массу Сс, %, будет иметь вид: |
|
Сс= 100Ср/(100-Wр). |
(2) |
28
Основой природных газов является метан, содержание которого в газе
(76,7…98,9) %.
В состав природного газа входят также водород Н2, водородные соединения СmHn , сероводород H2S и негорючие газы: двуокись углерода СО2, кислород О2, азот N2 и незначительное количество водяных паров Н2О.
Состав сухого газообразного топлива, в процентах по объему:
СО + Н2 + ∑CmHn + H2S + CO2 + N2 = 100. |
(3) |
Состав влажного газообразного топлива выражают следующим образом, % об.:
СО + Н2 + ∑CmHn + H2S + CO2 +О2 +N2+H2O = 100. |
(4) |
Примеры составов различных видов топлив приведены в табл. 4, 5, 6, 7.
3.2.1.3. Характеристики органических топлив
Все топлива характеризуются определенными показателями качества, например по ГОСТ 4.19, ГОСТ 13674, ГОСТ 26098, ГОСТ 10585, ГОСТ 5542. Основные из показателей рассмотрены ниже.
Влажность топлива. Различают два вида влаги в топливе:
внешнюю и внутреннюю (или гигроскопическую), называемую также анали-
тической. Внешняя влага состоит из влаги, осаждающейся на поверхности, и капиллярной, содержащейся в капиллярах топлива. Гигроскопическая (аналитическая) влага находится частью в коллоидально-связанном состоянии и равномерно распределена в горючей массе топлива, а частью в виде гидратной влаги, входящей в состав молекул минеральных примесей.
Большое содержание внешней влаги приводит к смерзанию твердого топлива в зимнее время, ухудшению его размола, уменьшению сыпучести.
В зависимости от содержания влаги и ее вида твердые топлива подразделяются на три категории:
1)рабочее топливо (в том виде, как оно поступает в топку) с рабочей влажностью Wp;
2)воздушно-сухое топливо, влажность которого Wа = Wги приведена в равновесие с влажностью окружающего воздуха;
З) абсолютно сухое топливо, которое совершенно не содержит влаги. Абсолютная влажность определяется отношением массы влаги к абсо-
лютно сухой массе топлива, относительная — отношением массы влаги к общей массе топлива.
Для топочных мазутов, транспортируемых водным путем или слитых при подогреве свежим паром, устанавливается норма содержания воды — не более
5 %. Влагосодержание газообразного топлива при теплотехнических расчетах принимается 10 г/м3 при температуре 10 °С.
29
Содержание влаги не является достаточной характеристикой энергетической ценности топлива. Для сравнительной оценки топлив по содержанию влаги введено понятие приведенной влажности, кг· % / МДж
Wпр = Wр/Qнр.
Зольность топлива. Зола представляет собой твердый минеральный остаток после сжигания топлива и состоит из топочных шлаков и летучей золы. Состав шлаков и золы, определяющий их свойства: SiО2, Al2О3, FeO, Fe2О3, известь СаО, Na2O, K2O‚ V2О5, сульфаты СаSО4, MgSO4. Содержание минеральных примесей в твердом топливе изменяется от 1 % у древесины до 75 % в горючих сланцах. В международной геологической статистике запасы углей подсчитываются только до значения зольности 50 %.
Зольность мазутов колеблется от 0,04 до 0,12 %, а у мазута, вырабатываемого из бикинских нефтей, зольность может достигать 0,5 %. Для сравнительной оценки количества золы используется приведенная зольность топлива, кг·
%/МДж
Апр=Ар/Qгр.
Важное практическое значение имеет плавкость золы, характеризующаяся следующими температурами: t1 − начало деформации, t2 −начало размягчения и t3 − начало жидкоплавкого состояния. Зола разделяется на тугоплавкую (t3
>1425 °С), среднеплавкую (1200 °С < t3 <1425 °С) и легкоплавкую (t3<1200 °С).
Выход летучих из топлива и коксовый остаток. После подачи в топку твердое топливо проходит следующие стадии перед воспламенением: нагрев и испарение поверхностной и капиллярной влаги; нагрев воздушно-сухого топлива и разложение его на газовую и твердую фазы. Газовая фаза называется выходом летучих и состоит из горючих соединений − углеводородов, окиси углерода и водорода и негорючих − углекислого газа, кислорода, азота и водяных паров. Твердая фаза, называемая также коксовым остатком, состоит из углерода, органической серы и минеральной части топлива.
Коксовый остаток в зависимости от типа топлива может быть спекшийся, слабоспекшийся и порошкообразный. Характер коксового остатка играет решающую роль при определении наиболее рационального пути использования топлива. Каменные жирные угли с большим содержанием битума дают спекшийся крупнопористый остаток, используемый в металлургических печах; в котлах и отопительных установках такие угли не сжигаются. Энергетические топлива имеют порошкообразный коксовый остаток.
Сернистость топлива. Сера, содержащаяся в твердом топливе, подразде-
ляется на органическую, сульфидную, элементарную и сульфатную. Обычно в расчетах принято элементарную серу относить к органической. Таким образом, общее содержание серы в топливе
Sобщ =Sо +Sсд +Sст. |
(5) |
30
Сульфатная сера Sст в горении не участвует.
При сжигании топлива Sобщ переходит в продукты сгорания. Так, при сжигании антрацита около 97 % Sобщ переходит в дымовые газы в виде SО2 и небольшого количества SO3(2...3) % Sобщ , содержится в летучей золе, которая уносится дымовыми газами, а шлак связывает менее 0,5 % Sобщ. При сжигании сланцев летучая зола может связывать больше половины общего количества серы в топливе. В рабочей массе твердого топлива содержится от 0,1 до 8,4 % серы.
Сера в жидком топливе содержится в виде сероорганических соединений (меркаптанов, сульфидов, дисульфидов в др.), элементарной серы и сероводорода. Все они участвуют в горении. Содержание серы в малосернистом мазуте — 0,5 %, в сернистом — 2,0 % , в высокосернистом — 3,5 %.
Сера в газовом топливе содержится в основном в виде сероводорода Н2S. В природных и промышленных газах сера практически отсутствует, в попутных газах содержание серы незначительно.
Важной характеристикой топлива является его теплота сгорания. Различают высшую Qвр и низшую Qнр рабочую теплоту сгорания. Высшей теплотой сгорания называют то количество теплоты, которое будет отдано продуктами сгорания, полученными от сжигания одного килограмма топлива, если продукты сгорания будут охлаждены до 0 °С, включая и теплоту конденсации водяных паров, находящихся в продуктах сгорания.
Низшая теплота сгорания Qнр отличается от высшей на теплоту испарения влаги топлива и влаги, образующейся при горении водорода. В энергетических установках влага в продуктах сгорания остается в парообразном состоянии и теплота, затраченная на ее испарение, не используется. Поэтому экономические показатели работы котлов и промышленных печей определяются, как правило, по низшей теплоте сгорания.
Вопросы для самопроверки
1.Какие виды органического топлива используются в промышленных установках? Назовите их основные характеристики.
2.Перечислите способы переработки различных видов топлива. Дайте характеристику продуктов переработки.
3.Назовите вновь разрабатываемые месторождения органического топлива. Дайте характеристику топлив этих месторождений.
4.Охарактеризуйте энергетический баланс РФ на данный период и тенденции его изменения.
5.Дайте характеристики топлив, используемых на Вашем предприятии.
6.Что понимается под элементарным составом топлива? Приведите данные по элементарному составу твердого, жидкого и газообразного топлива.
7.Что такое теплота сгорания топлива? В чем отличие высшей теплоты сгорания от низшей? Назовите теплоту сгорания для твердого, жидкого и газообразного топлива.
31
8.Как определить теплоту сгорания топлива экспериментальным методом
ирасчетом?
9.Назовите марки мазутов и их основные физико-химические свойства.
10.Дайте определение выхода летучих и коксового остатка. Поясните их влияние на воспламенение и устойчивость горения топлива.
11.Что такое условное топливо? Как рассчитать расход условного топлива, зная расход натурального, и наоборот?
3.2.2.Материальный и тепловой балансы процесса горения топлива
Впроцессе работы с данным разделом Вам предстоит:
-изучить две темы;
-выполнить блок практических занятий (задачи 5…7);
-ответить на вопросы для самопроверки;
-ответить на вопросы тренировочного теста № 2;
-завершить решение контрольной работы.
3.2.2.1.Материальный баланс процесса горения
3.2.2.1.1.Стехиометрические соотношения горения топлива
Горючие элементы топлива вступают в химическую реакцию с кислородом в определенном соотношении. Расход кислорода (а значит и воздуха) и количество образующихся продуктов сгорания определяются на основании стехиометрических уравнений горения.
Стехиометрическое уравнение горения углерода записывается в виде
С + О2 = СО2 , |
(6) |
т.е. 12 кг С +32 кг О2 = 44 кг СО2; при пересчете на 1 кг С
1 кг С + 32/12 кг О2 = 44/12 кг СО2 + 33 705 кДж/кг.
Из этого равенства следует, что для сжигания углерода требуется 32/12=2,67 кг кислорода, при этом выделяется 44/12 = 3,67 кг углекислого газа и 33 705 кДж/кг теплоты.
Для удобства расчета топливно-энергетических балансов и учета запасов энергии в топливах различной теплоценности, а также для сравнения удельных расходов топлива на единицу выработанной энергии используется понятие условного топлива с теплотой сгорания 29,3 МДж/ кг (7000 ккал/ кг). Для пере-
счета Qнр натурального топлива в Qнусл условного ее делят на 29,3, конечную величину называют тепловым эквивалентом данного топлива
32
|
Qр |
|
|
|
Э = |
н |
, |
(7) |
|
29,3 |
||||
|
|
|
который используется для пересчета расхода натурального топлива в расход условного топлива
Вусл=ВнатЭ. (8)
Количество расходуемого на сжигание топлива кислорода и образующихся продуктов сгорания приведено в табл. 8.
3.2.2.1.2. Количество воздуха, необходимое для сжигания топлива
Количество воздуха, расходуемого для сжигания топлива, определяется по количеству потребляемого для этого кислорода. Состав воздуха при расчетах горения обычно задается основными компонентами – азотом и кислородом.
Зная расход кислорода (табл. 8), найдем количество потребляемого воздуха, кг/кг (м3/кг):
G°в= Gо 2 100/23 = [2,67Ср + 8(Нр - Ор/8) |
+ Sлр] 100/23, |
(9) |
V°в = Vо 2 100/21 = [1,866 Ср + 5,6(Нр - Ор/8) |
+0,7 Sлр] 100/21. |
(10) |
Формулы (9), (10) позволяют определить теоретическое (минимальное) количество воздуха, которое необходимо для полного сжигания 1 кг топлива (твердого или жидкого), при условии, что весь содержащийся в воздухе кислород прореагирует с углеродом, водородом и серой.
В действительных условиях сжигания топлива в топках количество потребляемого воздуха требуется больше теоретически необходимого. Это обусловлено недостаточным качеством перемешивания частиц топлива с кислородом воздуха и другими факторами, определяющими процесс горения (например качество распыления жидкого топлива или тонина помола твердого топлива и качества перемешивания пыли с воздухом).
Отношение объемов действительного расхода воздуха к теоретически необходимому называют коэффициентом избытка воздуха:
α = Gв/Gв° = Vв/Vв°. |
(11) |
Значение коэффициента избытка воздуха зависит от вида топлива. Примерные эксплуатационные значения α следующие:
-для газового топлива α = 1,01…1,1;
-для мазута α = 1,02…1,15;
-для угля α = 1,03…1,6.
33

Таблица 8
|
|
Стехиометрические соотношения горения компонентов топлива |
|
|
|||||||||
|
|
|
|
|
|
|
На 1кг реагирующего вещества |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
расход кисло- |
подводится азо- |
|
|
получается |
|
|
||||
|
|
|
углекислоты |
сухих продук- |
|
|
|||||||
|
Реакция |
|
|
рода |
та (из воздуха) |
или сернистого |
водяных паров |
||||||
|
|
|
тов сгорания |
||||||||||
|
|
|
|
|
|
|
|
ангидрида |
|
|
|
|
|
|
|
|
по |
|
по объ- |
по |
по объ- |
по |
по объ- |
по |
по объ- |
по |
по объ- |
|
|
|
весу, |
|
ему, |
весу, |
ему, |
весу, |
ему, |
весу, |
ему, |
весу, |
ему, |
|
|
|
кг |
|
м3 |
кг |
м3 |
кг |
м3 |
кг |
м3 |
кг |
м3 |
|
Горение углерода |
|
2,67 |
|
1,866 |
8,83 |
7,024 |
3,67 |
1,866 |
12,5 |
9,0 |
- |
- |
|
С + О2 = СО2 |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
34 |
Горение водорода |
|
8 |
|
5,6 |
26,3 |
20,9 |
- |
- |
26,3 |
20,9 |
9,0 |
11,20 |
|
2Н + О2 = 2Н2О |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Горение серы (органиче- |
|
|
|
|
|
|
|
|
|
|
|
|
|
ской) |
|
1,0 |
|
0,7 |
3,3 |
2,63 |
2,0 |
0,7 |
5,3 |
3,31 |
- |
- |
|
S + О2 = SО2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Горение серы |
|
|
|
|
|
|
|
|
|
|
|
|
|
(железного колчедана) |
|
1,37 |
|
0,96 |
4,54 |
3,61 |
2,0 |
0,68 |
6,54 |
4,3 |
- |
- |
|
4FeS2+10O2=2Fe2O3+8SO2 |
|
|
|
|
|
|
|
|
|
|
|
|
Примечание. При составлении таблицы приняты следующие значения плотности газов: кислород – 1,429 кг/м3, углекислота – 1,964 кг/м3, водяные пары – 0,805 кг/м3, сернистый ангидрид – 2,927 кг/м3, азот – 1,257 кг/м3.
34
3.2.2.1.3. Состав и объем продуктов сгорания
Продукты сгорания при полном сжигании состоят из углекислого газа Vco2 , сернистого ангидрида Vso2 , паров воды Vн 2 о, кислорода Vo2 , соответст-
вующего избыточному количеству воздуха, и азота VN 2 , не участвующего в |
|
процессе горения, м3/кг |
|
Vг = Vсо 2 + Vsо 2 + Vо 2 + VN 2 + Vн 2 о, |
(12) |
где Vсо 2 + Vsо 2 + Vо 2 + VN 2 = Vсг – сухие газы. |
|
Общий объем продуктов сгорания найдется как сумма объемов сухих газов и водяных паров, м3/кг
Vг = Vсг + Vн2 о= 1,866 Ср/100 + 0,7 Sлр/100 + 0,21(α - 1) Vр°+ 0,79α Vв° +
+0,01Nр/1,25 + 1,242 (9Нр +Wр)/100 + 0,0016α Vв° d. |
(13) |
Сухие газы характеризуются также процентным содержанием в них каждого газа, %: кислорода – О2 = 100 Vо 2 / Vсг, азота − N2 = 100 VN 2 / Vсг; углекислого газа – СО2 = 100 Vсо 2 / Vсг, сернистого ангидрида – SO2 =100 Vsо 2 / Vсг .
При неполном сгорании топлива в продуктах сгорания находится окись углерода Vсо; содержание этого газа в сухих газах определится по следующей зависимости, %: СО = 100 Vсо/ Vсг.
При полном сжигании топлива (СО = 0) и при α = 1 продукты сгорания будут иметь минимальный объем, его значение, м3/кг, может быть найдено на основании уравнения (13), положив в нем α =1,
V°г = 1,866 Ср/100 + 0,7 Sлр/100 + 0,79 Vв° + 0,01Nр/1,25 + 1,242 (9Нр+
+Wр)/100 + 0,0016Vв° d. |
(14) |
Минимальный объем сухих газов составит, м3/кг |
|
V°сг = 1,866 Ср/100 + 0,7 Sлр/100 + 0,79 Vв°+ 0,01Nр/1,25. |
(15) |
Теоретический объем водяных паров будет равен, м3/кг |
|
V°н 2 о = 1,242 (9Нр +Wр)/100 + 0,0016Vв° d. |
(16) |
35
Располагая минимальным (теоретическим) объемом сухих газов, как следует из (15), который зависит от состава топлива, можно определить действительный объем сухих газов, м3/кг
Vсг = V°сг + (α - 1) Vв°. |
(17) |
Второе слагаемое этого выражения характеризует объем всего избыточного воздуха, который перешел в объем сухих газов.
3.2.2.1.4.Коэффициент избытка воздуха
Вобщем виде значение коэффициента избытка воздуха было записано формулой (11).
Численное значение коэффициента избытка воздуха рассчитывается
обычно по данным газового анализа продуктов сгорания. Существует несколько формул для определения α .
Обозначим через Vв действительный расход воздуха, ∆Vв – объем избыточного воздуха, не участвующего в горении; тогда теоретически необходимый
объем воздуха будет Vв-∆Vв. Общее выражение для коэффициента избытка воздуха в этом случае запишется в виде:
α = Vв/( Vв-∆Vв). |
(18) |
А. Кислородная формула расчета α .
Если сделать допущение, что при полном сжигании топлива объем действительно введенного воздуха равен объему сухих газов, Vв=Vсг, а избыточный объем воздуха выразить через содержание кислорода в продуктах сгорания
Vв =VO2 /0,21=O2Vсг / 21,
то формула (18) запишется следующим образом:
α = Vсг / (Vсг– O2Vсг / 21) = 1/(1–O2 21). |
(19) |
Окончательно кислородная формула по расчету коэффициента избытка воздуха принимает вид:
α = 21/(21–O2 ). |
(20) |
По газовому анализу продуктов сгорания определяется значение О2, а следовательно, может быть рассчитано значение α.
36
Б. Азотная формула расчета α .
В формуле (19) объем подошедшего на горение воздуха Vв можно выразить через содержание азота в продуктах сгорания (пренебрегая малым содержанием азота в топливе): Vв =VсгO2 / 21.
Тогда |
|
α = 1/ (1–∆Vв/Vв) = 1 (1–79О2/21N2). |
(21) |
Равенство (21) является азотной формулой для определения коэффициента избытка воздуха.
В. Углекислотная формула расчета α .
Для приближенных расчетов коэффициента избытка воздуха иногда применяют углекислотную формулу.
Если считать α = Vв/Vвº= Vсг/Vсгº, то можно выразить объемы сухих газов через содержание углекислого газа в продуктах сгорания:
Vсг=100V CO2 /CO2 и Vсг=100V CO2 /(CO2)max. |
(22) |
Отсюда получим углекислотную формулу для определения α
α = (CO2)max/CO2, |
(23) |
где (CO2)max – известная для каждого топлива характеристика, а CO2 определяется газоанализатором.
3.2.2.2.Тепловой баланс процесса горения
3.2.2.2.1.Анализ уравнения теплового баланса
Впроцессе горения химически связанная энергия топлива преобразуется
вфизическую теплоту продуктов сгорания, используемую в различных тепловых процессах и установках.
Вобщем виде тепловой баланс процесса горения можно представить как равенство между приходом и расходом теплоты. Приходная часть теплоты без потерь переходит в теплоту продуктов сгорания:
Qприх = Hг0 . |
(24) |
Приходная часть теплового баланса процесса горения в целом имеет вид:
Qприх = Qнр + Qфт + Qок + Qрасп, |
(25) |
37
где Qфт и Qок – соответственно физическая теплота топлива и окислителя; Qрасп
– теплота распылителя (например пара, используемого для распыления жидкого топлива).
Расходная часть теплового баланса адиабатического процесса горения имеет вид
Qрасх = Hг0 = Hг + ∑ Qпот , |
(26) |
где Hг – теплота (энтальпия) газообразных продуктов сгорания |
топлива; |
∑ Qпот – суммарные потери теплоты при горении, |
|
∑ Qпот = Qхн + Qмн + Qшл + Qд, |
(27) |
где Qхн – потеря теплоты вследствие химической неполноты сгорания топлива; Qмн - потеря теплоты вследствие механической неполноты сгорания топлива; Qшл - потери с физической теплотой шлаков; Qд – теплота, затрачиваемая на термическую диссоциацию продуктов сгорания.
При наличии теплообмена продуктов сгорания со стенами (ограждающими поверхностями) камеры сгорания, что является одной из причин неадиабатичности процесса горения в реальных условиях, возникает потеря теплоты через ограждающие поверхности Qно. С ее учетом суммарные потери
∑ Qпот = Qхн + Qмн + Qно + Qшл + Qд . |
(28) |
3.2.2.2.2. Тепловые характеристики продуктов сгорания
Энтальпией продуктов сгорания называют количество теплоты, которое содержится при постоянном давлении в газах, образовавшихся от сгорания 1 кг (1 м3) топлива, при нагревании их от 0 °С до температуры tг.
В случае адиабатического горения, когда вся теплота, выделяющаяся при сжигании 1 кг (1 м3) топлива, без потерь целиком переходит в продукты сгорания, последние имеют максимально возможную (теоретическую) энтальпию Hг0 . Энтальпия продуктов горения Hг, МДж/кг (МДж/м3), в общем виде запи-
шется
Hг = tг ∑ υi сi , |
(29) |
а в развернутом виде |
|
Hг = (υсо 2 ссо 2 + υsо 2 сsо 2 + υN 2 сN 2 + υо 2 со 2 + |
|
+ υн 2 осн 2 о+ α ун сзл Ар/100) tг , |
(30) |
где υсо 2 , υsо 2 , υN 2 и т. д. – объемы соответствующих газов в продуктах сгорания, м3/кг (м3/м3); ссо 2 , сsо 2 , сN 2 и т. д. – средние в интервале температур от 0 до tг
38
объемные теплоемкости соответствующих газов, МДж/(м3·К); α ун – доля золы топлива, уносимая продуктами сгорания; сзл – теплоемкость золы при tг, МДж/(кг·К).
Энтальпию продуктов полного сгорания |
можно представить также в виде |
|
Hг = Н°г + (α -1) |
H°ок + Hз , |
(31) |
где H°г – энтальпия теоретического количества продуктов сгорания (α =1) при расчетной температуре tг , МДж/кг (МДж/м3); определяется по теоретическому выходу продуктов сгорания
H°г = (υRO 2 сRO 2 + υ°N 2 сN 2 + υ°H 2 O cH 2 O) tг ; |
(32) |
где (α -1) H°ок – энтальпия избыточного, сверх теоретически необходимого количества окислителя;
H°ок = H°сух.ок + H°Н2 О , |
(33) |
где H°сух.ок – энтальпия теоретического объема сухого окислителя; |
|
H°Н 2 О – энтальпия водяных паров, содержащихся в окислителе. |
|
Энтальпия золы в уносе, МДж/кг, |
|
Hзл = 0,01α ун сзл Ар |
(34) |
подсчитывается только в том случае, если |
|
α ун Ар · 103/ Qнр > 1,4. |
(35) |
3.2.2.2.3 Температурные характеристики продуктов сгорания
Если вся введенная в топку теплота без потерь (Qхн= Qмн= Qно= Qшл= Qд=0) переходит в продукты сгорания, то при этом развивается наивысшая тем-
пература, которая называется адиабатической (калориметрической) температурой горения, ºС:
ta = Hr / Σvici. |
(36) |
0 |
|
С ростом α эта температура уменьшается.
Если полное сгорание топлива без потерь теплоты осуществляется в стехиометрическом количестве воздуха, т. е. при α = 1, и при вводе холодного воздуха и топлива, т. е. при tв = 0 ºС, tтоп = 0 ºС, то температура сгорания зависит только от качества топлива.
39
Такую температуру Д.И. Менделеев назвал жаропроизводительностью топлива, ºС:
tмакс=Qнр/ Σvici. |
(37) |
При сжигании углеводородного топлива имеют место эндотермические реакции диссоциации продуктов горения.
Примем Σ Qпот = Qд.
Развивающаяся в этом случае температура называется теоретической температурой горения, ºС:
tтеор=( Hг0 –Qд)/ Σvi'ci', |
(38) |
где vi' – выход продуктов сгорания с учетом диссоциации, м3/кг (м3/м3); ci' – средние теплоемкости продуктов сгорания с учетом диссоциации, кДж/(м3·К);
Qд – теплота, затрачиваемая на диссоциацию продуктов сгорания, кДж/кг
(кДж/м3).
Влияние диссоциации начинает заметно сказываться при температуре ta > 1500 ºС. Так, при сжигании мазута для ta = 1700 ºС теоретическая темпера-
тура tтеор = 1675 ºС, для ta = 1800 ºС tтеор = 1760 ºС, для ta = 2000 ºС tтеор = 1910 ºС,
для ta = 3000 ºС tтеор = 2500 ºС. Реальные температуры, развивающиеся в топках котлов и печей, обычно меньше 2200 ºС. При этом, с учетом (25), ºС:
tтеор=(Qнр+Qфт+Qфв–Qд)/ Σvici, |
(39) |
где vi и ci – выход и теплоемкость продуктов сгорания без учета их диссоциации, а потери теплоты Qд, кДж/кг(кДж/м3), рассчитываются с учетом диссоциации только СО2 и Н2О.
При температуре ниже 2000 ºС диссоциацией пренебрегают, в этом слу-
чае tа = tтеор.
При теплотехнических расчетах печей пользуются действительной тем-
пературой печи, ºС
tтоп = ηпtа, |
(40) |
где ηп – пирометрический коэффициент топки (печи), учитывающий потери теплоты вследствие неполного сгорания, потери через кладку, на излучение и выбивание газов через окна, а также прямую отдачу теплоты металлу излучением. Для большинства печей ηп = 0,60…0,85.
Температуры сгорания являются локальными для определенных точек факела и определенных условий горения. В ядре факела температура равна теоретической, а в остальных точках факела температура ниже tтеор. Среднюю температуру факела определяют из выражения, К
40

|
|
= 4 |
T2 |
T2 |
, |
(41) |
T |
||||||
|
ф |
теор |
T |
|
|
|
где TT – температура газов на выходе из топки, К.
Вопросы для самопроверки
1.Что такое теоретическое количество воздуха, необходимое для сжигания одного килограмма топлива? Как рассчитывается это количество воздуха? Чем отличается действительный расход воздуха от теоретического?
2.Как определяется объем сухих домовых газов? Каков порядок расчета объема водяных паров?
3.Что понимается под полным и неполным горением топлива?
4.Изложите порядок определения теоретического объема продуктов сгорания. Каково отличие действительного объема продуктов сгорания от теоретического?
5.Как составляются стехиометрические уравнения сгорания компонентов топлива?
6.Каков порядок расчета энтальпии продуктов сгорания? Изобразите диаграмму энтальпия - температура для продуктов сжигания при разных коэффициентах избытка воздуха.
7.Поясните физический смысл коэффициента избытка воздуха; как он определяется практически?
8.Уравнение теплового баланса процесса горения; поясните его составляющие.
9.Энтальпия дымовых газов, энтальпия воздуха, подаваемого для горения: физический смысл, единицы измерения и способы определения.
10.Поясните составляющие потерь процесса горения.
11.Дайте определение температуры вспышки, температуры воспламенения, температуры горения, теоретической и адиабатической температуры горения, расчет последних.
12.Напишите уравнения полного и неполного горения, поясните их составляющие.
3.2.3.Теоретические основы топочных процессов
Впроцессе работы с данным разделом Вма предстоит:
-изучить четыре темы;
-выполнить одну лабораторную работу (№ 6);
-выполнить блок практических занятий (задачи 8…14);
-ответить на вопросы для самопроверки;
-ответить на вопросы тренировочного теста № 3.
41
3.2.3.1.Основные понятия кинетики реакций горения
3.2.3.1.1.Параметры смесей и химические реакции
Газообразное топливо, пары жидкого топлива, воздух, продукты сгорания топлива состоят из различных химических компонентов, образующих газовую смесь. Состояние однокомпонентного газа определяется двумя термодинамическими параметрами: давлением и температурой, многокомпонентного – химическим составом, давлением и температурой. В процессе горения одни вещества исчезают и возникают другие. Термодинамика реагирующих в процессе горения веществ учитывает взаимные превращения веществ, энергии, теплоты и работы.
Состав сложной многокомпонентной смеси определяется концентрацией компонентов. Концентрацию i –го вещества в смеси определяют как число молекул Ni в единице объема V. В этом случае говорят о молекулярной концен-
трации
νi = |
Ni |
. |
(42) |
|
|||
|
V |
|
|
Молярная концентрация определяет число молей ni в единице объема
c = |
ni |
. |
|
|
|
(43) |
||||
|
|
|
|
|
|
|||||
i |
|
|
V |
|
|
|
|
|||
|
|
|
|
|
|
|
||||
Плотность i –го вещества |
|
|
|
|
|
|
|
|
|
|
ρi |
= |
|
Nimi |
|
, |
(44) |
||||
|
|
|
||||||||
|
|
|
|
|
V |
|
|
|
|
|
где mi – масса молекулы i – го вещества, |
|
|
|
|
|
|
|
|
|
|
m |
|
= |
Mi |
, |
|
(45) |
||||
|
|
|
||||||||
i |
|
|
|
N A |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
где Mi –молекулярная масса i-го вещества; NA = 6,02*1023 моль-1 – число Авагадро. Число молекул i-го вещества можно определить из выражения Ni = NAni.
Используя вышеприведенные выражения, легко установить связь между концентрациями
ρ |
= c M |
i |
= |
νi Mi |
. |
(46) |
|
||||||
i |
i |
|
N A |
|
||
|
|
|
|
|
||
42
Используют также относительные концентрации:
- относительная молярная концентрация определяется отношением
x |
= |
ci |
, |
(47) |
|
k |
|||||
i |
|
|
|
||
|
|
∑ci |
|
|
i =1
k
где ∑ci – число молей в смеси всех веществ, занимающих объем V, отнесенное
i =1
k |
|
k |
|
|
|
|
|
|
|
|
|
к этому объему, т. е. ∑ci = С, тогда ∑xi |
= 1; |
|
|
|
|
|
|
|
|||
i =1 |
|
i=1 |
|
|
|
|
|
|
|
|
|
- относительная массовая концентрация |
|
|
|
|
|
|
|
||||
|
|
ρi |
|
k |
|
|
|
|
k |
||
Yi = |
|
( ∑ρi =ρ; |
|
∑Yi =1). |
|||||||
|
k |
|
|||||||||
|
∑ρi |
i =1 |
|
|
|
i=1 |
|||||
|
i=1 |
|
|
|
|
|
|
|
|
||
Молекулярная масса смеси |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
−1 |
||
|
|
k |
|
|
∑Yi |
||||||
M = ∑Mi xi = |
i =1 |
|
|
|
|||||||
|
|
|
|
|
. |
||||||
M |
i |
|
|||||||||
|
|
i =1 |
|
|
|
|
|
|
|||
Отсюда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
x = MY и M |
= |
xi Mi |
. |
|||||||
|
|||||||||||
|
i |
i |
i |
|
|
|
|
Yi |
|||
|
|
|
|
|
|
|
|
|
|||
(48)
(49)
(50)
Приведенные соотношения справедливы как для газов, так для твердых и жидких однородных смесей, в которых компоненты распределены равномерно по всему объему.
В теории горения принимается, что все компоненты газовой смеси являются идеальными газами, т. е. в них отсутствует взаимное притяжение между молекулами, а объем молекул пренебрежимо мал по сравнению с объемом, занимаемым газом. Уравнение состояния i-го газа устанавливает связь между его парциальным давлением рi, концентрацией νi , температурой Т:
pi = kνiT , |
(51) |
43
где k =1,38·10-23Дж/К – постоянная Больцмана. Известно, что k=R/NA, ранее бы-
ло показано, что νi = ρi N A , тогда
Mi
pi = |
RTρi |
, |
(52) |
|
|||
|
Mi |
|
|
где R =8,31 Дж/(моль·К) – универсальная газовая постоянная. Закон Дальтона, справедливый для идеальных газов, имеет вид
k |
RTρ |
|
|
|
P = ∑pi = |
, |
(53) |
||
M |
||||
i =1 |
|
|
т. е. давление смеси газов равно сумме парциальных давлений его компонентов. Используя закон Авогадро (при одинаковых давлении и температуре одинаковые количества вещества различных идеальных газов занимают один и тот же объем), можно определить относительную молярную концентрацию i-го ве-
щества из выражения
x |
= |
ci |
= |
pi |
= |
Vi |
, |
(54) |
|
|
|
||||||
i |
|
C |
|
P V |
|
|||
|
|
|
|
|||||
где Vi – парциальный объем i-го вещества.
Уравнение химических реакций в общем виде можно описать следую-
щим выражением: |
|
|
|
∑ai' Ai ↔ ∑ai'' Bi (i=1,2…,k), |
(55) |
||
i |
i |
|
|
где i - номер реагирующего вещества; |
a' |
– стехиометрический коэффициент i- |
|
|
i |
|
|
го реагента в прямой реакции (т. е. реакции, идущей слева направо); a'i' – то же
для обратной реакции; Аi, Вi – химические символы i-х реагентов. Стехиометрические коэффициенты – это коэффициенты, определяющие количественные соотношения между реагирующими веществами.
Слева и справа от стрелок записаны все реагирующие вещества, исходные и конечные, так что a'i = 0 для конечных продуктов a'i' = 0 для исходных реаги-
рующих веществ прямой реакции.
Скорость химической реакции. Пусть за время dτв ходе химической реакции число молекул каждого реагирующего вещества из общего их количества i=1, 2, …, k изменится на значение dNi . При отсутствии обмена массы реаги-
рующих веществ с окружающей средой
44
dN1 |
= |
dN2 |
= ... = |
dNk |
, |
(56) |
||
a |
|
|
||||||
|
a |
2 |
|
a |
k |
|
||
1 |
|
|
|
|
|
|||
т. е. изменение количеств реагирующих веществ пропорционально их стехиометрическим коэффициентам. Это одно из определений известного в химии закона кратных отношений. В ходе химических реакций происходит превращение одних веществ в другие, молекулы исходных веществ в процессе химического реагирования исчезают, однако количество каждого типа атомов сохраняется неизменным. Равенство (56) выражает сам факт сохранения атомов при химических превращениях. Иначе закон сохранения атомов можно записать в форме
k |
k |
|
∑B jici = ∑B jici0 , |
(57) |
|
i =1 |
i =1 |
|
где Вji – число атомов j-го типа в i-м веществе; сi0 – молярная концентрация вещества до реагирования. Изменение числа молей любого вещества в процессе реагирования называется скоростью реакций w=(dci/d τ)/ai, где τ – время.
3.2.3.1.2. Химическое равновесие
Как уже указывалось, химические реакции идут в обе стороны с одновременным образованием конечных продуктов и исходных веществ. Если процесс химического реагирования длится достаточно долго, то между исходными и конечными продуктами реакции устанавливается динамическое равновесие. Так, тело, в разных местах которого поддерживается разная, но постоянная во времени температура, находится в стационарном состоянии. Если тело изолировать от внешней среды, то постепенно температура его во всем объеме выравнивается и наступает равновесное состояние. Таким образом, стационарное состояние определяется внешними условиями, а равновесие – внутренними причинами. Условия равновесия описываются с помощью функций состояния. В соответствии со вторым законом термодинамики, для функции состояния энтропии можно записать условие равновесия идеального обратимого процесса
ds – dQ/T = dQ’/T, |
(58) |
где dQ — теплота из внешней среды; dQ'— теплота реагирования внутри системы. При V, s = const условие химического равновесия имеет вид
dU |
|
V ,s = 0 . |
(59) |
|
|||
|
|
Внутренняя энергия U в этом случае называется термодинамическим потенциалом, сопряженным с параметрами V и s. Если использовать вместо V и
45
s другие термодинамические пары, то можно получить при равновесии следующее равенство:
dU |
|
V ,s = dH |
|
p,s = dF |
|
V ,T = dG |
|
p,T , |
(60) |
|
|
|
|
||||||
|
|
|
|
|
где Н=U+pV — энтальпия; F=U—Ts — изохорно-изотермический потенциал (энергия Гельмгольца); G = Н—Ts — изобарно-изотермический потенциал (энергия Гиббса). Отсюда следует, что условие равновесия одинаково для всех типов процессов (изотермических, изобарических и др.).
Взависимости от условий (температуры, давления) равновесие смещается
всторону исходных веществ или в сторону продуктов распада. Известно правило, называемое принципом Ле-Шателье-Брауна. В соответствии с этим принципом при изменении условий, в которых происходит реакция, равновесие смещается так, чтобы противодействовать изменению этих условий. Например, при горении прямая реакция идет с выделением теплоты, а обратная — с поглощением; в этом случае при повышении температуры в системе равновесие смещается в сторону исходных веществ, тепловыделение уменьшается, при понижении температуры равновесие смещается в сторону продуктов реакции. При не очень высоких температурах эти смещения незначительны.
Давление воздействует на положение равновесия, когда реакция протекает с изменением объема газов. В этом случае при повышении давления равновесие смещается в сторону уменьшения объема, а при понижении давления — в сторону увеличения объема. Так, в реакции
2Н2 + О2 = 2Н2О
с ростом давления равновесная полнота реагирования водорода с кислородом повышается, при уменьшении давления увеличивается равновесный распад водяного пара.
Принцип Ле-Шателье-Брауна показывает качественный характер смещения равновесия, но не позволяет провести количественные расчеты равновесного состава. Расчет равновесного состава является очень трудной задачей. Здесь мы укажем только общие положения такого расчета и поясним некоторые зависимости, необходимые для понимания процессов горения.
Пусть идеальная газовая смесь имеет температуру Т0, при которой известен ее состав, и объем V; в процессе реагирования смесь не обменивается массой с окружающей средой; температура смеси изменяется от Т0 до Т, при этом устанавливается новый равновесный состав. Перепишем уравнение (55) в следующем виде:
a'1 A1 + a'2 A2 + ... ↔ a' '1 B1 + a' '2 B2 + ... . |
(61) |
46
С приближением к условию (60), т. е. при стремлении термодинамической системы к равновесию, для реакции (61) можно записать
|
|
xBa''1 |
xBa''2 ... |
− |
G |
− s |
− |
H |
|
|
|
|
1 |
2 |
|
= Kx = e |
RT = e |
R e |
RT , |
(62) |
|
|
|
xAa'1 |
xAa'2 ... |
|||||||
|
1 |
2 |
|
|
|
|
|
|
|
|
где G – |
изменение изобарно-изотермического потенциала в реакции при |
|||||||||
стандартном давлении (1,01·104 Па) и температуре Т; |
|
H = ∑ai |
Hi — изме- |
|||||||
нение энтальпии, равное теплоте реакции Qp |
|
|
i |
|
||||||
при постоянном давлении; |
||||||||||
s = ∑ai |
si — изменение энтропии в реакции; Hi и |
si — теплота образования |
||||||||
i
иэнтропия исходных веществ и продуктов реакции при стандартном давлении
итемпературе Т; хА , хА , …; xB1 ,xB2 ,… — относительные молярные концентра-
ции исходных веществ и продуктов реакции (см. (57), (54)).
Кх называется константой равновесия по относительным молярным концентрациям. Она зависит от давления и температуры. Выражение (62) есть закон действующих масс (термодинамический): при равновесии связь между массами участвующих в прямой и обратной реакциях веществ определяется константой равновесия.
Запишем выражение (62) в виде
|
|
|
m |
|
|
|
|
|
|
∏xia''i |
|
|
|
K |
x |
= |
i =1 |
. |
(63) |
|
k |
||||||
|
|
|
|
|||
|
|
|
∏xia'i |
|
|
i=1
Кроме константы равновесия Кх, используют константы равновесия по парциальным давлениям Кр и молярным концентрациям Кс:
|
|
|
|
|
m |
|
|
||
|
|
|
|
|
∏pia''i |
|
|
||
K |
p |
= |
i =1 |
, |
(64) |
||||
k |
|||||||||
|
|
|
|
|
|
||||
|
|
|
|
|
∏xia'i |
|
|
||
|
|
|
|
|
i =1 |
|
|
||
|
|
|
|
|
m |
|
|
||
|
|
|
|
∏cia''i |
|
|
|||
K |
c |
= |
i =1 |
. |
|
(65) |
|||
|
|
||||||||
|
|
|
k |
|
|
||||
|
|
|
|
∏cia'i |
|
|
|||
i =1
47
3.2.3.1.3. Кинетический закон действующих масс
В предыдущих разделах были рассмотрены химические реакции с точки зрения термодинамики. При этом считалось, что равновесные концентрации в реакциях горения устанавливались мгновенно, и время из рассмотрения исключалось. Для многих практических задач такой подход правомерен, однако имеются задачи, когда необходим анализ химических процессов в их временном развитии. Скорости и механизмы механических процессов, законы их протекания во времени изучает химическая кинетика.
Равновесное состояние химический реакции вовсе не означает, что реакция прекратилась. В действительности реакция протекает непрерывно, но с одинаковой скоростью в обоих направлениях. Общее представление о скорости реакции было рассмотрено в ранее. Скорость зависит от концентрации реагентов и температуры. При постоянной температуре скорости прямой w" и обратной w" реакций пропорциональны произведениям концентраций реагентов, возведенных в целочисленные степени (равные стехиометрическим коэффициентам):
k |
m |
|
w' = k' ∏cia'i ; |
w'' = k'' ∏cia''i . |
(66) |
i =1 |
i =1 |
|
Коэффициенты пропорциональности k’ и k’’, зависящие от температуры и химической природы реагирующих веществ (но не от концентраций), называют константами скоростей. Константа скорости — это скорость реакции, которая была бы при условии, что концентрации всех реагентов равны единице, вовсевремяреагирования.
Скорость реакции пропорциональна числу столкновений молекул реагирующих веществ в единицу времени, а число столкновений в свою очередь пропорционально произведению концентрации; этим элементарно обосно-
вывается кинетический закон действующих масс, который можно записать в виде
k |
m |
|
w = w'−w'' = k' ∏cia'i |
− k'' ∏cia''i . |
(67) |
i =1 |
i =1 |
|
По мере расходования в процессе реагирования исходных реагентов скорость прямой реакции будет уменьшаться, а скорость обратной — увеличиваться, и наступит момент, когда w’ = w’’ и w = 0. Мы опять пришли к понятию равновесного состояния, но теперь с позиции кинетики: равновесие — это равенство скоростей прямой и обратной реакций. Из (67) при условии равновесия следует
|
|
|
k' |
|
∏cia''i |
|
|
|
K |
c |
= |
= |
i =1 |
, |
(68) |
||
k'' |
k |
|||||||
|
|
|
|
|
||||
|
|
|
|
∏cia'i |
|
|
i =1
48
что соответствует определению константы равновесия по концентрациям
(см. (65)).
3.2.3.1.4. Закон Аррениуса
Константа скорости элементарной реакции при постоянных концентрациях реагирующих веществ зависит от температуры но закону Аррениуса
− |
E |
|
|
( RT ) , |
|
||
k(T ) = k0e |
(69) |
||
где E – энергия активации, Дж/моль; k0 — частотный фактор, учитывающий общее столкновение молекул, размерность k0 совпадает с размерностью k.
Чтобы произошел один элементарный акт химической реакции, необходимо столкновение молекул и их взаимодействие. Число столкновений очень велико (численно оно пропорционально Т1/2), но не всякое столкновение приводит к реакции.
Пусть в процессе некоторой реакции один атом от молекулы А переходит к молекуле В, в результате чего образуются новые вещества С и D. Энергия ядра атома при химических реакциях не меняется, изменяется лишь энергия взаимодействия атома со всеми другими атомами. Условно зависимость энергии перехода атома от молекулы А к молекуле В можно изобразить в виде кривой (рис. 4). Зависимость энергии атома от координаты реакции х имеет два локальных минимума (и максимум между ними). Ордината ( · ) А – энергия атома в молекуле А. Состояние в ( · ) А устойчиво по отношению к бесконечно малым внешним воздействиям, иначе существование вещества А было бы невозможно. Ордината ( · ) В — энергия атома в молекуле В. Состояние в ( · ) В также устойчиво в малом.
Чтобы реакция произошла, т. е. чтобы атом смог перейти or молекулы А к молекуле В, нужно при столкновении молекул передать атому энергию, большую чем U0—UA. Атом должен преодолеть этот потенциальный барьер. Энергия U0—UA, проходящая через один моль вещества, и есть энергия активации:
E =(U0 −U A )N A ,
где N A – количество молекул А, находящихся в одном моле.
Экспоненциальный множитель —E/(RT) в законе Аррениуса (69) называется активационным множителем. Он указывает долю столкновений от общего их числа, при которых может произойти реакция.
После завершения реакции энергия атома становится равной UB . Величина (U A −U B )N A — теплота реакции одного моля вещества. На рис. 4.
49

Рис. 4. Энергия перехода при превращениях молекул
переход от А к В — экзотермическая реакция: (U A −U B )N A >0. В случае об-
ратной реакции атом преодолевает потенциальный барьер U0—UA более высокий, чем в прямой реакции; обратная реакция эндотермическая, теплота поглощается, причем в том же количестве, в котором она выделилась в прямой реакции. Теплота реакции не имеет прямого отношения к численному значению потенциального барьера, т. е. нет связи между теплотой реакции и энергией активации.
3.2.3.1.5. Влияние давления и состава смеси на скорость реакции
Существует классификация газовых реакций в зависимости oт вида молекул, вступающих в реакцию: мономолекулярные реакции, в которых реагирует один вид молекул, давая при этом одну или несколько новых молекул; бимолекулярные реакции, в которых взаимно реагируют две молекулы, давая одну или несколько новых молекул.
Изменение скорости реакции в зависимости от давления и состава гомогенной смеси можно установить, используя уравнение состояния газа
PV = nRT ,
где Р – давление смеси, Н/м2; п — количество смеси, моль; R — универсальная газовая постоянная, Дж/(моль-К). Для любого компонента газовой смеси
piV = ni RT ,
из (54) следует
pi = Pxi ;
с учетом (43)
pi = niVRT = ci RT .
50
Приравнивая два последних выражения, получим
ci = |
xi P |
|
. |
(70) |
|
( RT ) |
|||||
|
|
|
|||
Скорость реакции выразим через изменения концентрации одного из компонентов продуктов реакции cB1 . С учетом выражений (61), (66), (69) получим:
- для мономолекулярной реакции
|
|
dcB |
|
= k' ' cA , |
|
(71) |
|
|
|
1 |
|
|
|||
dτ |
|
|
|||||
|
|
1 |
|
|
|||
|
|
|
|
|
|
||
- для бимолекулярной реакции |
|
|
|
|
|||
|
dcB |
= k'' cA cA . |
(72) |
||||
|
1 |
|
|||||
|
|
||||||
|
|
dτ |
1 |
2 |
|
||
|
|
|
|
|
|||
С учетом (70) выражения (71) и (72) примут вид
dcB |
= |
|
k'' xA P |
; |
|
|
(73) |
|||||
1 |
|
|
|
1 |
|
|
||||||
dτ |
|
|
( RT ) |
|
|
|||||||
|
|
|
|
|
|
|
|
|||||
|
dcB |
|
|
|
|
|
k' ' xA |
xA |
P |
|
||
|
1 |
|
= |
|
1 |
2 |
|
. |
(74) |
|||
|
|
( RT )2 |
|
|||||||||
|
dτ |
|
|
|
|
|
|
|
|
|||
Таким образом, при постоянной температуре скорость реакции пропорциональна давлению смеси для мономолекулярной реакции и квадрату давления для бимолекулярной реакции. В общем виде
dcB |
н |
|
|
1 |
|
|
|
|
~Р |
, |
(75) |
dτ |
где н – порядок реакции.
Если продукты реакции выразить в относительных концентрациях (см. (47)), то выражения (73) и (74) примут вид:
|
dxB |
= k'' xA |
; |
(76) |
||
|
1 |
|
||||
dτ |
||||||
|
1 |
|
|
|||
|
|
|
|
|
||
dxB |
= k'' xA |
xA , |
(77) |
|||
1 |
|
|||||
|
|
|||||
|
dτ |
1 |
2 |
|
||
|
|
|
|
|||
51
т. е. скорость мономолекулярной реакции, выраженная через относительные молярные концентрации компонентов, не зависит от давления, а для других реакций пропорциональна давлению в степени на единицу меньше, чем порядок реакции:
dxB |
~Р |
н-1 |
. |
(78) |
1 |
||||
dτ |
|
3.2.3.1.6. Изменение скорости реакции во времени
Число прореагировавших молей в единице объема за время τ обозначим сB. Тогда, в соответствии с законом действующих масс, для рассматриваемо-
Рис. 5. Зависимость скорости реакции от порядка реакции
го момента времени скорость реакции можно записать в виде
dcB |
= k( cA − cB ), |
(79) |
|
dτ |
|||
|
|
где сА — начальная концентрация реагирующего вещества. Решение уравнения (79) при постоянной температуре имеет вид
cB = cA(1 − ekτ ). |
(80) |
Графическая иллюстрация зависимости (80) приведена на рис. 5. Экспоненциальный закон расходования исходного вещества показывает, что в начальный момент количество продуктов реакции (или расхода исходного вещества) увеличивается, затем этот процесс замедляется. С повышением порядка реакции χ скорость реакции падает.
Организация процесса горения предусматривает обеспечение многих факторов. Например:
-к горючему необходим подвод окислителя;
-составы горючего и окислителя должны соответствовать условиям воспламенения;
-необходимо обеспечить воспламенение топливоокислительной смеси;
52
- необходимо создать условия для стабилизации воспламенения и горе-
ния.
Удовлетворение этих условий зависит от протекания кинетических и диффузионных процессов. Рассмотрим некоторые из них.
В соответствии с современным представлением, основанном на работах Н. Н. Семенова, горение протекает по цепному принципу. В процессе цепной реакции на начальном этапе образуются промежуточные продукты (радикалы, свободные атомы), обладающие повышенной реакционной активностью. Последние вступают в химические взаимодействия между собой и исходными реагентами, в результате появляются конечные продукты и одновременно регенерируются активные промежуточные продукты, количество которых с течением времени при определенных условиях увеличивается. Скорость такого цепного процесса лавинообразно возрастает (цепной взрыв).
Начальный процесс образования активных продуктов из исходных веществ называется зарождением цепи. Этот процесс идет с поглощением энергии, т. е. является эндотермическим, так как для разрыва внутримолекулярных связей необходима энергия.
Разветвление цепи происходит в результате реагирования одной молекулы активного вещества с исходным веществом, вследствие чего образуются две или несколько молекул активного продукта.
Под обрывом цепи понимается процесс, при котором активный продукт исчезает. Если скорость разветвления больше скорости обрыва, то происходит развитие цепной реакции, если скорость обрыва больше скорости разветвления, то реакция не происходит. К обрыву цепи может привести столкновение активных центров между собой, с молекулами инертного газа или со стенкой сосуда.
Схема реакции горения водорода, протекающей по цепному принципу, приведена на рис. 6. Итоговый результат одной цепочки горения водорода можно представить следующим равенством:
Н+ 3Н2+О2 = 3Н + 2Н2О. |
(81) |
Из этого уравнения видно, что вступление одного атома водорода в реакцию привело к появлению конечного продукта (2Н2О) и трех новых активных центров — атомов водорода, т. е. имеется процесс разветвления цепи.
53
H2 + M →[H]+ H + M
+
O2
↓ |
↓ |
OH |
O |
+ |
+ |
H2 |
H2 |
↓ ↓ |
↓ ↓ |
H2O [H] |
[H] OH |
|
+ |
|
↓ ↓ |
|
H2 H2O |
|
↓ |
|
[H] |
Рис. 6. Цепной принцип горения водорода
3.2.3.2. Воспламенение и горение частицы топлива
Горение частицы пылевидного топлива. Примем следующую модель процесса: реагирование протекает на поверхности частицы топлива сферической формы; частица в газовой среде движется вместе с ней с одинаковой скоростью; горение выделяющихся летучих и догорание продуктов неполного сгорания происходит в объеме газовой среды; конвективный перенос теплоты из системы отсутствует, а лучистый теплообмен моделируется взаимодействием реагирующей смеси с облучателем, температура которого принимается постоянной; теплообмен частицы с газовой средой происходит путем конвекции и диффузионной теплопроводности [3].
Как известно, при очень тонком размоле углей зола топлива отделяется и поэтому в мелких частицах не содержится. С учетом того, что в процессе приготовления угольной пыли топливо подсушивается, в расчетах принято, что в процесс горения вступают топливные частицы, состоящие только из горючей массы.
Вначальный момент времени газовая среда имеет температуру, значительно превышающую температуру частицы. Частица топлива воспринимает теплоту газовой среды конвекцией и от горящего факела – радиацией и нагревается. При этом из него возгоняются летучие. Выделяющиеся летучие могут реагировать в газовой фазе, а твердая коксовая масса – в гетерогенном режиме.
Врасчетах принята наиболее общая схема реагирования: углерод реагиру-
ет с кислородом газовой фазы с образованием СО и СО2, получающийся диоксид углерода может реагировать с твердой фазой, образуя СО. Оксид углерода, получаемый как в первичном, так и во вторичном процессе реагирования, вступает в химическое соединение с кислородом в газовой фазе. Принимается, что
54
гетерогенные реакции и реакции, протекающие в окружающем частицу газовом объеме, идут по следующим итоговым уравнениям:
- окисление углерода до СО |
|
2С + О2 = 2СО + QСО; |
(82) |
- окисление углерода до СО2 |
|
С + О2 = СО2 + QCO2 ; |
(83) |
- восстановление диоксида углерода |
|
СО2 + С = 2СО - QCO2 ; |
(84) |
- горение оксида углерода |
|
2СО + О2 = 2СО + Q12. |
(85) |
Теплота химического реагирования, протекающего на поверхности частицы, передается конвекцией и диффузионной теплопроводностью окружающей газовой среде и частично расходуется на дальнейшей нагрев самой частицы. Температура частицы возрастает, причем это возрастание происходит тем более интенсивно, чем интенсивнее протекает химическое реагирование и чем меньше теплоотдача в газовую среду. В ходе реагирования диаметр частицы уменьшается, изменяются температура частицы, температура и состав газовой среды.
Горение единичной капли жидкого топлива и горение жидкого топлива в факеле подробно рассмотрено в [1].
3.2.3.3.Смесеобразование и горение
3.2.3.3.1.Смессообразование
Смесеобразование жидкого и газообразного топлива необходимо изучить, используя [1]. Смешение твердого топлива с воздухом производится различными способами в зависимости от метода сжигания: в плотном слое, в кипящем слое, в низкотемпературном вихре, в высокотемпературном вихре (циклоне), в факеле.
В неподвижном слое (рис. 7, а) куски топлива не перемещаются относительно решетки, под которую подается необходимый для горения воздух. В кипящем слое (рис. 7, б) частицы твердого топлива под действием скоростного напора воздуха интенсивно перемещаются одна относительно другой. Кипящий слой существует в границах скоростей от начала псевдоожижения до режима пневмотранспорта.
55
Рис. 7. Схемы сжигания топлива в неподвижном и кипящем слое: 1 – подвод воздуха; 2 – решетка; 3 – дутьевое кольцо
В топке с низкотемпературным вихрем (топка ЛПИ) на фронте котла устанавливают крупнощелевые горелки с наклоном вниз под углом 40…45°. Топливо (дробленые бурый уголь, торф) смешивается в горелке с воздухом (40…45 % от общего его расхода) и подается в топку; вторичный воздух (15…20 %) подается в топку через специальные каналы горелки; третичный воздух (35…40 %) подается через сопла, устанавливаемые в нижней части заднего скота холодной воронки (рис. 8).
Рис. 8. Топка с низкотемпературным вихрем:
1 – горелка; 2 – головка шахт; 3 – сопла нижнего дутья
Для сжигания огрубленной пыли и дробленки (R5 = 5…10 %) в высокотемпературном вихре камера сгорания выполнена в виде циклона. Дробленка подается через вихревые горелки первичным воздухом (15…20 % всего подаваемого на горелке воздуха). Вторичным воздухом подается в циклон тангенциального через сопла, размещенные на боковой поверхности циклона, со скоростью до 150 м/с. (рис. 9)
56
Рис. 9. Топка со встречным расположением горизонтальных циклонов.
Наиболее технически сложной является подготовка твердого топлива для сжигания его в пылевидном состоянии в факеле. Подготовка топливновоздушной смеси перед сжиганием производится частично в горелочном устройстве, где перемешивается угольная пыль и часть воздуха, подаваемого к горелке. Расход этого воздуха (первичного воздуха) составляет 15…25 % от теоретически необходимого при сжигании пыли АШ, ПА, тощих и каменных углей и 20…25 % – при сжигании пыли бурых углей. Этот же воздух транспортирует пыль и подает ее в топку. Остаток необходимого воздуха подается через специальные каналы горелочного устройства (рис. 10), так что окончательно топливо-воздушная смесь подготавливается на выходе из горелки перед фронтом воспламенения.
Рис. 10. Пылеугольная щелевая горелка с внешней подачей пылевоздушной смеси: 1 – патрубок пылевоздушной смеси; 2 – патрубок вторичного возду-
ха; 3 – каналы пылевоздушной смеси; 4 – каналы вторичного воздуха; 5 – отбойные плиты в каналах пылевоздушной смеси
57

3.2.3.3.2.Горение твердого топлива
Внеподвижном слое куски топлива не перемещаются относительно решетки, под которую подается необходимый для горения воздух (рис. 6, а). Горение топлива в неподвижном слое происходит поэтапно. Топливо 4 (рис. 11), ссылаемое на горящий кокс, прогревается. Выделяющиеся летучие сгорают, образуя послойное пламя 5. Максимальная температура (1300 – 1500 °С) наблюдается в области горения коксовых частиц 3.
Рис. 11. Структура неподвижного слоя при горении топлива и изменение α , О2, СО, СО2 и t по толщине слоя:
1 – решетка; 2- шлак; 3 – горячий кокс; 4 – топливо; 5 – надслойное пламя
Вслое можно выделить две зоны: окислительную, α > 1; восстановительную,
α< 1. В окислительной зоне продуктами реакции горючего и окислителя яв-
ляются как СО2, так и СО. По мере использования воздуха скорость образова-
ния СО2 замедляется, максимальное ее значение достигается при избытке воздуха α = 1. В восстановительной зоне ввиду недостаточного количества кисло-
рода (α < 1) начинается реакция между СО2 и горящим коксом (углеродом) с образованием СО. Концентрация СО в продуктах сгорания возрастает, а СО2 уменьшается. Длина зон в зависимости от среднего размера δкчастиц топлива
следующая: L1 =( 2 − 4 )δк ; L2 =( 4 − 6 )δк . На длины зон L1 и L2 (в сторону их уменьшения) влияют увеличение содержания летучих горючих VЛГ , уменьше-
ние зольности АР, рост температуры воздуха.
Поскольку в зоне 2 кроме СО содержится Н2 и СН4, появление которых связано с выделением летучих, то для их дожигания часть воздуха подается через дутьевые сопла 3, расположенные над слоем (см. рис. 7, а).
В кипящем слое крупные фракции топлива находятся во взвешенном состоянии. Кипящий слой может быть высокотемпературным и низкотемпературным. Низкотемпературное (800 – 900 °С) сжигание топлива достигается приразмещении в кипящем слое поверхности нагрева котла. Динамика кипящего слоя (по его высоте hсл) – выход газообразных составляющих (SO2, SO, H2 и О2)
58
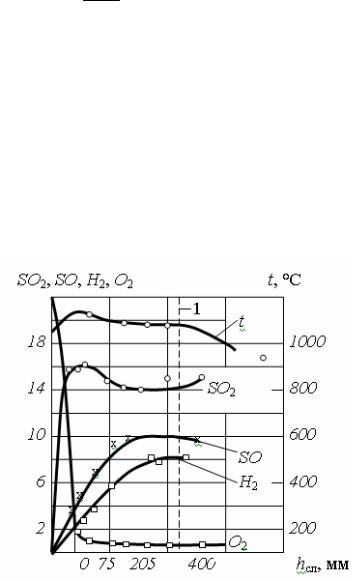
и изменение температуры t – представлена на рис. 12. В отличие от неподвижного слоя, где размер частиц топлива достигает 100 мм, в кипящем слое сжигается дробленый уголь с δк ≤ 25мм. В слое содержится 5 – 7 % топлива (по объ-
ему). Коэффициент теплоотдачи к поверхностям, расположенным в слое, до-
вольно высок и достигает 240 мВт2К .
При сжигании малозольных топлив для увеличения теплоотдачи в слой вводят наполнители в виде инертных зернистых материалов: шлак, песок, доломит. Доломит связывает оксиды серы (до 90 %), в результате чего снижается вероятность возникновения низкотемпературной коррозии. Более низкий уровень температур газов в кипящем слое способствует уменьшению образования в процессе горения оксидов азота, при выбросе которых в атмосферу загрязняется окружающая среда. Кроме того, исключается шлакование экранов, т. е. налипание на них минеральной части топлива.
Следует отметить также циркулирующий кипящий слой, характерной особенностью которого является приближение к работе слоя в режиме пневмотранспорта.
Рис. 12. Изменение газообразных составляющих
SO2, SO, H2 и О2 и температуры t в кипящем слое (по высоте hсл): 1 – граница кипящего слоя
Горение угольной пыли является сложным физико-химическим процессом, состоящим из химических реакций и физических процессов, протекающих в условиях взаимной связи и взаимного влияния.
Следовательно, при изучении горения пыли в факеле должны быть учтены следующие факторы:
1) непосредственное химическое реагирование происходит не в исходной пылевоздушной смеси, а после ее смешения с горячими продуктами сгорания, т. е. реагирующей является пылегазовоздушная смесь;
59
2) реагирующая смесь образуется в турбулентных пылегазовоздушных струях, распространяющихся в среде продуктов сгорания;
3) используемая для сжигания на электростанциях в качестве топлива угольная пыль является полидисперсной. В общей реакционной смеси частицы разных размеров реагируют с различной интенсивностью при различных температурах поверхности и концентрации кислорода у нее.
3.2.3.4. Образование оксдов азота при горении
В результате хозяйственной деятельности человека в атмосферу Земли выбрасывается значительное количество вредных веществ: золы, оксидов серы, углерода, азота. Наибольшей токсичностью из них обладает оксид азота NOх. Так, максимальная разовая предельно допустимая концентрация NO2 (ПДКмр) равна 0,085 мг/м3 по сравнению с 0,5 мг/м3 для SO2 и пыли и 5 мг/м3 для СО. Ежегодно в атмосферу поступает более 830 млн т NOХ. ИЗ этого количества 770 млн т появляются вследствие различных атмосферных явлений. Эти оксиды азота равномерно распределены в атмосфере Земли, концентрация их в воздухе незначительна и составляет безвредную фоновую концентрацию. Около 2,4 млн. т оксидов азота выбрасывается в атмосферу вследствие деятельности химической промышленности, 51 млн т — при сжигании органического топлива. Из них примерно 40 % приходится на долю тепловых электростанций. Эти оксиды азота имеют локальный характер, концентрация их особенно высока в районе расположения топливосжигающих установок.
Оксиды азота могут образовываться в зоне горения всех топлив по трем механизмам:
1)«термическому», когда окись азота образуется в результате взаимодействия азота с атомами и радикалами О, N и ОН диссоциированных молекул: выход NО в этом случае значительно зависит от температуры горения;
2)«быстрому», действующему в начале зоны горения; образование NО
происходит при взаимодействии азота с радикалами СН, СН2; этот механизм определяет минимальный выход оксида азота при горении газового топлива, слабо зависит от температуры и в значительной степени – от структуры молекулы топлива;
3)«топливному», зависящему от содержания азота в топливе и коэффициента избытка воздуха.
Методы снижения скорости реакции образования «термических» NО и тем самым уменьшения их концентрации в продуктах горения:
1) снижение общего уровня температур в топке путем рециркуляции продуктов сгорания с t < 400 °C, подачи пара и воды в зону горения и в дутьевой воздух;
2) снижение максимальных локальных температур в топке путем подачи газов рециркуляции, пара и воды в зоны максимальных температур;
3) уменьшение максимальной температуры и содержания кислорода в
60
зоне максимальных температур путем организации ступенчатого горения; 4) уменьшение общего избытка окислителя в пределах, допустимых по
условиям возникновения продуктов химического и механического недожога и бензопирена.
Для образования «быстрых» оксидов азота можно отметить следующее: - быстрое окисление азота во фронте пламени характер но для углеводо-
родов и углеродсодержащих топлив; - «быстрые» оксиды азота образуются на участке фронта пламени
около 10 % его ширины, причем процесс образования начинается уже у передней границы фронта пламени в области температур около 1000 К;
- наиболее характерными признаками образования «быстрых» оксидов азота являются: а) кратковременность процесса их образования; б) слабая зависимость выхода NO от температуры горения; в) сильная зависимость выхода NO от α и смещение пика концентраций в область богатых горючих смесей;
-выход «быстрых» NO при горении природного газа составляет 100...
120 мг/м3 и не может быть снижен ступенчатым горением;
-задача снижения «быстрых» NOх пока не решена.
По результатам исследования «топливных» оксидов азота можно сде-
лать следующие выводы: |
|
|
|
- необходимо учитывать влияние |
процесса окисления азотсодержа- |
||
щих соединений топлива на общее содержание NOх; |
|
|
|
- при сжигании низкокачественных |
топлив выход «топливных» NOх бо- |
||
лее значителен при низких температурах горения |
(Тmax<1800 К); |
при |
|
сжигании высокореакционных топлив |
в крупных |
установках влияние |
|
«топливных» NОх меньше;
-образование «топливных» NOХ − происходит на начальном участке факела в области образования «быстрых» NO и до образования «термических»
NO;
-абсолютный выход «топливных» NO тем больше, чем больше содержание азота в топливе;
-степень перехода азота топлива в NO быстро увеличивается с ростом
α.
Вопросы для самопроверки
1.Что понимается под химической обратимостью реакции? Какие факторы оказывают влияние на химическое равновесие данной реакции?
2.Как записывается закон действующих масс? Дайте определение скорости прямой и обратной реакции.
3.Объясните зависимость химического равновесия и скорости реакции от температуры.
4.Что такое константа химического равновесия и константа скорости ре-
акции?
5.Запишите и поясните закон Аррениуса.
61
6.Назовите и поясните условия, при которых возможно воспламенение и устойчивое горение.
7.Что понимается под диссоциацией водяного пара и углекислоты?
8.Какое влияние на скорость реакции оказывает давление?
9.Какое влияние на скорость реакции оказывает наличие инертной примеси в реагирующих веществах?
10.Что понимается под цепными реакциями горения?
11.Объясните основные положения стационарной теории теплового самовоспламенения.
12.Назовите и поясните механизмы образования оксидов азота при горении органических топлив.
13.Изобразите схему затопленной изотермической турбулентной струи.
14.Чем обусловлено нарастание расхода жидкости по длине струи?
15.Какая струя называется неизотермической?
16.Изобразите схему распространения пламени.
17.Какое влияние на скорость распространения пламени оказывают давление, состав и температура смеси?
18.Изобразите схему пламени в турбулентном потоке.
19.Поясните основные положения аэродинамики и гидрогазодинамики кипящего слоя.
3.2.4.Сжигание топлива
Впроцессе работы с данным разделом Вам предстоит:
-изучить две темы;
-решить одну задачу (№ 15) из блока практических занятий;
-ответить на вопросы для самопроверки;
-ответить на вопросы тренировочного теста № 4.
3.2.4.1. Подготовка топлива к сжиганию
Подготовка к сжиганию жидкого и газообразного топлива достаточно подробно рассмотрена в учебном пособии [1], его и следует использовать при изучении данного раздела. Подготовка к сжиганию твердого топлива включает в себя работы от приема топлива на территории котельной или ТЭС до подачи его в топку котла в кусковом, дробленом или пылевидном состоянии (в зависимости от способа сжигания).
Топливное хозяйство котельной, работающей на твердом топливе, представляет собой систему механизмов, схема работы и компоновка которых определяется количеством сжигаемого топлива, видом его (уголь, торф, горючие сланцы), способом доставки, особенностями выбранных механизмов. Необходимость разгружать, перегружать и погружать большое количество топлива требует полной механизации всех этих операций, так как они очень трудоемки и ручное выполнение их требует большого числа рабочих и значительной затраты денежных средств.
62
На рис. 13 показано выполнение системы углеподачи и угольного склада для небольшой котельной с применением автопогрузчиков. Топливо из штабеля 1 доставляется автопогрузчиком 4 по пандусу 6 к приемному бункеру 7 котельного цеха 8. Из этого бункера топливо наклонным питателем подается в бункера котельной. В бездействии автопогрузчик содержится под навесом 2. Взвешивают топливо на автомобильных весах 5.
Топливо хранят в штабелях правильной формы, вид которых определяется конфигурацией площади склада и родом погрузочно-разгрузочных механизмов; чаще всего штабель имеет форму прямоугольной усеченной пирамиды. Размеры штабелей по ширине, длине и высоте на механизированных складах не ограничиваются и определяются только возможностями складских механизмов. Высота штабеля для всех углей, кроме антрацита, ограничивается лишь при отсутствии механизации погрузочно-разгрузочных работ на складе.
Рис. 13. Угольный склад котельной:
1 – угольный штабель; 2 – навес для автопогрузчика; 3, 6 – пандусы; 4 – автопогрузка; 5 – автомобильные весы; 7 – приемный бункер; 8 – здание котельной
Важным условием нормальной эксплуатации является плановый обмен запаса топлива на складе. При отсутствии ненормального повышения температуры в штабеле и строгом соблюдении правил техники безопасности допускается
хранение топлива на складе в течение следующих сроков: |
|
Бурые и каменные угли, за исключением угля марки Т……………… |
6-8 мес. |
Уголь марки Т…………………………………………………………… |
до 12 мес. |
Антрацит………………………………………………………………… |
до 2 лет |
63

Топливное хозяйство ТЭС. Уголь на ТЭС доставляется железнодорожным транспортом широкой (1524 мм) колеи.
Поступающие на станцию полувагоны с топливом взвешиваются (рис. 14). Основной тип разгрузочного устройства на ТЭС – вагоноопрокидыватели.
Рис. 14. Техническая схема топливоподачи ГРЭС:
1 – здание вагоноопрокидователей; 2 – дробильный корпус; 3 – узлы пересыпок; 4 – угольный склад; 5 – траншея; 6 – краны-перегружатели; 7 – разгрузочная эстакада; 8 – подземные бункера; ЛК – ленточный конвейер
Перед сжиганием твердого топлива в факеле оно предварительно размельчается в специальных мельничных устройствах до пылевидного состояния.
Тонкость помола угольной пыли оценивается ее фракционным составом, получаемым обычно путем рассева определенной массы пробы пыли через ряд сит стандартных размеров. Тонкость помола существенно влияет на производительность мельницы и удельные расходы электроэнергии на размол, на потери теплоты от механического недожога, на надежность воспламенения и устойчивость фронта воспламенения и горения.
На практике качество пыли принято оценивать значением полного остатка при просеивании пробы пыли через сито с размерами ячеек 90 мкм – R90.
Тонкость помола и дисперсность угольной пыли определяют рассевом пыли по ГОСТ 3584-73. Масса 25…50 г пыли в течение 20 мин рассеивается
64
через 8…10 сит, установленных на специальной рассеевочной машине. Размеры ячеек сит 20, 50, 90, 200, 500, 1000, 1500 мкм.
По результатам рассева строится кривая зависимости остатков на разных ситах от размера х (Rх), называемая интегральной зерновой характеристикой, или помольной характеристикой
Rx =100e−bxn , |
(86) |
где b – коэффициент, характеризующий тонкость измельчения, чем больше b, тем пыль тоньше, значения b в промышленных мельницах изменяются от 4·10-3 для грубой пыли до 40·10-3 – для тонкой пыли; n – коэффициент полидисперсности пыли, он характеризует равномерность структуры пыли: чем больше значение n, тем меньше отличаются размеры пылинок друг от друга; для монодисперсной пыли n→∞.
Для пыли, выдаваемой, например, мельницей-вентилятором, n ≈ 0,9, среднеходной мельницей – 1,1…1,3, молотковой – 1,1…1,5, шаровой барабанной мельницей – 0,7…1,0.
Удельная поверхность пыли Fпл, м2/кг – суммарная поверхность частиц пыли массой 1 кг, она может быть определена по формуле
F |
= k |
1000 |
F , |
(87) |
|
пл |
ср ρ |
пл.каж |
1000 |
|
|
|
|
|
|
|
|
где kср = 1,75 – коэффициент, учитывающий действительную форму частиц;
F1000 – условная площадь поверхности 1 кг пыли для сферических пылинок при
ρпл.каж = 100 кг/м3.
Насыпная плотность пыли может быть определена по формуле, кг/м3
ρпл.нас = 0,5ρпл.каж + 0,004R90 . |
(88) |
Взрываемость пыли Взвешенная в воздухе пыль углей, лигнитов, торфа, сланцев, полукокса
образует при определенных условиях взрывоопасную смесь. Факторами, определяющими взрывоопасность пыли, являются: содержание летучих веществ, влажность и зольность топлива, содержание серы и окисляемость угля.
Взрываемость пыли характеризуется нижним и верхним концентрационными пределами взрываемости и минимальным содержанием кислорода в аэросмеси, ниже которой обеспечивается ее взрывобезопасность (табл. 9).
65
Таблица 9
Пределы взрывоопасных концентраций топлива и кислорода в аэросмеси и максимальных давлений, возникающих при взрыве аэросмеси
Топливо |
µмин, кг/м3 |
µмакс, кг/м3 |
|
µопт, кг/м3 |
О2мин , % |
Рвзрмакс , МПа |
Каменные |
|
|
|
|
|
|
угли |
0,32…0,47 |
3…4 |
|
1,2…2 |
19 |
0,13…0,17 |
Бурые угли |
0,215…0,26 |
5…6 |
|
1,7…2 |
18 |
0,31…0,33 |
Сланец и |
|
|
|
|
|
|
торф |
0,16…0,18 |
13…16 |
|
1-2 |
16 |
0,3…0,35 |
Здесь µмин, µмакс – соответственно минимальная и максимальная взрыво- |
||||||
опасная концентрация пыли в аэросмеси; |
µопт – некоторое промежуточное (оп- |
|||||
тимальное) значение концентраций пыли в аэросмеси, при котром разовьется максимальное давление в случае взрыва аэросмеси; – минимальная
концентрация кислорода, ниже которой обеспечивается взрывобезопасность пылевоздушной смеси.
3.2.4.2. Организация сжигания топлива
Сжигание твердого топлива в неподвижном слое производится в специальных топках. Топка с неподвижным слоем может быть ручкой, полумеханической или механической с цепной решеткой. Различают топки с прямым (рис. 15, а) и обратным (рис. 15, б) ходом решеток 1, приводимых в движение звездочками 2. Расход топлива, подаваемого из бункера 3, регулируется высотой установки шибера 4 (рис. 15, а) или скоростью движения дозаторов 7 (рис. 15, б). В решетках с обратным входом топливо подается на полотно забрасывателями 8 механического (рис. 15, б, в) или пневатического (рис. 15, г) типа. Мелкие фракции топлива сгорают во взевешенном состоянии, а крупные – в слое на решетке, под которую подводится воздух 9. Прогрев, воспламенение и горение топлива происходят за счет теплоты, передаваемой излучением от продуктов сгорания. Шлак 6 с помощью шлакоснимателя 5 (рис. 15, а) или под действием собственного веса (рис. 15, б) поступает в шлаковый бункер. Структура горящего слоя представлена на рис. 15, а. Область III горение кокса после зоны II подогрева поступающего топлива (зона I) расположена в центральной части решетки. Здесь же находится восстановительная зона IV.
Сжигание твердого топлива в кипящем слое может быть организовано как в топке, так и в специальном предтопке (ванне). Кипящий слой может быть высокоили низкотемпературным. Низкотемпературным (800…900 °С) слой будет при размещении в нем поверхностей нагрева. В отличие от неподвижного слоя, где размер частиц топлива достигает 100 мм, в кипящем слое сжигается дробленый уголь с δк ≤ 25мм. В слое содержится 5 – 7 % топлива (по объему).
66
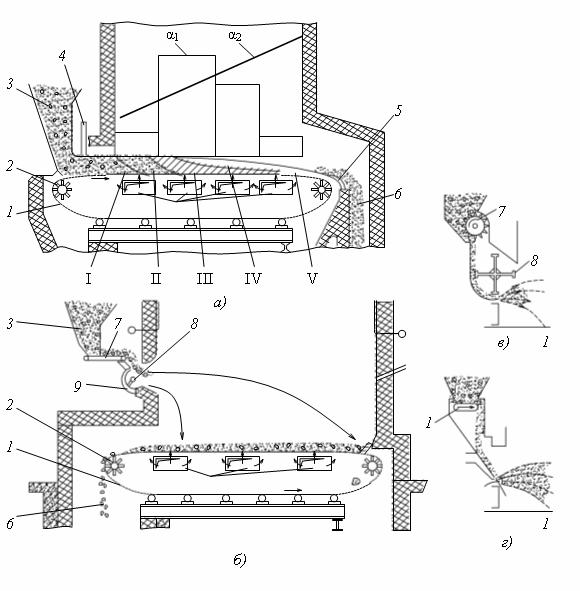
Рис. 15. Схемы цепных решеток и типы забрасывателей топлива.
Пример топки парового котла, в которой твердое топливо сжигается в низкотемпературном кипящем слое, приведен на рис. 16.
В зоне низкотемпературного кипящего слоя размещены перегревательные 8 и испарительные 9 поверхности нагрева. Подача топлива в слой 3 происходит сверху, а ввод воздуха – из короба 6 через колпачки (рис. 16, б), расположенные по полотну решетки. Отвод золы из слоя осуществляется по золоотводу 7. Мелкие фракции топлива сгорают во взвешенном состоянии над слоем. Передача теплоты испарительным поверхностям 2 в топке 1, перегревателю 11 и экономайзеру 10 происходит, как в барабанном котле.
Для обеспечения надежности циркуляции среды в испарительных поверхностях 9, расположенных в слое, используется циркуляционный насос 5.
67
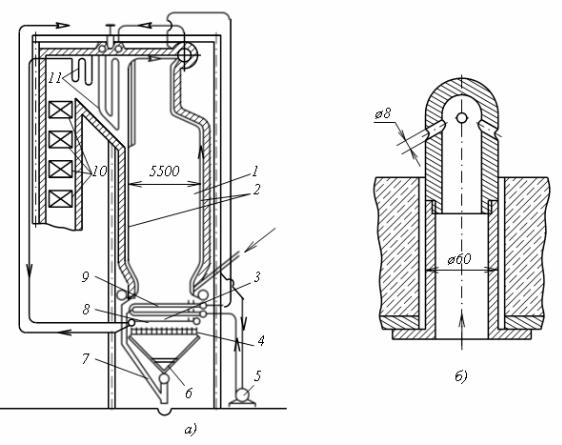
Рис. 16. Схема котла с топкой кипящего слоя: а) схема котла; б) конструкция колпачка раздачи воздуха; 1 – топка котла;
2 – экранные трубы; 3 − кипящий слой; 4 – воздухораздающая решетка; 5 – циркуляционный насос; 6 − воздушный коробок; 7 – золоотвод;
8 – пароперегревательные поверхности; 9 − испарительные поверхности; 10 – экономайзер; 11 − пароперегреватель
Факельный способ сжигания твердого топлива производится преимущественно в мощных энергетических котлах. Для сжигания в факеле размолотое до пылевидного состояния и предварительно подсушенное твердое топливо подают с частью воздуха (первичного) через горелки в топку. Остальную часть воздуха (вторичный) вводят в зону горения чаще всего через те же горелки или через специальные сопла. В топке пылевидное топливо горит во взвешенном состоянии в системе взаимодействующих газовоздушных потоков, перемещающихся в ее объеме. При большем измельчении топлива значительно возрастает площадь реагирующей поверхности, а следовательно, химических реакций горения.
По условиям смесеобразования в горящем факеле топочная камера может быть разделена на две зоны. В качестве критерия такого разделения предлагается структура поля скоростей в топочной камере. В первой зоне поле скоростей имеет значительные локальные неравномерности, что обусловлено горением несмешивающихся факелов отдельных горелок. Во второй зоне эти неравномерности незначительны, что объясняется накладкой факелов отдельных горелок, их взаимодействием (рис. 17).
68

Рис. 17. Взаимодействие факелов в горизонтальной топке котла
Тепловое напряжение топочного объема qv связано с тепловым напряжением отдельной горелки. Объем горящего факела
V = |
Sфlф |
, |
(89) |
|
|||
ф |
wсм |
|
|
|
|
|
где Sф − поперечное сечение факела; lф − его длина, wсм − скорость топливовоздушной смеси. Так как S ~ B, а lа ~ Вm , то
V = |
Bm+1 |
(90) |
, |
||
ф |
wсм |
|
|
|
а тепловое напряжение факела
qvф ~ |
wсм |
. |
(91) |
|
|||
|
Bm |
|
|
Отсюда следует, что тепловое напряжение факела отдельной горелки уменьшается при прочих равных условиях пропорционально производительности горелки в степени m. Увеличение скорости wсм приводит к повышению qvф. Распространяя эти положения на топку в целом, можно сказать, что при увеличении мощности топочного устройства для сохранения его экономичности и надежности необходимо уменьшать qv при соответствующем увеличении qF. Это положение справедливо при сохранении вида и характеристик сжигаемого топлива. При переходе на сжигание другого топлива необходимо уменьшать qv, если у него большое время индукции τинд, и можно увеличивать qv при меньшем τинд замещающего топлива. Так, при переходе с твердого топлива на газообразное qv может быть увеличено в 3...4 раза без конструктивных изменений топки,
69
мощность топки при этом возрастает на 30...50 % без ухудшения ее надежности и экономичности горения.
Надежность топочной камеры зависит также от местоположения максимума тепловыделения. Известно, что около 80...90 % топлива выгорает примерно на 50 % длины факела, т. е. максимальные тепловые потоки находятся в первой смесеобразовательной зоне топки. Допустимое значение локальных тепловых потоков определяется максимальной допустимой температурой металла экранных поверхностей топки, солесодержанием циркулирующей в экранах смеси (энтальпией среды в прямоточных и СКД-котлах) и скоростью ее движения. Следует отметить также, что с ростом локальных тепловых потоков возрастает генерация NOx [4]. В любом случае снижение локальных тепловых потоков, равномерное распределение тепловыделения факела по длине (высоте) топки способствуют более надежной ее работе. Наилучшим с этой точки зрения является прямоточный факел, но при его использовании возрастают габариты топки. Применение вихревых горелок позволяет уменьшить длину факела lф и размеры топочной камеры, однако при этом увеличивается qF, а зона максимального тепловыделения приближается к устью горелки. При сжигании мазута она располагается на расстоянии около 0,3 lф от устья горелки и 0,15 lф − при сжигании газа. Центр зоны максимального тепловыделения факела ортогонально проецируется на экранные поверхности, а радиус максимальных тепловых потоков на экраны может быть определен из выражения
Rq = 0,25B , |
(92) |
где В − производительность горелки, т/ч.
При установке вихревых горелок возрастает интенсивность перемешивания в первой зоне топки. Одной из задач топочного устройства является поддержание этой интенсивности по всей длине (высоте) топки. В значительной мере это достигается компоновкой горелок и конструкцией топочной камеры.
Другим фактором, оказывающим влияние на процессы смесеобразования в топочном устройстве под разрежением, являются неорганизованные присосы воздуха. Присосы в топке достигают 10…15 % (Δα = 0,1…0,15), а по всему тракту котла − до 30...45 %. Подача организованного воздуха через горелки уменьшается вследствие наличия присосов, смесеобразование ухудшается, так как присосный воздух в горении участвует неэффективно. К тому же наличие присосного воздуха снижает резервы по тяге дымососов, вследствие чего даже при незначительных загрязнениях поверхностей нагрева возникает недостаток тяги, что отрицательно сказывается на работе топки. При избытке воздуха на выходе из топки αт = 1,02…1,03 и присосах в топку αт = 0,1…0,13 подача организованного воздуха снижается до α ≈0,9, что нарушает нормальную работу горелок, приводит к росту длины факела и повышенному сажеобразованию. Поэтому снижать организованную подачу воздуха ниже α = 0,97…1,0 не рекомендуется, т. е. надежное и экономичное горение в топках котлов может быть обеспечено только при хорошем уплотнении топки и газового тракта.
70
Вопросы для самопроверки
1.Какое горение называется кинетическим видом горения? Как определяется скорость кинетического горения?
2.Когда наступает проскок пламени в горелку?
3.Какое горение называется диффузионным? Когда такое горение является ламинарным, когда − турбулентным? Чему равна скорость диффузионного горения?
4.Изобразите структуру турбулентного диффузионного факела.
5.Объясните пределы устойчивости горения ламинарного факела. Как осуществляется искусственная стабилизация пламени?
6.Какие методы используются для интенсификации сжигания газообразного топлива?
7.Рассмотрите классификацию горелок для сжигания газов.
8.Объясните физическую модель горения капли жидкого топлива. Изобразите схему факела жидкого топлива.
9.Какие форсунки применяются для распыления жидкого топлива? Объясните принцип их работы. Когда используется газомазутные горелочные устройства и какова особенность их конструкции?
10.Какие методы применяются для снижения вредных выбросов при сжигании мазута?
11.Объясните схему топливного тракта пылеприготовления.
12.Какова тонкость помола и зерновая характеристика угольной пыли?
13.Почему может произойти взрыв угольной пыли? Какие методы применяются для предотвращения этого процесса?
14.Объясните зависимость экономичности помола от размеров угольной
пыли.
15.Какие углеразмольные мельницы используются для приготовления угольной пыли?
16.Каковы особенности индивидуальных схем пылеприготовления с прямым вдуванием и с пылевым промежуточном бункером?
17.Объясните физическую модель гетерогенного горения твердого топлива. Какие факторы влияют на удельную скорость горения углерода?
18.В чем особенность горения мелких и крупных частиц твердого топли-
ва?
19.Какие факторы оказывают влияние на интенсификацию сжигания пылевидных топлив?
71
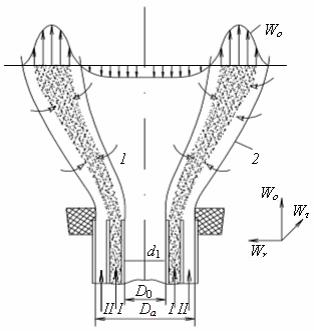
3.2.5.Горелочные устройства
Впроцессе работы с данным разделом Вам предстоит: - изучить две темы; - ответить на вопросы для самопроверки;
- ответить на вопросы тренировочного теста № 5.
3.2.5.1.Классификация и конструкции горелок
3.2.5.1.1.Горелки для пылевидного топлива
Вбольшинстве систем пылеприготовления транспортирование топлива в топку осуществляется первичным воздухом, являющимся только частью общего количества воздуха, необходимого для процесса горения. Подача вторичного воздуха в топку и организация взаимодействия его с первичным осуществляется в горелке.
Горелки предназначены для ввода в топку и перемешивания топлива и воздуха, обеспечения устойчивого воспламенения и выгорания и смеси. Они должны отвечать следующим требованиям:
- герметичность соединения с топкой; - ремонтопригодность;
- обеспечение устойчивого горения на сниженной нагрузке и при использовании резервного топлива (газа или мазута).
Взависимости от принципа организации процесса ввода пылевоздушной смеси пылеугольные горелки можно разделить на три типа: вихревые, прямоточные и плоскофакельные.
Принцип работы вихревой горелки (рис. 18) следующий.
Рис. 18. Схема работы вихревой горелки
72

Потоки первичного I и вторичного II воздуха вводят в топку через кольцевые концентрические каналы, в которых установлены завихрители. Направление крутки потоков одинаковое. Характерной особенностью такого течения является сопоставимость по величине всех трех составляющих скорости: аксиальной (продольной) wa , касательной wτ (окружной) и радиальной wr . Нали-
чие касательной составляющей скорости приводит к заметному расширению струи, образующей в пространстве параболическое тело вращения. В центральной внутренней части 1 струи образуется зона разрежения, величина которой
определяется втулочным отношением m = D0 и скоростью потоков на выходе
Da
из горелок. Под действием перепада давлений возникают обратные токи высокотемпературных продуктов сгорания (см. изменение скорости wa ), обеспечи-
вающие стабилизацию воспламенения пылевоздушной смеси. При движении первичный I и вторичный II воздух перемешиваются, и процесс горения распространяется на внешнюю поверхность 2 струи.
Взависимости от конструкции завихрителей различают горелки улиточнолопаточные, улиточно-улиточные, лопаточно-лопаточные, прямоточноулиточные и прямоточно-лопаточные. В названии сначала указывают тип завихрителя по первичному воздуху.
Через вихревые горелки целесообразна подача всех видов топлива кроме фрезерного торфа. К недостаткам этих горелок следует отнести: повышенное гидравлическое сопротивление, конструктивную сложность, необходимость выполнения выходной части из жаростойких материалов во избежание ее выгорания, повышенную склонность к сепарации топлива, несколько больший (по сравнению с горелками других конструкций) выброс окислов азота в атмосферу.
Впрямоточных горелках в отличие от вихревых потоки первичного I и вторичного II воздуха не закручиваются и имеют однонаправленное (спутное) движение (рис. 19). Касательная составляющая скорости отсутствует, а радиальная намного меньше продольной составляющей. Стабилизация воспламенения осуществляется благодаря эжекции продуктов сгорания 1 по периферии 2 струи. Нужная степень перемешивания воздуха достигается соответствующим соотношением скоростей первичного I и вторичного II воздуха.
Сопротивление прямоточных горелок меньше, чем вихревых, они проще в изготовлении, количество образующихся оксидов азота меньше.
Область применения прямоточных горелок – каменные и бурые угли. Горелки предварительного перемешивания, имеющие камеру смешения, приме-
няют в основном для торфа и бурых углей (V Г > 40 %).
К недостаткам прямоточных горелок следует отнести более высокую дальнобойность и худшие условия перемешивания смеси по сравнению с вихревыми.
В плоскофакельных горелках (рис. 20) в результате соударения струй вторичного воздуха 2, ориентированных под углом β1 друг к другу, происходит
73
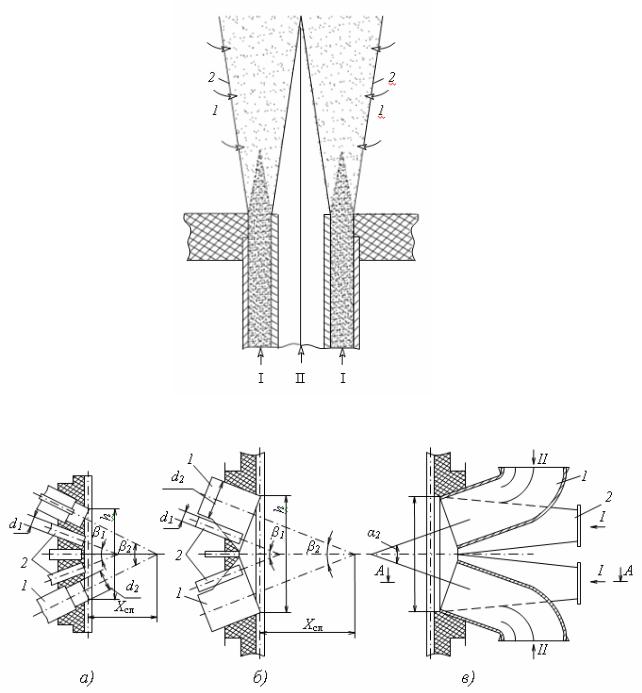
интенсификация перемешивания топлива и окислителя, увеличивается периметр струи, а следовательно, факела и уменьшается его дальнобойность. Стабилизация горения происходит так же, как и в прямоточных горелках при эжектировании горячих продуктов сгорания по поверхности струи. Отличительной конструктивной особенностью этих вариантов (рис. 20) является характер взаимного расположения каналов первичного 1 и вторичного 2 воздуха.
Рис. 19. Схема работы прямоточной горелки
Рис. 20. Плоскофакельные горелки: а, б – горелки конструкции НПО ЦКТИ; в – горелки конструкции МЭИ; I – подвод окислителя; II – подвод пыле-
воздушной смеси; 1 – пылевоздушная смесь; 2 – вторичный воздух; β1 , β2 − углы наклона каналов
74
В горелках конструкции НПО ЦКТИ (рис. 20, а, б) деформация потока происходит в основном в результате раздавливания струй первичного воздуха вторичным. В горелках конструкции МЭИ (рис. 20, в) вторичный воздух 2 как бы растягивает изнутри пылевоздушную смесь 1 по периферии. Углы наклона
каналов первичного и вторичного воздуха для схемы рис. 20, а, б β1 = 40 ÷50o, β2 = 50 ÷ 60o; для схемы рис. 19, в β2 = 20 ÷50o. Большие значения β2 прини-
маются для малореакционных топлив. Место пересечения осей струй первичного воздуха в горелке должно обеспечиваться на расстоянии от устья xсл = (2,2...2,8)bГ .
Горелки МЭИ применимы для сжигания каменных и бурых углей, а горелки НПО ЦКТИ (кроме того) – для малореакционных (рис. 20, а) и высокореакционных (рис. 20, б) топлив.
3.2.5.1.2. Форсунки для сжигания жидкого топлива
Существует два способа распределения жидкого топлива в окислителе:
1)подготовка топливовоздушной монодисперсной эмульсии (первичная смесь)
ираздача ее струями в движущийся поток воздуха, образовавшаяся при этом горючая смесь подается в топочную камеру; 2) распыление топлива различными способами и внедрение капель полифракционного состава в поток воздуха. Второй способ имеет наибольшее практическое применение, реализуется он с помощью форсунок различного типа. Горелочное устройство или горелка представляет собой инженерную конструкцию, состоящую из двух узлов − форсунки и устройства для подачи организованного потока воздуха.
Развитие конструкций форсунок для факельного сжигания жидкого топлива началось со струйного и механического принципов, затем для механических форсунок был использован центробежный эффект; в дальнейшем для распыления топлива в форсунках стала использоваться кинетическая энергия пара или воздуха. Многообразие технологий топливоиспользующих установок предопределило большое количество различных типов. Форсунки можно классифицировать в зависимости от их конструкции и технологии работы:
-механические форсунки;
-паровые форсунки;
-паромеханические форсунки;
-воздушные и компрессорные форсунки;
-ротационные (с разбросом и распылением топлива, вращающимся устройством форсунки).
Подробно конструкции форсунок и их работа рассмотрены в [3].
3.2.5.1.3.Горелки для сжигания газа
Кгорелкам для сжигания газа предъявляются следующие требования:
•создание условий для полного сгорания газа с минимальным избытком воздуха и выходом вредных веществ в продуктах сгорания;
75
•обеспечение максимального использования теплоты сжигаемого газа;
•возможность регулирования в пределах изменения нагрузки теплоагрегата;
•отсутствие шума;
•простота конструкции, удобство эксплуатации и ремонта;
•возможность применения средств автоматизации и безопасности;
•современный дизайн.
Всоответствии с ГОСТ 21204-83* по способу подачи воздуха и коэффи-
циенту избытка первичного воздуха α1 горелки подразделяются на диффузионные (α1 = 0), инжекционные (α1 > 1 и α1 < 1), с принудительной подачей воздуха (дутьевые).
Вкотельной технике наибольшее применение имеют горелки с принудительной подачей воздуха. Воздух, необходимый для горения, нагнетается в горелки вентилятором или компрессором. Газ из газопровода подается в газораспределительное устройство, выходя из которого, он смешивается с потоком воздуха. Подготовленная газовоздушная смесь подается в топку. В зависимости от конструкции работают эти горелки на газе низкого или среднего давления.
На рис. 21 приведена классификация газовых горелок с принудительной подачей воздуха.
76
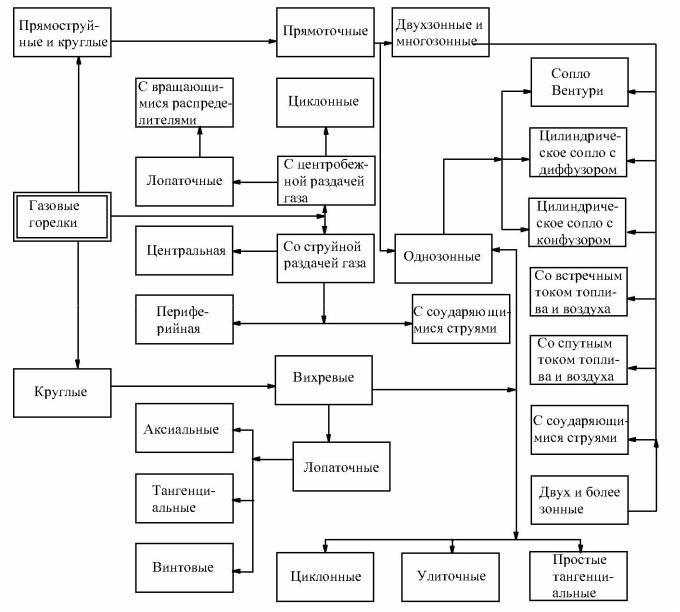
Рис. 21. Классификация газовых двухпроводных горелок
Конструкции горелок подробно рассмотрены в [1].
3.2.5.2. Размещение горелок и работа топочных устройств
Для котлов с горизонтальной ориентацией топки наиболее характерной является фронтовая компоновка горелок на передней стенке. С точки зрения надежности наилучшим вариантом является установка в горизонтальной топке одной горелки. При установке двух горелок оптимальным вариантом является компоновка их одна над другой. Для этих вариантов компоновки наиболее эффективно применение прямоточных или прямоточно-завихривающих горелок. При одногорелочной компоновке положение максимума излучения прямоточного факела сдвигается в глубину топки, что приводит к уменьшению численного значения максимальных тепловых потоков на экраны. В случае двухгоре-
77
лочной компоновки такой же эффект в длинной горизонтальной топке достигается затягиванием процесса горения накладкой факелов.
Для варианта компоновки двух вихревых горелок необходимо учитывать взаимодействие закрученных струй. Односторонняя закрутка потоков (рис. 22, б) снижает тангенциальную составляющую скорости потока в межгорелочной зоне и вызывает асимметрию факела. При противоположной закрутке (рис. 22, а) в межгорелочной области отсутствуют нулевые скорости и факел почти не отклоняется. В зоне накладки факелов их скорости суммируются, вследствие чего активизируется процесс горения и уменьшается неравномерность тепловых потоков на стены топки. Рекомендуемая установка таких горелок приведена на рис. 22, а.
Рис. 22. Взаимодействие закрученных струй вихревых горелок: а) противоположная закрутка струй; б) односторонняя закрутка струй
На котлах с вертикальной топочной камерой наибольшее распространение получили однофронтовая, встречная, тангенциальная и подовая компоновка горелок (рис. 23).
78
Рис. 23. Компоновка горелок:
а) фронтовая; б) встречная лобовая (ударная);
в) угловая тангенциальная; г) подовая; w − скорость потоков
При фронтовой компоновке горелочные устройства монтируются на передней стенке топки в один или несколько ярусов. Расстояние между осями соседних горелок яруса, от осей крайних горелок до стен топки, а также между ярусами горелок принимается не менее 2,5 Dгу; расстояние от нижнего яруса горелок до пода топки − также не менее 2,5 Dгу. При более тесной компоновке возрастает взаимодействие соседних горелок, при этом факел становится длиннее, возрастают неполнота сгорания и температура газов на выходе из топки. Длина горизонтальной и вертикальной составляющих общей длины факела определяется по известным зависимостям [3]. Глубину топочной камеры следует принимать на 5…10 % больше lфг; высоту камеры от отметки осей верхнего яруса горелок рекомендуется принимать не менее чем на 5...10 % больше lфв при фронтовой и встречной компоновке горелок и на 5 % − при тангенциальной. Преимущества однофронтовой компоновки горелок: простая система подвода воздуха к горелкам, удобство их обслуживания; недостатки: сложность достижения равномерного распределения воздуха по отдельным горелкам, возможность касания факелом противоположной стенки (экранов), неравномерность заполнения топочного объема факелами.
Встречная компоновка характеризуется интенсивным взаимодействием факелов, при соударении факелов повышается турбулентность потока, что интенсифицирует процесс горения. Недостатки такой компоновки: неравномерность избытка воздуха и температуры газов по ширине топки на выходе из неё,
79
необходимость и сложность равномерной раздачи воздуха и топлива на фронтовую и заднюю группу горелок, а также по ширине топки.
При тангенциальной компоновке оси горелок, монтируемых по углам топки, направляются по касательной к воображаемой окружности (в центре топки) с радиусом r = (0,2...0,3)R , где R – радиус окружности, вписанной в план топки квадратного сечения. Рекомендуется устанавливать не менее двух ярусов горелок, в каждой из которых закручивается 25...30 % всего количества подаваемого воздуха. При снижении нагрузки котла следует отключать встречно расположенные пары горелок по ярусам. Нарушение этого правила приведет к перекосу общего факела.
При тангенциальной компоновке наблюдается хорошее заполнение факелом топочного объема, температурное поле в сечениях топки равномерное (рис. 24), а эффективное перемешивание потоков в поперечном сечении топки повышает интенсивность и качество горения, а также и qv при прочих равных условиях. В конце топки более низкая средняя температура, что говорит о более высоком тепловосприятии экранов по высоте топки.
К достоинствам тангенциальной компоновки относится также снижение требований к точности распределения воздуха и топлива по отдельным горелкам. Если при фронтовой и встречной компоновках при сжигании топлива с α = 1,03 точность распределения должна быть около 5 %, то при тангенциальной − отклонение распределения может достигать 20...25 % даже при минимальных избытках воздуха. Недостатками такой компоновки являются сложность конструкции и обслуживания топливовоздушной системы, а также наличие значительных тепловых потоков в поясе горелочных устройств.
Рис. 24. Распределение температуры на выходе из топки при различной компоновке горелок:
1 − тангенциальной; 2 − фронтовой; 3 − встречной
80
Подовая компоновка по организации смесеобразования и характеристикам горения мало отличается от фронтовой или встречной. Однако особенности сжигания топлива и теплообмена в топке, присущие такой компоновке, способствуют все более широкому её применению. Достоинства подовой компоновки: возможность применения меньшего количества комбинированных горелок большей мощности; например, на котле типа ТГМ-204П установлено двенадцать подовых газомазутных горелок вместо тридцати шести при встречной их компоновке; ядро горения (зона максимальных тепловых потоков) располагается в части топки, где энтальпия водопаровой среды относительно невысока, что повышает надежность экранных труб; локальные тепловые нагрузки снижены за счет наложения факелов и затягивания процесса горения; горение происходит без химнедожога при минимальных избытках воздуха (α < 1,02); более эффективное (на 15…20 %) заполнение факелом топочного объема. Недостатком подовой компоновки является необходимость иметь дополнительное пространство для установки и обслуживания горелочных устройств, располагаемых ниже пода, что приводит к увеличению общей высоты котла.
Процесс смесеобразования в конце горящего факела и на выходе из топки в значительной степени затруднен вследствие расслоения потока, особенно в котлах с П-образной вертикальной компоновкой: факел перемещается к заднему экрану, температура газового потока в сечении возрастает к заднему экрану, а избыток кислорода − к переднему. Причина такого явления заключена в особенностях горячей аэродинамики в поворотной камере газохода: наименее нагретые (наиболее плотные) объемы газов отжимаются при движении в сторону большего радиуса поворота, наиболее нагретые движутся по траекториям меньшей кривизны; температура выше у той части потока, где активнее протекает горение, поэтому в ней содержится меньшее количество непрореагировавшего кислорода.
Расслоение потока не сказывается на работе топки при α ≥ l,08, но при меньших значениях избытка воздуха факел может затягиваться в конвективные поверхности нагрева. Для устранения явления расслоения потока используется подача вторичного воздуха через сопла, установленные в верхней части заднего фронта котла или верхняя часть заднего фронта выполняется с выступом внутрь топки («носом»), который перекрывает 20…30 % выходного сечения топки. Однако наиболее радикальной мерой борьбы с этим явлением следует считать применение тангенциальной компоновки горелочных устройств.
Вопросы для самопроверки
1.Какие горелки используются для сжигания пылевидного топлива? В чем особенность конструкции щелевой горелки?
2.Объясните принципы конструирования топок с пылеугольными горел-
ками.
3.Поясните особенности горения смеси топлив.
4.Какие горелки используются при сжигании смеси топлив? Назовите конструктивные особенности этих горелок.
81
