
Лаб раб №5Р химия 2011
.docЛабораторная работа №5.
ПРИГОТОВЛЕНИЕ РАСТВОРОВ
5.1
Цель
работы :

Привить студентам навыки работы с мерной химической посудой (пипетками, мерными стаканами, цилиндрами и т.д.). Научить студентов правильному приготовлению растворов заданной концентрации.
Теоретические основы.
5.2 Содержание работы
1) Приготовление растворов различной концентрации.
5.3 Техника безопасности
При выполнении работы пользоваться химическими реактивами аккуратно, не допуская разбрызгивания и проливания реактивов на лабораторный стол и одежду.
5.4. Теоретические основы
Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более компонентов (составных частей), относительные количества которых могут изменяться в широких пределах. Наиболее важный вид растворов – жидкие растворы.
Всякий раствор состоит из растворенных веществ и растворителя. Состав раствора определяется количествами растворенного вещества и растворителя.
Существует несколько способов количественного выражения состава растворов в виде различных долей либо в виде различных концентраций растворенного вещества.
-
массовая доля ω(В) вещества В – это отношение (обычно процентное) массы m(B) растворенного вещества В к общей массе mобщ раствора или смеси веществ:
ω(В) = m(B)/mобщ или ω(В) = 100m(B)/mобщ (%);
-
молярная концентрация с(В) вещества В – это отношение количества n(В) растворенного вещества В к объему раствора:
с(В) = n(В)/Vр, (моль/л);
-
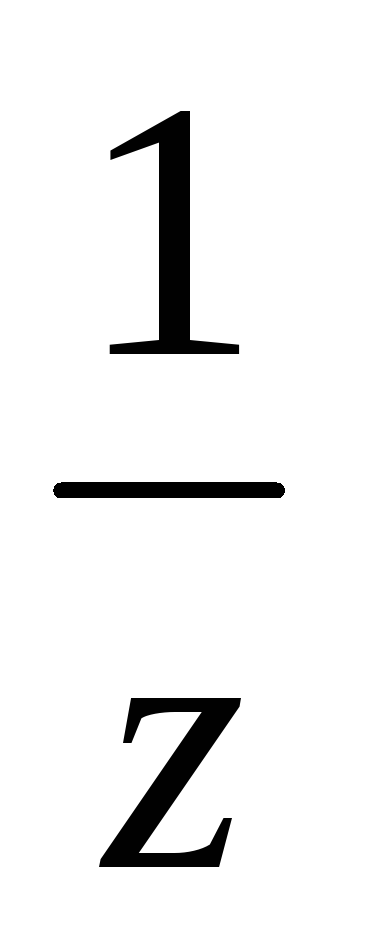
молярная концентрация эквивалентов (нормальная концентрация) с(
 В)
вещества В
– это отношение количества эквивалентов
n(
В)
вещества В
– это отношение количества эквивалентов
n(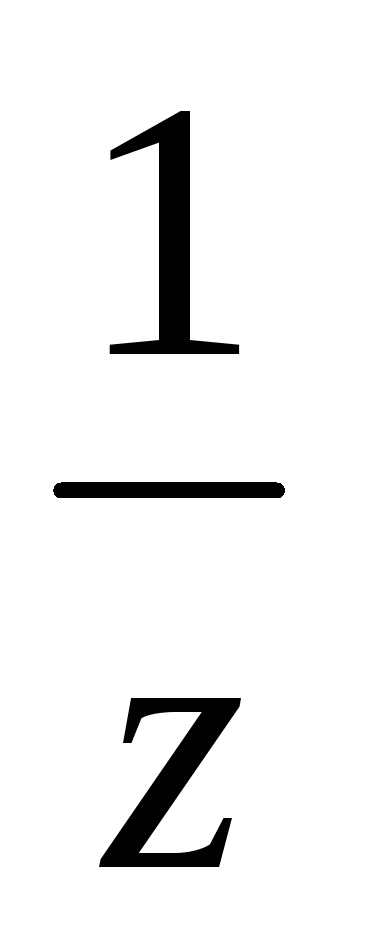 В)
растворенного вещества В к объему
раствора:
В)
растворенного вещества В к объему
раствора:
с(![]() В)
=
n(
В)
=
n(![]() В)/Vр,
(моль/л);
В)/Vр,
(моль/л);
кафедра прикладной химии
-
моляльная концентрация b(В) вещества В – это отношение количества n(В) растворенного вещества В к массе растворителя:
b(В) = n(В)/mр-ля, (моль/кг);
-
Титр раствора Т – это масса растворенного вещества в граммах, содержащаяся в 1 мл раствора:
![]() (г/мл)
(г/мл)
5.5 Необходимые реактивы и приборы
а) аналитические весы с разновесами;
б) фарфоровая ступка с пестиком;
в) мерная колба ёмк. 200 мл;
г) стаканы ёмк.100 мл и 300мл;
д) склянки для сливания растворов;
е) мензурки ёмк. 50,25 мл.
ж) хлорид натрия;
з) дистиллированная вода
5.6 Ход работы
Опыт 1. Приготовление 10%-ного раствора хлорида натрия.
Вычислить массу хлорида натрия, необходимую для приготовления 20 г 10%-ного раствора.
Отвесить это количество хлорида натрия в предварительно взвешенном стаканчике на аналитических весах с точностью до 0,0001 г.
Рассчитать какой объём воды необходим для растворения взятой навески.
Отмерить мензуркой этот объём воды и растворить в нем навеску соли. Полученный раствор вылить в приготовленную склянку.
Контрольные вопросы.
1) В 80 г воды растворено 10 г азотнокислого калия. Вычислить процентное содержание KNO3 в растворе.
2) Сколько граммов медного купороса CuSO45H2O и воды потребуется для приготовления 200 г 5%-ного раствора CuSO4?
3) Сколько граммов Н3РО4 нужно для приготовления 100 мл 0,02 н раствора?
4) Определить молярность 8%-ного раствора КОН, если плотность раствора ρ=1,065 г/мл.
5) В каком соотношении нужно смешать 96%-ный и 32%-ный растворы, чтобы получить 48% раствор?
кафедра прикладной химии
Литература:
1) Васильева З.Г., Грановская А.А.,Таперова А.А. «Лабораторные работы по общей и неорганической химии», М.,1986 г.
2) Балезин С.А, Разумовский Г.С., Филько А.Н. «Лабораторные работы по неорганической химии»,М., Госхимиздат,1948г.
3) Васильев В.П.,Морозова Р.П.,Кочергина Л.А. «Аналитическая химия»-Лабораторный практикум.,М.,Дрофа.,2006г.
Утверждено НМС ИВТиУР
Пр. №_13_ от 28.05.2013 г.
УМК по дисциплине «Химия»
кафедра прикладной химии
