
Лаб раб №10Р химия 2011
.docЛабораторная работа №10
ЭЛЕКТРОЛИЗ РАСТВОРОВ СОЛЕЙ
10.1 Цель работы
Изучение процесса электролиза растворов и расплавов солей.

10.2 Содержание работы
а) электролиз раствора сульфата меди.
б) Электролиз раствора иодида калия.
10.3 Техника безопасности
При выполнении работы пользоваться химическими реактивами аккуратно, не допуская разбрызгивания и проливания реактивов на лабораторный стол и одежду.
10.4 Теоретические основы
Окислительно-восстановительный процесс, протекающий при прохождении электрического тока через раствор или расплав электролита, называется электролизом.
Электрод, на котором при электролизе происходит восстановление, называется катодом, а электрод, на котором осуществляется процесс окисления - анодом.
Если система, в которой проводят электролиз, содержит различные окислители, то на катоде будет восстанавливаться наиболее активный из них, т.е. окисленная форма той электрохимической системы, которой отвечает наибольшее значение электродного потенциала.
Количественная характеристика процессов электролиза определяется законами, установленными Фарадеем. Им можно дать следующую общую формулировку: масса электролита, подвергшаяся превращению при электролизе, а также массы образующихся на электродах веществ прямо пропорциональны количеству электричества, прошедшего через раствор или расплав электролита, и эквивалентным массам соответствующих веществ.
Закон Фарадея выражается следующим уравнением:
![]()
m – масса образовавшегося или подвергшегося превращению вещества, г; Э – его эквивалентная масса; I – сила тока, А; t – время, сек; F – постоянная Фарадея (96500Кл/моль), т.е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
кафедра прикладной химии
Прибор для электролиза представляет собой U – образный сосуд с раствором электролита, в который погружено два электрода – растворимые или нерастворимые (в нашем случае - графитовые) (рисунок 1). Один из них подключен к положительному полюсу внешнего источника тока, а другой - отрицательному полюсу. При электролизе концентрированного раствора NaCl на аноде происходит окисление хлора, а при электролизе разбавленного раствора NaCl на аноде происходит окисление ОН- или Н2О. В обоих случаях на катоде восстанавливаются ионы водорода.
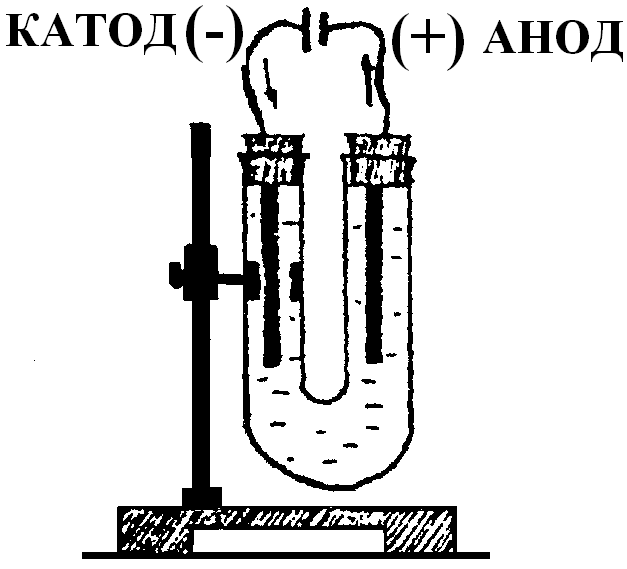
Рисунок 1 - Электролизер
Схема электролиза концентрированного NaCl выглядит так:
Катод NaCl Анод
-
-
НОН
+
Na+, H+ Cl-, OH- или Н2О
2Н2О+2е=Н2+2ОН- 2Cl--2e=Cl2
________________________________________________________
2NaCl+2H2O=H2+Cl2+2NaOH
Схема электролиза разбавленного раствора NaCl:
Катод NaCl Анод
-
-
НОН
+
Na+, H+ Cl-, OH- или Н2О
2Н2О+2е=Н2+2ОН- 2H2O-4e=O2+4H+
______________________________________________________________
2NaCl+2H2O=H2+O2+2NaOH+2HCl
кафедра прикладной химии
10.5 Необходимые реактивы и приборы:
а) электролизер;
б) растворы солей: сульфата меди (II), иодида калия.
10.6 Ход работы
Опыт 1. Электролиз сульфата меди
Налейте в электролизер раствор сульфата меди. Опустите в него графитовые электроды и пропустите через раствор электрический ток; опыт проводите несколько минут. Что наблюдается на катоде? Напишите уравнения катодного и анодного процессов. Какой газ выделяется на аноде?
Опыт 2. Электролиз иодида калия
Налейте в пробирку на 3/4 ее объема 0,1Н раствора KI и добавьте по 5-6 капель фенолфталеина и крахмального клейстера. Перемешайте раствор и перелейте в электролизер. Опустите в электролизер графитовые электроды и подключите их к источнику тока (рисунок 2).
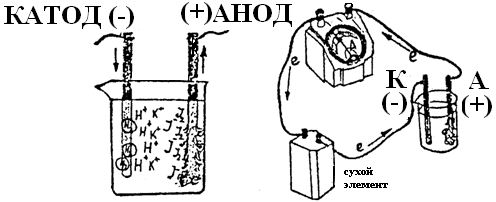
Рисунок 2 - Схема процесса электролиза
Почему на катоде не выделяется металлический калий? Сравните нормальные окислительно-восстановительные потенциалы калия, водорода, йода и кислорода. Появлением каких ионов в процессе электролиза обусловлено окрашивание в красный цвет раствора в катодном пространстве?
Напишите уравнение анодного и катодного процессов. Чем обусловлено посинение раствора в анодном пространстве?
10.7 Контрольные вопросы:
1. Ток силой 2,5 А, проходя через раствор электролита за 30 мин выделяет из раствора 2,77 г металла. Найди эквивалентную массу металла7
2. Сколько времени потребуется для полного разложения 2 молей воды током силой 2 А?
3. Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6 А через раствор нитрата серебра в течение 30 мин.
кафедра прикладной химии
10.8 Оформление работы
В лабораторную тетрадь записать результаты проведенных опытов, схему электролиза, написать уравнения катодного и анодного процессов.
Литература:
-
Практикум по неорганической химии / Под ред.Зломанова В.П. – М.: МГУ, 1994. – 320 с.
-
Практикум по неорганической химии / Под ред. Буркитбаева М.М., Бекишева К.Б. – Алматы: КазНУ, 2002. – 287 с.
Утверждено НМС ИВТиУР
Пр. №_13_ от 28.05.2013 г.
УМК по дисциплине «Химия»
кафедра прикладной химии
