
- •67 Федеральное агентство по образованию
- •Программа по дисциплине «химия»
- •Перечень лабораторных работ
- •Вопросы к экзамену
- •Контрольные задания
- •Тема 1. Строение атома и периодическая система элементов д.И.Менделеева
- •Задачи 1 20
- •Тема 2. Химическая связь
- •Теоретические основы
- •Задачи 21 40
- •Тема 3. Химическая термодинамика
- •Теоретические основы
- •Задачи 41 60
- •Тема 4. Химическая кинетика и равновесие
- •Теоретические основы
- •Задачи 61 80
- •Тема 5. Растворы
- •Теоретические основы
- •Задачи 81-100
- •Тема 6. Окислительно-восстановительные реакции
- •Задачи 101 120
- •Тема 7. Электродные потенциалы и электродвижущие силы
- •Тема 8. Коррозия металлов и способы защиты от неё
- •Задачи 141 160
- •Тема 9. Электролиз Теоретические основы
- •Задачи 141 160
- •Тема 10. Химические свойства элементов и их соединений
- •Теоретические основы
- •Задачи 161 180
- •Приложения
Задачи 161 180
Составьте уравнения реакций, с помощью которых можно осуществить ниже приведённые превращения. Реакции ионного обмена запишите в молекулярной и ионно-молекулярной форме. Для окислительно-восстановительных реакций составьте электронные уравнения процессов окисления и восстановления, укажите окислитель и восстановитель, подберите коэффициенты методом электронного баланса.
Схемы превращений
181.
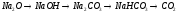 .
.
182.
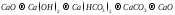 .
.
183. 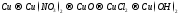 .
.
184.
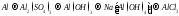 .
.
185. 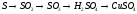 .
.
186. 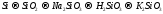 .
.
187. 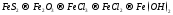 .
.
188. 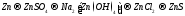
189. 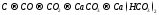 .
.
190. 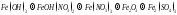 .
.
191. 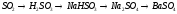 .
.
192.
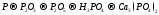 .
.
193. 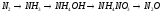 .
.
194. 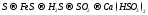 .
.
195. 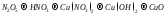 .
.
196. 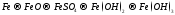 .
.
197. 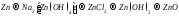 .
.
198. 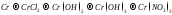 .
.
199. 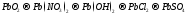 .
.
200.
 .
.
Приложения
Приложение 1
Относительные электроотрицательности элементов
|
Порядковый номер элемента |
Элемент |
Электроотрица- тельность |
|
1 |
H |
2.10 |
|
3 |
Li |
0.98 |
|
4 |
Be |
1.50 |
|
5 |
B |
2.04 |
|
7 |
N |
3.04 |
|
8 |
O |
3.44 |
|
9 |
F |
3.98 |
|
11 |
Na |
0.93 |
|
12 |
Mg |
1.31 |
|
14 |
Si |
1.90 |
|
15 |
P |
2.19 |
|
16 |
S |
2.58 |
|
17 |
Cl |
3.16 |
|
19 |
K |
0.82 |
|
20 |
Ca |
1.00 |
|
33 |
As |
2.18 |
|
34 |
Se |
2.55 |
|
35 |
Br |
2.96 |
|
52 |
Te |
2.10 |
|
53 |
I |
2.66 |
Приложение 2
Термодинамические константы некоторых веществ
|
Вещество |
Н298, Дж/моль |
S298, Дж /моль·К |
|
СН4 (г) |
74.8 |
186.4 |
|
С2Н2 (г) |
+ 226.8 |
200.8 |
|
С2Н4 (г) |
+ 52.3 |
219.5 |
|
С2Н6 (г) |
84.7 |
229.6 |
|
С3Н6 (г) |
+ 20.4 |
267.1 |
|
С3Н8 (г) |
103.9 |
270.1 |
|
С2Н5ОН (ж) |
277.6 |
161.1 |
|
СО (г) |
110.6 |
197.7 |
|
СО2 (г) |
393.8 |
213.8 |
|
Cl2 (г) |
0 |
223.1 |
|
CuO (т) |
|
42.7 |
|
Cu2S (т) |
|
121.0 |
|
Fe (т) |
0 |
27.2 |
|
FeO (т) |
265.6 |
60.8 |
|
Fe2O3 (т) |
822.7 |
87.5 |
|
Fe3O4 (т) |
1117.9 |
146.3 |
|
HI (г) |
+ 26.6 |
206.3 |
|
H2 (г) |
0 |
130.6 |
|
H2O (г) |
241.2 |
188.9 |
|
H2O(ж) |
286.0 |
70.0 |
|
H2S (г) |
20.9 |
193.2 |
Продолжение приложения 2
|
Вещество |
Н298, Дж/моль |
S298, Дж /моль·К |
|
H3РО4(т) |
1279.0 |
110.5 |
|
I2 (г) |
+ 62.5 |
260.8 |
|
NH3 (г) |
|
192.8 |
|
NO (г) |
+ 90.3 |
210.7 |
|
NO2 (г) |
+ 33.5 |
240.3 |
|
N2 (г) |
0 |
200.0 |
|
N2O (г) |
+ 82.1 |
220.0 |
|
O2 (г) |
0 |
205.0 |
|
S(т) |
0 |
31.9 |
|
SO2(г) |
297.1 |
248.2 |
|
SO3(г) |
376.2 |
256.4 |
|
РH3(г) |
+ 5.4 |
210.3 |
Приложение 3
Стандартные электродные потенциалы некоторых металлов при 25 С
|
Электрод |
, В |
Электрод |
, В |
|
Li+Li |
3.045 |
Fe2+Fe |
0.440 |
|
Rb+Rb |
2.925 |
Cd2+Cd |
0.403 |
|
K+K |
2.925 |
Co2+Co |
0.277 |
|
Cs+Cs |
2.923 |
Ni2+Ni |
0.250 |
|
Ba2+Ba |
2.900 |
Sn2+Sn |
0.136 |
|
Ca2+Ca |
2.866 |
Pb2+Pb |
0.126 |
|
Na+Na |
2.714 |
Fe3+Fe |
0.036 |
|
Mg2+Mg |
2.363 |
2H+H2 |
0.000 |
|
Al3+Al |
1.662 |
Cu2+Cu |
+ 0.337 |
|
Mn2+Mn |
1.180 |
Ag+Ag |
+ 0.799 |
|
Zn2+Zn |
0.763 |
Hg2+Hg |
+ 0.854 |
