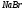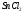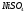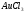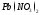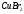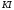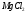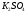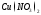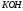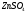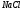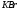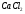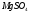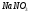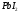- •67 Федеральное агентство по образованию
- •Программа по дисциплине «химия»
- •Перечень лабораторных работ
- •Вопросы к экзамену
- •Контрольные задания
- •Тема 1. Строение атома и периодическая система элементов д.И.Менделеева
- •Задачи 1 20
- •Тема 2. Химическая связь
- •Теоретические основы
- •Задачи 21 40
- •Тема 3. Химическая термодинамика
- •Теоретические основы
- •Задачи 41 60
- •Тема 4. Химическая кинетика и равновесие
- •Теоретические основы
- •Задачи 61 80
- •Тема 5. Растворы
- •Теоретические основы
- •Задачи 81-100
- •Тема 6. Окислительно-восстановительные реакции
- •Задачи 101 120
- •Тема 7. Электродные потенциалы и электродвижущие силы
- •Тема 8. Коррозия металлов и способы защиты от неё
- •Задачи 141 160
- •Тема 9. Электролиз Теоретические основы
- •Задачи 141 160
- •Тема 10. Химические свойства элементов и их соединений
- •Теоретические основы
- •Задачи 161 180
- •Приложения
Тема 9. Электролиз Теоретические основы
Электролизом называется совокупность окислительно-восстановительных процессов, протекающих на электродах при пропускании постоянного электрического тока через расплав или раствор электролита. Электрод, на котором происходит восстановление, является катодом; он заряжен положительно. На положительно заряженном аноде протекает окисление. При электролизе химическая реакция осуществляется за счёт энергии электрического тока, подводимой извне.
Протекание электролиза существенно зависит от материала анода. Электролиз может проводиться с применением нерастворимых (инертных) или растворимых (активных) анодов. Нерастворимым анодом называется анод, материал которого не претерпевает окисления в ходе электролиза (графит, уголь, платина, иридий). Растворимым называется анод, материал которого может окисляться в ходе электролиза; растворимые аноды при электролизе разрушаются.
При рассмотрении электролиза водных растворов электролитов необходимо учитывать возможность электрохимического окисления или восстановления воды.
Природа электрохимических процессов, протекающих на электродах при электролизе, зависит от относительных значений их электродных потенциалов. Из нескольких возможных процессов будет протекать тот, осуществление которого требует минимальной затраты энергии. Так, на катоде в первую очередь восстанавливается тот ион, который имеет наибольшее значение электродного потенциала. На аноде окисляется та частица, которая имеет наименьший потенциал.
В
связи с этим все металлы, в зависимости
от поведения при электролизе водных
растворов, можно разделить на три группы.
В первую входят активные металлы,
находящиеся в начале ряда напряжений
до титана включительно (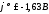 ).
При электролизе водных растворов их
солей на катоде будет восстанавливаться
вода, а не катионы металла:
).
При электролизе водных растворов их
солей на катоде будет восстанавливаться
вода, а не катионы металла:
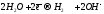
Вторую
группу составляют металлы, находящиеся
в ряду напряжений, начиная от олова
(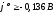 ).
).
При электролизе водных растворов их солей на катоде восстанавливаются только катионы металла:
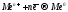 .
.
Если же катионом электролита является металл средней части ряда напряжений (от марганца до никеля включительно), то в зависимости от концентрации раствора и условий электролиза, возможно восстановление как воды, так и катионов металла.
При
рассмотрении анодных процессов следует
в первую очередь учитывать материал
анода. В случае электролиза с инертным
анодом характер процесса определяется
составом электролита. Так, анионы
кислородсодержащих кислот с центральным
атомом в высшей степени окисления (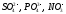 ),
а также анион
),
а также анион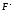 не
разряжается на аноде. Вместо этого идет
окисление воды:
не
разряжается на аноде. Вместо этого идет
окисление воды:
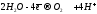 .
.
При
электролизе растворов солей бескислородных
кислот разряжаются их анионы (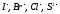 ,
но не
,
но не ),
а не воды:
),
а не воды:
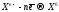
При электролизе c активным анодом, как правило, идёт окисление материала анода:
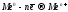
Количественно процессы электролиза описываются законами Фарадея, которые в обобщенном виде математически выражаются следующим образом:
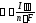 ,
где
,
где
– количество вещества, участвующего в электродном процессе, моль;
I – сила пропущенного через электролизёр тока, А;
– продолжительность электролиза, с;
n – число участвующих в электродной реакции электронов,
F
– число Фарадея (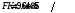 ).
).
Пример: Определить, какие вещества и в каких количествах выделяются на инертных электродах при электролизе водного раствора хлорида меди (II), если время электролиза 1 час, сила тока 1 А.
В растворе хлорид меди (П) диссоциирует на ионы:
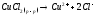
Значение
стандартного электродного потенциала
меди
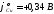 более
положительно, чем значение потенциала
восстановления воды, поэтому на катоде
будут восстанавливаться ионы меди:
более
положительно, чем значение потенциала
восстановления воды, поэтому на катоде
будут восстанавливаться ионы меди:
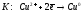 .
.
На
аноде будет протекать окисление
хлорид-ионов и выделение хлора: 
Суммарное уравнение процесса:
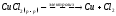
Количества вещества, выделившихся на электродах, рассчитываются по формуле закона Фарадея:
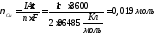 .
.
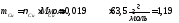
Объёмы газов, приведённых к нормальным условиям, могут быть рассчитаны по уравнению
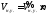 ,
где
,
где
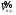 – молярный объём газа при нормальных
условиях.
– молярный объём газа при нормальных
условиях.
 ,
,
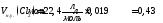 .
.
Таблица 7
|
№ задачи |
Электролит |
Время t |
Cила тока I, A |
|
161 |
|
2 ч 30 мин |
3 |
|
162 |
|
1 ч 30 мин |
2 |
|
163 |
|
2 ч 45 мин |
4 |
|
164 |
|
1ч 50 мин |
3 |
|
165 |
|
3 ч 20 мин |
5 |
|
166 |
|
2 ч 30 мин |
2 |
|
167 |
|
1 ч 30 мин |
4 |
|
168 |
|
1 ч 20 мин |
2 |
|
169 |
|
2 ч |
7 |
|
160 |
|
1 ч 30 мин |
5 |
|
171 |
|
1 ч 35 мин |
6 |
|
172 |
|
1 ч 50 мин |
4 |
|
173 |
|
2 ч 15 мин |
1 |
|
174 |
|
1 ч 40 мин |
3 |
|
175 |
|
1 ч 35 мин |
2 |
|
176 |
|
3 ч 10 мин |
4 |
|
177 |
|
2 ч 30 мин |
1 |
|
178 |
|
1 ч 45 мин |
5 |
|
179 |
|
1 ч 55 мин |
6 |
|
180 |
|
1 ч 30 мин |
8 |